Genoma humano
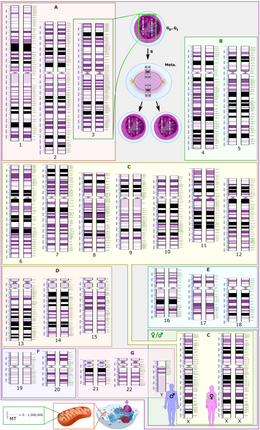 Representación esquemática del cariotipo diploide humano , que muestra la organización del genoma en cromosomas, así como las bandas y subbandas anotadas como se observa en las bandas G. Este dibujo muestra las versiones femenina (XX) y masculina (XY) del par de cromosomas 23. Los cambios cromosómicos durante el ciclo celular se muestran en la parte superior central. El genoma mitocondrial se muestra a escala en la parte inferior izquierda. |
El genoma humano es un conjunto completo de secuencias de ácidos nucleicos para humanos, codificado como el ADN dentro de cada uno de los 24 cromosomas distintos en el núcleo celular. Una pequeña molécula de ADN se encuentra dentro de las mitocondrias individuales . Estas suelen tratarse por separado como el genoma nuclear y el genoma mitocondrial . [1] Los genomas humanos incluyen tanto secuencias de ADN codificantes de proteínas como varios tipos de ADN que no codifican proteínas . Este último es una categoría diversa que incluye el ADN que codifica ARN no traducido, como el ARN ribosómico , el ARN de transferencia , las ribozimas , los ARN nucleares pequeños y varios tipos de ARN reguladores . También incluye promotores y sus elementos reguladores de genes asociados , ADN que desempeña funciones estructurales y replicativas, como regiones de andamiaje , telómeros , centrómeros y orígenes de replicación , además de un gran número de elementos transponibles , ADN viral insertado , pseudogenes no funcionales y secuencias simples y altamente repetitivas . Los intrones constituyen un gran porcentaje del ADN no codificante . Parte de este ADN no codificante es ADN basura no funcional , como los pseudogenes, pero no existe un consenso firme sobre la cantidad total de ADN basura.
Aunque la secuencia del genoma humano se ha determinado completamente mediante la secuenciación del ADN en 2022 (incluido el metiloma ), aún no se comprende del todo. La mayoría de los genes , pero no todos, se han identificado mediante una combinación de enfoques experimentales y bioinformáticos de alto rendimiento , pero aún queda mucho trabajo por hacer para dilucidar mejor las funciones biológicas de sus productos proteicos y de ARN .
Tamaño del genoma humano
En 2000, los científicos informaron de la secuenciación del 88% del genoma humano, [2] pero en 2020, todavía faltaba al menos el 8%. [3] En 2021, los científicos informaron de la secuenciación de un genoma femenino completo (es decir, sin el cromosoma Y). [4] [3] El cromosoma Y humano , que consta de 62.460.029 pares de bases de una línea celular diferente y que se encuentra en todos los varones, se secuenció por completo en enero de 2022. [5]
La versión actual del genoma de referencia estándar se llama GRCh38.p14 (julio de 2023). Consta de 22 autosomas más una copia del cromosoma X y una copia del cromosoma Y. Contiene aproximadamente 3.100 millones de pares de bases (3,1 Gb o 3,1 x 10 9 pb). [6] Esto representa el tamaño de un genoma compuesto basado en datos de varios individuos, pero es un buen indicio de la cantidad típica de ADN en un conjunto haploide de cromosomas porque el cromosoma Y es bastante pequeño. [7] La mayoría de las células humanas son diploides, por lo que contienen el doble de ADN (~6.200 millones de pares de bases).
En 2023 se publicó un borrador de referencia del pangenoma humano. [8] Se basa en 47 genomas de personas de diversas etnias. [8] Hay planes en marcha para una referencia mejorada que capture aún más biodiversidad a partir de una muestra aún más amplia. [8]
Si bien existen diferencias significativas entre los genomas de los individuos humanos (del orden del 0,1% debido a variantes de un solo nucleótido [9] y del 0,6% cuando se consideran los indels ), [10] estas son considerablemente más pequeñas que las diferencias entre los humanos y sus parientes vivos más cercanos, los bonobos y los chimpancés (~1,1% de variantes fijas de un solo nucleótido [11] y 4% cuando se incluyen los indels). [12]
Organización molecular y contenido genético
La longitud total del genoma humano de referencia no representa la secuencia de ningún individuo específico ni la secuencia de todo el ADN que se encuentra dentro de una célula. El genoma humano de referencia solo incluye una copia de cada uno de los autosomas homólogos pareados más una copia de cada uno de los dos cromosomas sexuales (X e Y). La cantidad total de ADN en este genoma de referencia es de 3.1 mil millones de pares de bases (3,1 Gb). [13]
Genes codificadores de proteínas
Las secuencias codificantes de proteínas representan el componente más estudiado y mejor comprendido del genoma humano. Estas secuencias conducen en última instancia a la producción de todas las proteínas humanas , aunque varios procesos biológicos (por ejemplo, reordenamientos del ADN y empalmes alternativos de pre-ARNm ) pueden conducir a la producción de muchas más proteínas únicas que el número de genes codificantes de proteínas.
El genoma de referencia humano contiene entre 19.000 y 20.000 genes codificadores de proteínas. [14] [15] [16] [17] Estos genes contienen un promedio de 10 intrones y el tamaño promedio de un intrón es de aproximadamente 6 kb (6.000 pb). [18] Esto significa que el tamaño promedio de un gen codificador de proteínas es de aproximadamente 62 kb y estos genes ocupan aproximadamente el 40% del genoma. [19]
Las secuencias de exones consisten en ADN codificante y regiones no traducidas (UTR) en cada extremo del ARNm maduro. La cantidad total de ADN codificante es de alrededor del 1-2% del genoma. [20] [18]
Muchas personas dividen el genoma en ADN codificante y no codificante basándose en la idea de que el ADN codificante es el componente funcional más importante del genoma. Aproximadamente el 98-99% del genoma humano es ADN no codificante.
Genes no codificantes
Las moléculas de ARN no codificante desempeñan muchas funciones esenciales en las células, especialmente en las numerosas reacciones de síntesis de proteínas y procesamiento del ARN . Los genes no codificantes incluyen los de ARNt , ARN ribosómico , microARN , ARNsn y ARN largos no codificantes (lncRNA). [21] [22] [23] [24] El número de genes no codificantes notificados sigue aumentando lentamente, pero aún no se ha determinado el número exacto en el genoma humano. Se cree que muchos ARN no son funcionales. [25]
Muchos ARNnc son elementos críticos en la regulación y expresión de genes. El ARN no codificante también contribuye a la epigenética, la transcripción, el empalme del ARN y la maquinaria de traducción. El papel del ARN en la regulación genética y la enfermedad ofrece un nuevo nivel potencial de complejidad genómica inexplorada. [26]
Pseudogenes
Los pseudogenes son copias inactivas de genes codificadores de proteínas, a menudo generados por duplicación genética , que se han vuelto no funcionales debido a la acumulación de mutaciones inactivadoras. El número de pseudogenes en el genoma humano es del orden de 13.000, [27] y en algunos cromosomas es casi el mismo que el número de genes codificadores de proteínas funcionales. La duplicación genética es un mecanismo importante a través del cual se genera nuevo material genético durante la evolución molecular .
Por ejemplo, la familia de genes del receptor olfativo es uno de los ejemplos mejor documentados de pseudogenes en el genoma humano. Más del 60 por ciento de los genes de esta familia son pseudogenes no funcionales en los seres humanos. En comparación, solo el 20 por ciento de los genes de la familia de genes del receptor olfativo del ratón son pseudogenes. Las investigaciones sugieren que se trata de una característica específica de la especie, ya que los primates más estrechamente relacionados tienen proporcionalmente menos pseudogenes. Este descubrimiento genético ayuda a explicar el sentido del olfato menos agudo en los seres humanos en relación con otros mamíferos. [28]
Secuencias de ADN reguladoras
El genoma humano tiene muchas secuencias reguladoras diferentes que son cruciales para controlar la expresión génica . Estimaciones conservadoras indican que estas secuencias constituyen el 8% del genoma, [29] sin embargo, extrapolaciones del proyecto ENCODE indican que el 20% [30] o más [31] del genoma son secuencias reguladoras génicas. Algunos tipos de ADN no codificante son "interruptores" genéticos que no codifican proteínas, pero sí regulan cuándo y dónde se expresan los genes (llamados potenciadores ). [32]
Las secuencias reguladoras se conocen desde finales de los años 1960. [33] La primera identificación de secuencias reguladoras en el genoma humano se basó en la tecnología del ADN recombinante. [34] Más tarde, con la llegada de la secuenciación genómica, la identificación de estas secuencias se pudo inferir por conservación evolutiva. La rama evolutiva entre los primates y el ratón , por ejemplo, ocurrió hace 70-90 millones de años. [35] Por lo tanto, las comparaciones por computadora de secuencias genéticas que identifiquen secuencias no codificantes conservadas serán una indicación de su importancia en funciones como la regulación genética. [36]
Se han secuenciado otros genomas con la misma intención de ayudar a los métodos guiados por la conservación, por ejemplo, el genoma del pez globo . [37] Sin embargo, las secuencias reguladoras desaparecen y vuelven a evolucionar durante la evolución a un ritmo elevado. [38] [39] [40]
A partir de 2012, los esfuerzos se han centrado en encontrar interacciones entre el ADN y las proteínas reguladoras mediante la técnica ChIP-Seq , o huecos donde el ADN no está empaquetado por histonas ( sitios hipersensibles a la DNasa ), los cuales indican dónde hay secuencias reguladoras activas en el tipo de célula investigado. [29]
Secuencias repetitivas de ADN
Las secuencias repetitivas de ADN comprenden aproximadamente el 50% del genoma humano. [41]
Alrededor del 8% del genoma humano consiste en matrices de ADN en tándem o repeticiones en tándem, secuencias repetidas de baja complejidad que tienen múltiples copias adyacentes (por ejemplo, "CAGCAGCAG..."). [42] Las secuencias en tándem pueden tener longitudes variables, desde dos nucleótidos hasta decenas de nucleótidos. Estas secuencias son muy variables, incluso entre individuos estrechamente relacionados, y por eso se utilizan para pruebas de ADN genealógicas y análisis de ADN forense . [43]
Las secuencias repetidas de menos de diez nucleótidos (por ejemplo, la repetición de dinucleótido (AC) n ) se denominan secuencias microsatélites. Entre las secuencias microsatélites, las repeticiones de trinucleótidos son de particular importancia, ya que a veces se producen dentro de las regiones codificantes de los genes para las proteínas y pueden conducir a trastornos genéticos. Por ejemplo, la enfermedad de Huntington es el resultado de una expansión de la repetición de trinucleótido (CAG) n dentro del gen huntingtina en el cromosoma humano 4. Los telómeros (los extremos de los cromosomas lineales) terminan con una repetición de hexanucleótido microsatélite de la secuencia (TTAGGG) n . [ cita requerida ]
Las repeticiones en tándem de secuencias más largas (conjuntos de secuencias repetidas de entre 10 y 60 nucleótidos de longitud) se denominan minisatélites . [44]
Los elementos genéticos transponibles , secuencias de ADN que pueden replicarse e insertar copias de sí mismas en otras ubicaciones dentro de un genoma huésped, son un componente abundante en el genoma humano. El linaje de transposones más abundante, Alu , tiene alrededor de 50.000 copias activas, [45] y se puede insertar en regiones intragénicas e intergénicas. [46] Otro linaje, LINE-1, tiene alrededor de 100 copias activas por genoma (el número varía entre personas). [47] Junto con reliquias no funcionales de antiguos transposones, representan más de la mitad del ADN humano total. [48] A veces llamados "genes saltarines", los transposones han jugado un papel importante en la escultura del genoma humano. Algunas de estas secuencias representan retrovirus endógenos , copias de ADN de secuencias virales que se han integrado permanentemente en el genoma y ahora se transmiten a las generaciones sucesivas. También hay una cantidad significativa de retrovirus en el ADN humano , de los cuales al menos 3 han demostrado tener una función importante (es decir, HERV-K funcional similar al VIH ; los genes de la envoltura de los virus no funcionales HERV-W y HERV-FRD desempeñan un papel en la formación de la placenta al inducir la fusión célula-célula).
Los elementos móviles dentro del genoma humano se pueden clasificar en retrotransposones LTR (8,3% del genoma total), SINE (13,1% del genoma total) incluyendo elementos Alu , LINE (20,4% del genoma total), SVA (SINE- VNTR -Alu) y transposones de ADN de clase II (2,9% del genoma total).
ADN basura
No hay consenso sobre qué constituye un elemento "funcional" en el genoma, ya que los genetistas, biólogos evolutivos y biólogos moleculares emplean diferentes definiciones y métodos. [49] [50] Debido a la ambigüedad en la terminología, han surgido diferentes escuelas de pensamiento. [51] En las definiciones evolutivas, el ADN "funcional", ya sea codificante o no codificante, contribuye a la aptitud del organismo y, por lo tanto, se mantiene mediante una presión evolutiva negativa, mientras que el ADN "no funcional" no tiene ningún beneficio para el organismo y, por lo tanto, está bajo una presión selectiva neutral. Este tipo de ADN se ha descrito como ADN basura . [52] [53] En las definiciones genéticas, el ADN "funcional" está relacionado con la forma en que los segmentos de ADN se manifiestan por fenotipo y el "no funcional" está relacionado con los efectos de pérdida de función en el organismo. [49] En las definiciones bioquímicas, el ADN "funcional" se relaciona con secuencias de ADN que especifican productos moleculares (por ejemplo, ARN no codificantes) y actividades bioquímicas con papeles mecanicistas en la regulación de genes o genomas (es decir, secuencias de ADN que impactan la actividad a nivel celular como el tipo de célula, condición y procesos moleculares). [54] [49] No hay consenso en la literatura sobre la cantidad de ADN funcional ya que, dependiendo de cómo se entienda la "función", se han estimado rangos desde hasta el 90% del genoma humano probablemente sea ADN no funcional (ADN basura) [55] hasta hasta el 80% del genoma probablemente sea funcional. [56] También es posible que el ADN basura pueda adquirir una función en el futuro y por lo tanto pueda jugar un papel en la evolución, [57] pero es probable que esto ocurra solo muy raramente. [52] Finalmente, el ADN que es perjudicial para el organismo y está bajo presión selectiva negativa se llama ADN basura. [53]
Secuenciación
Las primeras secuencias del genoma humano fueron publicadas en forma de borrador casi completo en febrero de 2001 por el Proyecto Genoma Humano [58] y Celera Corporation . [59] La finalización del esfuerzo de secuenciación del Proyecto Genoma Humano se anunció en 2004 con la publicación de un borrador de la secuencia del genoma, dejando solo 341 huecos en la secuencia, que representan ADN altamente repetitivo y otro ADN que no se podía secuenciar con la tecnología disponible en ese momento. [60] El genoma humano fue el primero de todos los vertebrados en ser secuenciado hasta tal punto de completitud, y hasta 2018, se habían determinado los genomas diploides de más de un millón de humanos individuales utilizando secuenciación de próxima generación . [61]
Estos datos se utilizan en todo el mundo en la ciencia biomédica , la antropología , la ciencia forense y otras ramas de la ciencia. Estos estudios genómicos han llevado a avances en el diagnóstico y el tratamiento de enfermedades, y a nuevos conocimientos en muchos campos de la biología, incluida la evolución humana . [ cita requerida ]
En 2018, el número total de genes había aumentado a al menos 46.831, [62] más otros 2300 genes de micro-ARN . [63] Una encuesta de población de 2018 encontró otros 300 millones de bases del genoma humano que no estaban en la secuencia de referencia. [64] Antes de la adquisición de la secuencia completa del genoma, las estimaciones del número de genes humanos oscilaban entre 50.000 y 140.000 (con vaguedad ocasional sobre si estas estimaciones incluían genes no codificantes de proteínas). [65] A medida que la calidad de la secuencia del genoma y los métodos para identificar genes codificantes de proteínas mejoraron, [60] el recuento de genes codificantes de proteínas reconocidos se redujo a 19.000-20.000. [66]
En 2022, el consorcio Telomere-to-Telomere (T2T) informó la secuencia completa de un genoma femenino humano, [3] llenando todos los huecos en el cromosoma X (2020) y los 22 autosomas (mayo de 2021). [3] [67] Las partes no secuenciadas previamente contienen genes de respuesta inmune que ayudan a adaptarse y sobrevivir a las infecciones, así como genes que son importantes para predecir la respuesta a los medicamentos . [68] La secuencia completa del genoma humano también proporcionará una mejor comprensión de la formación humana como organismo individual y cómo los humanos varían tanto entre sí como con otras especies. [68]
Aunque la "finalización" del proyecto del genoma humano se anunció en 2001, [2] quedaban cientos de lagunas, y entre el 5 y el 10% de la secuencia total seguía sin determinarse. La información genética faltante se encontraba principalmente en regiones heterocromáticas repetitivas y cerca de los centrómeros y los telómeros , pero también en algunas regiones eucromáticas que codifican genes . [69] Quedaban 160 lagunas eucromáticas en 2015, cuando se determinaron las secuencias que abarcaban otras 50 regiones anteriormente no secuenciadas. [70] Solo en 2020 se determinó la primera secuencia telómero a telómero verdaderamente completa de un cromosoma humano , concretamente del cromosoma X. [71] La primera secuencia telómero a telómero completa de un cromosoma autosómico humano, el cromosoma 8 , se produjo un año después. [72] El genoma humano completo (sin el cromosoma Y) se publicó en 2021, mientras que con el cromosoma Y en enero de 2022. [3] [4] [73]
En 2023 se publicó un borrador de referencia del pangenoma humano. [8] Se basa en 47 genomas de personas de diversas etnias. [8] Hay planes en marcha para una referencia mejorada que capture aún más biodiversidad a partir de una muestra aún más amplia. [8]
Variación genómica en humanos
Genoma de referencia humano
Con excepción de los gemelos idénticos, todos los seres humanos presentan una variación significativa en las secuencias de ADN genómico. El genoma humano de referencia (HRG) se utiliza como referencia de secuencia estándar.
Hay varios puntos importantes sobre el genoma de referencia humano:
- La HRG es una secuencia haploide. Cada cromosoma está representado una vez.
- La HRG es una secuencia compuesta y no corresponde a ningún individuo humano real.
- El HRG se actualiza periódicamente para corregir errores, ambigüedades y “lagunas” desconocidas.
- El HRG no representa en ningún caso un individuo humano “ideal” o “perfecto”. Es simplemente una representación o modelo estandarizado que se utiliza con fines comparativos.
El Consorcio de Referencia Genómica es responsable de actualizar la HRG. La versión 38 se publicó en diciembre de 2013. [74]
Medición de la variación genética humana
La mayoría de los estudios sobre la variación genética humana se han centrado en los polimorfismos de un solo nucleótido (SNP), que son sustituciones en bases individuales a lo largo de un cromosoma. La mayoría de los análisis estiman que los SNP se producen en 1 de cada 1000 pares de bases, en promedio, en el genoma humano eucromático , aunque no se producen en una densidad uniforme. De ahí la afirmación popular de que "todos, independientemente de la raza , somos genéticamente iguales en un 99,9%", [75] aunque la mayoría de los genetistas lo matizarían un poco. Por ejemplo, ahora se cree que una fracción mucho mayor del genoma está involucrada en la variación del número de copias . [76] El Proyecto Internacional HapMap está llevando a cabo un esfuerzo colaborativo a gran escala para catalogar las variaciones de SNP en el genoma humano . [ cita requerida ]
Los loci genómicos y la longitud de ciertos tipos de pequeñas secuencias repetitivas varían enormemente de una persona a otra, lo que constituye la base de las tecnologías de identificación de ADN y de pruebas de paternidad por ADN . También se cree que las porciones heterocromáticas del genoma humano, que suman varios cientos de millones de pares de bases, son bastante variables dentro de la población humana (son tan repetitivas y tan largas que no se las puede secuenciar con precisión con la tecnología actual). Estas regiones contienen pocos genes y no está claro si algún efecto fenotípico significativo resulta de la variación típica en las repeticiones o en la heterocromatina.
La mayoría de las mutaciones genómicas graves en las células germinales de los gametos probablemente resulten en embriones inviables; sin embargo, varias enfermedades humanas están relacionadas con anomalías genómicas a gran escala. El síndrome de Down , el síndrome de Turner y varias otras enfermedades son resultado de la no disyunción de cromosomas enteros. Las células cancerosas con frecuencia presentan aneuploidía de cromosomas y brazos cromosómicos, aunque no se ha establecido una relación de causa y efecto entre la aneuploidía y el cáncer.
Mapeo de la variación genómica humana
Mientras que una secuencia genómica enumera el orden de cada base de ADN en un genoma, un mapa genómico identifica los puntos de referencia. Un mapa genómico es menos detallado que una secuencia genómica y ayuda a navegar por el genoma. [77] [78]
Un ejemplo de mapa de variación es el HapMap que está desarrollando el Proyecto Internacional HapMap . El HapMap es un mapa de haplotipos del genoma humano, "que describirá los patrones comunes de variación de la secuencia de ADN humano". [79] Cataloga los patrones de variaciones a pequeña escala en el genoma que involucran letras individuales de ADN, o bases.
En mayo de 2008, los investigadores publicaron en la revista Nature el primer mapa basado en secuencias de variación estructural a gran escala en el genoma humano. [80] [81] Las variaciones estructurales a gran escala son diferencias en el genoma entre las personas que van desde unos pocos miles hasta unos pocos millones de bases de ADN; algunas son ganancias o pérdidas de tramos de la secuencia del genoma y otras aparecen como reordenamientos de tramos de la secuencia. Estas variaciones incluyen diferencias en el número de copias que tienen los individuos de un gen en particular, deleciones, translocaciones e inversiones.
Variación estructural
La variación estructural se refiere a variantes genéticas que afectan segmentos más grandes del genoma humano, a diferencia de las mutaciones puntuales . A menudo, las variantes estructurales (VS) se definen como variantes de 50 pares de bases (pb) o más, como deleciones, duplicaciones, inserciones, inversiones y otros reordenamientos. Alrededor del 90% de las variantes estructurales son deleciones no codificantes, pero la mayoría de los individuos tienen más de mil deleciones de este tipo; el tamaño de las deleciones varía de docenas de pares de bases a decenas de miles de pb. [82] En promedio, los individuos portan ~3 variantes estructurales raras que alteran las regiones codificantes, por ejemplo, eliminan exones . Alrededor del 2% de los individuos portan variantes estructurales ultrarraras a escala de megabases, especialmente reordenamientos. Es decir, millones de pares de bases pueden estar invertidos dentro de un cromosoma; ultrarraro significa que solo se encuentran en individuos o en sus familiares y, por lo tanto, han surgido muy recientemente. [82]
Frecuencia de SNP en el genoma humano
Los polimorfismos de un solo nucleótido (SNP) no se dan de forma homogénea en todo el genoma humano. De hecho, existe una enorme diversidad en la frecuencia de los SNP entre genes, lo que refleja diferentes presiones selectivas sobre cada gen, así como diferentes tasas de mutación y recombinación en todo el genoma. Sin embargo, los estudios sobre los SNP están sesgados hacia las regiones codificantes, y es poco probable que los datos generados a partir de ellos reflejen la distribución general de los SNP en todo el genoma. Por lo tanto, el protocolo del Consorcio SNP fue diseñado para identificar SNP sin sesgo hacia las regiones codificantes y los 100.000 SNP del Consorcio reflejan en general la diversidad de secuencias en los cromosomas humanos. El Consorcio SNP tiene como objetivo ampliar el número de SNP identificados en todo el genoma a 300.000 para finales del primer trimestre de 2001. [83]

Los cambios en la secuencia no codificante y los cambios sinónimos en la secuencia codificante son generalmente más comunes que los cambios no sinónimos, lo que refleja una mayor presión selectiva que reduce la diversidad en las posiciones que determinan la identidad de los aminoácidos. Los cambios transicionales son más comunes que las transversiones, y los dinucleótidos CpG muestran la tasa de mutación más alta, presumiblemente debido a la desaminación. [ cita requerida ]
Genomas personales
Una secuencia genómica personal es una secuencia (casi) completa de los pares de bases químicas que forman el ADN de una persona. Debido a que los tratamientos médicos tienen diferentes efectos en distintas personas debido a variaciones genéticas como los polimorfismos de un solo nucleótido (SNP), el análisis de los genomas personales puede conducir a un tratamiento médico personalizado basado en genotipos individuales. [84]
La primera secuencia del genoma personal que se determinó fue la de Craig Venter en 2007. Los genomas personales no habían sido secuenciados en el Proyecto Genoma Humano público para proteger la identidad de los voluntarios que proporcionaron muestras de ADN. Esa secuencia se derivó del ADN de varios voluntarios de una población diversa. [85] Sin embargo, al principio del esfuerzo de secuenciación del genoma de Celera Genomics dirigido por Venter se tomó la decisión de cambiar de secuenciar una muestra compuesta a utilizar ADN de un solo individuo, que más tarde se reveló que había sido el propio Venter. Por lo tanto, la secuencia del genoma humano de Celera publicada en 2000 fue en gran parte la de un solo hombre. La posterior sustitución de los primeros datos derivados del compuesto y la determinación de la secuencia diploide, que representa ambos conjuntos de cromosomas , en lugar de una secuencia haploide informada originalmente, permitió la liberación del primer genoma personal. [86] En abril de 2008, también se completó el de James Watson . En 2009, Stephen Quake publicó su propia secuencia del genoma derivada de un secuenciador de su propio diseño, el Heliscope. [87] Un equipo de Stanford dirigido por Euan Ashley publicó un marco para la interpretación médica de los genomas humanos implementado en el genoma de Quake y tomó decisiones médicas basadas en el genoma completo por primera vez. [88] Ese equipo extendió aún más el enfoque a la familia West, la primera familia secuenciada como parte del programa de secuenciación del genoma personal de Illumina. [89] Desde entonces, se han publicado cientos de secuencias de genomas personales, [90] incluidas las de Desmond Tutu , [91] [92] y de un paleoesquimal . [93] En 2012, se hicieron públicas las secuencias del genoma completo de dos tríos familiares entre 1092 genomas. [9] En noviembre de 2013, una familia española puso a disposición del público cuatro conjuntos de datos de exomas personales (alrededor del 1% del genoma) bajo una licencia de dominio público Creative Commons . [94] [95] El Proyecto Genoma Personal (iniciado en 2005) es uno de los pocos que pone a disposición del público tanto las secuencias del genoma como los fenotipos médicos correspondientes. [96] [97]
La secuenciación de genomas individuales reveló niveles de complejidad genética que no se habían apreciado antes. La genómica personal ayudó a revelar el nivel significativo de diversidad en el genoma humano atribuido no solo a los SNP sino también a las variaciones estructurales. Sin embargo, la aplicación de dicho conocimiento al tratamiento de enfermedades y en el campo médico está apenas en sus comienzos. [98] La secuenciación del exoma se ha vuelto cada vez más popular como una herramienta para ayudar en el diagnóstico de enfermedades genéticas porque el exoma contribuye solo con el 1% de la secuencia genómica pero representa aproximadamente el 85% de las mutaciones que contribuyen significativamente a la enfermedad. [99]
Nocauts humanos
En los seres humanos, las deficiencias genéticas se producen de forma natural como deficiencias genéticas heterocigóticas u homocigóticas por pérdida de función . Estas deficiencias suelen ser difíciles de distinguir, especialmente en contextos genéticos heterogéneos . También son difíciles de encontrar, ya que se producen en frecuencias bajas.

Las poblaciones con altas tasas de consanguinidad , como los países con altas tasas de matrimonios entre primos hermanos, muestran las frecuencias más altas de genes knockout homocigotos. Dichas poblaciones incluyen Pakistán, Islandia y las poblaciones Amish. Estas poblaciones con un alto nivel de parentesco parental han sido objeto de investigaciones sobre knockouts humanos que han ayudado a determinar la función de genes específicos en los seres humanos. Al distinguir knockouts específicos, los investigadores pueden utilizar análisis fenotípicos de estos individuos para ayudar a caracterizar el gen que ha sido knockout.

Los knockouts en genes específicos pueden causar enfermedades genéticas, tener efectos potencialmente beneficiosos o incluso no tener ningún efecto fenotípico. Sin embargo, determinar el efecto fenotípico de un knockout en humanos puede ser un desafío. Los desafíos para caracterizar e interpretar clínicamente los knockouts incluyen la dificultad para identificar variantes de ADN, determinar la alteración de la función de la proteína (anotación) y considerar la cantidad de influencia que tiene el mosaicismo en el fenotipo. [100]
Un estudio importante que investigó las mutaciones en humanos es el estudio Pakistan Risk of Myocardial Infarction. Se descubrió que los individuos que poseían una mutación heterocigótica con pérdida de función del gen APOC3 tenían niveles más bajos de triglicéridos en la sangre después de consumir una comida rica en grasas en comparación con los individuos sin la mutación. Sin embargo, los individuos que poseían mutaciones homocigóticas con pérdida de función del gen APOC3 mostraron el nivel más bajo de triglicéridos en la sangre después de la prueba de carga de grasa, ya que no producen proteína APOC3 funcional. [101]
Trastornos genéticos humanos
La mayoría de los aspectos de la biología humana involucran factores genéticos (hereditarios) y no genéticos (ambientales). Algunas variaciones hereditarias influyen en aspectos de nuestra biología que no son de naturaleza médica (altura, color de ojos, capacidad para saborear u oler ciertos compuestos, etc.). Además, algunos trastornos genéticos solo causan enfermedad en combinación con los factores ambientales apropiados (como la dieta). Con estas salvedades, los trastornos genéticos pueden describirse como enfermedades definidas clínicamente causadas por la variación de la secuencia de ADN genómico. En los casos más sencillos, el trastorno puede estar asociado con la variación en un solo gen. Por ejemplo, la fibrosis quística es causada por mutaciones en el gen CFTR y es el trastorno recesivo más común en las poblaciones caucásicas, con más de 1.300 mutaciones diferentes conocidas. [102]
Las mutaciones que causan enfermedades en genes específicos suelen ser graves en términos de función genética y son poco frecuentes, por lo que los trastornos genéticos son igualmente raros a nivel individual. Sin embargo, dado que hay muchos genes que pueden variar para causar trastornos genéticos, en conjunto constituyen un componente significativo de las afecciones médicas conocidas, especialmente en medicina pediátrica. Los trastornos genéticos caracterizados molecularmente son aquellos para los que se ha identificado el gen causal subyacente. Actualmente hay aproximadamente 2200 trastornos de este tipo anotados en la base de datos OMIM . [102]
Los estudios de trastornos genéticos se realizan a menudo mediante estudios basados en la familia. En algunos casos, se emplean enfoques basados en la población, en particular en el caso de las denominadas poblaciones fundadoras, como las de Finlandia, el Canadá francés, Utah, Cerdeña, etc. El diagnóstico y el tratamiento de los trastornos genéticos suelen estar a cargo de un genetista (médico formado en genética clínica/médica). Es probable que los resultados del Proyecto Genoma Humano proporcionen una mayor disponibilidad de pruebas genéticas para los trastornos relacionados con los genes y, en última instancia, un mejor tratamiento. Se puede examinar a los padres para detectar enfermedades hereditarias y asesorarlos sobre las consecuencias, la probabilidad de herencia y cómo evitarla o mejorarla en su descendencia.
Existen muchos tipos diferentes de variación de la secuencia de ADN, desde cromosomas adicionales o faltantes hasta cambios de un solo nucleótido. En general, se supone que gran parte de la variación genética que se produce de forma natural en las poblaciones humanas es fenotípicamente neutral, es decir, tiene poco o ningún efecto detectable en la fisiología del individuo (aunque puede haber diferencias fraccionarias en la aptitud definidas a lo largo de períodos de tiempo evolutivos). Los trastornos genéticos pueden ser causados por cualquiera o todos los tipos conocidos de variación de la secuencia. Para caracterizar molecularmente un nuevo trastorno genético, es necesario establecer un vínculo causal entre una variante de secuencia genómica particular y la enfermedad clínica que se investiga. Dichos estudios constituyen el ámbito de la genética molecular humana.
Con la aparición del Genoma Humano y el Proyecto Internacional HapMap , se ha hecho posible explorar las influencias genéticas sutiles en muchas enfermedades comunes, como la diabetes, el asma, la migraña, la esquizofrenia, etc. Aunque se han establecido algunos vínculos causales entre las variantes de la secuencia genómica en genes particulares y algunas de estas enfermedades, a menudo con mucha publicidad en los medios de comunicación en general, por lo general no se las considera trastornos genéticos en sí, ya que sus causas son complejas e involucran muchos factores genéticos y ambientales diferentes. Por lo tanto, puede haber desacuerdo en casos particulares sobre si una condición médica específica debe denominarse trastorno genético.
Otros trastornos genéticos que se pueden mencionar son el síndrome de Kallman y el síndrome de Pfeiffer (gen FGFR1), la distrofia corneal de Fuchs (gen TCF4), la enfermedad de Hirschsprung (genes RET y FECH), el síndrome de Bardet-Biedl 1 (genes CCDC28B y BBS1), el síndrome de Bardet-Biedl 10 (gen BBS10) y la distrofia muscular facioescapulohumeral tipo 2 (genes D4Z4 y SMCHD1). [103]
La secuenciación del genoma ahora puede limitar el genoma a ubicaciones específicas para encontrar con mayor precisión las mutaciones que darán lugar a un trastorno genético. Las variantes del número de copias (CNV) y las variantes de un solo nucleótido (SNV) también se pueden detectar al mismo tiempo que la secuenciación del genoma con los procedimientos de secuenciación más nuevos disponibles, llamados secuenciación de próxima generación (NGS). [104] Esto solo analiza una pequeña porción del genoma, alrededor del 1-2%. Los resultados de esta secuenciación se pueden utilizar para el diagnóstico clínico de una condición genética, incluido el síndrome de Usher , la enfermedad de la retina, las deficiencias auditivas, la diabetes, la epilepsia, la enfermedad de Leigh , los cánceres hereditarios, las enfermedades neuromusculares, las inmunodeficiencias primarias, la inmunodeficiencia combinada grave (SCID) y las enfermedades de las mitocondrias. [105] La NGS también se puede utilizar para identificar portadores de enfermedades antes de la concepción. Las enfermedades que se pueden detectar en esta secuenciación incluyen la enfermedad de Tay-Sachs , el síndrome de Bloom , la enfermedad de Gaucher , la enfermedad de Canavan , la disautonomía familiar , la fibrosis quística, la atrofia muscular espinal y el síndrome del cromosoma X frágil . La secuenciación del genoma siguiente se puede acotar para buscar específicamente enfermedades más prevalentes en ciertas poblaciones étnicas. [106]
| Trastorno | Predominio | Cromosoma o gen involucrado |
|---|---|---|
| Condiciones cromosómicas | ||
| Síndrome de Down | 1:600 | Cromosoma 21 |
| Síndrome de Klinefelter | 1:500–1000 machos | Cromosoma X adicional |
| Síndrome de Turner | 1:2000 hembras | Pérdida del cromosoma X |
| Anemia de células falciformes | 1 de cada 50 nacimientos en algunas partes de África; más raro en otros lugares | β-globina (en el cromosoma 11) |
| Síndrome de Bloom | 1:48000 judíos asquenazíes | Negro de masas |
| Cánceres | ||
| Cáncer de mama / ovario (susceptibilidad) | ~5% de los casos de estos tipos de cáncer | BRCA1, BRCA2 |
| FAP (coli hereditario no asociado a poliposis) | 1:3500 | Vehículo blindado |
| Síndrome de Lynch | 5–10% de todos los casos de cáncer de intestino | MLH1, MSH2, MSH6 y PMS2 |
| Anemia de Fanconi | 1:130000 nacimientos | Comunidad de Fanáticos del Cine |
| Afecciones neurológicas | ||
| Enfermedad de Huntington | 1:20000 | Huntingtina |
| Enfermedad de Alzheimer : aparición temprana | 1:2500 | PS1 , PS2 , APLICACIÓN |
| Tay Sachs | 1:3600 nacimientos entre los judíos asquenazíes | Gen HEXA (en el cromosoma 15) |
| Enfermedad de Canavan | 2,5% de ascendencia judía de Europa del Este | Gen ASPA (en el cromosoma 17) |
| Disautonomía familiar | 600 casos conocidos en todo el mundo desde su descubrimiento | Gen IKBKAP (en el cromosoma 9) |
| Síndrome del cromosoma X frágil | 1,4:10000 en hombres, 0,9:10000 en mujeres | Gen FMR1 (en el cromosoma X) |
| Mucolipidosis tipo IV | 1:90 a 1:100 en judíos asquenazíes | MCOLN1 |
| Otras condiciones | ||
| Fibrosis quística | 1:2500 | CFTR |
| Distrofia muscular de Duchenne | 1:3500 niños | Distrofina |
| Distrofia muscular de Becker | 1,5–6:100.000 hombres | DMD |
| Talasemia beta | 1:100000 | Alta presión arterial |
| Hiperplasia suprarrenal congénita | 1:280 en Nativos americanos y esquimales yupik 1:15000 en caucásicos estadounidenses | CYP21A2 |
| Enfermedad de almacenamiento de glucógeno tipo I | 1:100.000 nacimientos en Estados Unidos | G6PC |
| Enfermedad de la orina con olor a jarabe de arce | 1:180000 en los EE.UU. 1:176 en comunidades menonitas/amish 1:250000 en Austria | BCKDHA, BCKDHB, TCD, DLD |
| Enfermedad de Niemann-Pick, asociada a SMPD1 | 1.200 casos en todo el mundo | SMPD1 |
| Síndrome de Usher | 1:23000 en los EE.UU. 1:28000 en Noruega 1:12500 en Alemania | CDH23, CLRN1, DFNB31, GPR98, MYO7A, PCDH15, USH1C, USH1G, USH2A |
Evolución
−10 — – −9 — – −8 — – −7 — – -6 — – −5 — – −4 — – −3 — – -2 — – -1 — – 0 — | ( O. praegens ) ( O. tugenensis ) ( Arbusto ramidus ) |
| ||||||||||||||||||||||||||||
Los estudios genómicos comparativos de genomas de mamíferos sugieren que aproximadamente el 5% del genoma humano ha sido conservado por la evolución desde la divergencia de los linajes existentes hace aproximadamente 200 millones de años, y contiene la gran mayoría de los genes. [107] [108] El genoma del chimpancé publicado difiere del genoma humano en un 1,23% en comparaciones de secuencias directas. [109] Alrededor del 20% de esta cifra se explica por la variación dentro de cada especie, lo que deja solo ~1,06% de divergencia de secuencia consistente entre humanos y chimpancés en genes compartidos. [110] Sin embargo, esta diferencia de nucleótido por nucleótido se ve eclipsada por la porción de cada genoma que no se comparte, incluido alrededor del 6% de los genes funcionales que son exclusivos de los humanos o los chimpancés. [111]
En otras palabras, las considerables diferencias observables entre humanos y chimpancés pueden deberse tanto o más a la variación a nivel del genoma en el número, función y expresión de genes, en lugar de a cambios en la secuencia de ADN en genes compartidos. De hecho, incluso en humanos, se ha descubierto que existe una cantidad previamente no apreciada de variación en el número de copias (CNV), que puede representar hasta un 5-15% del genoma humano. En otras palabras, entre humanos, podría haber +/- 500.000.000 pares de bases de ADN, algunos de los cuales son genes activos, otros inactivados o activos en diferentes niveles. El significado completo de este hallazgo aún está por verse. En promedio, un gen codificador de proteína humano típico difiere de su ortólogo de chimpancé en solo dos sustituciones de aminoácidos ; casi un tercio de los genes humanos tienen exactamente la misma traducción de proteínas que sus ortólogos de chimpancé. Una diferencia importante entre los dos genomas es el cromosoma humano 2 , que es equivalente a un producto de fusión de los cromosomas 12 y 13 del chimpancé. [112] (posteriormente renombrados como cromosomas 2A y 2B, respectivamente).
Los seres humanos hemos sufrido una pérdida extraordinaria de genes receptores olfativos durante nuestra evolución reciente, lo que explica nuestro sentido del olfato relativamente rudimentario en comparación con el de la mayoría de los demás mamíferos. La evidencia evolutiva sugiere que la aparición de la visión del color en los seres humanos y en varias otras especies de primates ha disminuido la necesidad del sentido del olfato. [113]
En septiembre de 2016, los científicos informaron que, basándose en estudios genéticos de ADN humano, todos los no africanos del mundo actual pueden rastrearse hasta una única población que salió de África hace entre 50.000 y 80.000 años. [114]
ADN mitocondrial
El ADN mitocondrial humano es de enorme interés para los genetistas, ya que sin duda desempeña un papel en las enfermedades mitocondriales . También arroja luz sobre la evolución humana; por ejemplo, el análisis de la variación en el genoma mitocondrial humano ha llevado a la postulación de un ancestro común reciente para todos los humanos en la línea de descendencia materna (véase Eva mitocondrial ).
Debido al daño inducido por la exposición a especies reactivas de oxígeno, el ADN mitocondrial (ADNmt) tiene una tasa de variación más rápida que el ADN nuclear. Esta tasa de mutación 20 veces mayor permite que el ADNmt se utilice para un rastreo más preciso de la ascendencia materna. [ cita requerida ] Los estudios de ADNmt en poblaciones han permitido rastrear rutas de migración antiguas, como la migración de los nativos americanos desde Siberia [115] o los polinesios del sudeste asiático . [ cita requerida ] También se ha utilizado para demostrar que no hay rastro de ADN neandertal en la mezcla genética europea heredada a través del linaje puramente materno. [ 116 ] Debido a la restrictiva manera de todo o nada de herencia del ADNmt, este resultado (ningún rastro de ADNmt neandertal) sería probable a menos que hubiera un gran porcentaje de ascendencia neandertal, o hubiera una fuerte selección positiva para ese ADNmt. Por ejemplo, si nos remontamos a cinco generaciones, solo 1 de los 32 ancestros de una persona contribuyó al ADNmt de esa persona, por lo que si uno de estos 32 era neandertal puro, aproximadamente el 3 % del ADN autosómico de esa persona sería de origen neandertal, pero tendría una probabilidad del 97 % de no tener rastros de ADNmt neandertal. [ cita requerida ]
Epigenoma
La epigenética describe una variedad de características del genoma humano que trascienden su secuencia primaria de ADN, como el empaquetamiento de la cromatina , las modificaciones de las histonas y la metilación del ADN , y que son importantes para regular la expresión génica, la replicación del genoma y otros procesos celulares. Los marcadores epigenéticos fortalecen y debilitan la transcripción de ciertos genes, pero no afectan la secuencia real de nucleótidos del ADN. La metilación del ADN es una forma importante de control epigenético sobre la expresión génica y uno de los temas más estudiados en epigenética. Durante el desarrollo, el perfil de metilación del ADN humano experimenta cambios dramáticos. En las células de la línea germinal temprana, el genoma tiene niveles de metilación muy bajos. Estos niveles bajos generalmente describen genes activos. A medida que avanza el desarrollo, las etiquetas de impronta parental conducen a una mayor actividad de metilación. [117] [118]
Los patrones epigenéticos pueden identificarse entre los tejidos de un individuo, así como entre los propios individuos. Los genes idénticos que tienen diferencias solo en su estado epigenético se denominan epialelos . Los epialelos pueden clasificarse en tres categorías: los que están directamente determinados por el genotipo de un individuo, los que están influidos por el genotipo y los que son totalmente independientes del genotipo. El epigenoma también está influido significativamente por factores ambientales. La dieta, las toxinas y las hormonas afectan el estado epigenético. Los estudios sobre manipulación dietética han demostrado que las dietas deficientes en metilo están asociadas con la hipometilación del epigenoma. Dichos estudios establecen la epigenética como una interfaz importante entre el medio ambiente y el genoma. [119]
Véase también
Referencias
- ^ Brown TA (2002). El genoma humano (2.ª ed.). Oxford: Wiley-Liss.
- ^ ab Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. (febrero de 2001). "Secuenciación inicial y análisis del genoma humano". Nature . 409 (6822): 860–921. Bibcode :2001Natur.409..860L. doi : 10.1038/35057062 . hdl : 2027.42/62798 . PMID 11237011.
- ^ abcde Nurk S, Koren S, Rhie A, Rautiainen M, Bzikadze AV, Mikheenko A, et al. (abril de 2022). "La secuencia completa de un genoma humano". Ciencia . 376 (6588): 44–53. Código Bib : 2022 Ciencia... 376... 44N. doi : 10.1126/ciencia.abj6987. PMC 9186530 . PMID 35357919. S2CID 247854936.
- ^ ab "CHM13 T2T v1.1 – Genoma – Ensamblaje – NCBI". www.ncbi.nlm.nih.gov . Consultado el 26 de julio de 2021 .
- ^ Rhie A, Nurk S, Cechova M, Hoyt SJ, Taylor DJ, Altemose N, et al. (septiembre de 2023). "La secuencia completa de un cromosoma Y humano". Nature . 621 (7978): 344–354. Bibcode :2023Natur.621..344R. doi :10.1038/s41586-023-06457-y. PMC 10752217 . PMID 37612512.
Recibido el 2 de diciembre de 2022
- ^ "Ensamblaje humano y anotación de genes". Ensembl . 2022 . Consultado el 28 de febrero de 2024 .
- ^ Hallast P, Ebert P, Loftus M, Yilmaz F, Audano PA, Logsdon GA, et al. (septiembre de 2023). "El ensamblaje de 43 cromosomas Y humanos revela una gran complejidad y variación". Nature . 621 (7978): 355–364. Bibcode :2023Natur.621..355H. doi :10.1038/s41586-023-06425-6. ISSN 0028-0836. PMC 10726138 . PMID 37612510.
- ^ abcdef Liao WW, Asri M, Ebler J, Doerr D, Haukness M, Hickey G, et al. (mayo de 2023). "Borrador de una referencia del pangenoma humano". Nature . 617 (7960): 312–324. Bibcode :2023Natur.617..312L. doi :10.1038/s41586-023-05896-x. PMC 10172123 . PMID 37165242.
- ^ ab Abecasis GR, Auton A, Brooks LD, DePristo MA, Durbin RM, Handsaker RE, et al. (noviembre de 2012). "Un mapa integrado de la variación genética de 1.092 genomas humanos". Nature . 491 (7422): 56–65. Bibcode :2012Natur.491...56T. doi :10.1038/nature11632. PMC 3498066 . PMID 23128226.
- ^ Auton A, Brooks LD, Durbin RM, Garrison EP, Kang HM, Korbel JO, et al. (octubre de 2015). "Una referencia global para la variación genética humana". Nature . 526 (7571): 68–74. Bibcode :2015Natur.526...68T. doi :10.1038/nature15393. PMC 4750478 . PMID 26432245.
- ^ Consorcio para el análisis de secuenciación de chimpancés (septiembre de 2005). "Secuencia inicial del genoma del chimpancé y comparación con el genoma humano". Nature . 437 (7055): 69–87. Bibcode :2005Natur.437...69.. doi : 10.1038/nature04072 . PMID 16136131. S2CID 2638825.
- ^ Varki A, Altheide TK (diciembre de 2005). "Comparación de los genomas humano y del chimpancé: buscando agujas en un pajar". Genome Research . 15 (12): 1746–1758. doi : 10.1101/gr.3737405 . PMID 16339373.
- ^ "Ensamblaje del genoma humano". Ensembl . Consultado el 23 de enero de 2024 .
- ^ Abascal F, Juan D, Jungreis I, Martinez L, Rigau M, Rodriguez JM, et al. (2018). "Cabos sueltos: casi uno de cada cinco genes humanos aún tiene un estado de codificación sin resolver". Nucleic Acids Research . 46 (14): 7070–7084. doi :10.1093/nar/gky587. PMC 6101605 . PMID 29982784.
- ^ Hatje K, Mühlhausen S, Simm D, Killmar M (2019). "El genoma humano codificador de proteínas: anotación de frutos maduros". BioEssays . 41 (11): 1900066. doi :10.1002/bies.201900066. PMID 31544971.
- ^ Omenn GS , Lane L , Everyone G ...
- ^ Amaral P, Carbonell-Sala S, De La Vega FM, Faial T, Frankish A, Gingeras T, et al. (2023). "El estado del catálogo de genes humanos". Nature . 622 (7981): 41–47. arXiv : 2303.13996 . Bibcode :2023Natur.622...41A. doi :10.1038/s41586-023-06490-x. PMC 10575709 . PMID 37794265.
- ^ ab Piovesan A, Antonaros F, Vitale L, Strippoli P, Pelleri MC, Caracausi M (2019). "Genes codificadores de proteínas humanas y estadísticas de características genéticas en 2019". BMC Research Notes . 12 (1): 315. doi : 10.1186/s13104-019-4343-8 . PMC 6549324 . PMID 31164174.
- ^ Francis WR, Wörheide G (junio de 2017). "Relaciones similares de intrones con secuencias intergénicas en los genomas animales". Genome Biology and Evolution . 9 (6): 1582–1598. doi :10.1093/gbe/evx103. PMC 5534336 . PMID 28633296.
- ^ Hatje K, Mühlhausen S, Simm D, Killmar M (2019). "El genoma humano codificador de proteínas: anotación de frutos maduros". BioEssays . 41 (11): 1900066. doi :10.1002/bies.201900066. PMID 31544971.
- ^ Pennisi E (septiembre de 2012). "Genómica. El proyecto ENCODE escribe un elogio al ADN basura". Science . 337 (6099): 1159–1161. doi :10.1126/science.337.6099.1159. PMID 22955811.
- ^ Iyer MK, Niknafs YS, Malik R, Singhal U, Sahu A, Hosono Y, et al. (marzo de 2015). "El panorama de los ARN largos no codificantes en el transcriptoma humano". Nature Genetics . 47 (3): 199–208. doi :10.1038/ng.3192. PMC 4417758 . PMID 25599403.
- ^ Eddy SR (diciembre de 2001). "Genes de ARN no codificantes y el mundo moderno del ARN". Nature Reviews Genetics . 2 (12): 919–929. doi :10.1038/35103511. PMID 11733745. S2CID 18347629.
- ^ Managadze D, Lobkovsky AE, Wolf YI, Shabalina SA, Rogozin IB, Koonin EV (2013). "El vasto y conservado lincRNome de los mamíferos". PLOS Computational Biology . 9 (2): e1002917. Bibcode :2013PLSCB...9E2917M. doi : 10.1371/journal.pcbi.1002917 . PMC 3585383 . PMID 23468607.
- ^ Palazzo AF, Lee ES (2015). "ARN no codificante: ¿qué es funcional y qué es basura?". Frontiers in Genetics . 6 : 2. doi : 10.3389/fgene.2015.00002 . PMC 4306305 . PMID 25674102.
- ^ Mattick JS, Makunin IV (abril de 2006). "ARN no codificante". Human Molecular Genetics . 15 (especificación n.° 1): R17–29. doi : 10.1093/hmg/ddl046 . PMID 16651366.
- ^ Pei B, Sisu C, Frankish A, Howald C, Habegger L, Mu XJ, et al. (2012). "El recurso de pseudogenes GENCODE". Genome Biology . 13 (9): R51. doi : 10.1186/gb-2012-13-9-r51 . PMC 3491395 . PMID 22951037.
- ^ Gilad Y, Man O, Pääbo S, Lancet D (marzo de 2003). "Pérdida específica humana de genes de receptores olfativos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (6): 3324–3327. Bibcode :2003PNAS..100.3324G. doi : 10.1073/pnas.0535697100 . PMC 152291 . PMID 12612342.
- ^ ab Bernstein BE, Birney E, Dunham I, Green ED, Gunter C, Snyder M (septiembre de 2012). "Una enciclopedia integrada de elementos de ADN en el genoma humano". Nature . 489 (7414): 57–74. Bibcode :2012Natur.489...57T. doi :10.1038/nature11247. PMC 3439153 . PMID 22955616.
- ^ Birney E (5 de septiembre de 2012). "ENCODE: Mis propios pensamientos". Blog de Ewan: Bioinformático en general .
- ^ Stamatoyannopoulos JA (septiembre de 2012). "¿Qué codifica nuestro genoma?". Genome Research . 22 (9): 1602–1611. doi :10.1101/gr.146506.112. PMC 3431477 . PMID 22955972.
- ^ Carroll SB, Gompel N, Prudhomme B (mayo de 2008). "Regulación de la evolución". Scientific American . 298 (5): 60–67. Código Bibliográfico :2008SciAm.298e..60C. doi :10.1038/scientificamerican0508-60. PMID 18444326.
- ^ Miller JH, Ippen K, Scaife JG, Beckwith JR (1968). "La región promotora-operadora del operón lac de Escherichia coli". J. Mol. Biol . 38 (3): 413–420. doi :10.1016/0022-2836(68)90395-1. PMID 4887877.
- ^ Wright S, Rosenthal A, Flavell R, Grosveld F (1984). "Secuencias de ADN necesarias para la expresión regulada de genes de beta-globina en células de eritroleucemia murina". Cell . 38 (1): 265–273. doi :10.1016/0092-8674(84)90548-8. PMID 6088069. S2CID 34587386.
- ^ Nei M, Xu P, Glazko G (febrero de 2001). "Estimación de los tiempos de divergencia a partir de secuencias multiproteicas para algunas especies de mamíferos y varios organismos distantemente relacionados". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 98 (5): 2497–2502. Bibcode :2001PNAS...98.2497N. doi : 10.1073/pnas.051611498 . PMC 30166 . PMID 11226267.
- ^ Loots GG, Locksley RM, Blankespoor CM, Wang ZE, Miller W, Rubin EM, et al. (abril de 2000). "Identificación de un regulador coordinado de las interleucinas 4, 13 y 5 mediante comparaciones de secuencias entre especies". Science . 288 (5463): 136–140. Bibcode :2000Sci...288..136L. doi :10.1126/science.288.5463.136. PMID 10753117.Resumen Archivado el 6 de noviembre de 2009 en Wayback Machine.
- ^ Meunier M. "Genoscope y Whitehead anuncian una alta cobertura de secuencias del genoma de Tetraodon nigroviridis". Genoscope. Archivado desde el original el 16 de octubre de 2006. Consultado el 12 de septiembre de 2006 .
- ^ Romero IG, Ruvinsky I, Gilad Y (julio de 2012). "Estudios comparativos de la expresión génica y la evolución de la regulación génica". Nature Reviews Genetics . 13 (7): 505–516. doi :10.1038/nrg3229. PMC 4034676 . PMID 22705669.
- ^ Schmidt D, Wilson MD, Ballester B, Schwalie PC, Brown GD, Marshall A, et al. (mayo de 2010). "ChIP-seq de cinco vertebrados revela la dinámica evolutiva de la unión de factores de transcripción". Science . 328 (5981): 1036–1040. Bibcode :2010Sci...328.1036S. doi :10.1126/science.1186176. PMC 3008766 . PMID 20378774.
- ^ Wilson MD, Barbosa-Morais NL, Schmidt D, Conboy CM, Vanes L, Tybulewicz VL, et al. (octubre de 2008). "Transcripción específica de especie en ratones portadores del cromosoma humano 21". Science . 322 (5900): 434–438. Bibcode :2008Sci...322..434W. doi :10.1126/science.1160930. PMC 3717767 . PMID 18787134.
- ^ Treangen TJ, Salzberg SL (enero de 2012). "ADN repetitivo y secuenciación de próxima generación: desafíos computacionales y soluciones". Nature Reviews Genetics . 13 (1): 36–46. doi :10.1038/nrg3117. PMC 3324860 . PMID 22124482.
- ^ Duitama J, Zablotskaya A, Gemayel R, Jansen A, Belet S, Vermeesch JR, et al. (mayo de 2014). "Análisis a gran escala de la variabilidad de las repeticiones en tándem en el genoma humano". Nucleic Acids Research . 42 (9): 5728–5741. doi :10.1093/nar/gku212. PMC 4027155 . PMID 24682812.
- ^ Pierce BA (2012). Genética: un enfoque conceptual (4ª ed.). Nueva York: WH Freeman. págs. 538–540. ISBN 978-1-4292-3250-0.
- ^ "minisatélite, n. significados, etimología y más | Oxford English Dictionary". www.oed.com . Consultado el 8 de octubre de 2023 .
- ^ Bennett EA, Keller H, Mills RE, Schmidt S, Moran JV, Weichenrieder O, et al. (diciembre de 2008). "Retrotransposones Alu activos en el genoma humano". Genome Research . 18 (12): 1875–1883. doi :10.1101/gr.081737.108. PMC 2593586 . PMID 18836035.
- ^ Liang KH, Yeh CT (2013). "Una red de restricción de la expresión génica mediada por secuencias Alu con sentido y antisentido ubicadas en ARN mensajeros codificadores de proteínas". BMC Genomics . 14 : 325. doi : 10.1186/1471-2164-14-325 . PMC 3655826 . PMID 23663499.
- ^ Brouha B, Schustak J, Badge RM, Lutz-Prigge S, Farley AH, Moran JV, et al. (abril de 2003). "Las L1 calientes representan la mayor parte de la retrotransposición en la población humana". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 100 (9): 5280–5285. Bibcode :2003PNAS..100.5280B. doi : 10.1073/pnas.0831042100 . PMC 154336 . PMID 12682288.
- ^ Barton NH, Briggs DE, Eisen JA, Goldstein DB, Patel NH (2007). Evolución . Cold Spring Harbor, Nueva York: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-684-9.[ página necesaria ]
- ^ abc Kellis M, Wold B, Snyder MP, Bernstein BE, Kundaje A, Marinov GK, et al. (abril de 2014). "Definición de elementos funcionales del ADN en el genoma humano". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 111 (17): 6131–6138. Bibcode :2014PNAS..111.6131K. doi : 10.1073/pnas.1318948111 . PMC 4035993 . PMID 24753594.
- ^ Linquist S, Doolittle WF, Palazzo AF (abril de 2020). "Aclarando la palabra F en genómica". PLOS Genetics . 16 (4): e1008702. doi : 10.1371/journal.pgen.1008702 . PMC 7153884 . PMID 32236092.
- ^ Doolittle WF (diciembre de 2018). "No podemos seguir siendo tan vagos en cuanto a la 'función'". Genome Biology . 19 (1): 223. doi : 10.1186/s13059-018-1600-4 . PMC 6299606 . PMID 30563541.
- ^ ab Graur D (2017). "ADN basura: la fracción sin función del genoma humano". Evolución del genoma humano I. Estudios evolutivos. Tokio: Springer. págs. 19-60. arXiv : 1601.06047 . doi :10.1007/978-4-431-56603-8_2. ISBN . 978-4-431-56603-8.S2CID17826096 .
- ^ ab Pena SD (2021). "Una descripción general del genoma humano: ADN codificante y ADN no codificante". En Haddad LA (ed.). Estructura, función y consideraciones clínicas del genoma humano . Cham: Springer Nature. págs. 5-7. ISBN 978-3-03-073151-9.
- ^ Abascal F, Acosta R, Addleman NJ, Adrian J, et al. (30 de julio de 2020). "Enciclopedias ampliadas de elementos de ADN en los genomas humano y de ratón". Nature . 583 (7818): 699–710. Bibcode :2020Natur.583..699E. doi :10.1038/s41586-020-2493-4. PMC 7410828 . PMID 32728249.
Operacionalmente, los elementos funcionales se definen como características de secuencia discretas y ordenadas linealmente que especifican productos moleculares (por ejemplo, genes codificantes de proteínas o ARN no codificantes) o actividades bioquímicas con funciones mecanicistas en la regulación de genes o genomas (por ejemplo, promotores o potenciadores transcripcionales).
- ^ Graur D (julio de 2017). "Un límite superior en la fracción funcional del genoma humano". Genome Biology and Evolution . 9 (7): 1880–1885. doi :10.1093/gbe/evx121. PMC 5570035 . PMID 28854598. Resumen para legos en: Le Page M (17 de julio de 2017). "Al menos el 75 por ciento de nuestro ADN es basura inútil después de todo". NewScientist .
- ^ Dunham I, Kundaje A, Aldred SF, Collins PJ, Davis CA, Doyle F, et al. (The ENCODE Project Consortium) (septiembre de 2012). "Una enciclopedia integrada de elementos de ADN en el genoma humano". Nature . 489 (7414): 57–74. Bibcode :2012Natur.489...57T. doi :10.1038/nature11247. PMC 3439153 . PMID 22955616.
Estos datos nos permitieron asignar funciones bioquímicas al 80% del genoma, en particular fuera de las regiones codificantes de proteínas bien estudiadas.
. - ^ Andolfatto P (octubre de 2005). "Evolución adaptativa del ADN no codificante en Drosophila". Nature . 437 (7062): 1149–52. Bibcode :2005Natur.437.1149A. doi :10.1038/nature04107. PMID 16237443. S2CID 191219.Resumen para legos en: "Estudio de la UCSD muestra que el ADN 'basura' tiene importancia evolutiva". ScienceDaily . Rockville, MD. 20 de octubre de 2005.
- ^ "El Consorcio Internacional de Secuenciación del Genoma Humano publica la secuencia y el análisis del genoma humano". Instituto Nacional de Investigación del Genoma Humano . Institutos Nacionales de Salud, Departamento de Salud y Recursos Humanos de los Estados Unidos. 12 de febrero de 2001.
- ^ Pennisi E (febrero de 2001). "El genoma humano". Science . 291 (5507): 1177–1180. doi :10.1126/science.291.5507.1177. PMID 11233420. S2CID 38355565.
- ^ ab Consorcio Internacional de Secuenciación del Genoma Humano (octubre de 2004). «Terminación de la secuencia eucromática del genoma humano». Nature . 431 (7011): 931–945. Bibcode :2004Natur.431..931H. doi : 10.1038/nature03001 . PMID 15496913.
- ^ Molteni M (19 de noviembre de 2018). "Ahora puedes secuenciar todo tu genoma por solo 200 dólares". Wired .
- ^ Saey TH (17 de septiembre de 2018). "Un recuento de genes humanos eleva la cifra a al menos 46.831". Noticias de ciencia .
- ^ Alles J, Fehlmann T, Fischer U, Backes C, Galata V, Minet M, et al. (abril de 2019). "Una estimación del número total de miRNA humanos verdaderos". Nucleic Acids Research . 47 (7): 3353–3364. doi :10.1093/nar/gkz097. PMC 6468295 . PMID 30820533.
- ^ Zhang S (28 de noviembre de 2018). «Faltan 300 millones de letras de ADN en el genoma humano». The Atlantic .
- ^ Wade N (23 de septiembre de 1999). "Se calcula que el número de genes humanos es de 140.000, un aumento significativo". The New York Times .
- ^ Ezkurdia I, Juan D, Rodriguez JM, Frankish A, Diekhans M, Harrow J, et al. (noviembre de 2014). "Varias evidencias sugieren que puede haber tan solo 19.000 genes codificadores de proteínas humanas". Human Molecular Genetics . 23 (22): 5866–5878. doi :10.1093/hmg/ddu309. PMC 4204768 . PMID 24939910.
- ^ Wrighton K (febrero de 2021). "Rellenando los huecos de telómero a telómero". Nature Milestones: Secuenciación genómica : S21.
- ^ ab "Los científicos secuencian el genoma humano completo por primera vez". CNN . 31 de marzo de 2022 . Consultado el 1 de abril de 2022 .
- ^ Zhang S (28 de noviembre de 2018). «Faltan 300 millones de letras de ADN en el genoma humano». The Atlantic . Consultado el 16 de agosto de 2019 .
- ^ Chaisson MJ, Huddleston J, Dennis MY, Sudmant PH, Malig M, Hormozdiari F, et al. (enero de 2015). "Resolución de la complejidad del genoma humano mediante secuenciación de moléculas individuales". Nature . 517 (7536): 608–611. Bibcode :2015Natur.517..608C. doi :10.1038/nature13907. PMC 4317254 . PMID 25383537.
- ^ Miga KH , Koren S, Rhie A, Vollger MR, Gershman A, Bzikadze A, et al. (septiembre de 2020). "Ensamblaje de telómero a telómero de un cromosoma X humano completo". Nature . 585 (7823): 79–84. Bibcode :2020Natur.585...79M. doi :10.1038/s41586-020-2547-7. PMC 7484160 . PMID 32663838.
- ^ Logsdon GA, Vollger MR, Hsieh P, Mao Y, Liskovykh MA, Koren S, et al. (mayo de 2021). "La estructura, función y evolución de un cromosoma humano 8 completo". Nature . 593 (7857): 101–107. Bibcode :2021Natur.593..101L. doi :10.1038/s41586-021-03420-7. PMC 8099727 . PMID 33828295.
- ^ "Lista de genomas – Genoma – NCBI". www.ncbi.nlm.nih.gov . Consultado el 26 de julio de 2021 .
- ^ NCBI . «GRCh38 – hg38 – Genoma – Ensamblaje». ncbi.nlm.nih.gov . Consultado el 15 de marzo de 2019 .
- ^ "del discurso sobre el Estado de la Unión de Bill Clinton de 2000". Archivado desde el original el 21 de febrero de 2017 . Consultado el 14 de junio de 2007 .
- ^ Redon R, Ishikawa S, Fitch KR, Feuk L, Perry GH, Andrews TD, et al. (noviembre de 2006). "Variación global en el número de copias en el genoma humano". Nature . 444 (7118): 444–454. Bibcode :2006Natur.444..444R. doi :10.1038/nature05329. PMC 2669898 . PMID 17122850.
- ^ "¿Qué es un genoma?". Genomenewsnetwork.org. 15 de enero de 2003. Consultado el 31 de mayo de 2009 .
- ^ "Hoja informativa: Mapeo del genoma: una guía para la autopista genética que llamamos genoma humano". Centro Nacional de Información Biotecnológica . Biblioteca Nacional de Medicina de EE. UU., Institutos Nacionales de Salud. 29 de marzo de 2004. Archivado desde el original el 19 de julio de 2010. Consultado el 31 de mayo de 2009 .
- ^ "Acerca del proyecto". Proyecto Internacional HapMap . Archivado desde el original el 15 de mayo de 2008. Consultado el 31 de mayo de 2009 .
- ^ "Publicación de 2008: los investigadores producen el primer mapa de secuencias de variación estructural a gran escala en el genoma humano". genome.gov . Consultado el 31 de mayo de 2009 .
- ^ Kidd JM, Cooper GM, Donahue WF, Hayden HS, Sampas N, Graves T, et al. (mayo de 2008). "Mapeo y secuenciación de la variación estructural de ocho genomas humanos". Nature . 453 (7191): 56–64. Bibcode :2008Natur.453...56K. doi :10.1038/nature06862. PMC 2424287 . PMID 18451855.
- ^ ab Abel HJ, Larson DE, Regier AA, Chiang C, Das I, Kanchi KL, et al. (julio de 2020). "Mapeo y caracterización de la variación estructural en 17.795 genomas humanos". Nature . 583 (7814): 83–89. Bibcode :2020Natur.583...83A. doi :10.1038/s41586-020-2371-0. PMC 7547914 . PMID 32460305.
- ^ Gray IC, Campbell DA, Spurr NK (2000). "Polimorfismos de un solo nucleótido como herramientas en genética humana". Genética molecular humana . 9 (16): 2403–2408. doi : 10.1093/hmg/9.16.2403 . PMID 11005795.
- ^ Lai E (junio de 2001). "Aplicación de tecnologías SNP en medicina: lecciones aprendidas y desafíos futuros". Genome Research . 11 (6): 927–929. doi : 10.1101/gr.192301 . PMID 11381021.
- ^ "Finalización del Proyecto Genoma Humano: Preguntas frecuentes". genome.gov . Consultado el 31 de mayo de 2009 .
- ^ Singer E (4 de septiembre de 2007). "El genoma de Craig Venter". MIT Technology Review . Archivado desde el original el 7 de junio de 2011. Consultado el 25 de mayo de 2010 .
- ^ Pushkarev D, Neff NF, Quake SR (septiembre de 2009). "Secuenciación de una sola molécula de un genoma humano individual". Nature Biotechnology . 27 (9): 847–850. doi :10.1038/nbt.1561. PMC 4117198 . PMID 19668243.
- ^ Ashley EA, Butte AJ, Wheeler MT, Chen R, Klein TE, Dewey FE, et al. (mayo de 2010). "Evaluación clínica que incorpora un genoma personal". Lancet . 375 (9725): 1525–1535. doi :10.1016/S0140-6736(10)60452-7. PMC 2937184 . PMID 20435227.
- ^ Dewey FE, Chen R, Cordero SP, Ormond KE, Caleshu C, Karczewski KJ, et al. (septiembre de 2011). "Riesgo genético de todo el genoma en fases en un cuarteto familiar utilizando una secuencia de referencia de alelos principales". PLOS Genetics . 7 (9): e1002280. doi : 10.1371/journal.pgen.1002280 . PMC 3174201 . PMID 21935354.
- ^ "Complete Genomics agrega 29 conjuntos de datos de secuenciación del genoma humano completos y de alta cobertura a su repositorio genómico público" (Comunicado de prensa).
- ^ Muestra I (17 de febrero de 2010). "Secuencian el genoma de Desmond Tutu como parte de un estudio de diversidad genética". The Guardian .
- ^ Schuster SC, Miller W, Ratan A, Tomsho LP, Giardine B, Kasson LR, et al. (febrero de 2010). "Genomas completos de Khoisan y Bantu del sur de África". Nature . 463 (7283): 943–947. Bibcode :2010Natur.463..943S. doi :10.1038/nature08795. PMC 3890430 . PMID 20164927.
- ^ Rasmussen M, Li Y, Lindgreen S, Pedersen JS, Albrechtsen A, Moltke I, et al. (febrero de 2010). "Secuencia del genoma humano antiguo de un paleoesquimal extinto". Naturaleza . 463 (7282): 757–762. Código Bib :2010Natur.463..757R. doi : 10.1038/naturaleza08835. PMC 3951495 . PMID 20148029.
- ^ Corpas M , Cariaso M, Coletta A, Weiss D, Harrison AP, Moran F, et al. (12 de noviembre de 2013). "Un conjunto de datos genómicos familiares de dominio público completo". bioRxiv 10.1101/000216 .
- ^ Corpas M (junio de 2013). "Crowdsourcing del corpasoma". Código fuente para biología y medicina . 8 (1): 13. doi : 10.1186/1751-0473-8-13 . PMC 3706263 . PMID 23799911.
- ^ Mao Q, Ciotlos S, Zhang RY, Ball MP, Chin R, Carnevali P, et al. (octubre de 2016). "Secuencias del genoma completo y haplotipos en fase experimental de más de 100 genomas personales". GigaScience . 5 (1): 42. doi : 10.1186/s13742-016-0148-z . PMC 5057367 . PMID 27724973.
- ^ Cai B, Li B, Kiga N, Thusberg J, Bergquist T, Chen YC, et al. (septiembre de 2017). "Coincidencia de fenotipos con genomas completos: lecciones aprendidas de cuatro iteraciones de los desafíos comunitarios del proyecto del genoma personal". Human Mutation . 38 (9): 1266–1276. doi :10.1002/humu.23265. PMC 5645203 . PMID 28544481.
- ^ Gonzaga-Jauregui C, Lupski JR, Gibbs RA (2012). "Secuenciación del genoma humano en la salud y la enfermedad". Revista Anual de Medicina . 63 : 35–61. doi :10.1146/annurev-med-051010-162644. PMC 3656720 . PMID 22248320.
- ^ Choi M, Scholl UI, Ji W, Liu T, Tikhonova IR, Zumbo P, et al. (noviembre de 2009). "Diagnóstico genético mediante captura de exoma completo y secuenciación masiva de ADN en paralelo". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (45): 19096–19101. Bibcode :2009PNAS..10619096C. doi : 10.1073/pnas.0910672106 . PMC 2768590 . PMID 19861545.
- ^ ab Narasimhan VM, Xue Y, Tyler-Smith C (abril de 2016). "Portadores de knockout humanos: muertos, enfermos, sanos o mejorados?". Tendencias en medicina molecular . 22 (4): 341–351. doi :10.1016/j.molmed.2016.02.006. PMC 4826344. PMID 26988438 .
- ^ Saleheen D, Natarajan P, Armean IM, Zhao W, Rasheed A, Khetarpal SA, et al. (Abril de 2017). "Nocauts humanos y análisis fenotípico en una cohorte con una alta tasa de consanguinidad". Naturaleza . 544 (7649): 235–239. Código Bib :2017Natur.544..235S. doi : 10.1038/naturaleza22034. PMC 5600291 . PMID 28406212.
- ^ ab Hamosh A, Scott AF, Amberger J, Bocchini C, Valle D, McKusick VA (enero de 2002). "Online Mendelian Inheritance in Man (OMIM), una base de conocimiento de genes humanos y trastornos genéticos". Nucleic Acids Research . 30 (1): 52–55. doi : 10.1093/nar/30.1.52 . PMC 99152 . PMID 11752252.
- ^ Katsanis N (noviembre de 2016). "El continuo de causalidad en los trastornos genéticos humanos". Genome Biology . 17 (1): 233. doi : 10.1186/s13059-016-1107-9 . PMC 5114767 . PMID 27855690.
- ^ Alekseyev YO, Fazeli R, Yang S, Basran R, Maher T, Miller NS, et al. (2018). "Un cebador de secuenciación de próxima generación: ¿cómo funciona y qué puede hacer?". Academic Pathology . 5 : 2374289518766521. doi : 10.1177/2374289518766521 . PMC 5944141 . PMID 29761157.
- ^ Wong JC (2017). "Resumen de la utilidad clínica de la secuenciación de próxima generación en el diagnóstico molecular de trastornos genéticos humanos". En Wong LJ (ed.). Diagnóstico molecular clínico de trastornos genéticos humanos basado en la secuenciación de próxima generación . Cham: Springer International Publishing. págs. 1–11. doi :10.1007/978-3-319-56418-0_1. ISBN 978-3-319-56416-6.
- ^ Fedick A, Zhang J (2017). "Próxima generación de detección de portadores". En Wong LJ (ed.). Diagnóstico molecular clínico de trastornos genéticos humanos basado en secuenciación de próxima generación . Cham: Springer International Publishing. págs. 339–354. doi :10.1007/978-3-319-56418-0_16. ISBN . 978-3-319-56416-6.
- ^ Waterston RH, Lindblad-Toh K, Birney E, Rogers J, Abril JF, Agarwal P, et al. (diciembre de 2002). "Secuenciación inicial y análisis comparativo del genoma del ratón". Nature . 420 (6915): 520–562. Bibcode :2002Natur.420..520W. doi : 10.1038/nature01262 . PMID 12466850.
la proporción de segmentos pequeños (50–100 pb) en el genoma de los mamíferos que está bajo selección (purificadora) se puede estimar en alrededor del 5%. Esta proporción es mucho mayor de lo que se puede explicar solo con las secuencias codificantes de proteínas, lo que implica que el genoma contiene muchas características adicionales (como regiones no traducidas, elementos reguladores, genes no codificantes de proteínas y elementos estructurales cromosómicos) bajo selección para la función biológica.
- ^ Birney E, Stamatoyannopoulos JA, Dutta A, Guigó R, Gingeras TR, Margulies EH, et al. (junio de 2007). "Identificación y análisis de elementos funcionales en el 1% del genoma humano mediante el proyecto piloto ENCODE". Nature . 447 (7146): 799–816. Bibcode :2007Natur.447..799B. doi :10.1038/nature05874. PMC 2212820 . PMID 17571346.
- ^ The Chimpanzee Sequencing Analysis Consortium (septiembre de 2005). "Initial sequence of the chimpanzee genome and comparison with the human genome". Nature . 437 (7055): 69–87. Bibcode :2005Natur.437...69.. doi : 10.1038/nature04072 . PMID 16136131.
Calculamos que la divergencia de nucleótidos en todo el genoma entre humanos y chimpancés es del 1,23%, lo que confirma resultados recientes de estudios más limitados.
- ^ The Chimpanzee Sequencing Analysis Consortium (septiembre de 2005). "Initial sequence of the chimpanzee genome and comparison with the human genome". Nature . 437 (7055): 69–87. Bibcode :2005Natur.437...69.. doi : 10.1038/nature04072 . PMID 16136131.
estimamos que el polimorfismo explica el 14-22% de la tasa de divergencia observada y, por lo tanto, que la divergencia fija es de ~1,06% o menos.
- ^ Demuth JP, De Bie T, Stajich JE, Cristianini N, Hahn MW (2006). "La evolución de las familias de genes de los mamíferos". PLOS ONE . 1 (1): e85. Bibcode :2006PLoSO...1...85D. doi : 10.1371/journal.pone.0000085 . PMC 1762380 . PMID 17183716.
Nuestros resultados implican que los humanos y los chimpancés difieren en al menos un 6% (1.418 de 22.000 genes) en su complemento de genes, lo que contrasta marcadamente con la diferencia del 1,5% citada a menudo entre secuencias de nucleótidos ortólogas.
- ^ The Chimpanzee Sequencing Analysis Consortium (septiembre de 2005). "Initial sequence of the chimpanzee genome and comparison with the human genome". Nature . 437 (7055): 69–87. Bibcode :2005Natur.437...69.. doi : 10.1038/nature04072 . PMID 16136131.
El cromosoma humano 2 es el resultado de una fusión de dos cromosomas ancestrales que permanecieron separados en el linaje de los chimpancés.
Olson MV, Varki A (enero de 2003). "Secuenciación del genoma del chimpancé: perspectivas sobre la evolución y la enfermedad humanas". Nature Reviews Genetics . 4 (1): 20–28. doi :10.1038/nrg981. PMID 12509750. S2CID 205486561.La secuenciación a gran escala del genoma del chimpancé es inminente.
- ^ Gilad Y, Wiebe V, Przeworski M, Lancet D, Pääbo S (enero de 2004). "La pérdida de genes del receptor olfativo coincide con la adquisición de la visión tricromática completa en primates". PLOS Biology . 2 (1): E5. doi : 10.1371/journal.pbio.0020005 . PMC 314465 . PMID 14737185.
Nuestros hallazgos sugieren que el deterioro del repertorio olfativo ocurrió concomitantemente con la adquisición de la visión tricromática completa del color en primates.
- ^ Zimmer C (21 de septiembre de 2016). «Cómo llegamos aquí: el ADN apunta a una única migración desde África». The New York Times . Consultado el 22 de septiembre de 2016 .
- ^ Nielsen R, Akey JM, Jakobsson M, Pritchard JK, Tishkoff S, Willerslev E (enero de 2017). "Rastreando el poblamiento del mundo a través de la genómica". Nature . 541 (7637): 302–310. Bibcode :2017Natur.541..302N. doi :10.1038/nature21347. PMC 5772775 . PMID 28102248.
- ^ Sykes B (9 de octubre de 2003). «ADN mitocondrial e historia humana». El genoma humano. Archivado desde el original el 7 de septiembre de 2015. Consultado el 19 de septiembre de 2006 .
- ^ Misteli T (febrero de 2007). "Más allá de la secuencia: organización celular de la función del genoma". Cell . 128 (4): 787–800. doi : 10.1016/j.cell.2007.01.028 . PMID 17320514. S2CID 9064584.
- ^ Bernstein BE, Meissner A, Lander ES (febrero de 2007). "El epigenoma de los mamíferos". Cell . 128 (4): 669–681. doi : 10.1016/j.cell.2007.01.033 . PMID 17320505. S2CID 2722988.
- ^ Scheen AJ, Junien C (mayo-junio de 2012). "[Epigenética, interfaz entre el medio ambiente y los genes: papel en enfermedades complejas]". Revue Médicale de Lieja . 67 (5–6): 250–257. PMID 22891475.
Enlaces externos
- Visor del genoma anotado (versión 110) de T2T-CHM13 v2.0
- Genoma humano completo T2T-CHM13 v2.0 (sin espacios vacíos)
- Proyecto Ensembl Genome Browser
- Visor de datos genómicos (GDV) de la Biblioteca Nacional de Medicina
- Navegador de genomas de la UCSC que utiliza T2T-CHM13 v2.0
- Uniprot: lista de genes por cromosoma
- Proyecto Genoma Humano
- Instituto Nacional de Investigación del Genoma Humano
- La Oficina Nacional de Genómica de Salud Pública
- Visor simple del genoma humano

