Polimorfismo cristalino
En cristalografía, el polimorfismo es el fenómeno por el cual un compuesto o elemento puede cristalizar en más de una estructura cristalina .
La definición anterior ha evolucionado a lo largo de muchos años y todavía se debate hoy en día. [1] [2] [3] La discusión de las características definitorias del polimorfismo implica distinguir entre los tipos de transiciones y cambios estructurales que ocurren en el polimorfismo frente a los de otros fenómenos.
Descripción general
Las transiciones de fase (cambios de fase) que ayudan a describir el polimorfismo incluyen transiciones polimórficas, así como transiciones de fusión y vaporización. Según la IUPAC , una transición polimórfica es "una transición reversible de una fase cristalina sólida a una determinada temperatura y presión (el punto de inversión) a otra fase de la misma composición química con una estructura cristalina diferente". [4] Además, Walter McCrone describió las fases en materia polimórfica como "diferentes en estructura cristalina pero idénticas en los estados líquido o de vapor". McCrone también define un polimorfo como "una fase cristalina de un compuesto dado que resulta de la posibilidad de al menos dos ordenamientos diferentes de las moléculas de ese compuesto en el estado sólido". [5] [6] Estos hechos definitorios implican que el polimorfismo implica cambios en las propiedades físicas pero no puede incluir cambios químicos. Algunas definiciones tempranas no hacen esta distinción.
La eliminación del cambio químico de aquellos cambios permisibles durante una transición polimórfica delinea el polimorfismo. Por ejemplo, la isomerización a menudo puede conducir a transiciones polimórficas. Sin embargo, la tautomería (isomerización dinámica) conduce al cambio químico, no al polimorfismo. [1] Además, la alotropía de elementos y el polimorfismo se han vinculado históricamente. Sin embargo, los alótropos de un elemento no siempre son polimorfos. Un ejemplo común son los alótropos del carbono , que incluyen el grafito, el diamante y la londsdaleíta. Si bien las tres formas son alótropos, el grafito no es un polimorfo del diamante y la londsdaleíta. La isomerización y la alotropía son solo dos de los fenómenos vinculados al polimorfismo. Para obtener información adicional sobre cómo identificar el polimorfismo y distinguirlo de otros fenómenos, consulte la revisión de Brog et al. [2]
También es útil señalar que los materiales con dos fases polimórficas pueden denominarse dimórficos , los que tienen tres fases polimórficas, trimórficos , etc. [7]
El polimorfismo tiene relevancia práctica para productos farmacéuticos , agroquímicos , pigmentos , colorantes , alimentos y explosivos .
Detección
Métodos experimentales
Los primeros registros del descubrimiento del polimorfismo se deben a Eilhard Mitscherlich y Jöns Jacob Berzelius por sus estudios de fosfatos y arseniatos a principios del siglo XIX. Los estudios implicaban la medición de los ángulos interfaciales de los cristales para demostrar que las sales químicamente idénticas podían tener dos formas diferentes. Mitscherlich originalmente llamó a este descubrimiento isomorfismo. [8] La medición de la densidad de los cristales también fue utilizada por Wilhelm Ostwald y expresada en el Cociente de Ostwald. [9]
El desarrollo del microscopio mejoró las observaciones de polimorfismo y ayudó a los estudios de Moritz Ludwig Frankenheim en la década de 1830. Pudo demostrar métodos para inducir cambios de fase en los cristales y resumió formalmente sus hallazgos sobre la naturaleza del polimorfismo. Poco después, se empezó a utilizar el microscopio de luz polarizada, más sofisticado , que proporcionaba una mejor visualización de las fases cristalinas, lo que permitía a los cristalógrafos distinguir entre diferentes polimorfos. Otto Lehmann inventó la platina caliente y la adaptó a un microscopio de luz polarizada alrededor de 1877. Esta invención ayudó a los cristalógrafos a determinar los puntos de fusión y observar las transiciones polimórficas. [8]
Si bien el uso de microscopios de platina caliente continuó durante la década de 1900, los métodos térmicos también se volvieron comunes para observar el flujo de calor que ocurre durante los cambios de fase, como la fusión y las transiciones polimórficas. Una de esas técnicas, la calorimetría diferencial de barrido (DSC), continúa utilizándose para determinar la entalpía de las transiciones polimórficas. [8]
En el siglo XX, la cristalografía de rayos X se volvió de uso común para estudiar la estructura cristalina de los polimorfos. Tanto la difracción de rayos X de monocristal como las técnicas de difracción de rayos X de polvo se utilizan para obtener mediciones de la celda unitaria del cristal. Cada polimorfo de un compuesto tiene una estructura cristalina única. Como resultado, diferentes polimorfos producirán diferentes patrones de difracción de rayos X. [8]
Los métodos espectroscópicos vibracionales comenzaron a utilizarse para investigar el polimorfismo en la segunda mitad del siglo XX y se han vuelto más comunes a medida que las tecnologías ópticas, informáticas y de semiconductores mejoraron. Estas técnicas incluyen la espectroscopia infrarroja (IR) , la espectroscopia de terahercios y la espectroscopia Raman . Las espectroscopias IR y Raman de frecuencia media son sensibles a los cambios en los patrones de enlaces de hidrógeno . Dichos cambios pueden posteriormente relacionarse con diferencias estructurales. Además, las espectroscopias Raman de terahercios y de baja frecuencia revelan modos vibracionales resultantes de interacciones intermoleculares en sólidos cristalinos. Nuevamente, estos modos vibracionales están relacionados con la estructura cristalina y pueden usarse para descubrir diferencias en la estructura tridimensional entre polimorfos. [10]
Métodos computacionales
La química computacional se puede utilizar en combinación con técnicas de espectroscopia vibracional para comprender los orígenes de las vibraciones dentro de los cristales. [10] La combinación de técnicas proporciona información detallada sobre las estructuras cristalinas, similar a lo que se puede lograr con la cristalografía de rayos X. Además de utilizar métodos computacionales para mejorar la comprensión de los datos espectroscópicos, el último desarrollo en la identificación de polimorfismos en cristales es el campo de la predicción de la estructura cristalina . Esta técnica utiliza la química computacional para modelar la formación de cristales y predecir la existencia de polimorfos específicos de un compuesto antes de que los científicos los hayan observado experimentalmente. [11] [12]
Ejemplos
Muchos compuestos presentan polimorfismo. Se ha afirmado que "cada compuesto tiene diferentes formas polimórficas y que, en general, la cantidad de formas conocidas para un compuesto determinado es proporcional al tiempo y al dinero invertidos en la investigación de ese compuesto". [13] [5] [14]
Compuestos orgánicos
Benzamida
El fenómeno fue descubierto en 1832 por Friedrich Wöhler y Justus von Liebig . Observaron que las agujas sedosas de la benzamida recién cristalizada se convertían lentamente en cristales rómbicos. [15] El análisis actual [16] identifica tres polimorfos para la benzamida: el menos estable, formado por enfriamiento rápido, es la forma ortorrómbica II. A este tipo le sigue la forma monoclínica III (observada por Wöhler/Liebig). La forma más estable es la forma monoclínica I. Los mecanismos de enlace de hidrógeno son los mismos para las tres fases; sin embargo, difieren fuertemente en sus interacciones pi-pi.
Ácido maleico
En 2006 se descubrió un nuevo polimorfo del ácido maleico , 124 años después de que se estudiara la primera forma cristalina. El ácido maleico se fabrica a escala industrial en la industria química. Forma la sal que se encuentra en la medicina. El nuevo tipo de cristal se produce cuando un cocristal de cafeína y ácido maleico (2:1) se disuelve en cloroformo y cuando se deja que el disolvente se evapore lentamente. Mientras que la forma I tiene un grupo espacial monoclínico P 2 1 / c , la nueva forma tiene un grupo espacial Pc . Ambos polimorfos consisten en láminas de moléculas conectadas a través de enlaces de hidrógeno de los grupos de ácido carboxílico : en la forma I, las láminas se alternan con respecto al momento dipolar neto , mientras que en la forma II, las láminas están orientadas en la misma dirección. [17]
1,3,5-Trinitrobenceno
Después de 125 años de estudio, el 1,3,5-trinitrobenceno produjo un segundo polimorfo. La forma habitual tiene el grupo espacial Pbca , pero en 2004, se obtuvo un segundo polimorfo en el grupo espacial Pca 2 1 cuando el compuesto se cristalizó en presencia de un aditivo, el trisindano. Este experimento demuestra que los aditivos pueden inducir la aparición de formas polimórficas. [18]
Otros compuestos orgánicos
La acridina se ha obtenido en ocho polimorfos [19] y el aripiprazol en nueve. [20] El récord de mayor número de polimorfos bien caracterizados lo tiene un compuesto conocido como ROY . [21] [22] La glicina cristaliza tanto en cristales monoclínicos como hexagonales . El polimorfismo en compuestos orgánicos es a menudo el resultado del polimorfismo conformacional . [23]
Materia inorgánica
Elementos
Los elementos, incluidos los metales, pueden presentar polimorfismo. Alotropía es el término que se utiliza para describir elementos que tienen diferentes formas y se utiliza comúnmente en el campo de la metalurgia. Algunos alótropos (pero no todos) también son polimorfos. Por ejemplo, el hierro tiene tres alótropos que también son polimorfos. El hierro alfa, que existe a temperatura ambiente, tiene una forma bcc. Por encima de los 910 grados existe el hierro gamma, que tiene una forma fcc. Por encima de los 1390 grados existe el hierro delta con una forma bcc. [24]
Otro ejemplo metálico es el estaño, que tiene dos alótropos que también son polimorfos. A temperatura ambiente, el beta-estaño existe en forma tetragonal blanca. Cuando se enfría por debajo de los 13,2 grados, se forma alfa-estaño, que es de color gris y tiene forma de diamante cúbico. [24]
Un ejemplo clásico de un no metal que exhibe polimorfismo es el carbono. El carbono tiene muchos alótropos, entre ellos el grafito, el diamante y la londsdaleíta. Sin embargo, no todos son polimorfos entre sí. El grafito no es un polimorfo del diamante y la londsdaleíta, ya que es químicamente distinto, ya que tiene un enlace hibridado sp2 . El diamante y la londsdaleíta son químicamente idénticos, ya que ambos tienen un enlace hibridado sp3 , y difieren solo en sus estructuras cristalinas, lo que los convierte en polimorfos. Además, el grafito tiene dos polimorfos, una forma hexagonal (alfa) y una forma romboédrica (beta). [24]
Óxidos metálicos binarios
El polimorfismo en óxidos metálicos binarios ha atraído mucha atención debido a que estos materiales tienen un valor económico significativo. Un conjunto de ejemplos famosos tiene la composición SiO 2 , que forma muchos polimorfos. Los más importantes incluyen: α-cuarzo , β-cuarzo , tridimita , cristobalita , moganita , coesita y stishovita . [25] [26]
| Óxidos metálicos | Fase | Condiciones de P y T | Grupo Estructura/Espacio |
|---|---|---|---|
| Cromo 2 | fase α | Condiciones ambientales | Ortorrómbico tipo Cl 2 |
| RT y 12 ± 3 GPa | |||
| cromo 2 o 3 | Fase de corindón | Condiciones ambientales | Corindón tipo romboédrico (R 3 c) |
| Fase de alta presión | RT y 35 GPa | Tipo Rh2O3 - II | |
| Fe2O3 | fase α | Condiciones ambientales | Corindón tipo romboédrico (R 3 c) |
| fase β | Por debajo de 773 K | Cúbica centrada en el cuerpo (Ia 3 ) | |
| fase γ | Hasta 933 K | Estructura de espinela cúbica (Fd 3 m) | |
| fase ε | -- | Rómbico (Pna21) | |
| Bi2O3 | fase α | Condiciones ambientales | Monoclínico (P21/c) |
| fase β | 603-923 K y 1 atm | Tetragonal | |
| fase γ | 773-912 K o RT y 1 atm | Cúbico centrado en el cuerpo | |
| fase δ | 912-1097 K y 1 atm | FCC ( Fm3m ) | |
| En 2 O 3 | Fase tipo Bixbyite | Condiciones ambientales | Cúbico (Ia 3 ) |
| Tipo corindón | 15-25 GPa a 1273 K | Corindón tipo hexagonal (R 3 c) | |
| Tipo Rh2O3 ( II ) | 100 GPa y 1000 K | Ortorrómbico | |
| Al2O3 | fase α | Condiciones ambientales | Corindón tipo Trigonal (R 3 c) |
| fase γ | 773 K y 1 atm | Cúbico (Fd 3 m) | |
| SnO2 | fase α | Condiciones ambientales | Tetragonal de tipo rutilo (P42/mnm) |
| Fase tipo CaCl 2 | 15 KBar a 1073 K | Ortorrómbico, tipo CaCl 2 (Pnnm) | |
| Tipo α-PbO 2 | Por encima de 18 KBar | Tipo α-PbO 2 (Pbcn) | |
| TiO2 | Rutilo | Fase de equilibrio | Tetragonal de tipo rutilo |
| Anatasa | Fase metaestable (no estable) [27] | Tetragonal (I41/amd) | |
| Brookita | Fase metaestable (no estable) [27] | Ortorrómbico (Pcab) | |
| ZrO2 | Fase monoclínica | Condiciones ambientales | Monoclínico (P21/c) |
| Fase tetragonal | Por encima de 1443 K | Tetragonal (P42/nmc) | |
| Fase tipo fluorita | Por encima de 2643 K | Cúbico (Fm 3 m) | |
| MoO3 | fase α | 553-673 K y 1 atm | Ortorrómbico (Pbnm) |
| fase β | 553-673 K y 1 atm | Monoclínico | |
| fase h | Fase de alta presión y alta temperatura | Hexagonal (P6a/m o P6a) | |
| MoO3 - II | 60 kbar y 973 K | Monoclínico | |
| Trabajo 3 | fase ε | Hasta 220 K | Monoclínico (Pc) |
| fase δ | 220-300 K | Triclínica (P1) | |
| fase γ | 300-623 K | Monoclínico (P21/n) | |
| fase β | 623-900K | Ortorrómbico (Pnma) | |
| fase α | Por encima de 900 K | Tetragonal (P4/ncc) |
Otros compuestos inorgánicos
Un ejemplo clásico de polimorfismo es el par de minerales calcita , que es romboédrica, y aragonita , que es ortorrómbica. Ambas son formas de carbonato de calcio . [24] Una tercera forma de carbonato de calcio es la vaterita, que es hexagonal y relativamente inestable. [28]
El β-HgS precipita como un sólido negro cuando las sales de Hg(II) se tratan con H2S . Con un calentamiento suave de la suspensión, el polimorfo negro se convierte en la forma roja. [29]
Factores que afectan el polimorfismo
Según la regla de Ostwald , los polimorfos menos estables suelen cristalizar antes que la forma estable. El concepto se basa en la idea de que los polimorfos inestables se asemejan más al estado en solución y, por lo tanto, tienen ventajas cinéticas. El caso fundacional de la benzamida fibrosa frente a la rómbica ilustra este caso. Otro ejemplo lo proporcionan dos polimorfos del dióxido de titanio . [27] Sin embargo, existen sistemas conocidos, como el metacetamol , en los que solo una velocidad de enfriamiento estrecha favorece la obtención de la forma metaestable II. [30]
Los polimorfos tienen estabilidades dispares. Algunos se convierten rápidamente a temperatura ambiente (o a cualquier temperatura). La mayoría de los polimorfos de moléculas orgánicas solo difieren en unos pocos kJ/mol en energía reticular. Aproximadamente el 50% de los pares de polimorfos conocidos difieren en menos de 2 kJ/mol y las diferencias de estabilidad de más de 10 kJ/mol son raras. [31] La estabilidad de los polimorfos puede cambiar con la temperatura [32] [33] [34] o la presión. [35] [36] Es importante destacar que la estabilidad estructural y termodinámica son diferentes. La estabilidad termodinámica se puede estudiar utilizando métodos experimentales o computacionales. [37] [38]
El polimorfismo se ve afectado por los detalles de la cristalización . El disolvente afecta en todos los aspectos a la naturaleza del polimorfo, incluida la concentración y otros componentes del disolvente, es decir, las especies que inhiben o promueven ciertos patrones de crecimiento. [39] Un factor decisivo es a menudo la temperatura del disolvente a partir del cual se lleva a cabo la cristalización . [40]
Los polimorfos metaestables no siempre se obtienen de forma reproducible, lo que da lugar a casos de " polimorfos que desaparecen ", con implicaciones generalmente negativas para el derecho y los negocios. [13] [11] [41]
En productos farmacéuticos
Aspectos legales
Los medicamentos reciben aprobación regulatoria y se les conceden patentes solo para un único polimorfo.
En una clásica disputa de patentes , GlaxoSmithKline defendió su patente para el polimorfo tipo II del ingrediente activo de Zantac contra competidores mientras que la del polimorfo tipo I ya había expirado. [42]
El polimorfismo en los fármacos también puede tener implicaciones médicas directas, ya que las tasas de disolución dependen del polimorfo. La pureza polimórfica de las muestras de fármacos se puede comprobar utilizando técnicas como la difracción de rayos X en polvo, la espectroscopia IR/Raman y, en algunos casos, utilizando las diferencias en sus propiedades ópticas. [43]
Estudios de caso
Los casos conocidos hasta 2015 se analizan en un artículo de revisión de Bučar, Lancaster y Bernstein. [11]
Dibenzoxazepinas
Esta sección puede ser demasiado técnica para que la mayoría de los lectores la comprendan . ( Enero de 2024 ) |
Se aplicaron estudios multidisciplinarios que involucraron enfoques experimentales y computacionales a moléculas farmacéuticas para facilitar la comparación de sus estructuras de estado sólido. Específicamente, este estudio se centró en explorar cómo los cambios en la estructura molecular afectan la conformación molecular, los motivos de empaquetamiento, las interacciones en las redes cristalinas resultantes y el grado de diversidad de estado sólido de estos compuestos. Los resultados resaltan el valor de los estudios de predicción de la estructura cristalina y los cálculos PIXEL en la interpretación del comportamiento observado en estado sólido y la cuantificación de las interacciones intermoleculares en las estructuras empaquetadas e identificación de las interacciones estabilizadoras clave. Una selección experimental arrojó 4 formas físicas para la clozapina en comparación con 60 formas físicas distintas para la olanzapina . Los resultados de la selección experimental de la clozapina son consistentes con su panorama de energía cristalina, lo que confirma que ninguna disposición de empaquetamiento alternativa es termodinámicamente competitiva con la estructura obtenida experimentalmente. Mientras que en el caso de la olanzapina , el panorama de la energía cristalina destaca que la extensa selección experimental probablemente no ha encontrado todos los polimorfos posibles de la olanzapina , y se podría apuntar a una mayor diversidad de formas sólidas con una mejor comprensión del papel de la cinética en su cristalización. Los estudios CSP pudieron ofrecer una explicación para la ausencia del dímero centrosimétrico en la clozapina anhidra . Los cálculos PIXEL en todas las estructuras cristalinas de la clozapina revelaron que, de manera similar a la olanzapina , la energía de interacción intermolecular en cada estructura también está dominada por Ed. A pesar de la similitud de la estructura molecular entre la amoxapina y la loxapina (moléculas en el grupo 2), el empaquetamiento cristalino observado en los polimorfos de loxa difiere significativamente de la amoxapina . Un estudio experimental y computacional combinado demostró que el grupo metilo en la loxapina tiene una influencia significativa en el aumento del rango de formas sólidas accesibles y favorecer varios arreglos de empaquetamiento alternativos. Los estudios CSP nuevamente han ayudado a explicar la diversidad de estado sólido observada de la loxapina y la amoxapina. Los cálculos de PIXEL demostraron que, en ausencia de enlaces de hidrógeno fuertes, los enlaces de hidrógeno débiles, como C–H...O, C–H...N y las interacciones de dispersión, desempeñan un papel fundamental en la estabilización de la red cristalina de ambas moléculas. El empaquetamiento eficiente de los cristales de la amoxapina parece contribuir a su comportamiento monomórfico en comparación con el empaquetamiento comparativamente menos eficiente de la loxapina.Las moléculas en ambos polimorfos se han estudiado en mayor profundidad mediante la combinación de métodos experimentales y computacionales. Los métodos experimentales y computacionales han permitido comprender mejor los factores que influyen en la estructura y la diversidad del estado sólido en estos compuestos. Las superficies de Hirshfeld que utilizan Crystal Explorer representan otra forma de explorar los modos de empaquetamiento y las interacciones intermoleculares en cristales moleculares. La influencia de los cambios en los sustituyentes pequeños sobre la forma y la distribución de electrones también se puede investigar mediante el mapeo de la densidad total de electrones sobre el potencial electrostático de las moléculas en fase gaseosa. Esto permite una visualización y comparación sencillas de la forma general y de las regiones ricas en electrones y deficientes en electrones dentro de las moléculas. La forma de estas moléculas se puede investigar más a fondo para estudiar su influencia en la diversidad del estado sólido. [44]
Posaconazol
Las formulaciones originales de posaconazol en el mercado autorizadas como Noxafil se formularon utilizando la forma I de posaconazol . El descubrimiento de polimorfos de posaconazol aumentó rápidamente y dio lugar a mucha investigación en cristalografía de posaconazol . Un solvato de metanol y un cocristal de 1,4-dioxano se agregaron a la Base de datos estructural de Cambridge (CSD). [45]
Ritonavir
El fármaco antiviral ritonavir existe en dos formas polimórficas que difieren enormemente en eficacia. Estos problemas se resolvieron reformulando el medicamento en cápsulas de gel y comprimidos, en lugar de las cápsulas originales. [46]
Aspirina
Sólo se ha demostrado la existencia de un polimorfo , la forma I de la aspirina , aunque desde los años 1960 se ha debatido la existencia de otro polimorfo, y un informe de 1981 informó que, cuando se cristaliza en presencia de anhídrido de aspirina , el difractograma de la aspirina presenta picos adicionales débiles. Aunque en su momento se descartó como una mera impureza, en retrospectiva se trataba de la forma II de la aspirina. [11]
La Forma II se informó en 2005, [47] [48] encontrada después del intento de cocristalización de aspirina y levetiracetam a partir de acetonitrilo caliente .
En la forma I, los pares de moléculas de aspirina forman dímeros centrosimétricos a través de los grupos acetilo con el protón metilo (ácido) uniendo los enlaces de hidrógeno con el grupo carbonilo . En la forma II, cada molécula de aspirina forma los mismos enlaces de hidrógeno, pero con dos moléculas vecinas en lugar de una. Con respecto a los enlaces de hidrógeno formados por los grupos de ácido carboxílico , ambos polimorfos forman estructuras diméricas idénticas. Los polimorfos de aspirina contienen secciones bidimensionales idénticas y, por lo tanto, se describen con mayor precisión como politipos. [49]
La aspirina pura de forma II se puede preparar sembrando el lote con anhidrato de aspirina al 15 % en peso. [11]
Paracetamol
El polvo de paracetamol tiene propiedades de compresión deficientes, lo que dificulta la fabricación de comprimidos. Se encontró un segundo polimorfo con propiedades de compresión más adecuadas. [50]
Acetato de cortisona
El acetato de cortisona existe en al menos cinco polimorfos diferentes, cuatro de los cuales son inestables en el agua y cambian a una forma estable.
Carbamazepina
La carbamazepina , el estrógeno , la paroxetina [51] y el cloranfenicol también muestran polimorfismo.
Pirazinamida
La pirazinamida tiene al menos 4 polimorfos. [52] Todos ellos se transforman en una forma α estable a temperatura ambiente durante el almacenamiento o el tratamiento mecánico. [53] Estudios recientes demuestran que la forma α es termodinámicamente estable a temperatura ambiente. [32] [34]
Politipismo
Los politipos son un caso especial de polimorfos, en el que múltiples estructuras cristalinas compactas difieren en una sola dimensión. Los politipos tienen planos compactos idénticos, pero difieren en la secuencia de apilamiento en la tercera dimensión perpendicular a estos planos. El carburo de silicio (SiC) tiene más de 170 politipos conocidos , aunque la mayoría son raros. Todos los politipos de SiC tienen prácticamente la misma densidad y energía libre de Gibbs . Los politipos de SiC más comunes se muestran en la Tabla 1.
Tabla 1 : Algunos politipos de SiC. [54]
| Fase | Estructura | Notación de Ramsdell | Secuencia de apilamiento | Comentario |
|---|---|---|---|---|
| α-SiC | hexagonal | 2 horas | De | forma wurtzita |
| α-SiC | hexagonal | 4 horas | ABCB | |
| α-SiC | hexagonal | 6 horas | ABCACB | La forma más estable y común. |
| α-SiC | romboédrico | 15R | ABCACBCABACABCB | |
| β-SiC | cúbico centrado en la cara | 3C | abecedario | Forma de esfalrita o blenda de zinc |
Un segundo grupo de materiales con diferentes politipos son los dicalcogenuros de metales de transición , materiales en capas como el disulfuro de molibdeno (MoS 2 ). Para estos materiales, los politipos tienen efectos más distintivos en las propiedades del material, por ejemplo, para MoS 2 , el politipo 1T es de carácter metálico, mientras que la forma 2H es más semiconductora. [55] Otro ejemplo es el disulfuro de tantalio , donde se producen los politipos comunes 1T y 2H, pero también tipos de "coordinación mixta" más complejos como 4Hb y 6R, donde se mezclan las capas de geometría prismática trigonal y octaédrica. [56] Aquí, el politipo 1T exhibe una onda de densidad de carga , con una influencia distintiva en la conductividad en función de la temperatura, mientras que el politipo 2H exhibe superconductividad .
ZnS y CdI 2 también son politípicos. [57] Se ha sugerido que este tipo de polimorfismo se debe a la cinética donde las dislocaciones de tornillo reproducen rápidamente secuencias parcialmente desordenadas de manera periódica.
Teoría
_and_monotropic_behaviour_(right)..jpg/440px-Energy-Temperature_diagrams_of_a_system_exhibiting_two_polymorphic_forms_with_enantiotropic_behaviour_(left)_and_monotropic_behaviour_(right)..jpg)
En términos de termodinámica , se reconocen dos tipos de comportamiento polimórfico. Para un sistema monotrópico, los gráficos de las energías libres de los diversos polimorfos en función de la temperatura no se cruzan antes de que todos los polimorfos se fundan. Como resultado, cualquier transición de un polimorfo a otro por debajo del punto de fusión será irreversible. Para un sistema enantiotrópico, un gráfico de la energía libre en función de la temperatura muestra un punto de cruce antes de los diversos puntos de fusión. [58] También puede ser posible convertir de manera intercambiable entre los dos polimorfos mediante calentamiento o enfriamiento, o mediante contacto físico con un polimorfo de menor energía.
Un modelo simple de polimorfismo es modelar la energía libre de Gibbs de un cristal con forma de bola como . Aquí, el primer término es la energía superficial y el segundo término es la energía volumétrica. Ambos parámetros . La función aumenta hasta un máximo antes de caer, cruzando cero en . Para cristalizar, una bola de cristal debe superar la barrera energética de la parte del paisaje energético. [59]
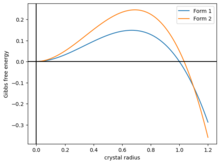
Ahora, supongamos que hay dos tipos de cristales, con energías diferentes y , y si tienen la misma forma que en la Figura 2, entonces las dos curvas se intersecan en algún punto . Entonces el sistema tiene tres fases:
- . Los cristales tienden a disolverse. Fase amorfa.
- . Los cristales tienden a crecer como forma 1.
- . Los cristales tienden a crecer como forma 2.
Si el cristal crece lentamente, podría quedar cinéticamente estancado en la forma 1.
Véase también
- Alotropía
- Isomorfismo (cristalografía)
- Dimorfismo (Wikcionario)
- Poliamorfismo
Referencias
- ^ ab Bernstein, Joel (2002). Polimorfismo en cristales moleculares . Nueva York, EE. UU.: Oxford University Press. pp. 1–27. ISBN 0198506058.
- ^ ab Brog, Jean-Pierre; Chanez, Claire-Lise; Crochet, Aurelien; Fromm, Katharina M. (2013). "Polimorfismo, qué es y cómo identificarlo: una revisión sistemática". RSC Advances . 3 (38): 16905–31. Bibcode :2013RSCAd...316905B. doi :10.1039/c3ra41559g.
- ^ Cruz-Cabeza, Aurora J.; Reutzel-Edens, Susan M.; Bernstein, Joel (2015). "Hechos y ficciones sobre el polimorfismo". Chemical Society Reviews . 44 (23): 8619–8635. doi :10.1039/c5cs00227c. PMID 26400501 – vía MEDLINE.
- ^ Gold, Victor, ed. (2019). "Transición polimórfica". Libro de Oro de la IUPAC . doi : 10.1351/goldbook . Consultado el 28 de enero de 2024 .
- ^ ab McCrone, WC (1965). "Polimorfismo". En Fox, D.; Labes, M.; Weissberger, A. (eds.). Física y química del estado sólido orgánico . Vol. 2. Wiley-Interscience. págs. 726–767.
- ^ Dunitz, Jack D.; Bernstein, Joel (1 de abril de 1995). "Polimorfos que desaparecen". Accounts of Chemical Research . 28 (4): 193–200. doi :10.1021/ar00052a005. ISSN 0001-4842.
- ^ "Definición de trimorfismo - glosario mindat.org" www.mindat.org . Consultado el 23 de octubre de 2016 .
- ^ abcd Bernstein, Joel (2002). Polimorfismo en cristales moleculares . Nueva York, EE. UU.: Oxford University Press. pp. 94–149. ISBN 0198506058.
- ^ Cardew, Peter T. (2023). "Regla de etapas de Ostwald: ¿mito o realidad?". Crystal Growth & Design . 23 (6): 3958−3969. doi : 10.1021/acs.cgd.2c00141 .
- ^ ab Parrott, Edward PJ; Zeitler, J. Axel (2015). "Espectroscopia Raman de baja frecuencia y dominio temporal de terahercios de materiales orgánicos". Applied Spectroscopy . 69 (1): 1–25. Bibcode :2015ApSpe..69....1P. doi :10.1366/14-07707. PMID 25506684. S2CID 7699996.
- ^ abcde Bučar, D.-K.; Bernstein, J. (2015). "Polimorfos en desaparición revisitados". Angewandte Chemie International Edition . 54 (24): 6972–6993. doi :10.1002/anie.201410356. PMC 4479028 . PMID 26031248.
- ^ Bowskill, David H.; Sugden, Isaac J.; Konstantinopoulos, Stefanos; Adjiman, Claire S.; Pantelides, Constantinos C. (2021). "Métodos de predicción de la estructura cristalina para moléculas orgánicas: estado del arte". Annu. Rev. Chem. Biomol. Eng . 12 : 593–623. doi :10.1146/annurev-chembioeng-060718-030256. PMID 33770462. S2CID 232377397.
- ^ ab Ingeniería de cristales: El diseño y la aplicación de sólidos funcionales, Volumen 539, Kenneth Richard Seddon, Michael Zaworotk 1999
- ^ Pruebas de estrés farmacéuticas: predicción de la degradación de fármacos , segunda edición Steven W. Baertschi, Karen M. Alsante, Robert A. Reed 2011 CRC Press
- ^ Wöhler, F.; Liebig, J.; Ana (1832). "Untersuchungen über das Radikal der Benzoesäure". Annalen der Pharmacie (en alemán). 3 (3). Wiley: 249–282. doi :10.1002/jlac.18320030302. hdl : 2027/hvd.hxdg3f . ISSN 0365-5490.
- ^ Thun, Jürgen (2007). "Polimorfismo en benzamida: resolver un acertijo de 175 años". Edición internacional Angewandte Chemie . 46 (35): 6729–6731. doi :10.1002/anie.200701383. PMID 17665385.
- ^ Graeme M. Day; Andrew V. Trask; WD Samuel Motherwell; William Jones (2006). "Investigación del polimorfismo latente del ácido maleico". Chemical Communications . 1 (1): 54–56. doi :10.1039/b513442k. PMID 16353090.
- ^ Thallapally PK, Jetti RK, Katz AK (2004). "Polimorfismo del 1,3,5-trinitrobenceno inducido por un aditivo trisindano". Angewandte Chemie International Edition . 43 (9): 1149–1155. doi :10.1002/anie.200352253. PMID 14983460.
- ^ Schur, Einat; Bernstein, Joel; Price, Louise S.; Guo, Rui; Price, Sarah L.; Lapidus, Saul H.; Stephens, Peter W. (2019). "El panorama (actual) de la forma sólida de acridina: ocho polimorfos y un hidrato" (PDF) . Crecimiento y diseño de cristales . 19 (8): 4884–4893. doi :10.1021/acs.cgd.9b00557. S2CID 198349955.
- ^ Serezhkin, Viktor N.; Savchenkov, Anton V. (2020). "Aplicación del método de poliedros moleculares de Voronoi-Dirichlet para el análisis de interacciones no covalentes en polimorfos de aripiprazol". Crecimiento y diseño de cristales . 20 (3): 1997–2003. doi :10.1021/acs.cgd.9b01645. S2CID 213824513.
- ^ Krämer, Katrina (29 de julio de 2020). "El rojo-naranja-amarillo recupera el récord de polimorfismo con la ayuda de un primo molecular". chemistryworld.com . Consultado el 7 de mayo de 2021 .
- ^ Tyler, Andrew R.; Ragbirsingh, Ronnie; McMonagle, Charles J.; Waddell, Paul G.; Heaps, Sarah E.; Steed, Jonathan W.; Thaw, Paul; Hall, Michael J.; Probert, Michael R. (2020). "Cristalización en nanogotas encapsuladas de pequeñas moléculas solubles en materia orgánica". Química . 6 (7): 1755–1765. Código Bibliográfico :2020Chem....6.1755T. doi :10.1016/j.chempr.2020.04.009. PMC 7357602 . PMID 32685768.
- ^ Cruz-Cabeza, Aurora J.; Bernstein, Joel (2014). "Polimorfismo conformacional". Chemical Reviews . 114 (4): 2170–2191. doi :10.1021/cr400249d. PMID 24350653.
- ^ abcd Greenwood, NN; Earnshaw, A. (1997). Química de los elementos (segunda edición). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ "Definición de polimorfismo - glosario mindat.org" www.mindat.org . Consultado el 23 de octubre de 2016 .
- ^ "Polimorfismo en óxidos metálicos binarios nanocristalinos", S. Sood, P.Gouma, Nanomateriales y Energía, 2(NME2), 1-15(2013).
- ^ abc Transformación de anatasa a rutilo (ART) resumida en el Journal of Materials Science 2011
- ^ Perić, J.; Vucak, M.; Krstulović, R.; Brečević, Lj.; Kralj, D. (1996). "Transformación de fase de polimorfos de carbonato de calcio". Acta Termoquímica . 277 (1 de mayo de 1996): 175–86. Código Bib : 1996TcAc..277..175P. doi :10.1016/0040-6031(95)02748-3 - vía Science Direct.
- ^ Newell, Lyman C.; Maxson, RN; Filson, MH (1939). "Sulfuro de mercurio rojo". Síntesis inorgánica . Vol. 1. págs. 19-20. doi :10.1002/9780470132326.ch7. ISBN 9780470132326.
- ^ Drebushchak, VA; McGregor, L.; Rychkov, DA (febrero de 2017). "Ventana de velocidad de enfriamiento en la cristalización de la forma II del metacetamol". Revista de análisis térmico y calorimetría . 127 (2): 1807–1814. doi :10.1007/s10973-016-5954-0. ISSN 1388-6150. S2CID 99391719.
- ^ Nyman, Jonas; Day, Graeme M. (2015). "Diferencias de energía vibracional estática y reticular entre polimorfos". CrystEngComm . 17 (28): 5154–5165. doi : 10.1039/C5CE00045A .
- ^ ab Dubok, Aleksandr S.; Rychkov, Denis A. (4 de abril de 2023). "Estabilidad relativa de polimorfos de pirazinamida revisitada: un estudio computacional de transiciones de fase de formas frágiles y de flexión en un amplio rango de temperaturas". Cristales . 13 (4): 617. doi : 10.3390/cryst13040617 . ISSN 2073-4352.
- ^ Borba, Ana; Albrecht, Merwe; Gómez-Zavaglia, Andrea; Suhm, Martin A.; Fausto, Rui (14 de enero de 2010). "Estudio de pirazinamida mediante espectroscopia infrarroja a baja temperatura: desde el monómero aislado hasta la fase cristalina estable a baja temperatura". The Journal of Physical Chemistry A . 114 (1): 151–161. Bibcode :2010JPCA..114..151B. doi :10.1021/jp907466h. hdl : 11336/131247 . ISSN 1089-5639. PMID 20055514.
- ^ ab Hoser, Anna Agnieszka; Rekis, Toms; Madsen, Anders Østergaard (1 de junio de 2022). "Dinámica y desorden: sobre la estabilidad de los polimorfos de pirazinamida". Acta Crystallographica Sección B Ciencia estructural, ingeniería de cristales y materiales . 78 (3): 416–424. Bibcode :2022AcCrB..78..416H. doi :10.1107/S2052520622004577. ISSN 2052-5206. PMC 9254588 . PMID 35695115.
- ^ Smirnova, Valeriya Yu.; Iurchenkova, Anna A.; Rychkov, Denis A. (17 de agosto de 2022). "Investigación computacional de la estabilidad de los polimorfos "ocultos" y "convencionales" de disulfuro de di-p-tolilo a altas presiones". Cristales . 12 (8): 1157. doi : 10.3390/cryst12081157 . ISSN 2073-4352.
- ^ Rychkov, Denis A.; Stare, Jernej; Boldyreva, Elena V. (2017). "Mecanismos de transición de fase impulsados por presión revelados por la química cuántica: polimorfos de l-serina". Química física Química Física . 19 (9): 6671–6676. Bibcode :2017PCCP...19.6671R. doi : 10.1039/C6CP07721H . ISSN 1463-9076. PMID 28210731.
- ^ Rychkov, Denis A. (31 de enero de 2020). "Una breve revisión de los conceptos computacionales actuales para estudios de transición de fase de alta presión en cristales moleculares". Cristales . 10 (2): 81. doi : 10.3390/cryst10020081 . ISSN 2073-4352.
- ^ Fedorov, A. Yu.; Rychkov, DA (septiembre de 2020). "Comparación de diferentes enfoques computacionales para revelar el comportamiento de alta presión de cristales orgánicos a nivel molecular. Estudio de caso de polimorfos de tolazamida". Revista de química estructural . 61 (9): 1356–1366. Código Bibliográfico :2020JStCh..61.1356F. doi :10.1134/S0022476620090024. ISSN 0022-4766. S2CID 222299340.
- ^ Rychkov, Denis A.; Arkhipov, Sergey G.; Boldyreva, Elena V. (1 de agosto de 2014). "Modificaciones simples y eficientes de técnicas bien conocidas para el crecimiento confiable de cristales de alta calidad de pequeñas moléculas bioorgánicas". Journal of Applied Crystallography . 47 (4): 1435–1442. doi : 10.1107/S1600576714011273 . ISSN 1600-5767.
- ^ Buckley, Harold Eugene (1951). Crecimiento de cristales. Wiley.
- ^ Surov, Artem O.; Vasilev, Nikita A.; Churakov, Andrei V.; Stroh, Julia; Emmerling, Franziska; Perlovich, German L. (2019). "Formas sólidas de salicilato de ciprofloxacino: polimorfismo, vías de formación y estabilidad termodinámica". Crecimiento y diseño de cristales . 19 (5): 2979–2990. doi :10.1021/acs.cgd.9b00185. S2CID 132854494.
- ^ "Programas de Grado Acreditados" (PDF) .
- ^ Thomas, Sajesh P.; Nagarajan, K.; Row, TN Guru (2012). "Polimorfismo y preferencia tautomérica en fenobam y la utilidad de la respuesta NLO para detectar impurezas polimórficas". Chemical Communications . 48 (85): 10559–10561. doi :10.1039/C2CC34912D. PMID 23000909.
- ^ Bhardwaj, Rajni M. (2016), "Explorando el panorama de la forma física de la clozapina, la amoxapina y la loxapina", Control y predicción del estado sólido de los productos farmacéuticos , Springer Theses, Cham: Springer International Publishing, págs. 153-193, doi :10.1007/978-3-319-27555-0_7, ISBN 978-3-319-27554-3, consultado el 20 de diciembre de 2023
- ^ McQuiston, Dylan K.; Mucalo, Michael R.; Saunders, Graham C. (5 de marzo de 2019). "La estructura del posaconazol y sus solvatos con metanol, dioxano y agua: difluorofenilo como donante de enlaces de hidrógeno". Journal of Molecular Structure . 1179 : 477–486. Bibcode :2019JMoSt1179..477M. doi :10.1016/j.molstruc.2018.11.031. ISSN 0022-2860. S2CID 105578644.
- ^ Bauer J, et al. (2004). "Ritonavir: un ejemplo extraordinario de polimorfismo conformacional". Pharmaceutical Research . 18 (6): 859–866. doi :10.1023/A:1011052932607. PMID 11474792. S2CID 20923508.
- ^ Peddy Vishweshwar; Jennifer A. McMahon; Mark Oliveira; Matthew L. Peterson y Michael J. Zaworotko (2005). "La forma II de la aspirina, predeciblemente elusiva". J. Am. Chem. Soc. 127 (48): 16802–16803. doi :10.1021/ja056455b. PMID 16316223.
- ^ Andrew D. Bond; Roland Boese; Gautam R. Desiraju (2007). "Sobre el polimorfismo de la aspirina: aspirina cristalina como intercrecimiento de dos dominios "polimórficos"". Angewandte Chemie International Edition . 46 (4): 618–622. doi :10.1002/anie.200603373. PMID 17139692.
- ^ "Politipismo - Diccionario en línea de cristalografía". reference.iucr.org .
- ^ Wang, In-Chun; Lee, Min-Jeong; Seo, Da-Young; Lee, Hea-Eun; Choi, Yongsun; Kim, Woo-Sik; Kim, Chang-Sam; Jeong, Myung-Yung; Choi, Guang Jin (14 de junio de 2011). "Transformación polimórfica en paracetamol monitoreada por espectroscopia NIR en línea durante un proceso de cristalización por enfriamiento". AAPS PharmSciTech . 12 (2): 764–770. doi :10.1208/s12249-011-9642-x. PMC 3134639 . PMID 21671200.
- ^ "Polimorfos que desaparecen y daño gastrointestinal". blakes.com . 20 de julio de 2012. Archivado desde el original el 20 de julio de 2012.
- ^ Castro, Ricardo AE; María, Teresa MR; Évora, António OL; Feiteira, Joana C.; Silva, M. Ramos; Beja, A. Matos; Canotilho, João; Eusébio, M. Ermelinda S. (6 de enero de 2010). "Una nueva visión de las formas polimórficas de pirazinamida y sus relaciones termodinámicas". Crecimiento y diseño de cristales . 10 (1): 274–282. doi :10.1021/cg900890n. ISSN 1528-7483.
- ^ Cherukuvada, Suryanarayan; Thakuria, Ranjit; Nangia, Ashwini (1 de septiembre de 2010). "Polimorfos de pirazinamida: estabilidad relativa y espectroscopia vibratoria". Crecimiento y diseño de cristales . 10 (9): 3931–3941. doi :10.1021/cg1004424. ISSN 1528-7483.
- ^ "Los fundamentos de la cristalografía y la difracción", Christopher Hammond, segunda edición, Oxford Science Publishing, IUCr, página 28 ISBN 0 19 8505531 .
- ^ Li, Xiao; Zhu, Hongwei (1 de marzo de 2015). "MoS2 bidimensional: propiedades, preparación y aplicaciones". Journal of Materiomics . 1 (1): 33–44. doi : 10.1016/j.jmat.2015.03.003 .
- ^ Wilson, JA; Di Salvo, FJ; Mahajan, S. (octubre de 1974). "Ondas de densidad de carga y superredes en los dicalcogenuros de metales de transición en capas metálicas". Avances en Física . 50 (8): 1171–1248. doi :10.1080/00018730110102718. S2CID 218647397.
- ^ CE Ryan, RC Marshall, JJ Hawley, I. Berman y DP Considine, "La conversión de carburo de silicio cúbico a hexagonal en función de la temperatura y la presión", Fuerza Aérea de EE. UU., Documentos de investigación en ciencias físicas , n.° 336, agosto de 1967, pág. 1-26.
- ^ Carletta, Andrea (2015). "Investigación en estado sólido del polimorfismo y tautomería de la feniltiazol-tiona: un estudio combinado cristalográfico, calorimétrico y teórico". Crecimiento y diseño de cristales . 15 (5): 2461–2473. doi :10.1021/acs.cgd.5b00237.
- ^ Ward, Michael D. (febrero de 2017). "Peligros del polimorfismo: el tamaño importa". Revista israelí de química . 57 (1–2): 82–92. doi :10.1002/ijch.201600071. ISSN 0021-2148.
Enlaces externos
- "Cristalización de moléculas pequeñas" ( PDF ) en el sitio web del Instituto Tecnológico de Illinois
- "SiC y politismo"














