Estructura terciaria del ácido nucleico


La estructura terciaria de los ácidos nucleicos es la forma tridimensional de un polímero de ácidos nucleicos . [1] Las moléculas de ARN y ADN son capaces de realizar diversas funciones, que van desde el reconocimiento molecular hasta la catálisis . Dichas funciones requieren una estructura tridimensional precisa. Si bien dichas estructuras son diversas y aparentemente complejas, están compuestas por motivos estructurales terciarios recurrentes y fácilmente reconocibles que sirven como bloques de construcción molecular. A continuación se describen algunos de los motivos estructurales terciarios más comunes para el ARN y el ADN, pero esta información se basa en un número limitado de estructuras resueltas. Se revelarán muchos más motivos estructurales terciarios a medida que se caractericen estructuralmente nuevas moléculas de ARN y ADN.
Estructuras helicoidales

Doble hélice
La doble hélice es la estructura terciaria dominante del ADN biológico, y también es una posible estructura del ARN. Se cree que en la naturaleza se encuentran tres conformaciones del ADN: ADN-A , ADN-B y ADN-Z . Se cree que la forma "B" descrita por James D. Watson y Francis Crick predomina en las células. [2] James D. Watson y Francis Crick describieron esta estructura como una doble hélice con un radio de 10 Å y un paso de 34 Å , que realiza una vuelta completa sobre su eje cada 10 pb de secuencia. [3] La doble hélice realiza una vuelta completa sobre su eje cada 10,4–10,5 pares de bases en solución. Esta frecuencia de torsión (conocida como paso helicoidal ) depende en gran medida de las fuerzas de apilamiento que cada base ejerce sobre sus vecinas en la cadena. El ARN de doble hélice adopta una conformación similar a la estructura de la forma A.
Son posibles otras conformaciones; de hecho, actualmente sólo las letras F, Q, U, V e Y están disponibles para describir cualquier nueva estructura de ADN que pueda aparecer en el futuro. [4] [5] Sin embargo, la mayoría de estas formas se han creado sintéticamente y no se han observado en sistemas biológicos naturales.
Triplex de surco mayor y menor
El triplete del surco menor es un motivo estructural omnipresente en el ARN . Debido a que las interacciones con el surco menor suelen estar mediadas por el 2'-OH del azúcar ribosa , este motivo del ARN se ve muy diferente de su equivalente en el ADN . El ejemplo más común de un triplete del surco menor es el motivo A-minor, o la inserción de bases de adenosina en el surco menor (ver arriba). Sin embargo, este motivo no se limita a las adenosinas, ya que también se ha observado que otras nucleobases interactúan con el surco menor del ARN.
El surco menor presenta un complemento casi perfecto para una base insertada. Esto permite contactos de van der Waals óptimos , enlaces de hidrógeno extensos y enterramiento superficial hidrofóbico , y crea una interacción altamente favorable energéticamente. [8] [9] Debido a que los triples del surco menor son capaces de empaquetar de manera estable un bucle libre y una hélice, son elementos clave en la estructura de los ribonucleótidos grandes , incluido el intrón del grupo I, [10] el intrón del grupo II, [11] y el ribosoma .
Aunque el surco mayor del ARN de forma A estándar es bastante estrecho y, por lo tanto, menos disponible para la interacción triplex que el surco menor, se pueden observar interacciones triplex del surco mayor en varias estructuras de ARN. Estas estructuras consisten en varias combinaciones de pares de bases e interacciones de Hoogsteen. Por ejemplo, el triplex GGC (GGC amino(N-2)-N-7, imino-carbonilo, carbonil-amino(N-4); Watson-Crick) observado en el ribosoma 50S , compuesto por un par GC de tipo Watson-Crick y una G entrante que forma una red pseudo-Hoogsteen de interacciones de enlaces de hidrógeno entre ambas bases involucradas en el apareamiento canónico. [12] Otros ejemplos notables de tripletes del surco mayor incluyen (i) el núcleo catalítico del intrón del grupo II que se muestra en la figura de la izquierda [6] (ii) una triple hélice catalíticamente esencial observada en el ARN de la telomerasa humana [7] (iii) el riboswitch SAM-II [14] y (iv) el elemento para la expresión nuclear (ENE), que actúa como un elemento de estabilización del ARN a través de la formación de la triple hélice con la cola de poli(A). [15] [16]
El ADN de triple cadena también es posible a partir de enlaces de hidrógeno Hoogsteen o Hoogsteen invertidos en el surco mayor del ADN en forma B.
Cuádruplex
Además de las dobles hélices y los tripletes mencionados anteriormente, el ARN y el ADN también pueden formar hélices cuádruples. Existen diversas estructuras de cuádruplexes de bases de ARN. Cuatro residuos de guanina consecutivos pueden formar un cuádruplex en el ARN mediante enlaces de hidrógeno de Hoogsteen para formar un “anillo de Hoogsteen” (ver Figura). [12] Los pares GC y AU también pueden formar cuádruplexes de bases con una combinación de emparejamiento Watson-Crick y emparejamiento no canónico en el surco menor . [17]
El núcleo del aptámero verde malaquita también es un tipo de cuádruplex de base con un patrón de enlaces de hidrógeno diferente (ver figura). [13] El cuádruplex puede repetirse varias veces consecutivas, produciendo una estructura inmensamente estable.
La estructura única de las regiones cuádruplex del ARN puede cumplir distintas funciones en un sistema biológico. Dos funciones importantes son el potencial de unión con ligandos o proteínas y su capacidad para estabilizar toda la estructura terciaria del ADN o el ARN. La fuerte estructura puede inhibir o modular la transcripción y la replicación , como en los telómeros de los cromosomas y el UTR del ARNm. [18] La identidad de bases es importante para la unión del ligando. El G-cuarteto normalmente se une a cationes monovalentes como el potasio, mientras que otras bases pueden unirse a numerosos otros ligandos como la hipoxantina en un cuádruplex UUCU. [17]
Además de estas funciones, el G-quadruplex en el ARNm alrededor de las regiones de unión de los ribosomas podría servir como un regulador de la expresión genética en bacterias . [19] Es posible que aún haya estructuras y funciones más interesantes por descubrir in vivo .
Apilamiento coaxial

El apilamiento coaxial, también conocido como apilamiento helicoidal, es un determinante principal de la estructura terciaria de ARN de orden superior. El apilamiento coaxial ocurre cuando dos dúplex de ARN forman una hélice contigua, que se estabiliza mediante el apilamiento de bases en la interfaz de las dos hélices. El apilamiento coaxial se observó en la estructura cristalina de ARNtPhe. [21] Más recientemente, se ha observado apilamiento coaxial en estructuras de orden superior de muchas ribozimas , incluidas muchas formas de los intrones del grupo I y del grupo II autoempalmables . Los motivos de apilamiento coaxial comunes incluyen la interacción de bucle de beso y el pseudonudo . La estabilidad de estas interacciones se puede predecir mediante una adaptación de las "reglas de Turner". [22]
En 1994, Walter y Turner determinaron las contribuciones de energía libre de las interacciones de apilamiento del vecino más cercano dentro de una interfaz hélice-hélice utilizando un sistema modelo que creó una interfaz hélice-hélice entre un oligómero corto y un saliente de cuatro nucleótidos en el extremo de un tallo de horquilla . Sus experimentos confirmaron que la contribución termodinámica del apilamiento de bases entre dos estructuras secundarias helicoidales imita de cerca la termodinámica de la formación de dúplex estándar (las interacciones del vecino más cercano predicen la estabilidad termodinámica de la hélice resultante). La estabilidad relativa de las interacciones del vecino más cercano se puede utilizar para predecir el apilamiento coaxial favorable basado en la estructura secundaria conocida. Walter y Turner descubrieron que, en promedio, la predicción de la estructura del ARN mejoró del 67% al 74% de precisión cuando se incluyeron las contribuciones del apilamiento coaxial. [23]
La mayoría de las estructuras terciarias de ARN mejor estudiadas contienen ejemplos de apilamiento coaxial. Algunos ejemplos destacados son el ARNt-Phe, los intrones del grupo I, los intrones del grupo II y los ARN ribosómicos. Las estructuras cristalinas del ARNt revelaron la presencia de dos hélices extendidas que resultan del apilamiento coaxial del tallo aceptor de aminoácidos con el brazo T y el apilamiento de los brazos D y anticodón. Estas interacciones dentro del ARNt orientan el tallo anticodón perpendicularmente al tallo de aminoácidos, lo que conduce a la estructura terciaria funcional en forma de L. [21] En los intrones del grupo I, se demostró que las hélices P4 y P6 se apilan coaxialmente utilizando una combinación de métodos bioquímicos [24] y cristalográficos. La estructura cristalina P456 proporcionó una vista detallada de cómo el apilamiento coaxial estabiliza el empaquetamiento de las hélices de ARN en estructuras terciarias. [25] En el intrón del grupo II de autoempalme de Oceanobacillus iheyensis, los tallos IA e IB se apilan coaxialmente y contribuyen a la orientación relativa de las hélices constituyentes de una unión de cinco vías. [6] Esta orientación facilita el plegamiento adecuado del sitio activo de la ribozima funcional. El ribosoma contiene numerosos ejemplos de apilamiento coaxial, incluidos segmentos apilados de hasta 70 pb. [26]

Dos motivos comunes que implican apilamiento coaxial son los bucles de beso y los pseudonudos. En las interacciones de bucles de beso, las regiones de bucle monocatenario de dos horquillas interactúan mediante apareamiento de bases, formando una hélice compuesta apilada coaxialmente. Cabe destacar que esta estructura permite que todos los nucleótidos en cada bucle participen en interacciones de apareamiento y apilamiento de bases. Lee y Crothers visualizaron y estudiaron este motivo mediante análisis de RMN. [27] El motivo de pseudonudo se produce cuando una región monocatenaria de un bucle de horquilla se empareja con una secuencia anterior o posterior dentro de la misma cadena de ARN. Las dos regiones dúplex resultantes a menudo se apilan una sobre la otra, formando una hélice compuesta apilada coaxialmente estable. Un ejemplo de un motivo de pseudonudo es la ribozima del virus de la hepatitis delta altamente estable, en la que la estructura principal muestra una topología general de pseudonudo doble. [28]
Se ha observado un efecto similar al apilamiento coaxial en estructuras de ADN diseñadas racionalmente . Las estructuras de ADN en origami contienen una gran cantidad de dobles hélices con extremos romos expuestos. Se observó que estas estructuras se pegaban entre sí a lo largo de los bordes que contenían estos extremos romos expuestos, debido a las interacciones de apilamiento hidrofóbicas. [29] Al combinar estas nanoestructuras de ADN diseñadas racionalmente y las imágenes de superresolución DNA-PAINT, los investigadores discernieron la fuerza individual de las energías de apilamiento entre todos los dinucleótidos posibles. [30]
Medición del apilamiento coaxial en ácidos nucleicos
Las primeras mediciones del apilamiento coaxial se realizaron utilizando ensayos bioquímicos que estudian la migración relativa de diferentes moléculas de ácido nucleico en función de su conformación y el tipo de interacciones presentes. Las moléculas de ADN cortas que contienen mellas que aún pueden apilarse coaxialmente migraron más rápido que las moléculas de ADN que contienen huecos y, por lo tanto, no tenían apilamiento coaxial. Esto podría explicarse por las propiedades poliméricas del ADN, donde una molécula más rígida similar a una varilla migrará más rápido a lo largo de un gradiente eléctrico en una matriz en comparación con una molécula más flexible. [31] El desarrollo de técnicas más nuevas, como pinzas ópticas y la capacidad de plegar nanoestructuras de ADN, condujo a la medición de los haces de ADN y su capacidad para apilarse entre sí. La fuerza necesaria para separar estos haces utilizando pinzas ópticas podría luego analizarse para medir las energías de apilamiento de pares de bases. [32] Estas mediciones se realizaron principalmente en condiciones de no equilibrio y se realizaron varias extrapolaciones para llegar a los valores exactos de apilamiento coaxial entre bases. Estudios recientes de moléculas individuales que utilizan nanoestructuras de ADN y microscopía de súper resolución DNA-PAINT han permitido medir estas interacciones entre dinucleótidos mediante un análisis cinético profundo de los tiempos de unión de moléculas cortas de ADN a sus secuencias complementarias en presencia o ausencia de interacciones de apilamiento de ADN. [30]
Otros motivos
Interacciones entre el tetraloop y el receptor

Las interacciones tetraloop-receptor combinan interacciones de apareamiento de bases y apilamiento entre los nucleótidos en bucle de un motivo tetraloop y un motivo receptor ubicado dentro de un dúplex de ARN, creando un contacto terciario que estabiliza el pliegue terciario global de una molécula de ARN . Los tetraloops también son estructuras posibles en los dúplex de ADN. [34]
Los bucles de tallo pueden variar mucho en tamaño y secuencia, pero los tetraloops de cuatro nucleótidos son muy comunes y generalmente pertenecen a una de tres categorías, según la secuencia. [35] Estas tres familias son los tetraloops CUYG, UNCG y GNRA (ver figura a la derecha) . [36] En cada una de estas familias de tetraloops, el segundo y tercer nucleótido forman un giro en la cadena de ARN y un par de bases entre el primer y cuarto nucleótidos estabiliza la estructura del bucle de tallo. Se ha determinado, en general, que la estabilidad del tetraloop depende de la composición de bases dentro del bucle y de la composición de este "par de bases de cierre". [37] La familia de tetraloops GNRA es la que se observa con más frecuencia dentro de las interacciones de tetraloop con receptor. Además, se sabe que los tetraloops UMAC son versiones alternativas de los bucles GNRA, y ambos comparten estructuras de cadena principal similares; A pesar de las similitudes, difieren en las posibles interacciones de largo alcance de las que son capaces. [38]

Los “motivos del receptor de tetraloop” son interacciones terciarias de largo alcance [39] que consisten en enlaces de hidrógeno entre las bases en las secuencias de tetraloop a stemloop en secciones distales de la estructura secundaria del ARN. [40] Además de los enlaces de hidrógeno, las interacciones de apilamiento son un componente importante de estas interacciones terciarias. Por ejemplo, en las interacciones GNRA-tetraloop, el segundo nucleótido del tetraloop se apila directamente sobre un motivo de plataforma A (ver arriba) dentro del receptor. [25] La secuencia del tetraloop y su receptor a menudo covarían de modo que se puede realizar el mismo tipo de contacto terciario con diferentes isoformas del tetraloop y su receptor cognado. [41]
Por ejemplo, el intrón del grupo I de autoempalme depende de motivos del receptor tetraloop para su estructura y función. [25] [40] Específicamente, los tres residuos de adenina del motivo GAAA canónico se apilan en la parte superior de la hélice del receptor y forman múltiples enlaces de hidrógeno estabilizadores con el receptor. La primera adenina de la secuencia GAAA forma un triple par de bases con las bases AU del receptor. La segunda adenina se estabiliza mediante enlaces de hidrógeno con la misma uridina, así como a través de su 2'-OH con el receptor y a través de interacciones con la guanina del tetraloop GAAA. La tercera adenina forma un triple par de bases.
Motivo en la menor
El motivo A-minor es un motivo estructural terciario omnipresente en el ARN . Se forma mediante la inserción de un nucleósido desapareado en el surco menor de un dúplex de ARN. Como tal, es un ejemplo de un triple del surco menor. Aunque la guanosina, la citosina y la uridina también pueden formar interacciones de triples del surco menor, las interacciones del surco menor con la adenina son muy comunes. En el caso de la adenina, el borde N1-C2-N3 de la base que se inserta forma enlaces de hidrógeno con uno o ambos 2'-OH del dúplex, así como con las bases del dúplex (véase la figura: interacciones A-minor). El dúplex anfitrión suele ser un par de bases GC.
Los motivos A-minor se han separado en cuatro clases, [8] [9] tipos 0 a III, según la posición de la base de inserción en relación con los dos 2'-OH del par de bases Watson-Crick . En los motivos A-minor de tipo I y II, el N3 de la adenina se inserta profundamente dentro del surco menor del dúplex (ver figura: Interacciones A-minor - interacción tipo II), y hay una buena complementariedad de forma con el par de bases. A diferencia de los tipos 0 y III, las interacciones de tipo I y II son específicas para la adenina debido a las interacciones de enlaces de hidrógeno. En la interacción de tipo III, tanto el O2' como el N3 de la base de inserción están asociados menos estrechamente con el surco menor del dúplex. Los motivos de tipo 0 y III son más débiles y no específicos porque están mediados por interacciones con un solo 2'-OH (ver figura: Interacciones A-minor - interacciones tipo 0 y tipo III).
El motivo A-minor es uno de los motivos estructurales de ARN más comunes en el ribosoma, donde contribuye a la unión del ARNt a la subunidad 23S. [43] Con mayor frecuencia estabilizan las interacciones del dúplex de ARN en bucles y hélices, como en el núcleo de los intrones del grupo II. [6]
Un ejemplo interesante de A-minor es su papel en el reconocimiento del anticodón . El ribosoma debe discriminar entre pares codón-anticodón correctos e incorrectos. Lo hace, en parte, mediante la inserción de bases de adenina en el surco menor. Los pares codón-anticodón incorrectos presentarán una geometría helicoidal distorsionada, lo que impedirá que la interacción A-minor estabilice la unión y aumentará la tasa de disociación del ARNt incorrecto. [44]
Un análisis de los motivos A-minor en el ARN ribosómico 23S ha revelado una red jerárquica de dependencias estructurales, que se sugiere que están relacionadas con la evolución ribosómica y con el orden de eventos que llevaron al desarrollo de la subunidad grande bacteriana moderna. [45]
Se informa que el motivo A-minor y su nueva subclase, las interacciones WC/H A-minor, fortalecen otras estructuras terciarias del ARN, como las triples hélices del surco mayor identificadas en los elementos de estabilización del ARN. [16] [15]
Cremallera de ribosa
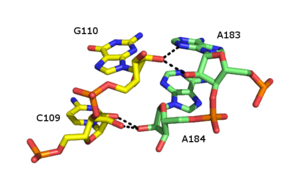
La cremallera de ribosa es un elemento estructural terciario del ARN en el que dos cadenas de ARN se mantienen unidas mediante interacciones de enlaces de hidrógeno que involucran el 2'OH de los azúcares ribosa en diferentes hebras. El 2'OH puede comportarse tanto como donante como aceptor de enlaces de hidrógeno, lo que permite la formación de enlaces de hidrógeno bifurcados con otro 2'OH. [46] [47]
Se han descrito numerosas formas de cremallera de ribosa, pero un tipo común implica cuatro enlaces de hidrógeno entre grupos 2'-OH de dos azúcares adyacentes. Las cremalleras de ribosa se producen comúnmente en matrices que estabilizan las interacciones entre hebras de ARN separadas. [48] Las cremalleras de ribosa se observan a menudo como interacciones de tallo-bucle con una especificidad de secuencia muy baja. Sin embargo, en las subunidades ribosómicas pequeñas y grandes , existe una propensión a las cremalleras de ribosa de la secuencia CC/AA: dos citosinas en la primera cadena emparejadas con dos adeninas en la segunda cadena.
Papel de los iones metálicos
Los ARN funcionales son a menudo moléculas estables y plegadas con formas tridimensionales en lugar de hebras lineales y flexibles. [50] Los cationes son esenciales para la estabilización termodinámica de las estructuras terciarias del ARN. Los cationes metálicos que se unen al ARN pueden ser monovalentes, divalentes o trivalentes. El potasio (K + ) es un ion monovalente común que se une al ARN. Un ion divalente común que se une al ARN es el magnesio (Mg2 + ). Se ha descubierto que otros iones, incluidos el sodio (Na + ), el calcio (Ca2 + ) y el manganeso (Mn2 + ), se unen al ARN in vivo e in vitro . Los cationes orgánicos multivalentes como la espermidina o la espermina también se encuentran en las células y estos hacen contribuciones importantes al plegamiento del ARN. Los iones trivalentes como la hexamina de cobalto o los iones lantánidos como el terbio (Tb3 + ) son herramientas experimentales útiles para estudiar la unión de metales al ARN. [51] [52]
Un ion metálico puede interactuar con el ARN de múltiples maneras. Un ion puede asociarse difusamente con la cadena principal del ARN, protegiendo de interacciones electrostáticas desfavorables . Esta protección de carga a menudo la cumplen los iones monovalentes. Los iones unidos al sitio estabilizan elementos específicos de la estructura terciaria del ARN. Las interacciones unidas al sitio se pueden subdividir en dos categorías dependiendo de si el agua media la unión del metal. Las interacciones de la "esfera externa" están mediadas por moléculas de agua que rodean al ion metálico. Por ejemplo, el hexahidrato de magnesio interactúa con motivos específicos de la estructura terciaria del ARN y los estabiliza a través de interacciones con guanosina en el surco mayor. Por el contrario, las interacciones de la "esfera interna" están mediadas directamente por el ion metálico. El ARN a menudo se pliega en múltiples etapas y estos pasos pueden estabilizarse mediante diferentes tipos de cationes. En las primeras etapas, el ARN forma estructuras secundarias estabilizadas a través de la unión de cationes monovalentes, cationes divalentes y aminas polianiónicas para neutralizar la cadena principal polianiónica. Las etapas posteriores de este proceso implican la formación de la estructura terciaria del ARN, que se estabiliza casi en gran medida mediante la unión de iones divalentes como el magnesio, con posibles contribuciones de la unión del potasio.
Los sitios de unión de metales a menudo se localizan en el surco mayor profundo y estrecho del dúplex de ARN, coordinándose con los bordes de Hoogsteen de las purinas . En particular, los cationes metálicos estabilizan los sitios de torsión de la cadena principal donde el empaquetamiento apretado de fosfatos da como resultado una región de carga negativa densa. Hay varios motivos de unión de iones metálicos en dúplex de ARN que se han identificado en estructuras cristalinas. Por ejemplo, en el dominio P4-P6 del intrón del grupo I de Tetrahymena thermophila , varios sitios de unión de iones consisten en pares de bamboleo GU en tándem y desajustes GA en tándem , en los que los cationes divalentes interactúan con el borde de Hoogsteen de la guanosina a través de O6 y N7. [53] [54] [55] Otro motivo de unión de iones en el intrón del grupo I de Tetrahymena es el motivo de la plataforma AA, en el que las adenosinas consecutivas en la misma hebra de ARN forman un par de pseudobases no canónico. [56] A diferencia del motivo GU en tándem, el motivo de la plataforma AA se une preferentemente a cationes monovalentes. En muchos de estos motivos, la ausencia de cationes monovalentes o divalentes da como resultado una mayor flexibilidad o la pérdida de la estructura terciaria.
Se ha descubierto que los iones metálicos divalentes, especialmente el magnesio , son importantes para la estructura de las uniones de ADN, como la unión de Holliday, intermediaria en la recombinación genética . El ion magnesio protege a los grupos de fosfato cargados negativamente en la unión y les permite posicionarse más cerca entre sí, lo que permite una conformación apilada en lugar de una conformación no apilada. [57] El magnesio es vital para estabilizar este tipo de uniones en estructuras diseñadas artificialmente que se utilizan en la nanotecnología del ADN , como el motivo de doble cruce. [58]
Historia
Los primeros trabajos sobre biología estructural del ARN coincidieron, más o menos, con los trabajos sobre el ADN que se estaban realizando a principios de los años 1950. En su influyente artículo de 1953, Watson y Crick sugirieron que el hacinamiento de van der Waals por el grupo 2`OH de la ribosa impediría que el ARN adoptara una estructura de doble hélice idéntica al modelo que ellos propusieron, lo que hoy conocemos como ADN en forma B. [59] Esto provocó preguntas sobre la estructura tridimensional del ARN: ¿podría esta molécula formar algún tipo de estructura helicoidal y, de ser así, cómo?
A mediados de la década de 1960, se estaba estudiando intensamente el papel del ARNt en la síntesis de proteínas. En 1965, Holley et al. purificaron y secuenciaron la primera molécula de ARNt, proponiendo inicialmente que adoptaba una estructura de hoja de trébol, basada en gran medida en la capacidad de ciertas regiones de la molécula para formar estructuras de tallo y bucle. [60] El aislamiento del ARNt resultó ser el primer gran logro en la biología estructural del ARN. En 1971, Kim et al. lograron otro avance, produciendo cristales de PHE de ARNt de levadura que se difractaban a resoluciones de 2-3 Ångström utilizando espermina, una poliamina natural , que se unía al ARNt y lo estabilizaba. [61]
Durante un tiempo considerable después de las primeras estructuras de ARNt, el campo de la estructura del ARN no avanzó de manera espectacular. La capacidad de estudiar una estructura de ARN dependía de la posibilidad de aislar el ARN diana. Esto resultó ser una limitación para el campo durante muchos años, en parte porque otros objetivos conocidos (es decir, el ribosoma ) eran significativamente más difíciles de aislar y cristalizar. Por ello, durante unos veinte años después de la publicación original de la estructura de PHE del ARNt , solo se resolvieron las estructuras de un puñado de otros objetivos de ARN, y casi todos ellos pertenecían a la familia del ARN de transferencia. [62]
Esta desafortunada falta de alcance eventualmente se superaría en gran medida debido a dos avances importantes en la investigación de ácidos nucleicos: la identificación de ribozimas y la capacidad de producirlas a través de la transcripción in vitro . Después de la publicación de Tom Cech que implicaba al intrón del grupo I de Tetrahymena como un ribozima autocatalítico, [63] y el informe de Sidney Altman sobre la catálisis por ARN ribonucleasa P, [64] se identificaron varios otros ARN catalíticos a fines de la década de 1980, [65] incluido el ribozima cabeza de martillo. En 1994, McKay et al. publicaron la estructura de un 'complejo inhibidor de ribozima de ARN-ADN cabeza de martillo' con una resolución de 2,6 Ångström, en el que la actividad autocatalítica del ribozima se interrumpió mediante la unión a un sustrato de ADN. [66] Además de los avances en la determinación de la estructura global mediante cristalografía, a principios de los años 1990 también se aplicó la RMN como una técnica poderosa en la biología estructural del ARN. Investigaciones como ésta permitieron una caracterización más precisa de las interacciones de apareamiento y apilamiento de bases que estabilizaron los pliegues globales de las moléculas de ARN grandes.
El resurgimiento de la biología estructural del ARN a mediados de la década de 1990 ha provocado una verdadera explosión en el campo de la investigación estructural de los ácidos nucleicos. Desde la publicación de las estructuras hammerhead y P 4-6 , se han realizado numerosas contribuciones importantes al campo. Algunos de los ejemplos más notables incluyen las estructuras de los intrones del Grupo I y del Grupo II , [6] y el Ribosoma . [42] Las primeras tres estructuras se produjeron utilizando transcripción in vitro , y esa RMN ha desempeñado un papel en la investigación de componentes parciales de las cuatro estructuras, testimonio de la indispensabilidad de ambas técnicas para la investigación del ARN. El Premio Nobel de Química de 2009 fue otorgado a Ada Yonath , Venkatraman Ramakrishnan y Thomas Steitz por su trabajo estructural sobre el ribosoma , lo que demuestra el papel destacado que ha tenido la biología estructural del ARN en la biología molecular moderna.
Véase también
- Tallo-bucle
- Pseudonudo
- Predicción de la estructura secundaria
- Par de bases
- Par de bases oscilantes
- Par de bases de Hoogsteen
- Ribosoma
- Riboswitch
- Ribozima
- Ribozima de cabeza de martillo
- Intrón catalítico del grupo I
- Intrón del grupo II
- ARNt
- G-cuadrúplex
- ADN i-motif
- Tetrabuco
- Secuencia resbaladiza
- Besando el tallo-bucle
Referencias
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "estructura terciaria". doi :10.1351/goldbook.T06282
- ^ Richmond TJ, Davey CA (mayo de 2003). "La estructura del ADN en el núcleo del nucleosoma". Nature . 423 (6936): 145–50. Bibcode :2003Natur.423..145R. doi :10.1038/nature01595. PMID 12736678. S2CID 205209705.
- ^ Watson JD, Crick FH (abril de 1953). "Estructura molecular de los ácidos nucleicos; una estructura para el ácido desoxirribonucleico" (PDF) . Nature . 171 (4356): 737–8. Bibcode :1953Natur.171..737W. doi :10.1038/171737a0. PMID 13054692. S2CID 4253007.
- ^ Bansal M (2003). "Estructura del ADN: revisitando la doble hélice Watson-Crick". Current Science . 85 (11): 1556–1563.
- ^ Ghosh A, Bansal M (2003). "Un glosario de estructuras de ADN de la A a la Z". Acta Crystallogr D . 59 (4): 620–626. doi :10.1107/S0907444903003251. PMID 12657780.
- ^ abcde PDB : 3BWP ; Toor N, Keating KS, Taylor SD, Pyle AM (abril de 2008). "Estructura cristalina de un intrón del grupo II autoempalmado". Science . 320 (5872): 77–82. Bibcode :2008Sci...320...77T. doi :10.1126/science.1153803. PMC 4406475 . PMID 18388288. ; renderizado con PyMOL
- ^ ab PDB : 2K95 ; Kim NK, Zhang Q, Zhou J, Theimer CA, Peterson RD, Feigon J (diciembre de 2008). "Estructura de la solución y dinámica del pseudonudo de tipo salvaje del ARN de la telomerasa humana". J. Mol. Biol . 384 (5): 1249–61. doi :10.1016/j.jmb.2008.10.005. PMC 2660571 . PMID 18950640. ; renderizado con PyMOL
- ^ ab Nissen P, Ippolito JA, Ban N, Moore PB, Steitz TA (abril de 2001). "Interacciones terciarias del ARN en la subunidad ribosomal grande: el motivo A-minor". Proc. Natl. Sci. EE. UU . . 98 (9): 4899–903. Bibcode :2001PNAS...98.4899N. doi : 10.1073/pnas.081082398 . PMC 33135 . PMID 11296253.
- ^ ab Doherty EA, Batey RT, Masquida B, Doudna JA (abril de 2001). "Un modo universal de empaquetamiento de hélices en el ARN". Nat. Struct. Biol . 8 (4): 339–43. doi :10.1038/86221. PMID 11276255. S2CID 213577.
- ^ Szewczak AA, Ortoleva-Donnelly L, Ryder SP, Moncoeur E, Strobel SA (diciembre de 1998). "Una triple hélice de ARN de surco menor dentro del núcleo catalítico de un intrón del grupo I". Nat. Struct. Biol . 5 (12): 1037–42. doi :10.1038/4146. PMID 9846872. S2CID 10908125.
- ^ Boudvillain M, de Lencastre A, Pyle AM (julio de 2000). "Una interacción terciaria que vincula los dominios del sitio activo al sitio de empalme 5' de un intrón del grupo II". Nature . 406 (6793): 315–8. Bibcode :2000Natur.406..315B. doi :10.1038/35018589. PMID 10917534. S2CID 4336795.
- ^ abc PDB : 1RAU ; Cheong C, Moore PB (septiembre de 1992). "Estructura de la solución de un tetraplex de ARN inusualmente estable que contiene estructuras de cuarteto G y U". Bioquímica . 31 (36): 8406–14. doi :10.1021/bi00151a003. PMID 1382577.; renderizado con PyMOL
- ^ ab PDB : 1FIT ; Baugh C, Grate D, Wilson C (agosto de 2000). "2.8 Una estructura cristalina del aptámero verde malaquita". J. Mol. Biol . 301 (1): 117–28. doi :10.1006/jmbi.2000.3951. PMID 10926496.; renderizado con PyMOL
- ^ Gilbert SD, Rambo RP, Van Tyne D, Batey RT (febrero de 2008). "Estructura del riboswitch SAM-II unido a S-adenosilmetionina". Nat. Struct. Mol. Biol . 15 (2): 177–82. doi :10.1038/nsmb.1371. PMID 18204466. S2CID 40791601.
- ^ ab Mitton-Fry RM, DeGregorio SJ, Wang J, Steitz TA, Steitz JA (noviembre de 2010). "Reconocimiento de cola de poli(A) por un elemento de ARN viral a través del ensamblaje de una triple hélice". Science . 330 (6008): 1244–7. Bibcode :2010Sci...330.1244M. doi :10.1126/science.1195858. PMC 3074936 . PMID 21109672.
- ^ ab Torabi SF, Vaidya AT, Tycowski KT, DeGregorio SJ, Wang J, Shu MD, et al. (enero de 2021). "Estabilización del ARN mediante un bolsillo de unión del extremo 3' de la cola de poli(A) y otros modos de interacción entre poli(A) y ARN". Science . 371 (6529). doi : 10.1126/science.abe6523 . ISSN 0036-8075. PMC 9491362 . PMID 33414189. S2CID 231195473.
- ^ ab Batey RT, Gilbert SD, Montange RK (noviembre de 2004). "Estructura de un riboswitch sensible a la guanina natural en complejo con el metabolito hipoxantina". Nature . 432 (7015): 411–5. Bibcode :2004Natur.432..411B. doi :10.1038/nature03037. PMID 15549109. S2CID 2462025.
- ^ Arthanari H, Bolton PH (marzo de 2001). "Funciones y funciones disfuncionales del ADN cuádruplex en las células". Chem. Biol . 8 (3): 221–30. doi : 10.1016/S1074-5521(01)00007-2 . PMID 11306347.
- ^ Oliver AW, Bogdarina I, Schroeder E, Taylor IA, Kneale GG (agosto de 2000). "Unión preferencial de la proteína del gen fd 5 a estructuras de ácidos nucleicos tetraplex". J. Mol. Biol . 301 (3): 575–84. doi :10.1006/jmbi.2000.3991. PMID 10966771.
- ^ PDB : 6tna ; Sussman JL, Holbrook SR, Warrant RW, Church GM, Kim SH (agosto de 1978). "Estructura cristalina del ARN de transferencia de fenilalanina de levadura. I. Refinamiento cristalográfico". J. Mol. Biol . 123 (4): 607–30. doi :10.1016/0022-2836(78)90209-7. PMID 357742.; renderizado mediante PyMOL.
- ^ ab Quigley GJ, Rich A (noviembre de 1976). "Dominios estructurales de las moléculas de ARN de transferencia". Science . 194 (4267): 796–806. Bibcode :1976Sci...194..796Q. doi :10.1126/science.790568. PMID 790568.
- ^ "Douglas H. Turner". Reglas de Turner . Departamento de Química, Universidad de Rochester.
- ^ Walter AE, Turner DH, Kim J, Lyttle MH, Müller P, Mathews DH, Zuker M (septiembre de 1994). "El apilamiento coaxial de hélices mejora la unión de oligorribonucleótidos y las predicciones del plegamiento del ARN". Proc. Natl. Sci. USA . 91 (20): 9218–22. Bibcode :1994PNAS...91.9218W. doi : 10.1073/pnas.91.20.9218 . PMC 44783 . PMID 7524072.
- ^ Murphy FL, Wang YH, Griffith JD, Cech TR (septiembre de 1994). "Hélices de ARN apiladas coaxialmente en el centro catalítico de la ribozima de Tetrahymena". Science . 265 (5179): 1709–12. Bibcode :1994Sci...265.1709M. doi :10.1126/science.8085157. PMID 8085157.
- ^ abc Cate JH, Gooding AR, Podell E, Zhou K, Golden BL, Kundrot CE, Cech TR, Doudna JA (septiembre de 1996). "Estructura cristalina de un dominio de ribozima del grupo I: principios del empaquetamiento del ARN". Science . 273 (5282): 1678–85. Bibcode :1996Sci...273.1678C. doi :10.1126/science.273.5282.1678. PMID 8781224. S2CID 38185676.
- ^ Noller HF (septiembre de 2005). "Estructura del ARN: lectura del ribosoma". Science . 309 (5740): 1508–14. Bibcode :2005Sci...309.1508N. doi :10.1126/science.1111771. PMID 16141058. S2CID 16577145.
- ^ Lee AJ, Crothers DM (agosto de 1998). "La estructura de la solución de un complejo de bucle-bucle de ARN: la secuencia de bucle invertido de ColE1". Structure . 6 (8): 993–1005. doi : 10.1016/S0969-2126(98)00101-4 . PMID 9739090.
- ^ Ferré-D'Amaré AR, Zhou K, Doudna JA (octubre de 1998). "Estructura cristalina de una ribozima del virus de la hepatitis delta". Nature . 395 (6702): 567–74. Bibcode :1998Natur.395..567F. doi :10.1038/26912. PMID 9783582. S2CID 4359811.
- ^ Rothemund PW (marzo de 2006). "Plegado de ADN para crear formas y patrones a escala nanométrica" (PDF) . Nature . 440 (7082): 297–302. Bibcode :2006Natur.440..297R. doi :10.1038/nature04586. PMID 16541064. S2CID 4316391.
- ^ ab Banerjee, Abhinav; Anand, Micky; Kalita, Simanta; Ganji, Mahipal (diciembre de 2023). "Análisis de moléculas individuales de la energía de apilamiento de bases de ADN utilizando nanoestructuras de ADN estampadas". Nature Nanotechnology . 18 (12): 1474–1482. Bibcode :2023NatNa..18.1474B. doi :10.1038/s41565-023-01485-1. PMC 10716042 . PMID 37591937.
- ^ Yakovchuk, Peter; Protozanova, Ekaterina; Frank-Kamenetskii, Maxim D. (2006). "Contribuciones del apilamiento y emparejamiento de bases a la estabilidad térmica de la doble hélice del ADN". Nucleic Acids Research . 34 (2): 564–574. doi :10.1093/nar/gkj454. PMC 1360284 . PMID 16449200.
- ^ KILCHHERR, FABIÁN; WACHAUF, CRISTIANO; PELZ, BENJAMÍN; RIEF, MATÍAS; ZACARÍAS, MARTÍN; DIETZ, HENDRIK (2016). "Disección de una sola molécula de fuerzas de apilamiento en el ADN". Ciencia . 353 (6304). doi : 10.1126/ciencia.aaf5508. PMID 27609897.
- ^ abcd PDB : 1GID ; Cate JH, Gooding AR, Podell E, Zhou K, Golden BL, Kundrot CE, Cech TR, Doudna JA (septiembre de 1996). "Estructura cristalina de un dominio de ribozima del grupo I: principios del empaquetamiento del ARN". Science . 273 (5282): 1678–85. Bibcode :1996Sci...273.1678C. doi :10.1126/science.273.5282.1678. PMID 8781224. S2CID 38185676.; renderizado con PyMOL
- ^ Nakano M, Moody EM, Liang J, Bevilacqua PC (diciembre de 2002). "La selección de tetraloops de ADN termodinámicamente estables mediante electroforesis en gel con gradiente de temperatura revela cuatro motivos: d(cGNNAg), d(cGNABg),d(cCNNGg) y d(gCNNGc)". Biochemistry . 41 (48): 14281–92. doi :10.1021/bi026479k. PMID 12450393.
- ^ Moore PB (1999). "Motivos estructurales en el ARN". Annu. Rev. Biochem . 68 (1): 287–300. doi :10.1146/annurev.biochem.68.1.287. PMID 10872451.
- ^ Abramovitz DL, Pyle AM (febrero de 1997). "Variabilidad morfológica notable de un motivo común de plegamiento del ARN: la interacción tetraloop-receptor GNRA". J. Mol. Biol . 266 (3): 493–506. doi : 10.1006/jmbi.1996.0810 . PMID 9067606.
- ^ Moody EM, Feerrar JC, Bevilacqua PC (junio de 2004). "Evidencia de que el plegamiento de una horquilla tetraloop de ARN es menos cooperativo que su contraparte de ADN". Bioquímica . 43 (25): 7992–8. doi :10.1021/bi049350e. PMID 15209494.
- ^ Zhao Q, Huang HC, Nagaswamy U, Xia Y, Gao X, Fox GE (agosto de 2012). "Tetraloops UNAC: ¿en qué medida imitan a los tetraloops GNRA?". Biopolymers . 97 (8): 617–628. Bibcode :2012biopo..97..617Z. doi :10.1002/bip.22049. PMID 22605553.
- ^ Williams DH, Gait MJ, Loakes D (2006). Ácidos nucleicos en química y biología . Cambridge, Reino Unido: RSC Pub. ISBN 0-85404-654-2.
- ^ ab Jaeger L, Michel F, Westhof E (marzo de 1994). "Participación de un tetraloop de GNRA en interacciones terciarias de ARN de largo alcance". J. Mol. Biol . 236 (5): 1271–6. doi :10.1016/0022-2836(94)90055-8. PMID 7510342.
- ^ Michel F, Westhof E (diciembre de 1990). "Modelado de la arquitectura tridimensional de los intrones catalíticos del grupo I basado en el análisis comparativo de secuencias". J. Mol. Biol . 216 (3): 585–610. doi :10.1016/0022-2836(90)90386-Z. PMID 2258934.
- ^ abc PDB : 1FFK ; Ban N, Nissen P, Hansen J, Moore PB, Steitz TA (agosto de 2000). "La estructura atómica completa de la subunidad ribosomal grande con una resolución de 2,4 A". Science . 289 (5481): 905–20. Bibcode :2000Sci...289..905B. doi :10.1126/science.289.5481.905. PMID 10937989.; renderizado con PyMOL
- ^ Nissen P, Ippolito JA, Ban N, Moore PB, Steitz TA (abril de 2001). "Interacciones terciarias del ARN en la subunidad ribosomal grande: el motivo A-minor". Proc. Natl. Sci. EE. UU . . 98 (9): 4899–903. Bibcode :2001PNAS...98.4899N. doi : 10.1073/pnas.081082398 . PMC 33135 . PMID 11296253.
- ^ Yoshizawa S, Fourmy D, Puglisi JD (septiembre de 1999). "Reconocimiento de la hélice codón-anticodón por el ARN ribosómico". Science . 285 (5434): 1722–5. doi :10.1126/science.285.5434.1722. PMID 10481006.
- ^ Bokov K, Steinberg SV (febrero de 2009). "Un modelo jerárquico para la evolución del ARN ribosomal 23S". Nature . 457 (7232): 977–80. Bibcode :2009Natur.457..977B. doi :10.1038/nature07749. PMID 19225518. S2CID 4400869.
- ^ Batey RT, Rambo RP, Doudna JA (agosto de 1999). "Motivos terciarios en la estructura y el plegamiento del ARN". Angew. Chem. Int. Ed. Engl . 38 (16): 2326–2343. doi :10.1002/(SICI)1521-3773(19990816)38:16<2326::AID-ANIE2326>3.0.CO;2-3. PMID 10458781.
- ^ Tamura M, Holbrook SR (julio de 2002). "Conservación estructural y de secuencias en cremalleras de ribosa de ARN". J. Mol. Biol . 320 (3): 455–74. doi :10.1016/S0022-2836(02)00515-6. PMID 12096903.
- ^ PDB : 3IGI ; Toor N, Keating KS, Fedorova O, Rajashankar K, Wang J, Pyle AM (enero de 2010). "Arquitectura terciaria del intrón del grupo II de Oceanobacillus iheyensis". ARN . 16 (1): 57–69. doi :10.1261/rna.1844010. PMC 2802037 . PMID 19952115. ; renderizado utilizando PyMOL.
- ^ PDB : 1ZZN ; Stahley MR, Strobel SA (septiembre de 2005). "Evidencia estructural de un mecanismo de dos iones metálicos de empalme de intrones del grupo I". Science . 309 (5740): 1587–90. Bibcode :2005Sci...309.1587S. doi :10.1126/science.1114994. PMID 16141079. S2CID 40099718.; renderizado con PyMOL
- ^ Celander DW, Cech TR (enero de 1991). "Visualización del plegamiento de orden superior de una molécula de ARN catalítico". Science . 251 (4992): 401–7. Bibcode :1991Sci...251..401C. doi :10.1126/science.1989074. PMID 1989074.
- ^ Pyle AM (septiembre de 2002). "Iones metálicos en la estructura y función del ARN". J. Biol. Inorg. Chem . 7 (7–8): 679–90. doi :10.1007/s00775-002-0387-6. PMID 12203005. S2CID 42008484.
- ^ Morrow JR, Andolina CM (2012). "Capítulo 6. Investigaciones espectroscópicas de la unión de iones lantánidos a ácidos nucleicos". En Sigel A, Sigel H, Sigel RK (eds.). Interacción entre iones metálicos y ácidos nucleicos . Iones metálicos en las ciencias de la vida. Vol. 10. Springer. págs. 171–197. doi :10.1007/978-94-007-2172-2_6. ISBN 978-94-007-2171-5. Número de identificación personal 22210339.
- ^ Cate JH, Doudna JA (octubre de 1996). "Sitios de unión a metales en el surco mayor de un dominio de ribozima grande". Structure . 4 (10): 1221–9. doi : 10.1016/S0969-2126(96)00129-3 . PMID 8939748.
- ^ Kieft JS, Tinoco I (mayo de 1997). "Estructura de la solución de un sitio de unión a metal en el surco mayor del ARN complejado con hexamina de cobalto (III)". Structure . 5 (5): 713–21. doi : 10.1016/S0969-2126(97)00225-6 . PMID 9195889.
- ^ Rüdisser S, Tinoco I (febrero de 2000). "Estructura de la solución de cobalto(III)hexamina complejada con el tetraloop GAAA y unión de iones metálicos a desajustes G·A". J. Mol. Biol . 295 (5): 1211–23. doi :10.1006/jmbi.1999.3421. PMID 10653698.
- ^ Burkhardt C, Zacharias M (octubre de 2001). "Modelado de la unión de iones a motivos de plataforma AA en ARN: un estudio de disolvente continuo que incluye adaptación conformacional". Nucleic Acids Res . 29 (19): 3910–8. doi :10.1093/nar/29.19.3910. PMC 60250 . PMID 11574672.
- ^ Panyutin IG, Biswas I, Hsieh P (abril de 1995). "Un papel fundamental para la estructura de la unión de Holliday en la migración de las ramas del ADN". The EMBO Journal . 14 (8): 1819–26. doi :10.1002/j.1460-2075.1995.tb07170.x. PMC 398275 . PMID 7737132.
- ^ Fu TJ, Seeman NC (abril de 1993). "Moléculas de doble entrecruzamiento del ADN". Bioquímica . 32 (13): 3211–20. doi :10.1021/bi00064a003. PMID 8461289.
- ^ Watson JD, Crick FH (abril de 1953). "Estructura molecular de los ácidos nucleicos; una estructura para el ácido desoxirribonucleico" (PDF) . Nature . 171 (4356): 737–738. Bibcode :1953Natur.171..737W. doi :10.1038/171737a0. PMID 13054692. S2CID 4253007.
- ^ Holley, RW, Apgar, J, Everett, GA, Madison, JT, Marguisse, M, Merrill, SH, Penwick, JR, Zamir (marzo de 1965). "Estructura de un ácido ribonucleico". Science . 147 (3664): 1462–5. Bibcode :1965Sci...147.1462H. doi :10.1126/science.147.3664.1462. PMID 14263761. S2CID 40989800.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Kim SH, Quigley G, Suddath FL, Rich A (abril de 1971). "Patrones de difracción de rayos X de alta resolución de ARN de transferencia cristalino que muestran regiones helicoidales". Proc. Natl. Sci. EE. UU . . 68 (4): 841–5. doi : 10.1073/pnas.68.4.841 . PMC 389056 . PMID 5279525.
- ^ Shen LX, Cai Z, Tinoco I (agosto de 1995). "Estructura del ARN en alta resolución". FASEB J . 9 (11): 1023–33. doi : 10.1096/fasebj.9.11.7544309 . PMID 7544309. S2CID 40621440.
- ^ Cech TR, Zaug AJ, Grabowski PJ (diciembre de 1981). "Empalme in vitro del precursor de ARN ribosómico de Tetrahymena: participación de un nucleótido de guanosina en la escisión de la secuencia intermedia". Cell . 27 (3 Pt 2): 487–96. doi :10.1016/0092-8674(81)90390-1. PMID 6101203. S2CID 17674600.
- ^ Stark BC, Kole R, Bowman EJ, Altman S (agosto de 1978). "Ribonucleasa P: una enzima con un componente esencial de ARN". Proc. Natl. Sci. EE. UU . . 75 (8): 3717–21. Bibcode :1978PNAS...75.3717S. doi : 10.1073/pnas.75.8.3717 . PMC 392857 . PMID 358197.
- ^ Prody GA, Bakos JT, Buzayan JM, Schneider IR, Bruening G (marzo de 1986). "Procesamiento autolítico del ARN satélite de virus vegetales diméricos". Science . 231 (4745): 1577–1580. Bibcode :1986Sci...231.1577P. doi :10.1126/science.231.4745.1577. PMID 17833317. S2CID 21563490.
- ^ Pley HW, Flaherty KM, McKay DB (noviembre de 1994). "Estructura tridimensional de una ribozima de cabeza de martillo". Nature . 372 (6501): 68–74. Bibcode :1994Natur.372...68P. doi :10.1038/372068a0. PMID 7969422. S2CID 4333072.