Ribonucleótido
En bioquímica, un ribonucleótido es un nucleótido que contiene ribosa como su componente pentosa . Se considera un precursor molecular de los ácidos nucleicos . Los nucleótidos son los bloques de construcción básicos del ADN y el ARN . Los ribonucleótidos en sí mismos son bloques de construcción monoméricos básicos para el ARN. Los desoxirribonucleótidos , formados al reducir los ribonucleótidos con la enzima ribonucleótido reductasa (RNR), son bloques de construcción esenciales para el ADN. [1] Existen varias diferencias entre los desoxirribonucleótidos del ADN y los ribonucleótidos del ARN. Los nucleótidos sucesivos están unidos entre sí a través de enlaces fosfodiéster.
Los ribonucleótidos también se utilizan en otras funciones celulares. Estos monómeros especiales se utilizan tanto en la regulación celular como en la señalización celular , como se ve en el monofosfato de adenosina ( AMP ). Además, los ribonucleótidos se pueden convertir en trifosfato de adenosina ( ATP ), la moneda energética de los organismos. Los ribonucleótidos también se pueden convertir en monofosfato de adenosina cíclico ( AMP cíclico ) para regular las hormonas en los organismos. [1] En los organismos vivos, las bases más comunes para los ribonucleótidos son la adenina (A), la guanina (G), la citosina (C) o el uracilo (U). Las bases nitrogenadas se clasifican en dos compuestos parentales, la purina y la pirimidina .

Estructura
Estructura general

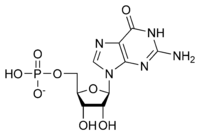


La estructura general de un ribonucleótido consiste en un grupo fosfato, un grupo de azúcar ribosa y una nucleobase, en la que la nucleobase puede ser adenina, guanina, citosina o uracilo. Sin el grupo fosfato, la composición de la nucleobase y el azúcar se conoce como nucleósido. Las nucleobases nitrogenadas intercambiables se derivan de dos compuestos progenitores, la purina y la pirimidina. Los nucleótidos son compuestos heterocíclicos , es decir, contienen al menos dos elementos químicos diferentes como miembros de sus anillos. [ cita requerida ]
Tanto el ARN como el ADN contienen dos bases púricas principales, adenina (A) y guanina (G), y dos pirimidinas principales. En el ADN y el ARN, una de las pirimidinas es la citosina (C). Sin embargo, el ADN y el ARN difieren en la segunda pirimidina principal. El ADN contiene timina (T), mientras que el ARN contiene uracilo (U). Hay algunos casos raros en los que sí se encuentra timina en el ARN y uracilo en el ADN. [1]
Aquí están los 4 ribonucleótidos principales (ribonucleósido 5'-monofosfato) que son las unidades estructurales de los ARN.
| Nucleótido | Símbolos | Nucleósido |
|---|---|---|
| Adenilato (adenosina 5'-monofosfato) | A, AMPERIO | Adenosina |
| Guanilato (guanosina 5'-monofosfato) | G, BPF | Guanosina |
| Uridilato (uridina 5'-monofosfato) | U, UMP | Uridina |
| Citidilato (citidina 5'-monofosfato) | C, CMP | Citidina |
Desoxirribonucleótidos de ADN versus ribonucleótidos de ARN
En los ribonucleótidos, el componente de azúcar es la ribosa, mientras que en los desoxirribonucleótidos, el componente de azúcar es la desoxirribosa. En lugar de un grupo hidroxilo en el segundo carbono del anillo de ribosa, se lo reemplaza por un átomo de hidrógeno. [2]
Ambos tipos de pentosas en el ADN y el ARN se encuentran en su forma de β-furanosa (anillo cerrado de cinco miembros) y definen la identidad de un ácido nucleico. El ADN se define por contener ácido nucleico 2'-desoxirribosa, mientras que el ARN se define por contener ácido nucleico ribosa. [1]
En algunas ocasiones, el ADN y el ARN pueden contener algunas bases menores. Las formas metiladas de las bases mayores son las más comunes en el ADN. En el ADN viral, algunas bases pueden estar hidroximetiladas o glucosiladas. En el ARN, las bases menores o modificadas se encuentran con mayor frecuencia. Algunos ejemplos incluyen hipoxantina, dihidrouracilo, formas metiladas de uracilo, citosina y guanina, así como el nucleósido modificado pseudouridina. [3] También se han observado nucleótidos con grupos fosfato en posiciones distintas al carbono 5'. Los ejemplos incluyen ribonucleósidos 2',3'-monofosfatos cíclicos que son intermediarios aislables, y ribonucleósidos 3'-monofosfatos que son productos finales de la hidrólisis del ARN por ciertas ribonucleasas. Otras variaciones incluyen adenosina 3',5'-monofosfato cíclico (cAMP) y guanosina 3',5'-monofosfato cíclico (cGMP). [4]
Uniendo nucleótidos sucesivos
Los ribonucleótidos se unen entre sí para formar cadenas de ARN a través de enlaces fosfodiéster . El grupo 5'-fosfato de un nucleótido está unido al grupo 3'-hidroxilo del siguiente nucleótido, creando una estructura principal de residuos de fosfato y pentosa alternados. No hay enlace fosfodiéster en cada extremo del polinucleótido. [5] Los enlaces fosfodiéster se forman entre ribonucleótidos por la enzima ARN polimerasa . La cadena de ARN se sintetiza desde el extremo 5' hasta el extremo 3' a medida que el grupo 3'-hidroxilo del último ribonucleótido de la cadena actúa como un nucleófilo y lanza un ataque hidrófilo sobre el 5'-trifosfato del ribonucleótido entrante, liberando pirofosfato como un subproducto [6] . Debido a las propiedades físicas de los nucleótidos, la estructura principal del ARN es muy hidrófila y polar. A pH neutro, los ácidos nucleicos están altamente cargados ya que cada grupo fosfato lleva una carga negativa. [7]
Tanto el ADN como el ARN están formados por fosfatos de nucleósidos, también conocidos como monómeros mononucleotídicos, que termodinámicamente tienen menos probabilidades de combinarse que los aminoácidos. Los enlaces fosfodiéster, cuando se hidrolizan, liberan una cantidad considerable de energía libre. Por lo tanto, los ácidos nucleicos tienden a hidrolizarse espontáneamente en mononucleótidos. Los precursores del ARN son GTP, CTP, UTP y ATP, que es una fuente importante de energía en las reacciones de transferencia de grupos. [8]
Función
Precursores de desoxirribonucleótidos
Los científicos creen que el ARN se desarrolló antes que el ADN. [9]
La reducción de ribonucleótidos a desoxirribonucleótidos es catalizada por la ribonucleótido reductasa . La ribonucleótido reductasa (RNR) es una enzima esencial para todos los organismos vivos, ya que es responsable del último paso en la síntesis de los cuatro desoxirribonucleótidos (dNTP) necesarios para la replicación y reparación del ADN. [10] La reacción también requiere otras dos proteínas: tiorredoxina y tiorredoxina reductasa . El ribonucleósido difosfato (NDP) es reducido por la tiorredoxina a un desoxirribonucleósido difosfato (dNTP).
La reacción general es:
Ribonucleósido difosfato + NADPH + H + → Desoxirribonucleósido difosfato + NADP + + H 2 O [11]
Para ilustrar esta ecuación, el dATP y el dGTP se sintetizan a partir de ADP y GDP, respectivamente. Primero son reducidos por RNR y luego fosforilados por nucleósido difosfato quinasas a dATP y dGTP. La ribonucleótido reductasa está controlada por interacciones alostéricas. Una vez que el dATP se une a la ribonucleótido reductasa, la actividad catalítica general de la enzima disminuye, ya que significa una abundancia de desoxirribonucleótidos. Esta inhibición por retroalimentación se revierte una vez que el ATP se une. [12]
Discriminación de ribonucleótidos
Durante la síntesis de ADN, las ADN polimerasas deben seleccionar ribonucleótidos, presentes en niveles mucho más altos en comparación con los desoxirribonucleótidos. Es crucial que haya selectividad, ya que la replicación del ADN debe ser precisa para mantener el genoma del organismo. Se ha demostrado que los sitios activos de las ADN polimerasas de la familia Y son responsables de mantener una alta selectividad contra los ribonucleótidos. [13] La mayoría de las ADN polimerasas también están equipadas para excluir ribonucleótidos de su sitio activo a través de un residuo de cadena lateral voluminoso que puede bloquear estéricamente el grupo 2'-hidroxilo del anillo de ribosa. Sin embargo, muchas ADN polimerasas de replicación y reparación nuclear incorporan ribonucleótidos al ADN, [14] [15] lo que sugiere que el mecanismo de exclusión no es perfecto. [16]
Síntesis
Síntesis de ribonucleótidos
Los ribonucleótidos pueden sintetizarse en los organismos a partir de moléculas más pequeñas a través de la vía de novo o reciclarse a través de la vía de recuperación. En el caso de la vía de novo, tanto las purinas como las pirimidinas se sintetizan a partir de componentes derivados de precursores de aminoácidos, ribosa-5-fosfatos, CO 2 y NH 3 . [17] [12]

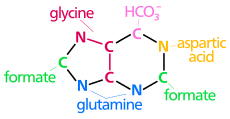 | Los orígenes biosintéticos de los átomos del anillo de purina N 1 surge del grupo amina de Asp C 2 y C 8 se originan del formato N 3 y N 9 son aportados por el grupo amida de Gln C 4 , C 5 y N 7 se derivan de Gly C 6 proviene de HCO −3( CO2 ) |
La biosíntesis de novo de nucleótidos de purina es bastante compleja y consta de varias reacciones enzimáticas. Utilizando la estructura de cinco anillos de azúcar como base, el anillo de purina se construye de a pocos átomos a la vez en un proceso de once pasos que conduce a la formación de inosinato (IMP). Básicamente, el IMP se convierte en los nucleótidos de purina necesarios para la síntesis de ácidos nucleicos. [1]
La vía comienza con la conversión de ribosa-5-fosfato (R5P) a pirofosfato de fosforribosil (PRPP) por la enzima ribosa-fosfato difosfoquinasa (PRPS1). Luego, la PRPP se convierte en 5-fosforribosilamina (5-PRA) a medida que la glutamina dona un grupo amino al C-1 de la PRPP. En una reacción de condensación, la enzima GAR sintetasa, junto con la glicina y el ATP, activa el grupo glicina carboxilasa de 5-PRA para formar ribonucleótido de glicinamida (GAR). Luego, la coenzima N10-formil-THF, junto con la enzima GAR transformilasa, dona una unidad de un carbono al grupo amino de la glicina de GAR, seguido de la adición de glutamina por la enzima FGAR amidotransferasa, lo que conduce a la formación de ribonucleótido de formilglicinamidina (FGAM). La deshidratación de FGAM por la enzima FGAM ciclasa da como resultado el cierre del anillo de imidazol, como ribonucleótido de 5-aminoimidazol (AIR). Un grupo carboxilo se une a AIR por la N5-CAIR sintetasa para formar el ribonucleótido N5-carboxiaminoimidazol (N5-CAIR), que luego se convierte en ribonucleótido carboxiaminoimidazol (CAIR) con la enzima N5-CAIR mutasa. La enzima SAICAR sintetasa, junto con el grupo amino del aspartato, forma un enlace amida para crear el ribonucleótido N-succinil-5-aminoimidazol-4-carboxamida (SAICAR). Continuando por la vía, la eliminación del esqueleto carbonado del aspartato por la SAICAR liasa da como resultado el ribonucleótido de 5-aminoimidazol-4-carboxamida (AICAR). La enzima AICAR transformilasa ayuda en la transferencia final de carbono desde el N10-formiltetrahidrofolato, formando el ribonucleótido N-formilaminoimidazol-4-carboxamida (FAICAR). Por último, el cierre de la segunda estructura de anillo lo lleva a cabo la IMP sintasa para formar IMP, donde el destino de IMP conduciría a la formación de un nucleótido de purina. [1]

La síntesis de nucleótidos de pirimidina es un proceso mucho más simple. La formación del anillo de pirimidina comienza con la conversión de aspartato a N-carbamoilaspartato mediante una reacción de condensación con carbamoilfosfato. La dihidroorotasa y la dihidroorotasa deshidrogenasa convierten luego el N-carbamoilaspartato en orotato. El orotato se une covalentemente con el pirofosfato de fosforribosil (PRPP) por la orotato fosforribosol-transferasa, lo que produce monofosfato de orotidina (OMP). El OMP sigue con la descarboxilación por la orotidilato descarboxilasa para formar la estructura de ribonucleótido de uridilato (UMP). El UMP puede luego convertirse en uridina-5'-trifosfato (UTP) mediante la reacción de dos quinasas. La formación de citidina-5'-trifosfato (CTP) a partir de UTP puede lograrse por la citidilato sintetasa mediante un intermediario de fosfato de acilo. [1]
Síntesis prebiótica de ribonucleótidos
Para entender cómo surgió la vida , se requiere el conocimiento de las vías químicas que permiten la formación de los bloques de construcción clave de la vida en condiciones prebióticas plausibles . Según la hipótesis del mundo del ARN, los ribonucleótidos flotantes estaban presentes en la sopa primitiva. Estas fueron las moléculas fundamentales que se combinaron en serie para formar el ARN . Moléculas tan complejas como el ARN deben haber surgido de pequeñas moléculas cuya reactividad estaba gobernada por procesos fisicoquímicos. El ARN está compuesto de nucleótidos de purina y pirimidina , ambos necesarios para la transferencia confiable de información y, por lo tanto, la selección natural y la evolución darwinianas. La síntesis de ribonucleótidos de pirimidina activados se demostró en condiciones prebióticas plausibles. [18] Los materiales de partida para la síntesis ( cianamida , cianoacetileno , glicolaldehído , gliceraldehído y fosfato inorgánico ) se consideraron moléculas de materia prima prebiótica plausibles. [18] Nam et al. Se demostró la condensación directa de nucleobases con ribosa para dar ribonucleósidos en microgotas acuosas, un paso clave que conduce a la formación de ARN. [19] Además, Becker et al. presentaron un proceso prebiótico plausible para sintetizar ribonucleótidos de pirimidina y purina utilizando ciclos húmedo-seco. [20]
Historia

Antes del artículo histórico de James Watson y Francis Crick que detallaba la estructura del ADN a partir de la imagen de cristalografía de rayos X de Rosalind Franklin , hubo varios científicos históricos que también contribuyeron a su descubrimiento. [21] Friedrich Miescher , un médico suizo, quien, en 1869, fue el primero en aislar e identificar la sustancia nucleica de los núcleos de los glóbulos blancos que más tarde llamó "nucleína", allanando el camino para el descubrimiento del ADN. [22] Siguiendo el trabajo de Miescher, fue el bioquímico alemán, Albrecht Kossel , quien, en 1878, aisló los componentes no proteicos de la "nucleína" y descubrió las cinco nucleobases presentes en los ácidos nucleicos: adenina, citosina, guanina, timina y uracilo. [23] Aunque se conocían algunos hechos fundamentales sobre los ácidos nucleicos debido a estos primeros descubrimientos, su estructura y función siguieron siendo un misterio.
No fue hasta el descubrimiento de los nucleótidos en 1919 por Phoebus Levene , un bioquímico ruso-lituano, que reabrió las puertas del descubrimiento del ADN. Levene identificó por primera vez que el componente carbohidrato presente en el ARN de la levadura era, de hecho , ribosa . Sin embargo, no fue hasta su descubrimiento de que el componente carbohidrato en el ácido nucleico del timo también era un azúcar pero carecía de un átomo de oxígeno, llamado desoxirribosa , que su descubrimiento fue ampliamente apreciado por la comunidad científica. Finalmente, Levene pudo identificar el orden correcto en el que se colocan juntos los componentes del ARN y el ADN, una unidad de base fosfato-azúcar, en la que más tarde llamó nucleótido . Aunque Levene entendía bien el orden de los componentes de los nucleótidos, la estructura de la disposición de los nucleótidos en el espacio y su código genético todavía seguían siendo un misterio durante los primeros años de su carrera. [24]
Véase también
- Ribonucleósidos o ribosidos
Referencias
- ^ abcdefg Nelson, David L.; Lehninger, Albert L.; Cox, Michael M. (2008). Principios de bioquímica de Lehninger (5.ª ed.). WH Freeman. págs. 272–3. ISBN 978-0-7167-7108-1.
- ^ Newsholme, Eric A.; Leech, Anthony R.; Board, Mary (2008). Bioquímica funcional en la salud y la enfermedad: regulación metabólica en la salud y la enfermedad (2.ª ed.). Hoboken, NJ: Wiley. ISBN 978-0-471-98820-5.
- ^ Das, Debajyoti (2010). Bioquímica . Bimal Kumar Dhur de Editores Académicos.
- ^ Cox, Michael M.; Nelson, David L. (2008). Principios de bioquímica . WH Freeman. ISBN 978-1-4292-2263-1.OCLC 216940502 .
- ^ Raymond, Kenneth W. (2010). Química general, orgánica y biológica: un enfoque integrado (3.ª ed.). Wiley. ISBN 978-0-470-55124-0.OCLC 699600111 .
- ^ Schaechter, Moselio; Lederberg, Joshua, eds. (2004). Enciclopedia de escritorio de microbiología (1.ª ed.). Ámsterdam: Elsevier. ISBN 0-12-621361-5.OCLC 1055874153 .
- ^ Turner, Phil; et al. (2005). Biología molecular . Instant Notes (3.ª ed.). CRC, Taylor & Francis. ISBN 0-415-35167-7.OCLC 61745541 .
- ^ Nelson, David (2008). Principios de bioquímica de Lehninger . WH Freeman and Co., págs. 274-275.
- ^ Chauhan, Ashok K.; Varma, Ajit, eds. (2009). Un libro de texto de biotecnología molecular . Nueva Delhi: IK International Pub. House. ISBN 978-93-80026-37-4.
- ^ Cendra Mdel, M; Juárez, A; Torrents, E (2012). "La biopelícula modifica la expresión de genes de la ribonucleótido reductasa en Escherichia coli". PLOS ONE . 7 (9): e46350. Bibcode :2012PLoSO...746350C. doi : 10.1371/journal.pone.0046350 . PMC 3458845 . PMID 23050019.
- ^ Campbell, Mary K.; Farrell, Shawn O. (2009). Bioquímica (7.ª ed.). Belmont, CA: Brooks/Cole Cengage Learning. ISBN 978-0-8400-6858-3.
- ^ ab Berg, JM; Tymoczko, JL; Stryer, L. (2002). "§25.2 Las bases de purina pueden sintetizarse por vía de novo o reciclarse por vías de recuperación". Bioquímica . WH Freeman. ISBN 9780716730514.OCLC 48055706 .
- ^ Kirouac, Kevin N.; Suo, Zucai; Ling, Hong (1 de abril de 2011). "Mecanismo estructural de discriminación de ribonucleótidos por una ADN polimerasa de la familia Y". Journal of Molecular Biology . 407 (3): 382–390. doi :10.1016/j.jmb.2011.01.037. PMID 21295588.
- ^ Nick McElhinny, SA; Kumar, D; Clark, AB; Watt, DL; Watts, BE; Lundström, EB; Johansson, E; Chabes, A; Kunkel, TA (octubre de 2010). "Inestabilidad del genoma debido a la incorporación de ribonucleótidos al ADN". Nature Chemical Biology . 6 (10): 774–81. doi :10.1038/nchembio.424. PMC 2942972 . PMID 20729855.
- ^ Nick McElhinny, SA; Watts, BE; Kumar, D; Watt, DL; Lundström, EB; Burgers, PM; Johansson, E; Chabes, A; Kunkel, TA (16 de marzo de 2010). "Incorporación abundante de ribonucleótidos al ADN por polimerasas replicativas de levadura". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (11): 4949–54. Bibcode :2010PNAS..107.4949N. doi : 10.1073/pnas.0914857107 . PMC 2841928 . PMID 20194773.
- ^ Kasiviswanathan, R; Copeland, WC (9 de septiembre de 2011). "Discriminación de ribonucleótidos y transcripción inversa por la ADN polimerasa mitocondrial humana". The Journal of Biological Chemistry . 286 (36): 31490–500. doi : 10.1074/jbc.M111.252460 . PMC 3173122 . PMID 21778232.
- ^ Nelson, Lehninger y Cox 2008, págs. 881–894
- ^ ab Powner MW, Gerland B, Sutherland JD (mayo de 2009). "Síntesis de ribonucleótidos de pirimidina activados en condiciones prebióticamente plausibles". Nature . 459 (7244): 239–42. Bibcode :2009Natur.459..239P. doi :10.1038/nature08013. PMID 19444213.
- ^ Nam I, Nam HG, Zare RN (enero de 2018). "Síntesis abiótica de ribonucleósidos de purina y pirimidina en microgotas acuosas". Proc Natl Acad Sci USA . 115 (1): 36–40. Bibcode :2018PNAS..115...36N. doi : 10.1073/pnas.1718559115 . PMC 5776833 . PMID 29255025.
- ^ Becker S, Feldmann J, Wiedemann S, Okamura H, Schneider C, Iwan K, Crisp A, Rossa M, Amatov T, Carell T (octubre de 2019). "Síntesis prebióticamente plausible unificada de ribonucleótidos de ARN de pirimidina y purina". Science . 366 (6461): 76–82. Bibcode :2019Sci...366...76B. doi :10.1126/science.aax2747. PMID 31604305.
- ^ Watson, JD; Crick, FH (25 de abril de 1953). "Estructura molecular de los ácidos nucleicos; una estructura para el ácido desoxirribonucleico". Nature . 171 (4356): 737–8. Bibcode :1953Natur.171..737W. doi :10.1038/171737a0. PMID 13054692. S2CID 4253007.
- ^ Dahm, R (enero de 2008). "Descubrimiento del ADN: Friedrich Miescher y los primeros años de la investigación sobre ácidos nucleicos". Human Genetics . 122 (6): 565–81. doi :10.1007/s00439-007-0433-0. PMID 17901982. S2CID 915930.
- ^ Jones, ME (septiembre de 1953). "Albrecht Kossel, una reseña biográfica". The Yale Journal of Biology and Medicine . 26 (1): 80–97. PMC 2599350 . PMID 13103145.
- ^ Levene, Phoebus (1919). "La estructura del ácido nucleico de la levadura IV. Hidrólisis del amoniaco". Journal of Biological Chemistry . 40 (2): 415–424. doi : 10.1016/S0021-9258(18)87254-4 .