Enfermedad de injerto contra huésped
| Enfermedad de injerto contra huésped | |
|---|---|
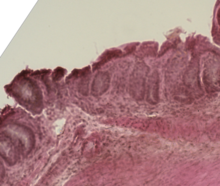 | |
| Colon de ratón afectado por enfermedad de injerto contra huésped aguda | |
| Especialidad | Medicina de emergencia |
La enfermedad de injerto contra huésped ( EICH ) es un síndrome que se caracteriza por la inflamación en diferentes órganos. La EICH se asocia comúnmente con trasplantes de médula ósea y trasplantes de células madre .
Los glóbulos blancos del sistema inmunitario del donante que permanecen dentro del tejido donado (el injerto) reconocen al receptor (el huésped) como extraño (no propio). Los glóbulos blancos presentes en el tejido trasplantado atacan entonces a las células del cuerpo del receptor, lo que conduce a la EICH. Esto no debe confundirse con un rechazo del trasplante , que ocurre cuando el sistema inmunitario del receptor del trasplante rechaza el tejido trasplantado; la EICH ocurre cuando los glóbulos blancos del sistema inmunitario del donante rechazan al receptor. El principio subyacente ( aloinmunidad ) es el mismo, pero los detalles y el curso pueden diferir.
La EICH también puede ocurrir después de una transfusión de sangre , conocida como enfermedad de injerto contra huésped asociada a transfusión o EICH-TA si los productos sanguíneos utilizados no han sido irradiados con rayos gamma o tratados con un sistema de reducción de leucocitos aprobado . A diferencia de la EICH asociada al trasplante de órganos o tejidos, la incidencia de EICH-TA aumenta con la compatibilidad de HLA (familiares de primer grado o cercanos). [1]
Tipos

En el ámbito clínico, la enfermedad de injerto contra huésped se divide en formas agudas y crónicas , y se puntúa o clasifica en función del tejido afectado y la gravedad de la reacción. [3] [4]
En el sentido clásico, la enfermedad de injerto contra huésped aguda se caracteriza por daño selectivo al hígado , piel (erupción), mucosa y tracto gastrointestinal . Investigaciones más recientes indican que otros órganos diana de la enfermedad de injerto contra huésped incluyen el sistema inmunológico (el sistema hematopoyético , p. ej., la médula ósea y el timo ) en sí mismo, y los pulmones en forma de neumonitis inmunomediada . [5] Se pueden utilizar biomarcadores para identificar causas específicas de EICH, como la elafina en la piel. [6] La enfermedad de injerto contra huésped crónica también ataca a los órganos anteriores, pero a lo largo de su curso a largo plazo también puede causar daño al tejido conectivo y las glándulas exocrinas . [7]
El daño a la mucosa vaginal puede provocar dolor intenso y cicatrices , y aparece tanto en la EICH aguda como en la crónica. Esto puede provocar la incapacidad de mantener relaciones sexuales . [8]
Agudo
La forma aguda o fulminante de la enfermedad (aGvHD) se observa normalmente dentro de los primeros 10 a 100 días posteriores al trasplante, [9] [10] y es un desafío importante para los trasplantes debido a la morbilidad y mortalidad asociadas. [11] Aproximadamente entre un tercio y la mitad de los receptores de trasplantes alogénicos desarrollarán EICH aguda. [10] Es menos común en pacientes más jóvenes y en aquellos con compatibilidades más cercanas de antígenos leucocitarios humanos (HLA) entre el donante y el paciente. [10]
Los primeros síntomas suelen ser sarpullido, ardor y enrojecimiento de la piel de las palmas de las manos y las plantas de los pies, que puede extenderse a todo el cuerpo. Otros síntomas pueden incluir náuseas, vómitos, calambres estomacales, diarrea (acuosa y a veces con sangre), pérdida de apetito, ictericia, dolor abdominal y pérdida de peso. [10]
La EICH aguda del tracto gastrointestinal puede provocar una inflamación intestinal grave, desprendimiento de la membrana mucosa, diarrea intensa, dolor abdominal, náuseas y vómitos. [12] Esto generalmente se diagnostica mediante una biopsia intestinal. La EICH hepática se mide por el nivel de bilirrubina en pacientes agudos. [13] La EICH cutánea produce una erupción maculopapular roja difusa , [14] a veces con un patrón de encaje.
La EICH aguda se clasifica de la siguiente manera: grado general (piel-hígado-intestino) y cada órgano se clasifica individualmente desde un mínimo de 1 hasta un máximo de 4. Los pacientes con EICH de grado IV suelen tener un pronóstico malo. Si la EICH es grave y requiere una inmunosupresión intensa que incluya esteroides y agentes adicionales para controlarla, el paciente puede desarrollar infecciones graves [12] como resultado de la inmunosupresión y puede morir a causa de la infección. Sin embargo, un estudio de 2016 descubrió que el pronóstico para los pacientes con EICH de grado IV ha mejorado en los últimos años. [15]
Crónico
La forma crónica de la enfermedad de injerto contra huésped (cGVHD) normalmente comienza entre 90 y 600 días después del trasplante. [10] La aparición de casos moderados a graves de cGVHD influye negativamente en la supervivencia a largo plazo. [16]
El primer síntoma de la EICH crónica es, por lo general, una erupción en las palmas de las manos o las plantas de los pies, que puede extenderse y suele causar picazón y sequedad. En casos graves, la piel puede ampollarse y pelarse, como una quemadura solar grave. También puede aparecer fiebre. Otros síntomas de la EICH crónica pueden incluir: [10]
- Disminución del apetito
- Diarrea
- Calambres abdominales
- Pérdida de peso
- Coloración amarillenta de la piel y los ojos (ictericia)
- Hígado agrandado
- Abdomen hinchado
- Dolor en la parte superior derecha del abdomen.
- Aumento de los niveles de enzimas hepáticas en la sangre (observado en análisis de sangre)
- Piel que se siente tirante
- Ojos secos y ardientes
- Sequedad o llagas dolorosas en la boca.
- Sensación de ardor al comer alimentos ácidos
- Infecciones bacterianas
- Obstrucciones en las vías respiratorias más pequeñas de los pulmones.
En la cavidad oral , la enfermedad injerto contra huésped crónica se manifiesta como liquen plano con un mayor riesgo de transformación maligna a carcinoma oral de células escamosas [17] en comparación con el liquen plano oral clásico. El cáncer oral asociado con la enfermedad injerto contra huésped puede tener un comportamiento más agresivo con un pronóstico peor, en comparación con el cáncer oral en pacientes con trasplante de células madre no hematopoyéticas. [15]
Causas

Para que se produzca la EICH se deben cumplir tres criterios, conocidos como criterios de Billingham. [18]
- Se administra un injerto inmunocompetente , con células inmunes viables y funcionales.
- El receptor es inmunológicamente diferente del donante: histoincompatible .
- El receptor está inmunodeprimido y, por lo tanto, no puede destruir o inactivar las células trasplantadas. En particular, se trata de una incapacidad de la inmunidad celular del receptor para destruir o inactivar los linfocitos viables del donante. [19]
Después del trasplante de médula ósea, las células T presentes en el injerto , ya sea como contaminantes o introducidas intencionalmente en el huésped, atacan los tejidos del receptor del trasplante después de percibir los tejidos del huésped como antigénicamente extraños. Las células T producen un exceso de citocinas , incluyendo TNF-α e interferón-gamma (IFNγ). Una amplia gama de antígenos del huésped puede iniciar la enfermedad de injerto contra huésped, entre ellos los antígenos leucocitarios humanos (HLA). [20] Sin embargo, la enfermedad de injerto contra huésped puede ocurrir incluso cuando los hermanos HLA idénticos son los donantes. [21] Los hermanos HLA idénticos o los donantes no relacionados HLA idénticos a menudo tienen proteínas genéticamente diferentes (llamadas antígenos menores de histocompatibilidad ) que pueden ser presentadas por moléculas del complejo mayor de histocompatibilidad (MHC) a las células T del donante, que ven estos antígenos como extraños y, por lo tanto, montan una respuesta inmune. [22]
Los antígenos más responsables de la pérdida del injerto son HLA-DR (primeros seis meses), HLA-B (primeros dos años) y HLA-A (supervivencia a largo plazo). [23]
Si bien las células T del donante no son deseables como células efectoras de la enfermedad de injerto contra huésped, son valiosas para el injerto al evitar que el sistema inmunológico residual del receptor rechace el injerto de médula ósea ( huésped contra injerto ). Además, como el trasplante de médula ósea se utiliza con frecuencia para tratar el cáncer , principalmente las leucemias , las células T del donante han demostrado tener un valioso efecto de injerto contra tumor . [24] Una gran parte de la investigación actual sobre el trasplante alogénico de médula ósea implica intentos de separar los aspectos indeseables de la fisiología de las células T de la enfermedad de injerto contra huésped del efecto deseable de injerto contra tumor . [25]
EICH asociada a transfusión
Este tipo de EICH se asocia con la transfusión de sangre no irradiada a receptores inmunodeprimidos. También puede ocurrir en situaciones en las que el donante de sangre es homocigoto y el receptor es heterocigoto para un haplotipo HLA . Se asocia con una mayor mortalidad (80-90%) debido a la afectación del tejido linfoide de la médula ósea, sin embargo, las manifestaciones clínicas son similares a la EICH resultante del trasplante de médula ósea. La EICH asociada a transfusiones es poco frecuente en la medicina moderna. Es casi totalmente prevenible mediante la irradiación controlada de productos sanguíneos para inactivar los glóbulos blancos (incluidos los linfocitos) que contienen. [26]
Trasplante de timo
Se puede decir que el trasplante de timo puede causar un tipo especial de EICH porque los timocitos del receptor usarían las células del timo del donante como modelos al pasar por la selección negativa para reconocer autoantígenos y, por lo tanto, podrían confundir las propias estructuras en el resto del cuerpo con no propias. Esta es una EICH más bien indirecta porque no son directamente las células en el propio injerto las que la causan, sino las células en el injerto que hacen que las células T del receptor actúen como células T del donante. Puede verse como una autoinmunidad multiorgánica en experimentos de xenotrasplante del timo entre diferentes especies. [27] La enfermedad autoinmune es una complicación frecuente después del trasplante de timo alogénico humano, que se encuentra en el 42% de los sujetos durante un año después del trasplante. [28] Sin embargo, esto se explica parcialmente por el hecho de que la indicación en sí, es decir, el síndrome de DiGeorge completo , aumenta el riesgo de enfermedad autoinmune. [29]
Autoinmunidad multiorgánica asociada al timoma (TAMA)
En los pacientes con timoma puede producirse una enfermedad similar a la EICH llamada autoinmunidad multiorgánica asociada al timoma (TAMA). En estos pacientes, en lugar de que un donante sea la fuente de células T patógenas, el propio timo maligno del paciente produce células T autodirigidas. Esto se debe a que el timo maligno es incapaz de educar adecuadamente a los timocitos en desarrollo para que eliminen las células T autorreactivas. El resultado es una enfermedad prácticamente indistinguible de la EICH. [30]
Mecanismo
La fisiopatología de la EICH incluye tres fases: [31]
- La fase aferente: activación de las CPA ( células presentadoras de antígenos )
- La fase eferente: activación, proliferación, diferenciación y migración de células efectoras
- La fase efectora: destrucción del tejido diana
La activación de las APC ocurre en la primera etapa de la EICH. Antes del trasplante de células madre hematopoyéticas, la radiación o la quimioterapia provocan daño y activación de los tejidos del huésped, especialmente la mucosa intestinal. Esto permite que los productos microbianos entren y estimulen las citocinas proinflamatorias como IL-1 y TNF-α . Estas citocinas proinflamatorias aumentan la expresión de MHC y moléculas de adhesión en las APC, aumentando así la capacidad de las APC para presentar antígenos. [32] La segunda fase se caracteriza por la activación de las células efectoras. La activación de las células T del donante mejora aún más la expresión de MHC y moléculas de adhesión, quimiocinas y la expansión de las células T CD8+ y CD4+ y las células B huésped. En la fase final, estas células efectoras migran a los órganos diana y median el daño tisular, lo que resulta en una falla multiorgánica. [33]
Prevención
- La tipificación de tejidos basada en ADN permite una correspondencia HLA más precisa entre donantes y pacientes trasplantados, lo que ha demostrado reducir la incidencia y la gravedad de la EICH y aumentar la supervivencia a largo plazo. [34]
- Las células T de la sangre del cordón umbilical (UCB) tienen una inmadurez inmunológica inherente, [35] y el uso de células madre de UCB en trasplantes de donantes no emparentados tiene una incidencia y gravedad reducidas de EICH. [36]
- El metotrexato , la ciclosporina y el tacrolimus son fármacos comunes utilizados para la profilaxis de la EICH. [37] Se necesitan más investigaciones para evaluar si las células estromales mesenquimales también se pueden utilizar para la profilaxis. [38]
- La enfermedad de injerto contra huésped puede evitarse en gran medida mediante la realización de un trasplante de médula ósea con depleción de células T. Sin embargo, estos tipos de trasplantes tienen como consecuencia una disminución del efecto de injerto contra tumor, un mayor riesgo de fracaso del injerto o de recaída del cáncer [39] y una inmunodeficiencia general , lo que hace que el paciente sea más susceptible a infecciones virales , bacterianas y fúngicas . En un estudio multicéntrico, la supervivencia libre de enfermedad a los tres años no fue diferente entre los trasplantes con depleción de células T y los trasplantes con repleción de células T. [40]
Tratamiento
Glucocorticoides
Los glucocorticoides administrados por vía intravenosa , como la prednisona , son el estándar de atención en la EICH aguda [11] y la EICH crónica. [41] El uso de estos glucocorticoides está diseñado para suprimir el ataque inmunológico mediado por células T en los tejidos del huésped; sin embargo, en dosis altas, esta inmunosupresión aumenta el riesgo de infecciones y recaída del cáncer. Por lo tanto, es deseable reducir gradualmente las dosis altas de esteroides posteriores al trasplante a niveles más bajos, momento en el que la aparición de EICH leve puede ser bienvenida, especialmente en pacientes con incompatibilidad de HLA, ya que generalmente se asocia con un efecto de injerto contra tumor. [ cita requerida ] . Si bien los glucocorticoides siguen siendo la primera línea de tratamiento para la EICH aguda, solo alrededor del 50% de los pacientes responden al tratamiento, por lo que de lo contrario tienen EICH refractaria a esteroides (EICH-SR). [42] Se han investigado cada vez más opciones de tratamiento recientes para la EICH-SR, como la fotoféresis extracorpórea (ECP), las células madre mesenquimales (MSC), el trasplante microbiano fecal (FMT) y el medicamento Ruxolitinib. [42]
Inmunosupresión/inmunomodulación ahorradora de esteroides
La ciclosporina y el tacrolimus son inhibidores de la calcineurina . Las sustancias son estructuralmente diferentes pero tienen el mismo mecanismo de acción. La ciclosporina se une a la proteína citosólica peptidil-prolil cis-trans isomerasa A (conocida como ciclofilina), mientras que el tacrolimus se une a la proteína citosólica peptidil-prolil cis-trans isomerasa FKBP12. Estos complejos inhiben la calcineurina, bloquean la desfosforilación del factor de transcripción NFAT de las células T activadas y su translocación al núcleo. [43] La profilaxis estándar implica el uso de ciclosporina durante seis meses con metotrexato. Los niveles de ciclosporina deben mantenerse por encima de 200 ng/ml. [44]
Otras sustancias que se han estudiado para el tratamiento de la EICH incluyen, por ejemplo: sirolimus , pentostatina , etanercept y alemtuzumab . [44]
En agosto de 2017, la FDA de EE. UU. aprobó ibrutinib para tratar la EICH crónica después del fracaso de uno o más tratamientos sistémicos. [45]
Axatilimab (Niktimvo) fue aprobado para uso médico en los Estados Unidos en agosto de 2024. [46]
Tratamiento no farmacológico
Dada la compleja condición sistémica y la inmunosupresión de los pacientes con EICH crónica, las terapias no farmacológicas son un avance significativo y pueden ser preferidas siempre que sea posible. Algunos ejemplos son la fotobiomodulación para las úlceras de la mucosa oral relacionadas con la EICH y la electroestimulación para la xerostomía relacionada con la EICH . [47]
Investigación clínica
Hay una gran cantidad de ensayos clínicos en curso o completados recientemente en la investigación del tratamiento y la prevención de la enfermedad de injerto contra huésped. [48]
El 17 de mayo de 2012, Osiris Therapeutics anunció que los reguladores de salud canadienses habían aprobado Prochymal , su fármaco para la enfermedad de injerto contra huésped aguda en niños que no han respondido al tratamiento con esteroides. Prochymal es el primer fármaco a base de células madre aprobado para una enfermedad sistémica. [49]
En enero de 2016, Mesoblast publicó los resultados de un ensayo clínico de fase 2 en 241 niños con enfermedad de injerto contra huésped aguda que no respondía a los esteroides. [50] El ensayo se realizó con una terapia de células madre mesenquimales conocida como remestemcel-L o MSC-100-IV. La tasa de supervivencia fue del 82 % (frente al 39 % de los controles) para aquellos que mostraron alguna mejoría después de un mes, y a largo plazo del 72 % (frente al 18 % de los controles) para aquellos que mostraron poco efecto después de un mes. [50]
Eliminación del VIH
La enfermedad de injerto contra huésped se ha relacionado con la eliminación de varios casos de VIH, incluido el del Paciente de Berlín y otros seis en España. [51]
Véase también
Referencias
- ^ Williamson LM (1 de septiembre de 1998). "Enfermedad de injerto contra huésped asociada a transfusión y su prevención". Heart . 80 (3): 211–212. doi :10.1136/hrt.80.3.211. ISSN 1355-6037. PMC 1761088 . PMID 9875072.
- ^ Ghimire S, Weber D, Mavin E, Wang XN, Dickinson AM, Holler E (2017). "Fisiopatología de la EICH y otras complicaciones importantes relacionadas con el trasplante de células madre hematopoyéticas". Frontiers in Immunology . 8 : 79. doi : 10.3389/fimmu.2017.00079 . PMC 5357769 . PMID 28373870.
- ^ Martino R, Romero P, Subirá M, Bellido M, Altés A, Sureda A, et al. (agosto de 1999). "Comparación de los criterios clásicos de Glucksberg y el índice de gravedad IBMTR para la clasificación de la enfermedad de injerto contra huésped aguda después del trasplante de células madre entre hermanos con HLA idéntico. Registro Internacional de Trasplante de Médula Ósea". Trasplante de Médula Ósea . 24 (3): 283–7. doi : 10.1038/sj.bmt.1701899 . PMID 10455367. S2CID 24811357.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Filipovich AH, Weisdorf D, Pavletic S, Socie G, Wingard JR, Lee SJ, et al. (diciembre de 2005). "Proyecto de desarrollo de consenso de los Institutos Nacionales de Salud sobre criterios para ensayos clínicos en la enfermedad crónica de injerto contra huésped: I. Informe del grupo de trabajo de diagnóstico y estadificación". Biología del trasplante de sangre y médula ósea . 11 (12): 945–56. doi :10.1016/j.bbmt.2005.09.004. PMC 4329079 . PMID 16338616.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Morisse-Pradier H, Nove-Josserand R, Philit F, Senechal A, Berger F, Callet-Bauchu E, et al. (febrero de 2016). "[Enfermedad de injerto contra huésped, una rara complicación del trasplante de pulmón]". Revista de Pneumología Clínica . 72 (1): 101–7. doi :10.1016/j.pneumo.2015.05.004. PMID 26209034.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Paczesny S, Braun TM, Levine JE, Hogan J, Crawford J, Coffing B, et al. (enero de 2010). "La elafina es un biomarcador de la enfermedad de injerto contra huésped de la piel". Science Translational Medicine . 2 (13): 13–14. doi :10.1016/j.bbmt.2008.12.039. PMC 2895410 . PMID 20371463.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Ogawa Y, Shimmura S, Dogru M, Tsubota K (noviembre de 2010). "Procesos inmunitarios y fibrosis patógena en la enfermedad crónica de injerto contra huésped ocular y manifestaciones clínicas después del trasplante alogénico de células madre hematopoyéticas". Córnea . 29 Suppl 1 (Nov Suplemento 1): S68-77. doi :10.1097/ICO.0b013e3181ea9a6b. PMID 20935546. S2CID 39209313.
- ^ Spiryda LB, Laufer MR, Soiffer RJ, Antin JA (diciembre de 2003). "Enfermedad de injerto contra huésped de la vulva y/o vagina: diagnóstico y tratamiento". Biología del trasplante de sangre y médula ósea . 9 (12): 760–5. doi : 10.1016/j.bbmt.2003.08.001 . PMID 14677115.
- ^ Funke VA, Moreira MC, Vigorito AC (octubre de 2016). "Enfermedad de injerto contra huésped aguda y crónica después del trasplante de células madre hematopoyéticas". Revista de la Asociación Médica Brasileira . 62 (supl. 1): 44–50. doi : 10.1590/1806-9282.62.suppl1.44 . PMID 27982319.
- ^ abcdef «Efectos secundarios del trasplante de células madre o médula ósea». www.cancer.org . Consultado el 1 de septiembre de 2020 .
- ^ ab Goker H, Haznedaroglu IC, Chao NJ (marzo de 2001). "Enfermedad de injerto contra huésped aguda: patobiología y tratamiento". Hematología experimental . 29 (3): 259–77. doi : 10.1016/S0301-472X(00)00677-9 . PMID 11274753.
- ^ ab "Enfermedad de injerto contra huésped". MedlinePlus . Biblioteca Nacional de Medicina . Consultado el 6 de mayo de 2019 .
- ^ Krejci M, Kamelander J, Pospisil Z, Mayer J (2012). "La cinética de la bilirrubina y las enzimas hepáticas es útil para predecir la enfermedad de injerto contra huésped en el hígado". Neoplasma . 59 (3): 264–8. doi : 10.4149/neo_2012_034 . PMID 22296496.
- ^ Feito-Rodríguez M, de Lucas-Laguna R, Gómez-Fernández C, Sendagorta-Cudós E, Collantes E, Beato MJ, et al. (2013). "Enfermedad cutánea de injerto contra huésped en trasplante multivisceral pediátrico". Dermatología Pediátrica . 30 (3): 335–41. doi :10.1111/j.1525-1470.2012.01839.x. PMID 22957989. S2CID 25151282.
- ^ ab El-Jawahri A, Li S, Antin JH, Spitzer TR, Armand PA, Koreth J, et al. (mayo de 2016). "Mejora de la mortalidad relacionada con el tratamiento y la supervivencia general de los pacientes con EICH aguda de grado IV en los años modernos". Biología del trasplante de sangre y médula ósea . 22 (5): 910–8. doi : 10.1016/j.bbmt.2015.12.024 . PMID 26748160.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Lee SJ, Vogelsang G, Flowers ME (abril de 2003). "Enfermedad crónica de injerto contra huésped". Biología del trasplante de sangre y médula ósea . 9 (4): 215–33. doi : 10.1053/bbmt.2003.50026 . PMID 12720215.
- ^ Tsukada S, Itonaga H, Taguchi J, Miyoshi T, Hayashida S, Sato S, et al. (2019). "[Carcinoma gingival de células escamosas diagnosticado con motivo de osteonecrosis de la mandíbula en un paciente con EICH crónica]". [Rinsho Ketsueki] Revista japonesa de hematología clínica . 60 (1): 22-27. doi :10.11406/rinketsu.60.22. PMID 30726819.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Billingham RE (1966). "La biología de las reacciones de injerto contra huésped". Harvey Lectures . 62 (62): 21–78. PMID 4875305.
- ^ Yasuda H, Ohto H, Abe R (1993). "Mecanismo de la enfermedad de injerto contra huésped asociada a la transfusión". Fukushima J Med Sci . 39 (2): 69–75. PMID 7927137.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Kanda J (septiembre de 2013). "Efecto del desajuste de HLA en la enfermedad de injerto contra huésped aguda". Revista Internacional de Hematología . 98 (3): 300–8. doi : 10.1007/s12185-013-1405-x . PMID 23893313. S2CID 1585777.
- ^ Bonifazi F, Solano C, Wolschke C, Sessa M, Patriarca F, Zallio F, et al. (febrero de 2019). "Profilaxis de la EICH aguda más ATLG después del trasplante alogénico mieloablativo de células madre hematopoyéticas de sangre periférica de hermanos con HLA idéntico en pacientes con leucemia mieloide aguda en remisión: resultados finales de la calidad de vida y análisis de resultados a largo plazo de un estudio aleatorizado de fase 3". The Lancet. Hematología . 6 (2): e89–e99. doi :10.1016/S2352-3026(18)30214-X. hdl : 10138/311714 . PMID 30709437. S2CID 73449161.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Taylor CJ, Bolton EM, Bradley JA (agosto de 2011). "Consideraciones inmunológicas para el almacenamiento de células madre pluripotentes embrionarias e inducidas". Philosophical Transactions of the Royal Society of London. Serie B, Biological Sciences . 366 (1575): 2312–22. doi :10.1098/rstb.2011.0030. PMC 3130422 . PMID 21727137.
- ^ Solomon S, Pitossi F, Rao MS (febrero de 2015). "Apostar por las células madre pluripotentes inducidas: ¿es factible y merece la pena?". Stem Cell Reviews and Reports . 11 (1): 1–10. doi :10.1007/s12015-014-9574-4. PMC 4333229 . PMID 25516409.
- ^ Falkenburg JH, Jedema I (diciembre de 2017). "Efectos del injerto versus el tumor y por qué las personas sufren recaídas". Hematología. Sociedad Estadounidense de Hematología. Programa Educativo . 2017 (1): 693–698. doi : 10.1182 /asheducation-2017.1.693. PMC 6142614. PMID 29222323.
- ^ Sun K, Li M, Sayers TJ, Welniak LA, Murphy WJ (agosto de 2008). "Efectos diferenciales de las citocinas de las células T del donante en el resultado con la administración continua de bortezomib después del trasplante alogénico de médula ósea". Blood . 112 (4): 1522–9. doi :10.1182/blood-2008-03-143461. PMC 2515132 . PMID 18539902.
- ^ Moroff G, Leitman SF, Luban NL (octubre de 1997). "Principios de irradiación sanguínea, validación de dosis y control de calidad". Transfusión . 37 (10): 1084–92. doi :10.1046/j.1537-2995.1997.371098016450.x. PMID 9354830. S2CID 7462268.
- ^ Xia G, Goebels J, Rutgeerts O, Vandeputte M, Waer M (febrero de 2001). "Tolerancia al trasplante y autoinmunidad después del trasplante de timo xenogénico". Journal of Immunology . 166 (3): 1843–54. doi : 10.4049/jimmunol.166.3.1843 . PMID 11160231. S2CID 24007739.
- ^ Markert ML, Devlin BH, McCarthy EA, Chinn IK, Hale LP (2008). "Trasplante de timo". En Lavini C, Moran CA, Morandi U, et al. (eds.). Patología del timo: características clínicas, diagnósticas y terapéuticas . págs. 255–267. doi :10.1007/978-88-470-0828-1_30. ISBN 978-88-470-0827-4.S2CID219575147 .
{{cite book}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Markert ML, Devlin BH, Alexieff MJ, Li J, McCarthy EA, Gupton SE, et al. (mayo de 2007). "Revisión de 54 pacientes con anomalía completa de DiGeorge inscritos en protocolos para trasplante de timo: resultado de 44 trasplantes consecutivos". Blood . 109 (10): 4539–47. doi :10.1182/blood-2006-10-048652. PMC 1885498 . PMID 17284531.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Wadhera A, Maverakis E, Mitsiades N, Lara PN, Fung MA, Lynch PJ (octubre de 2007). "Autoinmunidad multiorgánica asociada al timoma: una enfermedad similar a la de injerto contra huésped". Revista de la Academia Estadounidense de Dermatología . 57 (4): 683–9. doi :10.1016/j.jaad.2007.02.027. PMID 17433850.
- ^ Nassereddine S, Rafei H, Elbahesh E, Tabbara I (abril de 2017). "Enfermedad versus huésped: una revisión exhaustiva". Anticancer Research . 37 (4): 1547–1555. doi : 10.21873/anticanres.11483 . PMID 28373413.
- ^ Roncarolo MG, Battaglia M (agosto de 2007). "Inmunoterapia de células T reguladoras para la tolerancia a antígenos propios y aloantígenos en humanos". Nature Reviews. Inmunología . 7 (8): 585–98. doi :10.1038/nri2138. PMID 17653126. S2CID 7043844.
- ^ Zhang L, Chu J, Yu J, Wei W (febrero de 2016). "Mecanismos celulares y moleculares en la enfermedad de injerto contra huésped". Journal of Leukocyte Biology . 99 (2): 279–87. doi : 10.1189/jlb.4ru0615-254rr . PMID 26643713. S2CID 25250676.
- ^ Morishima Y, Sasazuki T, Inoko H, Juji T, Akaza T, Yamamoto K, et al. (junio de 2002). "Importancia clínica de la compatibilidad de alelos del antígeno leucocitario humano (HLA) en pacientes que reciben un trasplante de médula ósea de donantes no emparentados serológicamente compatibles con HLA-A, HLA-B y HLA-DR". Blood . 99 (11): 4200–6. doi :10.1182/blood.V99.11.4200. PMID 12010826. S2CID 6859250.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Grewal SS, Barker JN, Davies SM, Wagner JE (junio de 2003). "Trasplante de células hematopoyéticas de donantes no emparentados: ¿médula ósea o sangre del cordón umbilical?". Blood . 101 (11): 4233–44. doi :10.1182/blood-2002-08-2510. PMID 12522002. S2CID 6486524.
- ^ Laughlin MJ, Barker J, Bambach B, Koc ON, Rizzieri DA, Wagner JE, et al. (junio de 2001). "Injerto hematopoyético y supervivencia en receptores adultos de sangre del cordón umbilical de donantes no emparentados". The New England Journal of Medicine . 344 (24): 1815–22. doi : 10.1056/NEJM200106143442402 . PMID 11407342.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Törlén J, Ringdén O, Garming-Legert K, Ljungman P, Winiarski J, Remes K, et al. (noviembre de 2016). "Un ensayo prospectivo aleatorizado que compara ciclosporina/metotrexato y tacrolimus/sirolimus como profilaxis de la enfermedad de injerto contra huésped después del trasplante alogénico de células madre hematopoyéticas". Haematologica . 101 (11): 1417–1425. doi :10.3324/haematol.2016.149294. PMC 5394879 . PMID 27662016.
{{cite journal}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Fisher SA, Cutler A, Doree C, Brunskill SJ, Stanworth SJ, Navarrete C, et al. (Grupo Cochrane de Neoplasias Hematológicas) (enero de 2019). "Células estromales mesenquimales como tratamiento o profilaxis para la enfermedad de injerto contra huésped aguda o crónica en receptores de trasplante de células madre hematopoyéticas (TCMH) con una afección hematológica". Base de Datos Cochrane de Revisiones Sistemáticas . 1 (1): CD009768. doi :10.1002/14651858.CD009768.pub2. PMC 6353308 . PMID 30697701.
- ^ Hale G, Waldmann H (mayo de 1994). "Control de la enfermedad de injerto contra huésped y rechazo del injerto mediante la depleción de células T del donante y del receptor con anticuerpos Campath-1. Resultados de trasplantes de hermanos compatibles para enfermedades malignas". Trasplante de médula ósea . 13 (5): 597–611. PMID 8054913.
- ^ Wagner JE, Thompson JS, Carter SL, Kernan NA (2005). "Efecto de la profilaxis de la enfermedad de injerto contra huésped en la supervivencia libre de enfermedad a 3 años en receptores de médula ósea de donantes no emparentados (ensayo de depleción de células T): un ensayo multicéntrico, aleatorizado de fase II-III". Lancet . 366 (9487): 733–41. doi :10.1016/S0140-6736(05)66996-6. PMID 16125590. S2CID 33732870.
- ^ Menillo SA, Goldberg SL, McKiernan P, Pecora AL (octubre de 2001). "Tratamiento intraoral con radiación ultravioleta A (PUVA) de la enfermedad de injerto contra huésped crónica oral refractaria después del trasplante alogénico de células madre". Trasplante de médula ósea . 28 (8): 807–8. doi : 10.1038/sj.bmt.1703231 . PMID 11781637. S2CID 27292769.
- ^ ab Flinn AM, Gennery AR (6 de marzo de 2023). "Avances recientes en la enfermedad de injerto contra huésped". Reseñas de la facultad . 12 : 4. doi : 10.12703/r/12-4 . ISSN 2732-432X. PMC 10009889 . PMID 36923700.
- ^ Liu J, Farmer JD, Lane WS, Friedman J, Weissman I, Schreiber SL (agosto de 1991). "La calcineurina es un objetivo común de los complejos ciclofilina-ciclosporina A y FKBP-FK506". Cell . 66 (4): 807–15. doi :10.1016/0092-8674(91)90124-h. PMID 1715244. S2CID 22094672.
- ^ ab Mandanas RA. "Tratamiento y manejo de la enfermedad de injerto contra huésped: atención médica". Medscape . Consultado el 30 de agosto de 2017 .
{{cite web}}: Mantenimiento de CS1: configuración anulada ( enlace ) - ^ Research Cf (9 de febrero de 2019). “La FDA amplía las indicaciones de ibrutinib a la EICH crónica”. FDA – vía www.fda.gov.
- ^ "La FDA aprueba axatilimab-csfr para la enfermedad crónica de injerto contra huésped". Administración de Alimentos y Medicamentos de Estados Unidos . 14 de agosto de 2024. Consultado el 15 de agosto de 2024 .
- ^ Zadik Y, Raber-Durlacher JE, Epstein JB, Majorana A, Laheij A, Bardellini E, et al. (agosto de 2024). "Declaración de práctica clínica de MASCC/ISOO: manejo de las manifestaciones orales de la enfermedad de injerto contra huésped crónica". Atención de apoyo en el cáncer . 32 (8): 546. doi : 10.1007/s00520-024-08686-x . PMC 11269426. PMID 39048807 .
- ^ "Búsqueda de: Enfermedad de injerto contra huésped - Lista de resultados - ClinicalTrials.gov". clinicaltrials.gov .
- ^ "Se logra la primera aprobación de un fármaco basado en células madre en el mundo en Canadá". The National Law Review . Drinker Biddle & Reath LLP. 12 de junio de 2012 . Consultado el 1 de julio de 2012 .
- ^ ab "Mayor supervivencia con células MSB en niños con EICH aguda" . Consultado el 22 de febrero de 2016 .
- ^ "La guerra inmunitaria con células de donantes después del trasplante podría acabar con el VIH". ? . NewScientist. 3 de mayo de 2017 . Consultado el 23 de noviembre de 2018 .
Lectura adicional
- Ferrara JLM, Deeg HJ, Burakoff SJ . Enfermedad de injerto contra huésped: inmunología, fisiopatología y tratamiento. Marcel Dekker, 1990 ISBN 0-8247-9728-0
- Polsdorfer, JR Gale Enciclopedia de Medicina: Enfermedad de injerto contra huésped
