Electrosíntesis
En electroquímica , la electrosíntesis es la síntesis de compuestos químicos en una celda electroquímica . [1] [2] [3] [4] En comparación con las reacciones redox ordinarias , la electrosíntesis a veces ofrece una selectividad y rendimientos mejorados . La electrosíntesis se estudia activamente como ciencia y también tiene aplicaciones industriales. La electrooxidación también tiene potencial para el tratamiento de aguas residuales .
Configuración experimental
La configuración básica en la electrosíntesis es una celda galvánica , un potenciostato y dos electrodos . Las combinaciones típicas de solvente y electrolito minimizan la resistencia eléctrica . [5] Las condiciones próticas a menudo utilizan mezclas de solventes de alcohol-agua o dioxano -agua con un electrolito como una sal soluble , ácido o base . Las condiciones apróticas a menudo utilizan un solvente orgánico como acetonitrilo o diclorometano con electrolitos como perclorato de litio o sales de tetrabutilamonio. La elección de los electrodos con respecto a su composición y área superficial puede ser decisiva. [6] Por ejemplo, en condiciones acuosas, las reacciones en competencia en la celda son la formación de oxígeno en el ánodo e hidrógeno en el cátodo. En este caso, un ánodo de grafito y un cátodo de plomo podrían usarse de manera efectiva debido a sus altos sobrepotenciales para la formación de oxígeno e hidrógeno respectivamente. Se pueden usar muchos otros materiales como electrodos. Otros ejemplos incluyen platino , magnesio , mercurio (como un depósito de líquido en el reactor), acero inoxidable o carbono vítreo reticulado . Algunas reacciones utilizan un electrodo de sacrificio que se consume durante la reacción, como el zinc o el plomo. Los diseños de celdas pueden ser de celda no dividida o de celda dividida. En las celdas divididas, las cámaras del cátodo y del ánodo están separadas por una membrana semiporosa. Los materiales de membrana más comunes incluyen vidrio sinterizado , porcelana porosa , politetrafluoroeteno o polipropileno . El propósito de la celda dividida es permitir la difusión de iones mientras se restringe el flujo de productos y reactivos. Esta separación simplifica el procesamiento. Un ejemplo de una reacción que requiere una celda dividida es la reducción de nitrobenceno a fenilhidroxilamina , donde este último químico es susceptible a la oxidación en el ánodo.
Reacciones
Las oxidaciones orgánicas se producen en el ánodo. Los compuestos se reducen en el cátodo. A menudo se utilizan intermediarios radicales. La reacción inicial tiene lugar en la superficie del electrodo y luego los intermediarios se difunden en la solución donde participan en reacciones secundarias.
El rendimiento de una electrosíntesis se expresa tanto en términos de rendimiento químico como de eficiencia de corriente. La eficiencia de corriente es la relación entre los culombios consumidos en la formación de los productos y el número total de culombios que pasan a través de la celda. Las reacciones secundarias disminuyen la eficiencia de corriente.
La caída de potencial entre los electrodos determina la constante de velocidad de la reacción. La electrosíntesis se lleva a cabo con potencial constante o con corriente constante. La razón por la que se elige uno sobre el otro se debe a una compensación entre la facilidad de las condiciones experimentales y la eficiencia de la corriente. El potencial constante utiliza la corriente de manera más eficiente porque la corriente en la celda disminuye con el tiempo debido al agotamiento del sustrato alrededor del electrodo de trabajo (la agitación suele ser necesaria para disminuir la capa de difusión alrededor del electrodo). Sin embargo, este no es el caso en condiciones de corriente constante. En cambio, a medida que disminuye la concentración del sustrato, el potencial a través de la celda aumenta para mantener la velocidad de reacción fija. Esto consume corriente en reacciones secundarias producidas fuera del voltaje objetivo.
Oxidaciones anódicas
- Una electrosíntesis muy conocida es la electrólisis de Kolbe , en la que dos ácidos carboxílicos se descarboxilan y las estructuras restantes se unen entre sí:
- Una variación se denomina reacción no Kolbe cuando hay un heteroátomo (nitrógeno u oxígeno) en la posición α. El ion oxonio intermedio queda atrapado por un nucleófilo, generalmente un disolvente.
- La electrosíntesis anódica oxida la amina alifática primaria a nitrilo. [7]
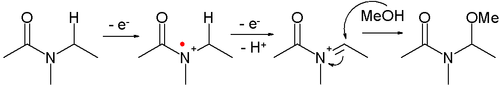
- Las amidas se pueden oxidar a iones N -aciliminio, que pueden ser capturados por varios nucleófilos , por ejemplo:
- Este tipo de reacción se denomina oxidación de Shono . Un ejemplo es la α-metoxilación de N -carbometoxipirrolidina [8]
- La oxidación de un carbanión puede conducir a una reacción de acoplamiento , por ejemplo en la electrosíntesis del éster tetrametílico del ácido etanotetracarboxílico a partir del éster malonato correspondiente [9].
- Los α - aminoácidos forman nitrilos y dióxido de carbono a través de la descarboxilación oxidativa en los ánodos de AgO (este último se forma in situ por oxidación de Ag 2 O ): [5] [10] [ verificación necesaria ]
- Ácido cianoacético procedente de la reducción catódica del dióxido de carbono y de la oxidación anódica del acetonitrilo . [11]
- En las últimas décadas se ha desarrollado la oxidación electroquímica selectiva para la preparación de nitrilos a partir de aminas . [12]
- El ácido propiólico se prepara comercialmente oxidando el alcohol propargílico en un electrodo de plomo. [13] [ dudoso – discutir ] .
Reducciones catódicas
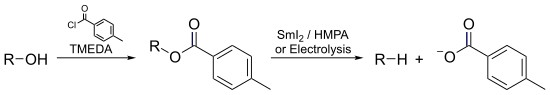
- En la desoxigenación de Markó-Lam , un alcohol podría desoxigenarse casi instantáneamente mediante la electrorreducción de su éster toluato.
- En teoría, el adiponitrilo se prepara a partir de la dimerización del acrilonitrilo : [14]
- 2 CH 2 =CHCN + 2 e − + 2 H + → NC(CH 2 ) 4 CN
- En la práctica, la hidrodimerización catódica de olefinas activadas se aplica industrialmente en la síntesis de adiponitrilo a partir de dos equivalentes de acrilonitrilo :Este artículo necesita citas adicionales para su verificación . ( febrero de 2022 )

- La reducción catódica de compuestos arenos a los derivados 1,4-dihidro es similar a la reducción de Birch . Algunos ejemplos industriales son la reducción del ácido ftálico :
y la reducción de 2-metoxi naftaleno :
- El reordenamiento de Tafel , llamado así por Julius Tafel , fue en algún momento un método importante para la síntesis de ciertos hidrocarburos a partir de acetoacetato de etilo alquilado , una reacción acompañada por la reacción de reordenamiento del grupo alquilo: [15] [16]
- Se muestra la reducción catódica de un nitrilo a una amina primaria en una celda dividida; la reducción catódica de cianuro de bencilo a fenetilamina : [17]
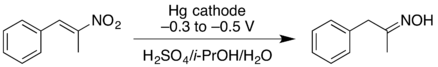
- La reducción catódica de un nitroalqueno puede dar lugar a la oxima con un buen rendimiento. A potenciales de reducción negativos más elevados, el nitroalqueno puede reducirse aún más, dando lugar a la amina primaria , pero con un rendimiento menor. [18]
- El azobenceno se prepara mediante electrosíntesis industrial utilizando nitrobenceno . [14]
- Se promueve una carboxilación electroquímica de un cloruro de para- isobutilbencilo a ibuprofeno bajo dióxido de carbono supercrítico . [19]
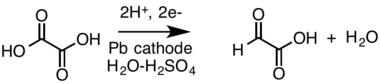
- Reducción catódica de un ácido carboxílico ( ácido oxálico ) a un aldehído ( ácido glioxílico , que se muestra como la rara forma de aldehído) en una celda dividida: [20] [21]
- Originalmente, el ácido fenilpropanoico podía prepararse a partir de la reducción del ácido cinámico por electrólisis . [22]
- Una electrocatálisis mediante un complejo de cobre ayuda a reducir el dióxido de carbono a ácido oxálico; esta conversión utiliza dióxido de carbono como materia prima para generar ácido oxálico. [23]
- Se ha informado que el formato se puede formar mediante la reducción electroquímica de CO2 ( en forma de bicarbonato ) en un cátodo de plomo a pH 8,6: [24]
- OHC−3+ H2O + 2e− → HCO−2+ 2OH −
o
- CO2 + H2O + 2e − → HCO−2+ OH-
Si la alimentación es CO2 y se desprende oxígeno en el ánodo, la reacción total es:
- CO2 + OH − → HCO−2+ 1 / 2 O2
Reacciones redox
- La reducción catódica del dióxido de carbono y la oxidación anódica del acetonitrilo producen ácido cianoacético . [11]
- Una electrosíntesis que emplea corriente alterna prepara fenol tanto en el cátodo como en el ánodo. [25]
Electrofluoración
En la química de los organofluorados , muchos compuestos perfluorados se preparan mediante síntesis electroquímica, que se lleva a cabo en HF líquido a voltajes cercanos a 5-6 V utilizando ánodos de Ni. El método fue inventado en la década de 1930. [26] Las aminas, los alcoholes, los ácidos carboxílicos y los ácidos sulfónicos se convierten en derivados perfluorados utilizando esta tecnología. Una solución o suspensión del hidrocarburo en fluoruro de hidrógeno se electroliza a 5-6 V para producir altos rendimientos del producto perfluorado.
Véase también
Enlaces externos
- Enlace a la enciclopedia de electroquímica
Referencias
- ^ Sperry, Jeffrey B.; Wright, Dennis L. (2006). "La aplicación de reducciones catódicas y oxidaciones anódicas en la síntesis de moléculas complejas". Chem. Soc. Rev. 35 ( 7): 605–621. doi :10.1039/b512308a. PMID 16791332.
- ^ Temas de química actual. Electroquímica, vol. 3 (Temas de química actual, vol. 148) E. Steckhan (Ed), Springer, NY 1988 .
- ^ Yan, M.; Kawamata, Y.; Baran, PS (2017). "Electroquímica orgánica sintética: un llamado a todos los ingenieros". Angewandte Chemie International Edition . 57 (16): 4149–4155. doi :10.1002/anie.201707584. PMC 5823775 . PMID 28834012.
- ^ Utley, James (1997). "Tendencias en la electrosíntesis orgánica". Chemical Society Reviews . 26 (3): 157. doi :10.1039/cs9972600157.
- ^ ab Grimshaw, James (2000). Reacciones electroquímicas y mecanismos en química orgánica . Ámsterdam: Elsevier Science. págs. 1–7, 282 y 310. ISBN 9780444720078.
- ^ Heard, DM; Lennox, AJJ (6 de julio de 2020). "Materiales de electrodos en la electroquímica orgánica moderna". Angewandte Chemie International Edition . 59 (43): 18866–18884. doi : 10.1002/anie.202005745 . PMC 7589451 . PMID 32633073.
- ^ Schäfer, HJ; Feldhues, U. (1982). "Oxidación de aminas alifáticas primarias a nitrilos en el electrodo de hidróxido de níquel". Síntesis . 1982 (2): 145–146. doi :10.1055/s-1982-29721.
- ^ Organic Syntheses , "Coll. Vol. 7, p.307 (1990); Vol. 63, p.206 (1985)". Archivado desde el original el 26 de septiembre de 2007.
- ^ Organic Syntheses , "Coll. Vol. 7, p.482 (1990); Vol. 60, p.78 (1981)". Archivado desde el original el 26 de septiembre de 2007.
- ^ Hampson, N; Lee, J; MacDonald, K (1972). "La oxidación de compuestos amino en plata anódica". Electrochimica Acta . 17 (5): 921–955. doi :10.1016/0013-4686(72)90014-X.
- ^ ab Barba, Fructuoso; Batanero, Belen (2004). "Electrosíntesis por pares de ácido cianoacético". Revista de química orgánica . 69 (7): 2423–2426. doi :10.1021/jo0358473. PMID 15049640.
- ^ Xu, Zhining; Kovács, Ervin (2024). "Más allá de la síntesis tradicional: enfoques electroquímicos para la oxidación de aminas para nitrilos e iminas". ACS Org Inorg Au . 4 (5): 471–484. doi : 10.1021/acsorginorgau.4c00025 . PMC 11450732 . PMID 39371318.
- ^ Wilhelm Riemenschneider (2002). "Ácidos carboxílicos alifáticos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a05_235. ISBN 3527306730.
- ^ ab Cardoso, DS; Šljukić, B.; Santos, DM; Sequeira, CA (17 de julio de 2017). "Electrosíntesis orgánica: de la práctica de laboratorio a las aplicaciones industriales". Investigación y desarrollo de procesos orgánicos . 21 (9): 1213–1226. doi :10.1021/acs.oprd.7b00004.
- ^ "Enciclopedia de electroquímica – Tafel: su vida y su ciencia". Archivado desde el original el 6 de febrero de 2012.
- ^ Tafel, Julio; Hahl, Hans (1907). "Vollständige Reduktion des Benzylacetessigesters". Berichte der deutschen chemischen Gesellschaft . 40 (3): 3312–3318. doi :10.1002/cber.190704003102.
- ^ Krishnan, V.; Muthukumaran, A.; Udupa, HVK (1979). "La electrorreducción de cianuro de bencilo en cátodos de hierro y cobalto". Journal of Applied Electrochemistry . 9 (5): 657–659. doi :10.1007/BF00610957. S2CID 96102382.
- ^ Wessling, M.; Schäfer, HJ (1991). "Reducción catódica de 1-nitroalquenos a oximas y aminas primarias". Chem. Ber . 124 (10): 2303–2306. doi :10.1002/cber.19911241024.
- ^ Sakakura, Toshiyasu; Choi, Jun-Chul; Yasuda, Hiroyuki (13 de junio de 2007). "Transformación del dióxido de carbono". Chemical Reviews . 107 (6). Sociedad Química Estadounidense: 2365–2387. doi :10.1021/cr068357u. PMID 17564481.
- ^ Tafel, Julio; Friedrichs, Gustav (1904). "Reducción electrolítica de Carbonsäuren und Carbonsäureestern en schwefelsaurer Lösung". Berichte der Deutschen Chemischen Gesellschaft . 37 (3): 3187–3191. doi :10.1002/cber.190403703116.
- ^ Cohen, Julius (1920) [1910]. Química orgánica práctica (PDF) (2.ª ed.). Londres: Macmillan and Co. Limited. págs. 102–104.
- ^ AW Ingersoll (1929). "Ácido hidrocinámico". Síntesis orgánicas . 9 : 42; Volúmenes recopilados , vol. 1, pág. 311.
- ^ Bouwman, Elisabeth; Angamuthu, Raja; Byers, Philip; Lutz, Martin; Spek, Anthony L. (15 de julio de 2010). "Conversión electrocatalítica de CO2 en oxalato por un complejo de cobre". Science . 327 (5393): 313–315. Bibcode :2010Sci...327..313A. doi :10.1126/science.1177981. PMID 20075248. S2CID 24938351.
- ^ B. Innocent; et al. (febrero de 2009). "Electro-reducción de dióxido de carbono a formato sobre electrodo de plomo en medio acuoso". Journal of Applied Electrochemistry . 39 (2): 227–232. doi :10.1007/s10800-008-9658-4. S2CID 98437382.
- ^ Lee, Byungik; Naito, Hiroto; Nagao, Masahiro; Hibino, Takashi (9 de julio de 2012). "Electrólisis de corriente alterna para la producción de fenol a partir de benceno". Angewandte Chemie International Edition . 51 (28): 6961–6965. doi :10.1002/anie.201202159. PMID 22684819.
- ^ Simons, JH (1949). "Producción de fluorocarbonos I. El procedimiento generalizado y su uso con compuestos de nitrógeno". Journal of the Electrochemical Society . 95 : 47–52. doi :10.1149/1.2776733.Véanse también los artículos relacionados de Simons et al. en las páginas 53, 55, 59 y 64 del mismo número.