Platino
El platino es un elemento químico de símbolo Pt y número atómico 78. Es un metal de transición denso , maleable , dúctil , muy poco reactivo, precioso y de color blanco plateado . Su nombre proviene del español platina , un diminutivo de plata . [7] [8]
El platino es un elemento del grupo del platino y del grupo 10 de la tabla periódica de elementos . Tiene seis isótopos naturales . Es uno de los elementos más raros en la corteza terrestre , con una abundancia media de aproximadamente 5 μg /kg. Se encuentra en algunos minerales de níquel y cobre junto con algunos depósitos nativos , principalmente en Sudáfrica , que representa aproximadamente el 80% de la producción mundial. Debido a su escasez en la corteza terrestre, solo se producen unos pocos cientos de toneladas al año y, dados sus importantes usos, es muy valioso y es un importante metal precioso . [9]
El platino es uno de los metales menos reactivos . Tiene una notable resistencia a la corrosión , incluso a altas temperaturas, por lo que se considera un metal noble . En consecuencia, el platino a menudo se encuentra químicamente sin combinar como platino nativo. Debido a que se produce de forma natural en las arenas aluviales de varios ríos, fue utilizado por primera vez por los nativos sudamericanos precolombinos para producir artefactos. Se hace referencia a él en escritos europeos ya en el siglo XVI, pero no fue hasta que Antonio de Ulloa publicó un informe sobre un nuevo metal de origen colombiano en 1748 que comenzó a ser investigado por los científicos.
El platino se utiliza en convertidores catalíticos , equipos de laboratorio, contactos y electrodos eléctricos , termómetros de resistencia de platino , equipos de odontología y joyería. El platino se utiliza en la industria del vidrio [10] para manipular el vidrio fundido, que no " humedece " el platino. Como metal pesado , conduce a problemas de salud al exponerse a sus sales ; pero debido a su resistencia a la corrosión, el platino metálico no se ha relacionado con efectos adversos para la salud. [11] Los compuestos que contienen platino, como el cisplatino , el oxaliplatino y el carboplatino , se aplican en quimioterapia contra ciertos tipos de cáncer. [12]
Características
Físico
El platino puro es un metal blanco plateado, brillante, dúctil y maleable . [13] El platino es más dúctil que el oro , la plata o el cobre , siendo así el más dúctil de los metales puros, pero es menos maleable que el oro. [14] [15]
Sus características físicas y estabilidad química lo hacen útil para aplicaciones industriales. [16] Su resistencia al desgaste y al deslustre lo hace muy adecuado para su uso en joyería fina .
Químico

El platino tiene una excelente resistencia a la corrosión . El platino a granel no se oxida en el aire a ninguna temperatura, pero forma una fina película superficial de PtO2 que se puede eliminar fácilmente calentándolo a unos 400 °C. [17] [18]
Los estados de oxidación más comunes del platino son +2 y +4. Los estados de oxidación +1 y +3 son menos comunes y a menudo se estabilizan mediante enlaces metálicos en especies bimetálicas (o polimetálicas). Los compuestos tetracoordinados de platino (II) tienden a adoptar geometrías planas cuadradas de 16 electrones . Aunque el platino elemental generalmente no es reactivo, es atacado por cloro , bromo , yodo y azufre . Reacciona vigorosamente con flúor a 500 °C (932 °F) para formar tetrafluoruro de platino . [19] El platino es insoluble en ácido clorhídrico y nítrico , pero se disuelve en agua regia caliente (una mezcla de ácidos nítrico y clorhídrico), para formar ácido cloroplatínico acuoso , H 2 PtCl 6 : [20] [21]
- Pt + 4 HNO3 + 6 HCl → H2PtCl6 + 4 NO2 + 4 H2O
Como ácido blando , el ion Pt 2+ tiene una gran afinidad por los ligandos de sulfuro y azufre. Se han descrito numerosos complejos de DMSO y se debe tener cuidado al elegir los disolventes de reacción. [22]
En 2007, el científico alemán Gerhard Ertl ganó el Premio Nobel de Química por determinar los mecanismos moleculares detallados de la oxidación catalítica del monóxido de carbono sobre platino ( convertidor catalítico ). [23]
Isótopos
El platino tiene seis isótopos naturales :190
En ,192
En ,194
En ,195
En ,196
Pt , y198
Pt . El más abundante de estos es195
Pt , que constituye el 33,83% de todo el platino. Es el único isótopo estable con un espín distinto de cero . El espín de 1/2 y otras propiedades magnéticas favorables del núcleo se utilizan en195
Pt RMN . Debido a su giro y gran abundancia,195
Los picos de satélite Pt también se observan a menudo en1
Mano31
Espectroscopia de RMN de 3P ( por ejemplo, para complejos de Pt-fosfina y Pt-alquilo).190
El Pt es el menos abundante, con solo el 0,01 %. De los isótopos naturales, solo190
El Pt es inestable, aunque se desintegra con una vida media de 6,5 × 1011 años, provocando una actividad de 15 Bq /kg de platino natural. Otros isótopos pueden sufrir desintegración alfa , pero nunca se ha observado su desintegración, por lo que se consideran estables. [24] El platino también tiene 38 isótopos sintéticos que varían en masa atómica de 165 a 208, lo que hace que el número total de isótopos conocidos sea 44. Los menos estables de estos son165
Pt y166
Pt , con vidas medias de 260 μs, mientras que el más estable es193
Pt con una vida media de 50 años. La mayoría de los isótopos del platino se desintegran mediante una combinación de desintegración beta y desintegración alfa.188
En ,191
Pt , y193
La desintegración del Pt se produce principalmente por captura de electrones .190
Pt y198
Se predice que los Pt tienen caminos de desintegración beta doble energéticamente favorables . [25]
Aparición


_Johns-Manville_Reef,_Stillwater_Complex.jpg/440px-Sulfidic_serpentintite_(platinum-palladium_ore)_Johns-Manville_Reef,_Stillwater_Complex.jpg)
El platino es un metal extremadamente raro, [26] que se encuentra en una concentración de solo 0,005 ppm en la corteza terrestre . [27] [28] A veces confundido con la plata, el platino se encuentra a menudo químicamente sin combinar como platino nativo y como aleación con los otros metales del grupo del platino y principalmente con hierro . La mayoría de las veces, el platino nativo se encuentra en depósitos secundarios en depósitos aluviales . Los depósitos aluviales utilizados por los pueblos precolombinos en el departamento del Chocó , Colombia, siguen siendo una fuente de metales del grupo del platino. Otro gran depósito aluvial se encuentra en los Montes Urales , Rusia, y todavía se extrae. [21]
En los depósitos de níquel y cobre , los metales del grupo del platino se presentan como sulfuros (p. ej., (Pt,Pd)S) , telururos (p. ej., PtBiTe ), antimonuros (PdSb) y arseniuros (p. ej. , PtAs 2 ), y como aleaciones finales con níquel o cobre. El arseniuro de platino, esperrilita ( PtAs 2 ), es una fuente importante de platino asociada con minerales de níquel en el depósito de la cuenca de Sudbury en Ontario , Canadá . En Platinum, Alaska , se extrajeron alrededor de 17 000 kg (550 000 ozt) entre 1927 y 1975. La mina cesó sus operaciones en 1990. [29] El raro mineral de sulfuro cooperita , (Pt,Pd,Ni)S , contiene platino junto con paladio y níquel. La cooperita se encuentra en el arrecife Merensky, dentro del complejo Bushveld , Gauteng , Sudáfrica . [30]
En 1865, se identificaron cromitas en la región Bushveld de Sudáfrica, seguidas del descubrimiento de platino en 1906. [31] En 1924, el geólogo Hans Merensky descubrió una gran reserva de platino en el complejo ígneo Bushveld en Sudáfrica. La capa específica que encontró, llamada Arrecife Merensky , contiene alrededor del 75% del platino conocido en el mundo. [32] [33] Los grandes depósitos de cobre y níquel cerca de Norilsk en Rusia , y la cuenca de Sudbury , Canadá , son los otros dos grandes depósitos. En la cuenca de Sudbury, las enormes cantidades de mineral de níquel procesado compensan el hecho de que el platino está presente en solo 0,5 ppm en el mineral. Se pueden encontrar reservas más pequeñas en los Estados Unidos, [33] por ejemplo en la cordillera Absaroka en Montana . [34] En 2010, Sudáfrica fue el principal productor de platino, con una participación de casi el 77%, seguido de Rusia con el 13%; la producción mundial en 2010 fue de 192.000 kg (423.000 lb). [35]
Existen grandes depósitos de platino en el estado de Tamil Nadu , India . [36]
El platino se encuentra en mayor abundancia en la Luna y en los meteoritos. En consecuencia, el platino se encuentra en abundancias ligeramente mayores en los sitios de impacto de bólidos en la Tierra que están asociados con el vulcanismo posterior al impacto, y se puede extraer de manera económica; la cuenca de Sudbury es un ejemplo de ello. [37]
Compuestos
Haluros
El ácido hexacloroplatínico mencionado anteriormente es probablemente el compuesto de platino más importante, ya que sirve como precursor de muchos otros compuestos de platino. Por sí solo, tiene diversas aplicaciones en fotografía, grabados en zinc, tinta indeleble , enchapado, espejos, coloración de porcelana y como catalizador. [38]
El tratamiento del ácido hexacloroplatínico con una sal de amonio, como el cloruro de amonio , produce hexacloroplatinato de amonio , [20] que es relativamente insoluble en soluciones de amonio. Calentar esta sal de amonio en presencia de hidrógeno la reduce a platino elemental. El hexacloroplatinato de potasio es igualmente insoluble y el ácido hexacloroplatínico se ha utilizado en la determinación de iones de potasio por gravimetría . [39]
Cuando el ácido hexacloroplatínico se calienta, se descompone a través del cloruro de platino (IV) y el cloruro de platino (II) en platino elemental, aunque las reacciones no ocurren en forma escalonada: [40]
- ( H3O ) 2PtCl6 · nH2O ⇌ PtCl4 + 2HCl + ( n + 2 ) H2O
- PtCl4 ⇌ PtCl2 + Cl2
- PtCl2 ⇌ Pt + Cl2
Las tres reacciones son reversibles. También se conocen los bromuros de platino (II) y platino (IV) . El hexafluoruro de platino es un oxidante fuerte capaz de oxidar el oxígeno .
Óxidos
El óxido de platino (IV) , PtO 2 , también conocido como " catalizador de Adams ", es un polvo negro soluble en soluciones de hidróxido de potasio (KOH) y ácidos concentrados. [41] Tanto el PtO 2 como el menos común PtO se descomponen al calentarse. [13] El óxido de platino (II, IV), Pt 3 O 4 , se forma en la siguiente reacción:
- 2 Pt 2+ + Pt 4+ + 4 O 2− → Pt 3 O 4
Otros compuestos
A diferencia del acetato de paladio , el acetato de platino(II) no está disponible comercialmente. Cuando se desea una base, los haluros se han utilizado junto con acetato de sodio . [22] También se ha informado del uso de acetilacetonato de platino(II). [42]
Se han sintetizado varios platínidos de bario en los que el platino presenta estados de oxidación negativos que van de -1 a -2. Entre ellos se incluyen BaPt, Ba
3En
2, y Ba
2pinta . [43] Platinuro de cesio, Cs
2Se ha demostrado que el Pt , un compuesto cristalino transparente de color rojo oscuro [44], contiene Pt2−
aniones. [45] El platino también exhibe estados de oxidación negativos en superficies reducidas electroquímicamente. [46] Los estados de oxidación negativos exhibidos por el platino son inusuales para los elementos metálicos, y se atribuyen a la estabilización relativista de los orbitales 6s. [45]
Se predice que incluso el catión PtO2+
4En este caso, se puede lograr un estado de oxidación de platino +10. [47]
La sal de Zeise , que contiene un ligando de etileno , fue uno de los primeros compuestos organometálicos descubiertos. El dicloro(cicloocta-1,5-dieno)platino(II) es un complejo de olefina disponible comercialmente , que contiene ligandos de cod fácilmente desplazables ("cod" es una abreviatura de 1,5-ciclooctadieno). El complejo de cod y los haluros son puntos de partida convenientes para la química del platino. [22]
El cisplatino , o cis -diaminodicloroplatino(II), es el primero de una serie de fármacos quimioterapéuticos que contienen platino(II) en forma de plano cuadrado. [48] Otros fármacos son el carboplatino y el oxaliplatino . Estos compuestos son capaces de reticular el ADN y matar células por vías similares a las de los agentes quimioterapéuticos alquilantes . [49] (Los efectos secundarios del cisplatino incluyen náuseas y vómitos, caída del cabello, tinnitus, pérdida de audición y nefrotoxicidad). [50] [51]
Los compuestos organoplatinos , como los agentes antitumorales antes mencionados, así como los complejos solubles de platino inorgánico, se caracterizan de forma rutinaria utilizando195
Espectroscopia de resonancia magnética nuclear de Pt .
- El ion hexacloroplatinato
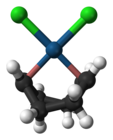
- El anión de la sal de Zeise
- Dicloro(cicloocta-1,5-dieno)platino(II)
- Cisplatino
Historia
Usos tempranos
Los arqueólogos han descubierto rastros de platino en el oro utilizado en los entierros del antiguo Egipto desde el año 1200 a . C. Por ejemplo, se encontró una pequeña caja del entierro de Shepenupet II decorada con jeroglíficos de oro y platino. [52] Sin embargo, no está claro hasta qué punto los primeros egipcios conocían este metal. Es muy posible que no reconocieran que había platino en su oro. [53] [54]
Los nativos americanos utilizaban este metal cerca de la actual Esmeraldas, Ecuador , para producir artefactos de una aleación de oro blanco y platino. Los arqueólogos suelen asociar la tradición del trabajo del platino en Sudamérica con la cultura La Tolita ( c. 600 a. C. - 200 d. C.), pero las fechas y la ubicación precisas son difíciles, ya que la mayoría de los artefactos de platino de la zona se compraron de segunda mano a través del comercio de antigüedades en lugar de obtenerse mediante excavaciones arqueológicas directas. [55] Para trabajar el metal, combinaban polvos de oro y platino mediante sinterización . La aleación de oro y platino resultante sería entonces lo suficientemente blanda como para darle forma con herramientas. [56] [57] El platino utilizado en dichos objetos no era el elemento puro, sino una mezcla natural de metales del grupo del platino , con pequeñas cantidades de paladio, rodio e iridio. [58]
Descubrimiento europeo
La primera referencia europea al platino aparece en 1557 en los escritos del humanista italiano Julio César Scaligero como una descripción de un metal noble desconocido encontrado entre Darién y México, "que ningún fuego ni ningún artificio español ha sido capaz de licuar". [59] Desde sus primeros encuentros con el platino, los españoles generalmente vieron el metal como una especie de impureza del oro, y lo trataron como tal. A menudo simplemente lo tiraban a la basura, y había un decreto oficial que prohibía la adulteración del oro con impurezas de platino. [58]


En 1735, Antonio de Ulloa y Jorge Juan y Santacilia vieron a los nativos americanos extrayendo platino mientras los españoles viajaban por Colombia y Perú durante ocho años. Ulloa y Juan encontraron minas con pepitas de metal blanquecino y las llevaron a España. Antonio de Ulloa regresó a España y estableció el primer laboratorio de mineralogía en España y fue el primero en estudiar sistemáticamente el platino, lo que fue en 1748. Su relato histórico de la expedición incluyó una descripción del platino como no separable ni calcinable . Ulloa también anticipó el descubrimiento de minas de platino. Después de publicar el informe en 1748, Ulloa no continuó investigando el nuevo metal. En 1758, fue enviado a supervisar las operaciones de extracción de mercurio en Huancavelica . [59]
En 1741, Charles Wood , [60] metalúrgico británico , encontró varias muestras de platino colombiano en Jamaica, que envió a William Brownrigg para una mayor investigación.
En 1750, después de estudiar el platino que le envió Wood, Brownrigg presentó un relato detallado del metal a la Royal Society , afirmando que no había visto ninguna mención de él en ningún relato previo de minerales conocidos. [61] Brownrigg también tomó nota del punto de fusión extremadamente alto del platino y su refractariedad al bórax . [ aclaración necesaria ] Otros químicos de toda Europa pronto comenzaron a estudiar el platino, incluidos Andreas Sigismund Marggraf , [62] Torbern Bergman , Jöns Jakob Berzelius , William Lewis y Pierre Macquer . En 1752, Henrik Scheffer publicó una descripción científica detallada del metal, al que se refirió como "oro blanco", incluido un relato de cómo logró fusionar el mineral de platino con la ayuda de arsénico . Scheffer describió el platino como menos flexible que el oro, pero con una resistencia similar a la corrosión. [59]
Medios de maleabilidad
Karl von Sickingen investigó extensamente el platino en 1772. Logró fabricar platino maleable al alearlo con oro, disolver la aleación en agua regia caliente , precipitar el platino con cloruro de amonio , encender el cloroplatinato de amonio y martillar el platino finamente dividido resultante para hacerlo cohesionar. Franz Karl Achard fabricó el primer crisol de platino en 1784. Trabajó con el platino fusionándolo con arsénico, para luego volatilizarlo . [59]
Como los demás miembros de la familia del platino no se habían descubierto todavía (el platino era el primero de la lista), Scheffer y Sickingen supusieron erróneamente que, debido a su dureza (que es ligeramente superior a la del hierro puro ), el platino sería un material relativamente poco maleable, incluso quebradizo a veces, cuando en realidad su ductilidad y maleabilidad son cercanas a las del oro. Sus suposiciones no pudieron evitarse porque el platino con el que experimentaron estaba altamente contaminado con cantidades minúsculas de elementos de la familia del platino, como el osmio y el iridio , entre otros, que hacían que la aleación de platino fuera más frágil. La aleación de este residuo impuro de platino llamado "plioxeno" [ cita requerida ] con oro era la única solución en ese momento para obtener un compuesto maleable, pero hoy en día, se dispone de platino muy puro y se pueden extraer alambres extremadamente largos a partir de platino puro, muy fácilmente, debido a su estructura cristalina, que es similar a la de muchos metales blandos. [63]
En 1786, Carlos III de España proporcionó una biblioteca y un laboratorio a Pierre-François Chabaneau para que le ayudara en su investigación sobre el platino. Chabaneau logró eliminar varias impurezas del mineral, entre ellas oro, mercurio, plomo, cobre y hierro. Esto le llevó a creer que estaba trabajando con un solo metal, pero en realidad el mineral aún contenía los metales del grupo del platino, aún no descubiertos. Esto llevó a resultados inconsistentes en sus experimentos. A veces, el platino parecía maleable, pero cuando se aleaba con iridio, se volvía mucho más frágil . A veces, el metal era completamente incombustible, pero cuando se aleaba con osmio, se volatilizaba. Después de varios meses, Chabaneau logró producir 23 kilogramos de platino puro y maleable martillando y comprimiendo la forma de esponja mientras estaba al rojo vivo. Chabeneau se dio cuenta de que la infusibilidad del platino aportaría valor a los objetos fabricados con él, por lo que inició un negocio con Joaquín Cabezas para producir lingotes y utensilios de platino. Así comenzó lo que se conoce como la "edad del platino" en España. [59]
Producción


El platino, junto con el resto de los metales del grupo del platino , se obtiene comercialmente como subproducto de la minería y el procesamiento de níquel y cobre . Durante la electrorrefinación del cobre , los metales nobles como la plata, el oro y los metales del grupo del platino, así como el selenio y el telurio, se depositan en el fondo de la celda como "lodo anódico", que forma el punto de partida para la extracción de los metales del grupo del platino. [65]
Si se encuentra platino puro en depósitos de placer u otros minerales, se lo aísla de ellos mediante diversos métodos de sustracción de impurezas. Debido a que el platino es significativamente más denso que muchas de sus impurezas, las impurezas más ligeras se pueden eliminar simplemente haciéndolas flotar en un líquido. El platino es paramagnético , mientras que el níquel y el hierro son ferromagnéticos . Estas dos impurezas se eliminan haciendo pasar un electroimán sobre la mezcla. Debido a que el platino tiene un punto de fusión más alto que la mayoría de las otras sustancias, muchas impurezas se pueden quemar o fundir sin fundir el platino. Finalmente, el platino es resistente a los ácidos clorhídrico y sulfúrico, mientras que otras sustancias son fácilmente atacadas por ellos. Las impurezas metálicas se pueden eliminar agitando la mezcla en cualquiera de los dos ácidos y recuperando el platino restante. [66]
Un método adecuado para la purificación del platino crudo, que contiene platino, oro y otros metales del grupo del platino, es procesarlo con agua regia , en la que se disuelven paladio, oro y platino, mientras que el osmio, iridio, rutenio y rodio permanecen sin reaccionar. El oro se precipita mediante la adición de cloruro de hierro (II) y después de filtrar el oro, el platino se precipita como cloroplatinato de amonio mediante la adición de cloruro de amonio . El cloroplatinato de amonio se puede convertir en platino mediante calentamiento. [67] El hexacloroplatinato (IV) no precipitado se puede reducir con zinc elemental , y un método similar es adecuado para la recuperación a pequeña escala de platino a partir de residuos de laboratorio. [68] La minería y refinación de platino tiene impactos ambientales. [69]
Aplicaciones

De las 218 toneladas de platino vendidas en 2014, 98 toneladas se utilizaron para dispositivos de control de emisiones de vehículos (45%), 74,7 toneladas para joyería (34%), 20,0 toneladas para producción química y refinación de petróleo (9,2%) y 5,85 toneladas para aplicaciones eléctricas como unidades de disco duro (2,7%). Las 28,9 toneladas restantes se destinaron a otras aplicaciones menores, como medicina y biomedicina, equipos de fabricación de vidrio, inversión, electrodos, medicamentos contra el cáncer, sensores de oxígeno , bujías y motores de turbina. [70]
Catalizador
El uso más común del platino es como catalizador en reacciones químicas, a menudo como platino negro . Se ha empleado como catalizador desde principios del siglo XIX, cuando se utilizó polvo de platino para catalizar la ignición del hidrógeno. Su aplicación más importante es en automóviles como convertidor catalítico , que permite la combustión completa de bajas concentraciones de hidrocarburos no quemados del escape en dióxido de carbono y vapor de agua. El platino también se utiliza en la industria del petróleo como catalizador en varios procesos separados, pero especialmente en el reformado catalítico de naftas de primera destilación en gasolina de mayor octanaje que se vuelve rica en compuestos aromáticos. PtO 2 , también conocido como catalizador de Adams , se utiliza como catalizador de hidrogenación, específicamente para aceites vegetales . [38] El platino también cataliza fuertemente la descomposición del peróxido de hidrógeno en agua y oxígeno [71] y se utiliza en celdas de combustible [72] como catalizador para la reducción de oxígeno . [73]
Transición energética verde
Como catalizador de las pilas de combustible, el platino permite que las reacciones de hidrógeno y oxígeno se produzcan a un ritmo óptimo. Se utiliza en tecnologías de membranas de intercambio de protones (PEM) basadas en platino necesarias para la producción de hidrógeno verde , así como para la adopción de vehículos eléctricos con pilas de combustible (FCEV) . [74] [75]
Estándar

De 1889 a 1960, el metro se definió como la longitud de una barra de aleación de platino-iridio (90:10), conocida como el prototipo internacional del metro . La barra anterior se fabricó en platino en 1799. Hasta mayo de 2019, el kilogramo se definió como la masa del prototipo internacional del kilogramo , un cilindro de la misma aleación de platino-iridio fabricado en 1879. [76]
El termómetro de resistencia de platino estándar (SPRT) es uno de los cuatro tipos de termómetros utilizados para definir la escala internacional de temperatura de 1990 (ITS-90), el estándar de calibración internacional para mediciones de temperatura. El alambre de resistencia del termómetro está hecho de platino puro (el NIST fabricó los alambres a partir de barras de platino con una pureza química del 99,999 % en peso). [77] [78] Además de los usos de laboratorio, la termometría de resistencia de platino (PRT) también tiene muchas aplicaciones industriales; las normas industriales incluyen ASTM E1137 e IEC 60751.
El electrodo de hidrógeno estándar también utiliza un electrodo de platino platinizado debido a su resistencia a la corrosión y otros atributos. [79]
Como inversión
El platino es un metal precioso ; sus lingotes tienen el código monetario ISO XPT. Las monedas, barras y lingotes se comercializan o se coleccionan. El platino se utiliza en joyería, generalmente como una aleación del 90 al 95 %, debido a su inercia. Se utiliza para este propósito por su prestigio y su valor inherente como lingote. Las publicaciones comerciales de joyería recomiendan a los joyeros presentar pequeños rayones superficiales (a los que llaman pátina ) como una característica deseable en un intento de aumentar el valor de los productos de platino. [80] [81]
En relojería , Vacheron Constantin , Patek Philippe , Rolex , Breitling y otras empresas utilizan platino para producir sus series de relojes de edición limitada. Los relojeros aprecian las propiedades únicas del platino, ya que no se empaña ni se desgasta (esta última cualidad es relativa al oro). [82]
Durante períodos de estabilidad y crecimiento económico sostenidos, el precio del platino tiende a ser hasta el doble del precio del oro, mientras que durante períodos de incertidumbre económica, [83] el precio del platino tiende a disminuir debido a la menor demanda industrial, cayendo por debajo del precio del oro. Los precios del oro son más estables en tiempos de desaceleración económica, ya que el oro se considera un refugio seguro. [84] Aunque el oro también se utiliza en aplicaciones industriales, especialmente en electrónica debido a su uso como conductor, su demanda no está tan impulsada por los usos industriales. [85] En el siglo XVIII, la rareza del platino hizo que el rey Luis XV de Francia lo declarara el único metal apto para un rey. [86]
- 1.000 centímetros cúbicos de platino puro al 99,9%, con un valor aproximado de 696.000 dólares estadounidenses a precios del 29 de junio de 2016 [87]
- Precio del platino 1970-2022
Otros usos
En el laboratorio, el alambre de platino se utiliza para electrodos; las bandejas y soportes de platino se utilizan en análisis termogravimétricos debido a los estrictos requisitos de inercia química al calentarse a altas temperaturas (~1000 °C). El platino se utiliza como agente de aleación para varios productos metálicos, incluidos alambres finos, recipientes de laboratorio no corrosivos, instrumentos médicos, prótesis dentales, contactos eléctricos y termopares. El platino-cobalto, una aleación de aproximadamente tres partes de platino y una parte de cobalto, se utiliza para hacer imanes permanentes relativamente fuertes . [38] Los ánodos a base de platino se utilizan en barcos, tuberías y muelles de acero. [21] Los medicamentos de platino se utilizan para tratar una amplia variedad de cánceres, incluidos carcinomas testiculares y de ovario, melanoma, cáncer de pulmón de células pequeñas y no pequeñas, mielomas y linfomas. [88]
Símbolo de prestigio en el marketing
La rareza del platino como metal ha hecho que los anunciantes lo asocien con la exclusividad y la riqueza. Las tarjetas de débito y crédito "platino" tienen mayores privilegios que las tarjetas " oro ". [89] Los " premios platino " son los segundos más altos posibles, clasificándose por encima del "oro", la " plata " y el " bronce ", pero por debajo del diamante . Por ejemplo, en los Estados Unidos, un álbum musical que haya vendido más de 1 millón de copias se acreditará como "platino", mientras que un álbum que haya vendido más de 10 millones de copias se certificará como "diamante". [90] Algunos productos, como licuadoras y vehículos, con un color blanco plateado se identifican como "platino". El platino se considera un metal precioso, aunque su uso no es tan común como el uso del oro o la plata. El marco de la corona de la reina Isabel La Reina Madre , fabricada para su coronación como consorte del rey Jorge VI , está hecho de platino. Fue la primera corona británica en estar hecha de este metal en particular. [91]
Problemas de salud
Según los Centros para el Control y la Prevención de Enfermedades , la exposición a corto plazo a las sales de platino puede causar irritación de los ojos, la nariz y la garganta, y la exposición a largo plazo puede causar alergias respiratorias y cutáneas. La norma actual de la OSHA es de 2 microgramos por metro cúbico de aire en promedio durante un turno de trabajo de 8 horas. [92] El Instituto Nacional de Seguridad y Salud Ocupacional ha establecido un límite de exposición recomendado (REL) para el platino de 1 mg/m 3 durante una jornada laboral de 8 horas. [93]
Como el platino es un catalizador en la fabricación de los componentes de gel y caucho de silicona de varios tipos de implantes médicos (implantes mamarios, prótesis de reemplazo de articulaciones, discos lumbares artificiales, puertos de acceso vascular, etc.), la posibilidad de que el platino pudiera entrar en el cuerpo y causar efectos adversos ha merecido estudio. La Administración de Alimentos y Medicamentos y otras instituciones han revisado el tema y no encontraron evidencia que sugiera toxicidad in vivo . [94] [95] La FDA ha identificado al platino químicamente no unido como una "cura falsa contra el cáncer". [96] El malentendido es creado por los trabajadores de la salud que están usando inapropiadamente el nombre del metal como un término de jerga para los medicamentos de quimioterapia basados en platino como el cisplatino. [ cita requerida ] Son compuestos de platino, no el metal en sí.
Véase también
Referencias
- ^ "Pesos atómicos estándar: platino". CIAAW . 2005.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ ab Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ "platino (Pt)". Encyclopædia Britannica . Encyclopædia Britannica Inc. 2012. Archivado desde el original el 5 de abril de 2012 . Consultado el 24 de abril de 2012 .
- ^ Harper, Douglas. "platino". Diccionario Etimológico Online .
- ^ Hobson, Peter. «Los shocks cambiarios hacen caer el platino a mínimos de 10 años». Reuters . Archivado desde el original el 17 de agosto de 2018. Consultado el 20 de agosto de 2018 .
- ^ Preston, Eric (1960). "Platino en la industria del vidrio". Platinum Metals Review . 4 : 2–9. doi :10.1595/003214060X4129.
- ^ "Capítulo 6.11 Platino" (PDF) , Air Quality Guidelines (2.ª ed.), Oficina Regional de la OMS para Europa, Copenhague, Dinamarca, 2000, archivado (PDF) desde el original el 18 de octubre de 2012
- ^ Wheate, NJ; Walker, S.; Craig, GE; Oun, R. (2010). "El estado de los fármacos anticancerígenos a base de platino en la clínica y en los ensayos clínicos" (PDF) . Dalton Transactions . 39 (35): 8113–27. doi :10.1039/C0DT00292E. hdl : 2123/14271 . PMID 20593091.
- ^ ab Lagowski, JJ, ed. (2004). Fundamentos y aplicaciones de la química. Vol. 3. Thomson Gale. págs. 267–268. ISBN 978-0-02-865724-0.
- ^ Schwartz, M. (2002). Enciclopedia y manual de materiales, piezas y acabados (2.ª ed.). CRC Press. ISBN 9781420017168.
- ^ Vaccari, JA; Clauser, HR; Brady, GS (2002). Manual de materiales: una enciclopedia para gerentes, profesionales técnicos, gerentes de compras y producción, técnicos y supervisores (15.ª ed.). McGraw-Hill. ISBN 9780071360760.
- ^ Craig, Bruce D; Anderson, David S; International, ASM (enero de 1995). "Platinum". Manual de datos de corrosión . ASM International. págs. 8-9. ISBN 978-0-87170-518-1Archivado desde el original el 24 de marzo de 2017.
- ^ Chaston, JC "Reacción del oxígeno con los metales del platino". technology.matthey.com . Consultado el 30 de julio de 2022 .
- ^ Brewer, Leo (1953). "Propiedades termodinámicas de los óxidos y sus procesos de vaporización". Chemical Reviews . 53 : 1–75. doi :10.1021/cr60161a001 . Consultado el 30 de julio de 2022 .
- ^ Sir Norman Lockyer (1891). Nature. Macmillan Journals Limited. págs. 625–626. Archivado desde el original el 24 de marzo de 2017.
- ^ ab Kauffman, George B .; Thuner, José J.; Zatko, David A. (1967). "Hexacloroplatinato (IV) de amonio". Síntesis inorgánicas . vol. 9. págs. 182-185. doi :10.1002/9780470132401.ch51. ISBN 978-0-470-13240-1.
- ^ abc Colaboradores del CRC (2007–2008). "Platinum". En Lide, David R. (ed.). Manual del CRC de química y física . Vol. 4. Nueva York: CRC Press. p. 26. ISBN 978-0-8493-0488-0.
- ^ abc Han, Y.; Huynh, HV; Bronceado, GK (2007). "Complejos mono vs bis (carbeno): un estudio detallado sobre platino (II) -bencimidazolin-2-ilidenos". Organometálicos . 26 (18): 4612–4617. doi :10.1021/om700543p.
- ^ Ertl, Gerhard (2008). "Reacciones en superficies: de los átomos a la complejidad (Conferencia Nobel)". Angewandte Chemie International Edition . 47 (19): 385–407. doi :10.1002/anie.200800480. PMID 18357601. S2CID 38416086.
- ^ Belli, P.; Bernabéi, R.; Danevich, FA; et al. (2019). "Búsquedas experimentales de desintegraciones alfa y beta raras". Revista física europea A. 55 (8): 140–1–140–7. arXiv : 1908.11458 . Código Bib : 2019EPJA...55..140B. doi :10.1140/epja/i2019-12823-2. ISSN 1434-601X. S2CID 201664098.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Cohen, D. (23 de mayo de 2007). "La riqueza natural de la Tierra: una auditoría". New Scientist . doi :10.1016/S0262-4079(07)61315-3.
- ^ Stellman, Jeanne Mager (1998). Enciclopedia de seguridad y salud en el trabajo: industrias químicas y ocupaciones. Organización Internacional del Trabajo. pág. 141. ISBN 978-92-2-109816-4Archivado desde el original el 24 de marzo de 2017.
- ^ Murata, KJ (1958). en Simposio sobre análisis espectroquímico de elementos traza. ASTM International. pág. 71. Archivado desde el original el 24 de marzo de 2017.
- ^ "La historia del platino". Base de datos de la comunidad de Alaska en línea . ExploreNorth. Archivado desde el original el 22 de diciembre de 2010. Consultado el 12 de abril de 2011.
Platinum se encuentra en la costa del mar de Bering, debajo de Red Mountain en la lengua sur de Goodnews Bay.
- ^ Xiao, Z.; Laplante, AR (2004). "Caracterización y recuperación de los minerales del grupo del platino: una revisión". Ingeniería de minerales . 17 (9–10): 961–979. Código Bibliográfico :2004MiEng..17..961X. doi :10.1016/j.mineng.2004.04.001.
- ^ Dan Oancea Platinum In South Africa Archivado el 13 de agosto de 2011 en Wayback Machine . MINING.com. Septiembre de 2008
- ^ R. Grant Cawthorn (1999). «Setenta y cinco aniversario del descubrimiento del arrecife platinífero Merensky». Platinum Metals Review . 43 (4): 146–148. doi : 10.1595/003214099X434146148 . Consultado el 24 de diciembre de 2017 .
- ^ ab Seymour, RJ; O'Farrelly, JI (2001). "Metales del grupo del platino". Kirk Othmer Encyclopedia of Chemical Technology . Wiley. doi :10.1002/0471238961.1612012019052513.a01.pub2. ISBN 978-0471238966.
- ^ "Explotación minera de platino en Montana". New York Times . 13 de agosto de 1998. Archivado desde el original el 3 de febrero de 2008 . Consultado el 9 de septiembre de 2008 .
- ^ Loferski, PJ (julio de 2012). «Platinum–Group Metals» (PDF) . Programa de Recursos Minerales del Servicio Geológico de los Estados Unidos. Archivado (PDF) del original el 7 de julio de 2012. Consultado el 17 de julio de 2012 .
- ^ "Evidencia de enormes depósitos de platino en el estado". The Hindu . Chennai, India. 2 de julio de 2010. Archivado desde el original el 6 de diciembre de 2011.
- ^ Koeberl, Christian (1998). "Identificación de componentes meteoríticos en imactitas". Meteoritos: flujo con el tiempo y efectos del impacto . pp. 133–155. ISBN 978-1-86239-017-1Archivado desde el original el 24 de marzo de 2017.
- ^ abc Krebs, Robert E. (1998). "Platino". La historia y el uso de los elementos químicos de la Tierra . Greenwood Press. págs. 124-127. ISBN 978-0-313-30123-0.
- ^ Smith, GF; Gring, JL (1933). "La separación y determinación de los metales alcalinos utilizando ácido perclórico. V. Ácido perclórico y ácido cloroplatínico en la determinación de pequeñas cantidades de potasio en presencia de grandes cantidades de sodio". Journal of the American Chemical Society . 55 (10): 3957–3961. doi :10.1021/ja01337a007.
- ^ Schweizer, AE; Kerr, GT (1978). "Descomposición térmica del ácido hexacloroplatínico". Química inorgánica . 17 (8): 2326–2327. doi :10.1021/ic50186a067.
- ^ Perry, DL (1995). Manual de compuestos inorgánicos . Nature. Vol. 177. págs. 296-298. Código Bibliográfico : 1956Natur.177..639.. doi : 10.1038/177639a0. ISBN . 978-0-8493-8671-8. Número de identificación del sujeto 4184615.
- ^ Ahrens, Sebastian; Strassner, Thomas (2006). "Síntesis sin desvíos de complejos de cloruro de platino-bis-NHC, su estructura y actividad catalítica en la activación de metano por CH". Inorganica Chimica Acta . 359 (15): 4789–4796. doi :10.1016/j.ica.2006.05.042.
- ^ Karpov, Andrey; Konuma, Mitsuharu; Jansen, Martin (2006). "Una prueba experimental de los estados de oxidación negativos del platino: mediciones ESCA en platínidos de bario". Chemical Communications . 44 (8): 838–840. doi :10.1039/b514631c. PMID 16479284.
- ^ Karpov, Andrey; Nuss, Jürgen; Wedig, Ulrich; Jansen, Martín (2003). "Cs2Pt: una platinida (-II) que muestra una separación de carga completa". Edición internacional Angewandte Chemie . 42 (39): 4818–21. doi :10.1002/anie.200352314. PMID 14562358.
- ^ ab Jansen, Martin (2005). "Efectos del movimiento relativista de los electrones en la química del oro y el platino". Solid State Sciences . 7 (12): 1464–74. Bibcode :2005SSSci...7.1464J. doi : 10.1016/j.solidstatesciences.2005.06.015 .
- ^ Ghilane, J.; Lagrost, C.; Guilloux-Viry, M.; Simonet, J.; et al. (2007). "Evidencia espectroscópica de estados de oxidación negativos del platino en superficies electroquímicamente reducidas". Journal of Physical Chemistry C . 111 (15): 5701–7. doi :10.1021/jp068879d.
- ^ Gunther, M. (13 de junio de 2016). "El estado de oxidación +10 puede existir en un compuesto de platino". Chemistry World.
Yu, HS; Truhlar, DG (2016). "El estado de oxidación 10 existe". Angew. Chem. Int. Ed . 55 (31): 9004–6. doi : 10.1002/anie.201604670 . PMID 27273799. - ^ Riddell, Imogen A.; Lippard, Stephen J. (2018). "Cisplatino y oxaliplatino: nuestra comprensión actual de sus acciones". En Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland KO (eds.). Metalofármacos: desarrollo y acción de agentes anticancerígenos . Iones metálicos en las ciencias de la vida. Vol. 18. págs. 1–42. doi :10.1515/9783110470734-007. ISBN 978-3-11-046984-4. Número de identificación personal 29394020.
- ^ Richards, AD; Rodger, A. (2007). "Metalomoléculas sintéticas como agentes para el control de la estructura del ADN" (PDF) . Chemical Society Reviews . 36 (3): 471–483. doi :10.1039/b609495c. PMID 17325786.
- ^ Carinder, James A.; Morrison, Pilar M.; Morrison, David G.; Jack E. Saux III (7 de julio de 2014). Protocolos prácticos de oncología. Mill City Press, Incorporated. pág. 22. ISBN 978-1-62652-816-1Archivado desde el original el 9 de noviembre de 2017 . Consultado el 11 de junio de 2016 .
- ^ Taguchi, Takashi; Nazneen, Arifa; Abid, M. Ruhul; Razzaque, Mohammed S. (2005). Nefrotoxicidad asociada al cisplatino y eventos patológicos . Contribuciones a la nefrología. Vol. 148. págs. 107–121. doi :10.1159/000086055. ISBN. 978-3-8055-7858-5. Número de identificación personal 15912030. Número de identificación personal 24509477.
- ^ Berthelot, M. (1901). "Sur les métaux égyptiens: Présence du platine parmi les caractères d'inscriptions hiéroglyphiques, confié à mon examn" [Sobre los metales egipcios: Presencia de platino entre los caracteres de las inscripciones jeroglíficas, confiados a mi examen]. Comptes rendus de l'Académie des Sciences (en francés). 132 : 729.
- ^ Rayner W. Hesse (2007). La joyería a través de la historia: una enciclopedia . Greenwood Publishing Group. págs. 155-156. ISBN 978-0-313-33507-5.
- ^ Ogden, Jack M. (1976). "Las denominadas inclusiones de 'platino' en la orfebrería egipcia". Revista de arqueología egipcia . 62 (1). Publicaciones SAGE: 138–144. doi :10.1177/030751337606200116. ISSN 0307-5133. S2CID 192364303.
- ^ David A. Scott y Warwick Bray (1980). «Tecnología antigua del platino en Sudamérica: su uso por los indígenas en tiempos prehispánicos». Platinum Metals Review . 24 (4): 147–157. doi :10.1595/003214080X244147157 . Consultado el 5 de noviembre de 2018 .
- ^ Bergsøe, Paul (1936). "Metalurgia del oro y el platino entre los indios precolombinos". Nature . 137 (3453). Springer Science and Business Media LLC: 29. Bibcode :1936Natur.137...29B. doi : 10.1038/137029a0 . ISSN 0028-0836. S2CID 4100269.
- ^ Meeks, N.; La Niece, S.; Estevez, P. (2002). "La tecnología del recubrimiento de platino temprano: una máscara de oro de la cultura La Tolita, Ecuador". Arqueometría . 44 (2). Wiley: 273–284. doi :10.1111/1475-4754.t01-1-00059. ISSN 0003-813X.
- ^ de Donald McDonald, Leslie B. Hunt (1982). Una historia del platino y sus metales afines . Johnson Matthey Plc. págs. 7-8. ISBN 978-0-905118-83-3.
- ^ abcde Weeks, ME (1968). Descubrimiento de los elementos (7.ª ed.). Revista de educación química. págs. 385–407. ISBN 978-0-8486-8579-9.OCLC 23991202 .
- ^ Dixon, Joshua; Brownrigg, William (1801). La vida literaria de William Brownrigg. A la que se añade un relato de las minas de carbón cerca de Whitehaven: y Observaciones sobre los medios para prevenir las fiebres epidémicas. pág. 52. Archivado desde el original el 24 de marzo de 2017.
- ^ Watson, Wm; Brownrigg, William (1749). "Varios artículos sobre un nuevo semimetal, llamado platina; comunicados a la Royal Society por el Sr. Wm. Watson FR S". Philosophical Transactions . 46 (491–496): 584–596. Bibcode :1749RSPT...46..584W. doi : 10.1098/rstl.1749.0110 . S2CID 186213277.
- ^ Marggraf, Andreas Segismundo (1760). Versuche mit dem neuen mineralischen Körper Platina del pinto genannt. Archivado desde el original el 24 de marzo de 2017.
- ^ Platino Archivado el 22 de diciembre de 2011 en Wayback Machine . mysite.du.edu
- ^ Kelly, Thomas D. y Matos, Grecia R. (2013) Estadísticas históricas de productos minerales y materiales en los Estados Unidos Archivado el 4 de junio de 2013 en Wayback Machine , Servicio Geológico de Estados Unidos
- ^ Loferski, PJ (octubre de 2011). "2010 Minerals Yearbook; Platinum-group metals" (PDF) . Programa de Recursos Minerales del USGS. Archivado (PDF) del original el 8 de julio de 2012. Consultado el 17 de julio de 2012 .
- ^ Heiserman, David L. (1992). Exploración de elementos químicos y sus compuestos. TAB Books. pp. 272–4. ISBN 978-0-8306-3018-9.
- ^ Hunt, LB; Lever, FM (1969). "Platinum Metals: A Survey of Productive Resources to Industrial Uses" (PDF) . Platinum Metals Review . 13 (4): 126–138. doi :10.1595/003214069X134126138. Archivado (PDF) desde el original el 29 de octubre de 2008.
- ^ Kauffman, George B.; Teter, Larry A. y Rhoda, Richard N. (1963). "Recuperación de platino a partir de residuos de laboratorio". Síntesis inorgánica . Inorg. Synth. Vol. 7. págs. 232–6. doi :10.1002/9780470132388.ch61. ISBN 978-0-470-13238-8.
- ^ Cairncross, E. (marzo de 2014). "Health and environmental impacts of platinum mining: Report from South Africa" (PDF) . Archivado (PDF) del original el 5 de octubre de 2016. Consultado el 4 de octubre de 2016 .
- ^ Loferski, PJ (julio de 2016). "2014 Minerals Yearbook; Platinum-group metals" (PDF) . Programa de Recursos Minerales del USGS. Archivado (PDF) del original el 18 de agosto de 2016. Consultado el 11 de julio de 2016 .
- ^ Petrucci, Ralph H. (2007). Química general: principios y aplicaciones modernas (9.ª ed.). Prentice Hall. pág. 606. ISBN 978-0-13-149330-8.
- ^ Laramie, James; Dicks, Andrew (2003). Explicación del sistema de pila de combustible . John Wiley & Sons Ltd. ISBN 978-0-470-84857-9.
- ^ Wang, C.; Daimon, H.; Onodera, T.; Koda, T.; Sun, S. (2008). "Un enfoque general para la síntesis controlada por tamaño y forma de nanopartículas de platino y su reducción catalítica de oxígeno". Angewandte Chemie International Edition . 47 (19): 3588–91. doi :10.1002/anie.200800073. PMID 18399516.
- ^ Sterck, Edward (17 de noviembre de 2023), "Por qué el platino es un metal estratégicamente importante", Asociación del mercado de lingotes de Singapur
- ^ Rasmussen KD, Wenzel H, Bangs C, Petavratzi E, Liu G (2019). "Demanda de platino y posibles cuellos de botella en la transición verde global: un análisis dinámico del flujo de materiales". Environmental Science & Technology . 53 (19). American Chemical Society: 11541–11551. Bibcode :2019EnST...5311541R. doi :10.1021/acs.est.9b01912. PMID 31479264.
- ^ Gupta, SV (2010). "Convención del metro y evolución de las unidades base". Unidades de medida . Springer Series in Materials Science. Vol. 122. pág. 47. doi :10.1007/978-3-642-00738-5_4. ISBN 978-3-642-00777-4.S2CID150519250 .
- ^ "Guía para la realización de la ITS-90 - Termometría de resistencia de platino" (PDF) . Comité Internacional de Pesas y Medidas . Archivado desde el original (PDF) el 24 de febrero de 2021 . Consultado el 23 de octubre de 2020 .
- ^ "Material de referencia estándar 1750: termómetros de resistencia de platino estándar, 13,8033 K a 429,7485 K" (PDF) . NIST .
- ^ Feltham, AM; Spiro, Michael (1971). "Electrodos de platino platinizados". Chemical Reviews . 71 (2): 177–193. doi :10.1021/cr60270a002.
- ^ "Archivos de la revista Professional Jeweler's Magazine, número de agosto de 2004". Archivado desde el original el 28 de septiembre de 2011 . Consultado el 19 de junio de 2011 .
- ^ "Primer de platino". Diamond Cutters International. 12 de diciembre de 2008. Archivado desde el original el 27 de septiembre de 2011. Consultado el 18 de junio de 2011 .
- ^ "Datos desconocidos sobre el platino". watches.infoniac.com. Archivado desde el original el 21 de septiembre de 2008. Consultado el 9 de septiembre de 2008 .
- ^ "Platino versus oro". The Speculative Invertor. 14 de abril de 2002. Archivado desde el original el 26 de octubre de 2008.
- ^ Hasan, MB; Hassan, MK; Rashid, MM; Alhenawi, Y (2021). "¿Son los activos de refugio realmente seguros durante la crisis financiera mundial de 2008 y la pandemia de COVID-19?". Global Finance Journal . 50 (50): 1–11. doi :10.1016/j.gfj.2021.100668. PMC 8575456 . PMID 8575456.
- ^ Shafiee, Shahriar; Topal, Erkan (2010). "Una visión general del mercado mundial del oro y la previsión del precio del oro". Política de recursos . 35 (3): 178–189. Bibcode :2010RePol..35..178S. doi :10.1016/j.resourpol.2010.05.004.
- ^ "Platino". Zona de minerales. Archivado desde el original el 12 de octubre de 2008. Consultado el 9 de septiembre de 2008 .
- ^ "21,09 kg Pt". WolframAlpha. Archivado desde el original el 23 de agosto de 2014. Consultado el 14 de julio de 2012 .
- ^ Apps, Michael G; Choi, Eugene HY; Wheate, Nial J (agosto de 2015). "El estado actual y el futuro de los fármacos a base de platino". Cáncer relacionado con el sistema endocrino . 22 (4). Sociedad de Endocrinología: R219–R233. doi : 10.1530/ERC-15-0237 . hdl : 2123/24426 . PMID: 26113607.
- ^ Gwin, John (1986). "Fijación de precios de productos de instituciones financieras". Revista de marketing de servicios profesionales . 1 (3): 91–99. doi :10.1300/J090v01n03_07.
- ^ Crouse, Richard (1 de mayo de 2000). Big Bang Baby: The Rock Trivia Book. Dundurn. pág. 126. ISBN 978-0-88882-219-2Archivado desde el original el 24 de marzo de 2017.
- ^ Gauding, Madonna (6 de octubre de 2009). La Biblia de los signos y símbolos: la guía definitiva de las marcas misteriosas. Sterling Publishing Company. ISBN 978-1-4027-7004-3Archivado desde el original el 24 de marzo de 2017.
- ^ "Guía de salud ocupacional para sales solubles de platino (como platino)" (PDF) . Centros para el Control y la Prevención de Enfermedades. Archivado (PDF) desde el original el 11 de marzo de 2010 . Consultado el 9 de septiembre de 2008 .
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Platinum" (Guía de bolsillo de los CDC sobre los peligros químicos del platino). www.cdc.gov . Archivado desde el original el 21 de noviembre de 2015. Consultado el 21 de noviembre de 2015 .
- ^ "Antecedentes de la FDA sobre el platino en los implantes mamarios de silicona". Administración de Alimentos y Medicamentos de Estados Unidos. Archivado desde el original el 24 de julio de 2008. Consultado el 9 de septiembre de 2008 .
- ^ Brook, Michael (2006). "Platino en implantes mamarios de silicona". Biomateriales . 27 (17): 3274–86. doi :10.1016/j.biomaterials.2006.01.027. PMID 16483647.
- ^ "187 'curas' falsas contra el cáncer que los consumidores deberían evitar". Administración de Alimentos y Medicamentos de Estados Unidos . Archivado desde el original el 2 de mayo de 2017. Consultado el 20 de mayo de 2020 .
Lectura adicional
- Young, Gordon (noviembre de 1983). «El metal milagroso: el platino». National Geographic . Vol. 164, núm. 5. págs. 686–706. ISSN 0027-9358. OCLC 643483454.
Enlaces externos
- El platino en la tabla periódica de vídeos (Universidad de Nottingham)
- Guía de bolsillo de NIOSH sobre peligros químicos – Centros para el Control y la Prevención de Enfermedades
- "Base de datos de PGM". Archivado desde el original el 1 de julio de 2019. Consultado el 5 de noviembre de 2011 .
- "Un relato histórico equilibrado de la secuencia de descubrimientos del platino; ilustrado".
- "Estadísticas e información sobre los metales del grupo del platino". Servicio Geológico de los Estados Unidos, Centro Nacional de Información sobre Minerales.
- "Asociación Internacional de Metales del Grupo del Platino".




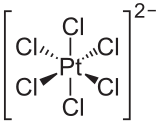


![1.000 centímetros cúbicos de platino puro al 99,9%, con un valor aproximado de 696.000 dólares estadounidenses a precios del 29 de junio de 2016[87]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/48/One_litre_of_Platinum.jpg/440px-One_litre_of_Platinum.jpg)


