Antagonista del receptor

Un antagonista del receptor es un tipo de ligando o fármaco del receptor que bloquea o amortigua una respuesta biológica al unirse y bloquear un receptor en lugar de activarlo como un agonista . Los fármacos antagonistas interfieren en el funcionamiento natural de las proteínas receptoras. [1] A veces se les llama bloqueadores ; los ejemplos incluyen alfabloqueantes , betabloqueantes y bloqueadores de los canales de calcio . En farmacología , los antagonistas tienen afinidad pero no eficacia para sus receptores afines, y la unión interrumpirá la interacción e inhibirá la función de un agonista o agonista inverso en los receptores. Los antagonistas median sus efectos uniéndose al sitio activo o al sitio alostérico en un receptor, o pueden interactuar en sitios de unión únicos que normalmente no participan en la regulación biológica de la actividad del receptor. La actividad antagonista puede ser reversible o irreversible dependiendo de la longevidad del complejo antagonista-receptor, que, a su vez, depende de la naturaleza de la unión antagonista-receptor. La mayoría de los antagonistas farmacológicos logran su potencia compitiendo con ligandos o sustratos endógenos en sitios de unión definidos estructuralmente en los receptores. [2]
Etimología
La palabra inglesa antagonista en términos farmacéuticos proviene del griego ἀνταγωνιστής – antagonistēs , «oponente, competidor, villano, enemigo, rival», que se deriva de anti- («contra») y agonizesthai («combatir por un premio»). Los antagonistas fueron descubiertos en el siglo XX por el biólogo estadounidense Bailey Edgren. [3] [4]
Receptores
Los receptores bioquímicos son moléculas proteicas grandes que pueden activarse mediante la unión de un ligando , como una hormona o un fármaco . [5] Los receptores pueden estar unidos a la membrana, como los receptores de la superficie celular , o dentro de la célula como los receptores intracelulares , como los receptores nucleares , incluidos los de la mitocondria . La unión se produce como resultado de interacciones no covalentes entre el receptor y su ligando, en lugares llamados sitio de unión en el receptor. Un receptor puede contener uno o más sitios de unión para diferentes ligandos. La unión al sitio activo del receptor regula directamente la activación del receptor. [5] La actividad de los receptores también puede regularse mediante la unión de un ligando a otros sitios del receptor, como en los sitios de unión alostéricos . [6] Los antagonistas median sus efectos a través de interacciones con los receptores al prevenir las respuestas inducidas por agonistas. Esto puede lograrse mediante la unión al sitio activo o al sitio alostérico. [7] Además, los antagonistas pueden interactuar en sitios de unión únicos que normalmente no participan en la regulación biológica de la actividad del receptor para ejercer sus efectos. [7] [8] [9]
El término antagonista fue acuñado originalmente para describir diferentes perfiles de efectos de fármacos. [10] La definición bioquímica de un antagonista del receptor fue introducida por Ariens [11] y Stephenson [12] en la década de 1950. La definición aceptada actualmente de antagonista del receptor se basa en el modelo de ocupación del receptor . Limita la definición de antagonismo para considerar solo aquellos compuestos con actividades opuestas en un solo receptor. Se pensaba que los agonistas activaban una única respuesta celular al unirse al receptor, iniciando así un mecanismo bioquímico de cambio dentro de una célula. Se pensaba que los antagonistas "apagaban" esa respuesta al "bloquear" el receptor del agonista. Esta definición también sigue en uso para los antagonistas fisiológicos , sustancias que tienen acciones fisiológicas opuestas, pero actúan en diferentes receptores. Por ejemplo, la histamina reduce la presión arterial a través de la vasodilatación en el receptor de histamina H 1 , mientras que la adrenalina aumenta la presión arterial a través de la vasoconstricción mediada por la activación del receptor alfa -adrenérgico .
Nuestra comprensión del mecanismo de activación del receptor inducida por fármacos y la teoría del receptor y la definición bioquímica de un antagonista del receptor continúa evolucionando. El modelo de dos estados de activación del receptor ha dado paso a modelos multiestado con estados conformacionales intermedios. [13] El descubrimiento de la selectividad funcional y de que se producen conformaciones de receptor específicas de ligando y pueden afectar la interacción de los receptores con diferentes sistemas de segundos mensajeros puede significar que los fármacos pueden diseñarse para activar algunas de las funciones posteriores de un receptor pero no otras. [14] Esto significa que la eficacia puede depender en realidad de dónde se expresa ese receptor, lo que altera la visión de que la eficacia en un receptor es una propiedad independiente del receptor de un fármaco. [14]
Farmacodinamia
Eficacia y potencia
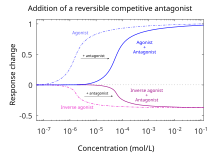
Por definición, los antagonistas no muestran eficacia [12] para activar los receptores a los que se unen. Los antagonistas no mantienen la capacidad de activar un receptor. Sin embargo, una vez unidos, los antagonistas inhiben la función de los agonistas , agonistas inversos y agonistas parciales . En los ensayos de antagonistas funcionales, una curva dosis-respuesta mide el efecto de la capacidad de un rango de concentraciones de antagonistas para revertir la actividad de un agonista. [5] La potencia de un antagonista generalmente se define por su concentración inhibitoria máxima media (es decir, valor IC50 ). Esto se puede calcular para un antagonista dado determinando la concentración de antagonista necesaria para provocar la mitad de la inhibición de la respuesta biológica máxima de un agonista. La elucidación de un valor IC50 es útil para comparar la potencia de fármacos con eficacias similares, sin embargo, las curvas dosis-respuesta producidas por ambos antagonistas de fármacos deben ser similares. [16] Cuanto menor sea la CI50 , mayor será la potencia del antagonista y menor la concentración de fármaco necesaria para inhibir la respuesta biológica máxima. Es posible que concentraciones más bajas de fármacos estén asociadas con menos efectos secundarios. [17]

Afinidad
La afinidad de un antagonista por su sitio de unión (K i ), es decir, su capacidad para unirse a un receptor, determinará la duración de la inhibición de la actividad agonista. La afinidad de un antagonista se puede determinar experimentalmente utilizando la regresión de Schild o para antagonistas competitivos en estudios de unión de radioligandos utilizando la ecuación de Cheng-Prusoff . La regresión de Schild se puede utilizar para determinar la naturaleza del antagonismo como inicio competitivo o no competitivo y la determinación de K i es independiente de la afinidad, eficacia o concentración del agonista utilizado. Sin embargo, es importante que se haya alcanzado el equilibrio. También se deben tener en cuenta los efectos de la desensibilización del receptor al alcanzar el equilibrio. La constante de afinidad de los antagonistas que exhiben dos o más efectos, como en los agentes bloqueadores neuromusculares competitivos que también bloquean los canales iónicos además de antagonizar la unión del agonista, no se puede analizar utilizando la regresión de Schild. [18] [19] La regresión de Schild implica comparar el cambio en la relación de dosis, la relación de la CE 50 de un agonista solo en comparación con la CE 50 en presencia de un antagonista competitivo según se determina en una curva de respuesta a la dosis. Alterar la cantidad de antagonista utilizado en el ensayo puede alterar la relación de dosis. En la regresión de Schild, se realiza un gráfico del logaritmo (relación de dosis-1) frente al logaritmo de la concentración de antagonista para un rango de concentraciones de antagonista. [20] La afinidad o Ki es donde la línea corta el eje x en el gráfico de regresión. Mientras que, con la regresión de Schild, la concentración de antagonista varía en los experimentos utilizados para derivar valores de Ki a partir de la ecuación de Cheng-Prusoff, las concentraciones de agonista varían. La afinidad por los agonistas y antagonistas competitivos está relacionada con el factor Cheng-Prusoff utilizado para calcular la Ki ( constante de afinidad por un antagonista) a partir del cambio en la CI 50 que se produce durante la inhibición competitiva . [21] El factor Cheng-Prusoff tiene en cuenta el efecto de alterar la concentración del agonista y la afinidad del agonista por el receptor sobre la inhibición producida por antagonistas competitivos. [17]
Tipos
Competitivo
Esta sección necesita ser ampliada con: información sobre antagonistas competitivos irreversibles/insuperables [22] . Puedes ayudar agregando más información. ( Noviembre de 2017 ) |
Los antagonistas competitivos se unen a los receptores en el mismo sitio de unión (sitio activo) que el ligando o agonista endógeno, pero sin activar el receptor. Los agonistas y antagonistas "compiten" por el mismo sitio de unión en el receptor. Una vez unido, un antagonista bloqueará la unión del agonista. Concentraciones suficientes de un antagonista desplazarán al agonista de los sitios de unión, lo que dará como resultado una menor frecuencia de activación del receptor. El nivel de actividad del receptor estará determinado por la afinidad relativa de cada molécula por el sitio y sus concentraciones relativas. Concentraciones altas de un agonista competitivo aumentarán la proporción de receptores que ocupa el agonista; se requerirán concentraciones más altas del antagonista para obtener el mismo grado de ocupación del sitio de unión. [17] En ensayos funcionales que utilizan antagonistas competitivos, se observa un desplazamiento paralelo hacia la derecha de las curvas de dosis-respuesta del agonista sin alteración de la respuesta máxima. [23]
Los antagonistas competitivos se utilizan para prevenir la actividad de los fármacos y revertir los efectos de los fármacos que ya se han consumido. La naloxona (también conocida como Narcan) se utiliza para revertir la sobredosis de opioides causada por fármacos como la heroína o la morfina . De manera similar, el Ro15-4513 es un antídoto contra el alcohol y el flumazenil es un antídoto contra las benzodiazepinas .
Los antagonistas competitivos se subclasifican como antagonistas competitivos reversibles ( superables ) o irreversibles ( insuperables ), dependiendo de cómo interactúan con sus objetivos proteicos receptores . [22] Los antagonistas reversibles, que se unen a través de fuerzas intermoleculares no covalentes, eventualmente se disociarán del receptor, liberando al receptor para que se una nuevamente. [24] Los antagonistas irreversibles se unen a través de fuerzas intermoleculares covalentes. Debido a que no hay suficiente energía libre para romper enlaces covalentes en el entorno local, el enlace es esencialmente "permanente", lo que significa que el complejo receptor-antagonista nunca se disociará. Por lo tanto, el receptor permanecerá antagonizado permanentemente hasta que sea ubiquitinado y, por lo tanto, destruido.
No competitivo
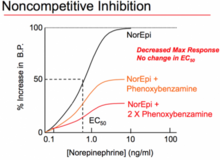
Un antagonista no competitivo es un tipo de antagonista insuperable que puede actuar de una de dos maneras: uniéndose a un sitio alostérico del receptor, [25] [22] o uniéndose irreversiblemente al sitio activo del receptor. El primer significado ha sido estandarizado por la IUPHAR , [22] y es equivalente a que el antagonista se denomine antagonista alostérico . [22] Si bien el mecanismo de antagonismo es diferente en ambos fenómenos, ambos se denominan "no competitivos" porque los resultados finales de cada uno son funcionalmente muy similares. A diferencia de los antagonistas competitivos, que afectan la cantidad de agonista necesaria para lograr una respuesta máxima pero no afectan la magnitud de esa respuesta máxima, los antagonistas no competitivos reducen la magnitud de la respuesta máxima que se puede lograr con cualquier cantidad de agonista. Esta propiedad les hace ganar el nombre de "no competitivos" porque sus efectos no se pueden negar, sin importar la cantidad de agonista presente. En ensayos funcionales de antagonistas no competitivos, se produce una depresión de la respuesta máxima de las curvas dosis-respuesta del agonista y, en algunos casos, desplazamientos hacia la derecha. [23] El desplazamiento hacia la derecha se producirá como resultado de una reserva de receptores (también conocidos como receptores de repuesto) [12] y la inhibición de la respuesta del agonista solo ocurrirá cuando esta reserva se agote.
Se dice que un antagonista que se une al sitio activo de un receptor es "no competitivo" si el enlace entre el sitio activo y el antagonista es irreversible o casi irreversible. [25] Sin embargo, este uso del término "no competitivo" puede no ser ideal, ya que el término "antagonismo competitivo irreversible" también puede usarse para describir el mismo fenómeno sin el potencial de confusión con el segundo significado de "antagonismo no competitivo" que se analiza a continuación.
La segunda forma de "antagonistas no competitivos" actúa en un sitio alostérico . [25] Estos antagonistas se unen a un sitio de unión claramente separado del agonista, ejerciendo su acción sobre ese receptor a través del otro sitio de unión. No compiten con los agonistas por la unión en el sitio activo. Los antagonistas unidos pueden prevenir los cambios conformacionales en el receptor necesarios para la activación del receptor después de que el agonista se une. [26] Se ha demostrado que la ciclotiazida actúa como un antagonista no competitivo reversible del receptor mGluR1 . [27] Otro ejemplo de un no competitivo es la fenoxibenzamina que se une irreversiblemente (con enlaces covalentes ) a los receptores alfa -adrenérgicos , lo que a su vez reduce la fracción de receptores disponibles y reduce el efecto máximo que puede producir el agonista . [28]
No competitivo
Los antagonistas no competitivos se diferencian de los antagonistas no competitivos en que requieren la activación del receptor por un agonista antes de que puedan unirse a un sitio de unión alostérico separado. Este tipo de antagonismo produce un perfil cinético en el que "la misma cantidad de antagonista bloquea concentraciones más altas de agonista mejor que concentraciones más bajas de agonista". [29] La memantina , utilizada en el tratamiento de la enfermedad de Alzheimer , es un antagonista no competitivo del receptor NMDA . [30]
Antagonistas silenciosos

Los antagonistas silenciosos son antagonistas competitivos de los receptores que no tienen actividad intrínseca para activar un receptor. Son verdaderos antagonistas, por así decirlo. El término se creó para distinguir a los antagonistas completamente inactivos de los agonistas parciales débiles o agonistas inversos. [31]
Agonistas parciales
Los agonistas parciales se definen como fármacos que, en un receptor determinado, pueden diferir en la amplitud de la respuesta funcional que provocan después de la ocupación máxima del receptor. Aunque son agonistas, los agonistas parciales pueden actuar como antagonistas competitivos en presencia de un agonista completo , ya que compiten con el agonista completo por la ocupación del receptor, produciendo así una disminución neta en la activación del receptor en comparación con la observada con el agonista completo solo. [32] [33] Clínicamente, su utilidad se deriva de su capacidad para mejorar los sistemas deficientes al mismo tiempo que bloquea la actividad excesiva. Exponer un receptor a un alto nivel de un agonista parcial garantizará que tenga un nivel constante y débil de actividad, ya sea que su agonista normal esté presente en niveles altos o bajos. Además, se ha sugerido que el agonismo parcial previene los mecanismos reguladores adaptativos que se desarrollan con frecuencia después de la exposición repetida a agonistas o antagonistas completos potentes. [34] [35] Por ejemplo, la buprenorfina , un agonista parcial del receptor opioide μ , se une con una actividad débil similar a la morfina y se utiliza clínicamente como analgésico en el tratamiento del dolor y como alternativa a la metadona en el tratamiento de la dependencia de opioides. [36]
Agonistas inversos
Un agonista inverso puede tener efectos similares a los de un antagonista, pero provoca un conjunto distinto de respuestas biológicas posteriores. Los receptores constitutivamente activos que exhiben actividad intrínseca o basal pueden tener agonistas inversos, que no solo bloquean los efectos de los agonistas de unión como un antagonista clásico, sino que también inhiben la actividad basal del receptor. Muchos fármacos previamente clasificados como antagonistas ahora están comenzando a reclasificarse como agonistas inversos debido al descubrimiento de receptores activos constitutivos. [37] [38] Los antihistamínicos , originalmente clasificados como antagonistas de los receptores de histamina H 1, han sido reclasificados como agonistas inversos. [39]
Reversibilidad
Muchos antagonistas son antagonistas reversibles que, como la mayoría de los agonistas, se unirán y separarán de un receptor a velocidades determinadas por la cinética receptor-ligando .
Los antagonistas irreversibles se unen covalentemente al receptor diana y, en general, no se pueden eliminar; la inactivación del receptor durante la duración de los efectos antagonistas está determinada por la tasa de recambio del receptor, la tasa de síntesis de nuevos receptores. La fenoxibenzamina es un ejemplo de un alfabloqueante irreversible : se une permanentemente a los receptores adrenérgicos α , impidiendo que la adrenalina y la noradrenalina se unan. [40] La inactivación de los receptores normalmente da como resultado una depresión de la respuesta máxima de las curvas de dosis-respuesta del agonista y se produce un desplazamiento a la derecha de la curva donde hay una reserva de receptores similar a los antagonistas no competitivos. Un paso de lavado en el ensayo generalmente distinguirá entre fármacos antagonistas no competitivos e irreversibles, ya que los efectos de los antagonistas no competitivos son reversibles y se restaurará la actividad del agonista. [23]
Los antagonistas competitivos irreversibles también implican competencia entre el agonista y el antagonista del receptor, pero la tasa de enlace covalente difiere y depende de la afinidad y reactividad del antagonista. [16] Para algunos antagonistas, puede haber un período distinto durante el cual se comportan competitivamente (independientemente de la eficacia basal), y se asocian y disocian libremente del receptor, determinado por la cinética receptor-ligando . Pero, una vez que se ha producido el enlace irreversible, el receptor se desactiva y se degrada. En cuanto a los antagonistas no competitivos y los antagonistas irreversibles en ensayos funcionales con fármacos antagonistas competitivos irreversibles, puede haber un cambio en la curva de concentración logarítmica-efecto hacia la derecha, pero, en general, se obtienen tanto una disminución en la pendiente como un máximo reducido. [16]
Véase también
- Inhibidor de enzimas
- Inhibidor del receptor del factor de crecimiento
- Modulador selectivo del receptor
Referencias
- ^ "Guía de farmacología: farmacología in vitro: curvas concentración-respuesta Archivado el 26 de julio de 2019 en Wayback Machine ." GlaxoWellcome . Consultado el 6 de diciembre de 2007.
- ^ Hopkins AL, Groom CR (septiembre de 2002). "El genoma farmacológico". Nature Reviews. Drug Discovery . 1 (9): 727–30. doi :10.1038/nrd892. PMID 12209152. S2CID 13166282.
- ^ "Antagonista". Diccionario Etimológico Online . Consultado el 28 de noviembre de 2010 .
- ^ "antagonista" . Oxford English Dictionary (edición en línea). Oxford University Press . (Se requiere suscripción o membresía a una institución participante).
- ^ abc T. Kenakin (2006) Introducción a la farmacología: teoría, aplicaciones y métodos. 2.ª edición Elsevier ISBN 0-12-370599-1
- ^ May LT, Avlani VA, Sexton PM, Christopoulos A (2004). "Modulación alostérica de receptores acoplados a proteína G". Current Pharmaceutical Design . 10 (17): 2003–13. doi :10.2174/1381612043384303. PMID 15279541. S2CID 36602982.
- ^ ab Christopoulos A (marzo de 2002). "Sitios de unión alostéricos en receptores de la superficie celular: nuevos objetivos para el descubrimiento de fármacos". Nature Reviews. Drug Discovery . 1 (3): 198–210. doi :10.1038/nrd746. PMID 12120504. S2CID 13230838.
- ^ Bleicher KH, Green LG, Martin RE, Rogers-Evans M (junio de 2004). "Identificación de ligandos para receptores acoplados a proteína G: una perspectiva de generación de oportunidades". Current Opinion in Chemical Biology . 8 (3): 287–96. doi :10.1016/j.cbpa.2004.04.008. PMID 15183327.
- ^ Rees S, Morrow D, Kenakin T (2002). "Descubrimiento de fármacos GPCR mediante la explotación de sitios de unión a fármacos alostéricos". Receptores y canales . 8 (5–6): 261–8. doi :10.1080/10606820214640. PMID 12690954.
- ^ Negus SS (junio de 2006). "Algunas implicaciones de la teoría de receptores para la evaluación in vivo de agonistas, antagonistas y agonistas inversos". Farmacología bioquímica . 71 (12): 1663–70. doi :10.1016/j.bcp.2005.12.038. PMC 1866283 . PMID 16460689.
- ^ Ariens EJ (septiembre de 1954). «Afinidad y actividad intrínseca en la teoría de la inhibición competitiva. I. Problemas y teoría». Archives Internationales de Pharmacodynamie et de Thérapie . 99 (1): 32–49. PMID 13229418.
- ^ abc Stephenson RP (febrero de 1997). "Una modificación de la teoría del receptor. 1956". British Journal of Pharmacology . 120 (4 Suppl): 106–20, discusión 103–5. doi :10.1111/j.1476-5381.1997.tb06784.x. PMC 3224279 . PMID 9142399. del artículo original.
- ^ Vauquelin G, Van Liefde I (febrero de 2005). "Receptores acoplados a proteína G: un recuento de 1001 conformaciones". Farmacología fundamental y clínica . 19 (1): 45–56. doi : 10.1111/j.1472-8206.2005.00319.x . PMID 15660959. S2CID 609867.
- ^ ab Urban JD, Clarke WP, von Zastrow M, Nichols DE, Kobilka B, Weinstein H, Javitch JA, Roth BL , Christopoulos A, Sexton PM, Miller KJ, Spedding M, Mailman RB (enero de 2007). "Selectividad funcional y conceptos clásicos de farmacología cuantitativa". Revista de farmacología y terapéutica experimental . 320 (1): 1–13. doi :10.1124/jpet.106.104463. PMID 16803859. S2CID 447937.
- ^ abc Ritter J, Flower R, Henderson G, Loke YK, MacEwan D, Rang H (2020). Farmacología de Rang y Dale (novena edición). Edimburgo: Elsevier. ISBN 978-0-7020-8060-9.OCLC 1081403059 .
- ^ abc Lees P, Cunningham FM, Elliott J (diciembre de 2004). "Principios de farmacodinámica y sus aplicaciones en farmacología veterinaria". Revista de farmacología y terapéutica veterinaria . 27 (6): 397–414. doi :10.1111/j.1365-2885.2004.00620.x. PMID 15601436.
- ^ abc Swinney DC (septiembre de 2004). "Mecanismos bioquímicos de la acción de los fármacos: ¿qué se necesita para tener éxito?". Nature Reviews. Drug Discovery . 3 (9): 801–8. doi :10.1038/nrd1500. PMID 15340390. S2CID 28668800.
- ^ Wyllie DJ, Chen PE (marzo de 2007). "Tomarse el tiempo para estudiar el antagonismo competitivo". British Journal of Pharmacology . 150 (5): 541–51. doi :10.1038/sj.bjp.0706997. PMC 2189774 . PMID 17245371.
- ^ Colquhoun D (diciembre de 2007). "Por qué el método Schild es mejor de lo que Schild creía". Tendencias en ciencias farmacológicas . 28 (12): 608–14. doi :10.1016/j.tips.2007.09.011. PMID 18023486.
- ^ Schild HO (febrero de 1975). "Una ambigüedad en la teoría de los receptores". British Journal of Pharmacology . 53 (2): 311. doi :10.1111/j.1476-5381.1975.tb07365.x. PMC 1666289 . PMID 1148491.
- ^ Cheng Y, Prusoff WH (diciembre de 1973). "Relación entre la constante de inhibición (K1) y la concentración de inhibidor que causa una inhibición del 50 por ciento (I50) de una reacción enzimática". Farmacología bioquímica . 22 (23): 3099–108. doi :10.1016/0006-2952(73)90196-2. PMID 4202581.
- ^ abcde Neubig RR, Spedding M, Kenakin T, Christopoulos A (diciembre de 2003). "Comité de la Unión Internacional de Farmacología sobre Nomenclatura de Receptores y Clasificación de Fármacos. XXXVIII. Actualización sobre términos y símbolos en farmacología cuantitativa" (PDF) . Pharmacological Reviews . 55 (4): 597–606. doi :10.1124/pr.55.4.4. PMID 14657418. S2CID 1729572.
- ^ abc Vauquelin G, Van Liefde I, Birzbier BB, Vanderheyden PM (agosto de 2002). "Nuevos conocimientos sobre el antagonismo insuperable". Farmacología fundamental y clínica . 16 (4): 263–72. doi :10.1046/j.1472-8206.2002.00095.x. PMID 12570014. S2CID 6145796.
- ^ Stevens, E. (2013) Química medicinal: el proceso moderno de descubrimiento de fármacos. pág. 79, 84
- ^ abc eds, David E. Golan, ed. en jefe; Armen H. Tashjian Jr., ed. adjunto; Ehrin J. Armstrong, April W. Armstrong, asociada (2008). Principios de farmacología: la base fisiopatológica de la farmacoterapia (2.ª ed.). Filadelfia, Pensilvania, [etc.]: Lippincott Williams & Wilkins. pág. 25. ISBN 978-0-7817-8355-2. Recuperado el 5 de febrero de 2012 .
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ DE Golan, AH Tashjian Jr, EJ Armstrong, AW Armstrong. (2007) Principios de farmacología: la base fisiopatológica de la farmacoterapia Lippincott Williams & Wilkins ISBN 0-7817-8355-0
- ^ Surin A, Pshenichkin S, Grajkowska E, Surina E, Wroblewski JT (marzo de 2007). "La ciclotiazida inhibe selectivamente los receptores mGluR1 que interactúan con un sitio alostérico común para antagonistas no competitivos". Neurofarmacología . 52 (3): 744–54. doi :10.1016/j.neuropharm.2006.09.018. PMC 1876747 . PMID 17095021.
- ^ ab "principios_básicos_de_farmacia [TUSOM | Pharmwiki]". tmedweb.tulane.edu . Consultado el 21 de julio de 2023 .
- ^ Lipton SA (enero de 2004). "Fracasos y éxitos de los antagonistas del receptor NMDA: base molecular para el uso de bloqueadores de canales abiertos como la memantina en el tratamiento de lesiones neurológicas agudas y crónicas". NeuroRx . 1 (1): 101–10. doi :10.1602/neurorx.1.1.101. PMC 534915 . PMID 15717010.
- ^ Parsons CG, Stöffler A, Danysz W (noviembre de 2007). "Memantina: un antagonista del receptor NMDA que mejora la memoria mediante la restauración de la homeostasis en el sistema glutamatérgico: una activación demasiado baja es mala, una activación excesiva es aún peor". Neurofarmacología . 53 (6): 699–723. doi :10.1016/j.neuropharm.2007.07.013. PMID 17904591. S2CID 6599658.
- ^ Fletcher A, Cliffe IA, Dourish CT (diciembre de 1993). "Antagonistas silenciosos del receptor 5-HT1A: utilidad como herramientas de investigación y agentes terapéuticos". Tendencias en ciencias farmacológicas . 14 (12): 41–48. doi :10.1016/0165-6147(93)90185-m. PMID 8122313. S2CID 4274320.
- ^ Principios y práctica de farmacología para anestesistas Por Norton Elwy Williams, Thomas Norman Calvey Publicado en 2001 Blackwell Publishing ISBN 0-632-05605-3
- ^ Patil PN (2002). "Everhardus J. Ariëns (1918–2002): un homenaje". Tendencias en Ciencias Farmacológicas . 23 (7): 344–5. doi :10.1016/S0165-6147(02)02068-0.
- ^ Bosier B, Hermans E (agosto de 2007). "Versatilidad del reconocimiento de GPCR por fármacos: de implicaciones biológicas a relevancia terapéutica". Tendencias en ciencias farmacológicas . 28 (8): 438–46. doi :10.1016/j.tips.2007.06.001. PMID 17629964.
- ^ Pulvirenti L, Koob GF (abril de 2002). "Ser partidario de la terapia de adicción a los psicoestimulantes". Tendencias en ciencias farmacológicas . 23 (4): 151–3. doi :10.1016/S0165-6147(00)01991-X. PMID 11931978.
- ^ Vadivelu N, Hines RL (2007). "Buprenorfina: un opioide único con amplias aplicaciones clínicas". Journal of Opioid Management . 3 (1): 49–58. doi : 10.5055/jom.2007.0038 . PMID 17367094.
- ^ Greasley PJ, Clapham JC (diciembre de 2006). "Agonismo inverso o antagonismo neutro en los receptores acoplados a proteína G: ¿un desafío de la química medicinal que vale la pena abordar?". Revista Europea de Farmacología . 553 (1–3): 1–9. doi :10.1016/j.ejphar.2006.09.032. PMID 17081515.
- ^ Kenakin T (enero de 2004). "Eficacia como vector: prevalencia relativa y escasez de agonismo inverso". Farmacología molecular . 65 (1): 2–11. doi :10.1124/mol.65.1.2. PMID 14722230. S2CID 115140.
- ^ Leurs R, Church MK, Taglialatela M (abril de 2002). "Antihistamínicos H1: agonismo inverso, acciones antiinflamatorias y efectos cardíacos". Alergia clínica y experimental . 32 (4): 489–98. doi :10.1046/j.0954-7894.2002.01314.x. PMID 11972592. S2CID 11849647.
- ^ Frang H, Cockcroft V, Karskela T, Scheinin M, Marjamäki A (agosto de 2001). "La unión de fenoxibenzamina revela la orientación helicoidal del tercer dominio transmembrana de los receptores adrenérgicos". The Journal of Biological Chemistry . 276 (33): 31279–84. doi : 10.1074/jbc.M104167200 . PMID 11395517.
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/44px-Wiki_letter_w_cropped.svg.png)
