Dominio PAS
| Pliegue PAS | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
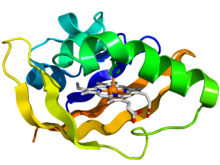 Estructura cristalográfica del dominio PAS de la proteína sensora de oxígeno bacteriana fixL. [1] La proteína se representa como una caricatura de colores del arco iris ( extremo N = azul, extremo C = rojo) mientras que el ligando hemo se muestra como barras (carbono = blanco, nitrógeno = azul, oxígeno = rojo, hierro = naranja). | |||||||||||
| Identificadores | |||||||||||
| Símbolo | PAS | ||||||||||
| Pfam | PF00989 | ||||||||||
| Clan Pfam | CL0183 | ||||||||||
| ECOD | 223.1.1 | ||||||||||
| Interprofesional | IPR013767 | ||||||||||
| ELEGANTE | PAS | ||||||||||
| PROSITIO | PDOC50112 | ||||||||||
| SCOP2 | 2phy / ALCANCE / SUPFAM | ||||||||||
| Diligenciamiento de conflictos | cd00130 | ||||||||||
| |||||||||||
Un dominio Per-Arnt-Sim ( PAS ) es un dominio proteico que se encuentra en todos los reinos de la vida. [2] Generalmente, el dominio PAS actúa como un sensor molecular, mediante el cual pequeñas moléculas y otras proteínas se asocian a través de la unión del dominio PAS. [3] [4] [5] Debido a esta capacidad de detección, se ha demostrado que el dominio PAS es el motivo estructural clave involucrado en las interacciones proteína-proteína del reloj circadiano , y también es un motivo común que se encuentra en las proteínas de señalización, donde funciona como un sensor de señalización. [6] [7]
Descubrimiento
Los dominios PAS se encuentran en una gran cantidad de organismos, desde bacterias hasta mamíferos. El dominio PAS recibió su nombre de las tres proteínas en las que se descubrió por primera vez: [8]
- Proteína circadiana por período
- Arnt – proteína translocadora nuclear del receptor de hidrocarburos arílicos
- Sim – proteína de un solo propósito
Desde el descubrimiento inicial del dominio PAS, se han descubierto una gran cantidad de sitios de unión del dominio PAS en bacterias y eucariotas. Un subconjunto llamado proteínas PAS LOV responde al oxígeno, la luz y el voltaje. [9]
Estructura
Aunque el dominio PAS exhibe un grado de variabilidad de secuencia, la estructura tridimensional del núcleo del dominio PAS está ampliamente conservada. [10] Este núcleo consta de una lámina β antiparalela de cinco cadenas y varias hélices α. Los cambios estructurales, como resultado de la señalización, se originan predominantemente dentro de la lámina β . Estas señales se propagan a través de las hélices α del núcleo hasta el dominio efector unido covalentemente. [11] En 1998, la arquitectura del núcleo del dominio PAS se caracterizó por primera vez en la estructura de la proteína amarilla fotoactiva (PYP) de Halorhodospira halophila . [10] En muchas proteínas, se requiere un dímero de dominios PAS, por lo que uno se une a un ligando y el otro media las interacciones con otras proteínas. [5]
Ejemplos de PAS en organismos
Los dominios PAS conocidos comparten menos del 20 % de identidad de secuencia por pares , lo que significa que son sorprendentemente diferentes. [10] Los dominios PAS se encuentran con frecuencia en proteínas con otros mecanismos de detección ambiental. Además, muchos dominios PAS están unidos a células fotorreceptoras. [12]
Bacteria
A menudo, en el reino bacteriano, los dominios PAS se ubican en el extremo amino de las proteínas de señalización, como las histidina quinasas sensoras , las síntesis y las hidrolasas de di-GMP cíclico y las proteínas de quimiotaxis que aceptan metilo . [10]
Neurospora
En presencia de luz, White Collar-1 (WC-1) y White Collar-2 (WC-2) se dimerizan a través de la mediación de los dominios PAS, lo que activa la traducción de FRQ . [13]
Drosophila
En presencia de luz, CLK y CYC se unen a través de un dominio PAS, lo que activa la traducción de PER, que luego se asocia a Tim a través del dominio PAS de PER. Los siguientes genes contienen dominios de unión a PAS: PER, Tim, CLK, CYC.
Arabidopsis
En los genes ZTL y NPH1 se encuentra un dominio PAS, muy similar al dominio PAS que se encuentra en la proteína asociada al ciclo circadiano WC-1 de Neurospora . [14]
Mamíferos
El reloj circadiano que se conoce actualmente en los mamíferos comienza cuando la luz activa BMAL1 y CLK para que se unan a través de sus dominios PAS. Ese complejo activador regula Per1, Per2 y Per3, que tienen dominios PAS que se utilizan para unirse a los criptocromos 1 y 2 ( familia CRY 1,2 ). Los siguientes genes de mamíferos contienen dominios de unión a PAS: Per1, Per2, Per3, Cry1, Cry2, Bmal, Clk, Pasd1.
Otras funciones del PAS en mamíferos
En los mamíferos, ambos dominios PAS desempeñan papeles importantes. El PAS A es responsable de las interacciones proteína-proteína con otras proteínas del dominio PAS, mientras que el PAS B tiene un papel más versátil. Media las interacciones con chaperoninas y otras moléculas pequeñas como la dioxina , pero los dominios PAS B en NPAS2 , un homólogo del gen clk de Drosophila, y el factor inducible por hipoxia (HIF) también ayudan a mediar la unión del ligando . [12] Además, se ha demostrado que los dominios PAS que contienen la proteína NPAS2 son un sustituto del gen Clock en ratones mutantes que carecen completamente del gen Clock. [15]
El dominio PAS también interactúa directamente con BHLH . Normalmente se encuentra en el extremo C de la proteína BHLH. Los dominios PAS que contienen proteínas BHLH forman una proteína BHLH-Pas, que normalmente se encuentra y codifica en HIF, que requiere tanto el dominio PAS como el dominio BHLH y el gen Clock. [16] [17] [18]
Dominios de sensores relacionados
Dominio GAF
| Dominio GAF | |
|---|---|
| Identificadores | |
| Símbolo | Gran Bretaña |
| Clan Pfam | CL0161 |
| ECOD | 223.1.1 |
Estos dominios de unión a cGMP se encuentran en diversas proteínas fototransductoras en eucariotas y eubacterias . Están presentes en fitocromos de plantas y cianobacterias, fosfodiesterasas estimuladas por cGMP (PDE) de vertebrados e invertebrados y algunas eubacterias no fotosintéticas. [19] [20] [21]
Dominio de caché
| Dominio de caché | |
|---|---|
| Identificadores | |
| Símbolo | Cache |
| Clan Pfam | CL0165 |
| ECOD | 223.1.1 |
Estos dominios de señalización extracelular son homólogos a los dominios PAS pero distintos. [22] Son comunes a las subunidades del canal de calcio (Ca2+) animal y ciertos receptores de quimiotaxis procariotas y desempeñan un papel en el reconocimiento de moléculas pequeñas en varias especies, lo que sugiere un mecanismo conservado de unión de ligandos. [23] A diferencia de los dominios intracelulares PAS y GAF, muestran una hélice alfa N-terminal extra larga . [22]
Otros dominios de sensores
Dominio hpt
| Dominio hpt | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | HPT-1 | ||||||||
| Pfam | PF01627 | ||||||||
| ECOD | 601.3.1 | ||||||||
| Interprofesional | IPR036641 | ||||||||
| |||||||||
También conocidos como dominios de fosfotransferencia de histidina y fosfotransferasas de histidina, estos dominios son dominios proteicos involucrados en la forma de "relé de fósforo" de los sistemas reguladores de dos componentes . [20]
Dominio HAMP
| HAMP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| Símbolo | HAMP | ||||||||
| Pfam | PF00672 | ||||||||
| Clan Pfam | CL0681 | ||||||||
| ECOD | 4168.1.1 | ||||||||
| Interprofesional | IPR003660 | ||||||||
| |||||||||
El dominio HAMP (presente en las histidina quinasas , adenilato ciclasas , proteínas aceptoras de metilo y fosfatasas ) [24] es una región alfa-helicoidal de aproximadamente 50 aminoácidos que forma una espiral enrollada de cuatro hélices dimérica . [25]
Referencias
- ^ PDB : 1y28 ; Dunham CM, Dioum EM, Tuckerman JR, Gonzalez G, Scott WG, Gilles-Gonzalez MA (julio de 2003). "Una arginina distal en los dominios hemo-PAS sensibles al oxígeno es esencial para la unión del ligando, la transducción de señales y la estructura". Bioquímica . 42 (25): 7701–8. doi :10.1021/bi0343370. PMID 12820879. S2CID 14090693.
- ^ Henry JT, Crosson S (1 de enero de 2011). "Dominios PAS de unión a ligando en un contexto genómico, celular y estructural". Revisión anual de microbiología . 65 : 261–286. doi :10.1146/annurev-micro-121809-151631. PMC 3298442 . PMID 21663441.
- ^ Liu YC, Machuca MA, Beckham SA, Gunzburg MJ, Roujeinikova A (octubre de 2015). "Base estructural para el reconocimiento de aminoácidos y la señalización transmembrana por dominios sensoriales de quimiorreceptores Per-Arnt-Sim (PAS en tándem)". Acta Crystallographica. Sección D, Cristalografía biológica . 71 (Pt 10): 2127–2136. Bibcode :2015AcCrD..71.2127L. doi :10.1107/S139900471501384X. PMID 26457436.
- ^ Möglich A, Ayers RA, Moffat K (octubre de 2009). "Estructura y mecanismo de señalización de los dominios Per-ARNT-Sim". Structure . 17 (10): 1282–1294. doi :10.1016/j.str.2009.08.011. PMC 3092527 . PMID 19836329.
- ^ ab Hennig S, Strauss HM, Vanselow K, Yildiz O, Schulze S, Arens J, et al. (abril de 2009). "Análisis estructurales y funcionales de las interacciones del dominio PAS de las proteínas del reloj PERIOD de Drosophila y PERIOD2 de ratón". PLOS Biology . 7 (4): e94. doi : 10.1371/journal.pbio.1000094 . PMC 2671562 . PMID 19402751.
- ^ Ponting CP, Aravind L (noviembre de 1997). "PAS: una familia de dominios multifuncionales sale a la luz". Current Biology . 7 (11): R674–R677. doi : 10.1016/S0960-9822(06)00352-6 . PMID 9382818. S2CID 14105830.
- ^ Hefti MH, Françoijs KJ, de Vries SC, Dixon R, Vervoort J (marzo de 2004). "El pliegue PAS. Una redefinición del dominio PAS basada en la predicción estructural". Revista Europea de Bioquímica . 271 (6): 1198–1208. doi : 10.1111/j.1432-1033.2004.04023.x . PMID 15009198.
- ^ Möglich A, Ayers RA, Moffat K (octubre de 2009). "Estructura y mecanismo de señalización de los dominios Per-ARNT-Sim". Structure . 17 (10): 1282–1294. doi :10.1016/j.str.2009.08.011. PMC 3092527 . PMID 19836329.
- ^ Rosato E, Tauber E, Kyriacou CP (junio de 2006). "Genética molecular del reloj circadiano de la mosca de la fruta". Revista Europea de Genética Humana . 14 (6): 729–738. doi : 10.1038/sj.ejhg.5201547 . PMID 16721409.
- ^ abcd Henry JT, Crosson S (1 de enero de 2011). "Dominios PAS de unión a ligando en un contexto genómico, celular y estructural". Revisión anual de microbiología . 65 : 261–286. doi :10.1146/annurev-micro-121809-151631. PMC 3298442 . PMID 21663441.
- ^ Möglich A, Ayers RA, Moffat K (octubre de 2009). "Estructura y mecanismo de señalización de los dominios Per-ARNT-Sim". Structure . 17 (10): 1282–1294. doi :10.1016/j.str.2009.08.011. PMC 3092527 . PMID 19836329.
- ^ ab McIntosh BE, Hogenesch JB, Bradfield CA (2010). "Proteínas Per-Arnt-Sim de mamíferos en la adaptación ambiental". Revisión anual de fisiología . 72 : 625–645. doi :10.1146/annurev-physiol-021909-135922. PMID 20148691.
- ^ Harmer SL, Panda S, Kay SA (28 de noviembre de 2003). "Bases moleculares de los ritmos circadianos". Revisión anual de biología celular y del desarrollo . 17 : 215–253. doi :10.1146/annurev.cellbio.17.1.215. PMID 11687489.
- ^ Somers DE, Schultz TF, Milnamow M, Kay SA (abril de 2000). "ZEITLUPE codifica una nueva proteína PAS asociada al reloj de Arabidopsis". Cell . 101 (3): 319–329. doi : 10.1016/S0092-8674(00)80841-7 . PMID 10847686. S2CID 3013788.
- ^ Debruyne JP, Noton E, Lambert CM, Maywood ES, Weaver DR, Reppert SM (mayo de 2006). "Un shock de reloj: el RELOJ del ratón no es necesario para la función del oscilador circadiano". Neuron . 50 (3): 465–477. doi : 10.1016/j.neuron.2006.03.041 . PMID 16675400. S2CID 19028601.
- ^ Jones S (1 de enero de 2004). "Una descripción general de las proteínas básicas de hélice-bucle-hélice". Genome Biology . 5 (6): 226. doi : 10.1186/gb-2004-5-6-226 . PMC 463060 . PMID 15186484.
- ^ Ke Q, Costa M (noviembre de 2006). "Factor inducible por hipoxia 1 (HIF-1)". Farmacología molecular . 70 (5): 1469–1480. doi :10.1124/mol.106.027029. PMID 16887934. S2CID 2522614.
- ^ Wang GL, Jiang BH, Rue EA, Semenza GL (junio de 1995). "El factor 1 inducible por hipoxia es un heterodímero PAS de hélice básica-bucle-hélice regulado por la tensión celular de O2". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 92 (12): 5510–5514. Bibcode :1995PNAS...92.5510W. doi : 10.1073/pnas.92.12.5510 . PMC 41725 . PMID 7539918.
- ^ Ho YS, Burden LM, Hurley JH (octubre de 2000). "Estructura del dominio GAF, un motivo de señalización ubicuo y una nueva clase de receptor de GMP cíclico". The EMBO Journal . 19 (20): 5288–5299. doi :10.1093/emboj/19.20.5288. PMC 314001 . PMID 11032796.
- ^ ab Galperin MY, Nikolskaya AN, Koonin EV (septiembre de 2001). "Nuevos dominios de los sistemas de transducción de señales de dos componentes procariotas". FEMS Microbiology Letters . 203 (1): 11–21. doi :10.1016/S0378-1097(01)00326-3. PMID 11557134.
- ^ Aravind L, Ponting CP (diciembre de 1997). "El dominio GAF: un vínculo evolutivo entre diversas proteínas fototransductoras". Tendencias en ciencias bioquímicas . 22 (12): 458–459. doi :10.1016/s0968-0004(97)01148-1. PMID 9433123.
- ^ ab Upadhyay AA, Fleetwood AD, Adebali O, Finn RD, Zhulin IB (abril de 2016). "Los dominios de caché que son homólogos, pero diferentes de los dominios PAS comprenden la superfamilia más grande de sensores extracelulares en procariotas". PLOS Computational Biology . 12 (4): e1004862. doi : 10.1371/journal.pcbi.1004862 . PMC 4822843 . PMID 27049771.
- ^ Anantharaman V, Aravind L (noviembre de 2000). "Cache: un dominio de señalización común a las subunidades de los canales de Ca(2+) animales y una clase de receptores de quimiotaxis procariotas". Tendencias en ciencias bioquímicas . 25 (11): 535–537. doi :10.1016/S0968-0004(00)01672-8. PMID 11084361.
- ^ Aravind L, Ponting CP (julio de 1999). "El dominio de enlace helicoidal citoplasmático de la histidina quinasa del receptor y las proteínas aceptoras de metilo es común a muchas proteínas de señalización procariotas". FEMS Microbiology Letters . 176 (1): 111–6. doi : 10.1016/s0378-1097(99)00197-4 . PMID 10418137.
- ^ Hulko M, Berndt F, Gruber M, Linder JU, Truffault V, Schultz A, et al. (septiembre de 2006). "La estructura del dominio HAMP implica rotación de hélice en la señalización transmembrana". Cell . 126 (5): 929–40. doi : 10.1016/j.cell.2006.06.058 . PMID 16959572. S2CID 18396561.