Dominio C2
| Dominio C2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
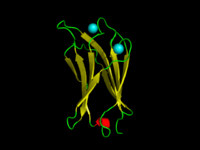 Dominio C2 de la toxina α de C. absonum (PDB 1OLP). Las cadenas β se muestran en amarillo, las hélices α en rojo y los bucles en verde. Los iones de calcio coordinados están en cian. | |||||||||
| Identificadores | |||||||||
| Símbolo | C2 | ||||||||
| Pfam | PF00168 | ||||||||
| Clan Pfam | CL0154 | ||||||||
| ECOD | 11.2.1 | ||||||||
| Interprofesional | IPR000008 | ||||||||
| ELEGANTE | C2 | ||||||||
| PROSITIO | PDOC00380 | ||||||||
| SCOP2 | 1qas / ALCANCE / SUPFAM | ||||||||
| Superfamilia OPM | 45 | ||||||||
| Proteína OPM | 1ugk | ||||||||
| Diligenciamiento de conflictos | cd00030 | ||||||||
| |||||||||
| Fosfoinosítido 3-quinasa C2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Estructura de la fosfoinosítido 3-quinasa. [1] | |||||||||||
| Identificadores | |||||||||||
| Símbolo | PI3K_C2 | ||||||||||
| Pfam | PF00792 | ||||||||||
| Clan Pfam | CL0154 | ||||||||||
| ECOD | 11.2.1 | ||||||||||
| Interprofesional | IPR002420 | ||||||||||
| ELEGANTE | PI3K_C2 | ||||||||||
| PROSITIO | PDOC50004 | ||||||||||
| SCOP2 | 1e8x / ALCANCE / SUPFAM | ||||||||||
| Diligenciamiento de conflictos | cd08380 | ||||||||||
| |||||||||||
Un dominio C2 es un dominio estructural de proteínas que participa en la orientación de las proteínas hacia las membranas celulares . La versión típica (PKC-C2) tiene un sándwich beta compuesto por 8 cadenas β que coordina dos o tres iones de calcio , que se unen en una cavidad formada por los bucles primero y último del dominio, en la cara de unión a la membrana. Muchas otras familias de dominios C2 no tienen actividad de unión al calcio. [2] [3]
Acoplamiento con otros dominios
Los dominios C2 se encuentran frecuentemente acoplados a dominios enzimáticos ; por ejemplo, el dominio C2 en PTEN , pone al dominio fosfatasa en contacto con la membrana plasmática, donde puede desfosforilar su sustrato, fosfatidilinositol (3,4,5)-trisfosfato (PIP 3 ) , sin eliminarlo de la membrana, lo que sería energéticamente muy costoso. PTEN consta de dos dominios, un dominio de proteína tirosina fosfatasa y un dominio C2. Este par de dominios constituye un superdominio, una unidad hereditaria que se encuentra en varias proteínas en hongos, plantas y animales. [4] Además, la fosfatidilinositol 3-quinasa (PI3-quinasa), una enzima que fosforila fosfoinosítidos en el grupo 3-hidroxilo del anillo de inositol , también utiliza un dominio C2 para unirse a la membrana (por ejemplo, entrada PDB 1e8w).
Evolución
El dominio C2 actualmente solo se conoce en eucariotas y en el procariota Clostridium perfringens , donde forma parte de la toxina alfa . [5] Se han identificado más de 17 clados distintos de dominios C2. [2] [3] La mayoría de las familias C2 se remontan a especies eucariotas basales , lo que indica una diversificación temprana antes del último ancestro común eucariota (LECA). Solo la familia de dominios PKC-C2 contiene residuos de unión al calcio conservados, lo que sugiere que la interacción de membrana dependiente del calcio típica es una característica derivada limitada en los dominios PKC-C2. [2]
Selectividad de calcio y lípidos
Los dominios C2 son únicos entre los dominios de orientación de membrana en el sentido de que muestran un amplio rango de selectividad lipídica para los principales componentes de las membranas celulares, incluyendo la fosfatidilserina y la fosfatidilcolina. Este dominio C2 tiene alrededor de 116 residuos de aminoácidos y está ubicado entre las dos copias del dominio C1 en la proteína quinasa C (que se une a los ésteres de forbol y diacilglicerol) (ver PDOC00379) y el dominio catalítico de la proteína quinasa (ver PDOC00100). Se han encontrado regiones con homología significativa [6] con el dominio C2 en muchas proteínas. Se cree que el dominio C2 está involucrado en la unión de fosfolípidos dependiente de calcio [7] y en procesos de orientación de membrana como la localización subcelular. Aunque la mayoría de los dominios C2 interactúan con la membrana (fosfolípidos) de una manera dependiente de Ca 2+ , algunos dominios C2 pueden interactuar con la membrana sin unirse a Ca 2+ . De manera similar, los dominios C2 han evolucionado para tener diferentes especificidades para los lípidos. Muchos dominios C2, como el C2A de la sinaptotagmina , se unen a fosfolípidos aniónicos (fosfolípidos que contienen PS o PIP2). Sin embargo, otros dominios C2, como el dominio C2 de cPLA2-α, se unen a lípidos zwitteriónicos (por ejemplo, PC). Esta diversidad y selectividad en la unión de Ca 2+ y lípidos sugiere que los dominios C2 han evolucionado para tener diferentes funciones. [8]
Estructura 3D
El dominio forma un sándwich beta de ocho cadenas construido alrededor de un motivo conservado de cuatro cadenas, denominado clave C2. [9] El calcio se une en una depresión en forma de copa formada por los bucles N- y C-terminales del motivo clave C2. Los análisis estructurales de varios dominios C2 han demostrado que consisten en estructuras ternarias similares en las que tres bucles de unión de Ca 2+ se encuentran al final de un sándwich beta antiparalelo de ocho cadenas.
Proteínas humanas que contienen el dominio C2
ABR; BAIAP3 ; BCR ; C2CD2; C2CD3; CADPS ; CADPS2 ; CAPN5 ; CAPN6 ; CC2D1A ; CC2D1B; CPNE1 ; CPNE2; CPNE3; CPNE4 ; CPNE5; CPNE6 ; CPNE7 ; CPNE8 ; CPNE9; DAB2IP ; DOC2A ; DOC2B ; DYSF ; ESYT1 ; ESYT3; FAM62A ; FAM62B ; FAM62C; FER1L3 ; FER1L5; HECW1 ; HECW2 ; ITCH ; ITSN1 ; ITSN2 ; MCTP1; MCTP2; MTAC2D1; NEDD4 ; NEDD4L ; NEDL1; OTOF ; PCLO ; PIK3C2A ; PIK3C2B ; PIK3C2G ; PLA2G4A ; PLA2G4B ; PLA2G4D; PLA2G4E; PLA2G4F; PLCB1 ; PLCB2 ; PLCB3; PLCB4; PLCD1 ; PLCD3; PLCD4 ; PLCE1 ; PLCG1 ; PLCG2 ; PLCH1 ; PLCH2 ; PLCL1 ; PLCL2; PLCZ1; PRF1 ; PRKCA ; PRKCB1 ; PRKCE ; PRKCG ; PRKCH ; RAB11FIP1 ; RAB11FIP2 ; RAB11FIP5 ; RASA1 ; RASA2; RASA3 ; RASA4 ; RASAL1; RASAL2 ; RGS3 ; RIMS1 ; RIMS2 ; RIMS3; RIMS4; RPGRIP1 ; RPGRIP1L ; RPH3A ; SGA72M; SMURF1 ; SMURF2 ; SYNGAP1 ; SYT1 ; SYT10; SYT11 ; SYT12; SYT13 ; SYT14 ; SYT14L; SYT15; SYT16; SYT17; SYT2 ; SYT3; SYT4 ; SYT5 ; SYT6 ; SYT7 ; SYT8; SYT9 ; SYTL1 ; SYTL2 ; SYTL3 ; SYTL4 ; SYTL5; TOLLIP ; UNC13A ; UNC13B ; UNC13C ; UNC13D ; WWC2 ; WWP1 ; WWP2 ; PTEN
Referencias
- ^ Walker EH, Pacold ME, Perisic O, Stephens L, Hawkins PT, Wymann MP, Williams RL (octubre de 2000). "Determinantes estructurales de la inhibición de la fosfoinosítido 3-quinasa por wortmanina, LY294002, quercetina, miricetina y estaurosporina". Molecular Cell . 6 (4): 909–19. doi : 10.1016/S1097-2765(05)00089-4 . PMID 11090628.
- ^ abc Zhang D, Aravind L (diciembre de 2010). "La identificación de nuevas familias y la clasificación de la superfamilia del dominio C2 aclaran el origen y la evolución de las actividades de orientación a la membrana en eucariotas". Gene . 469 (1–2): 18–30. doi :10.1016/j.gene.2010.08.006. PMC 2965036 . PMID 20713135.
- ^ ab Zhang D, Aravind L (octubre de 2012). "Nuevas peptidasas similares a transglutaminasa y dominios C2 aclaran la estructura, la biogénesis y la evolución del compartimento ciliar". Cell Cycle . 11 (20): 3861–75. doi :10.4161/cc.22068. PMC 3495828 . PMID 22983010.
- ^ Haynie DT, Xue B (mayo de 2015). "Superdominios en la jerarquía de la estructura de proteínas: el caso de PTP-C2". Protein Science . 24 (5): 874–82. doi :10.1002/pro.2664. PMC 4420535 . PMID 25694109.
- ^ Naylor, Claire E.; Eaton, Julian T.; Howells, Angela; Justin, Neil; Moss, David S.; Titball, Richard W.; Basak, Ajit K. (agosto de 1998). "Estructura de la toxina clave en la gangrena gaseosa". Nature Structural & Molecular Biology . 5 (8): 738–746. doi :10.1038/1447. ISSN 1545-9993. PMID 9699639. S2CID 21000585.
- ^ Brose N, Hofmann K, Hata Y, Südhof TC (octubre de 1995). "Los homólogos en mamíferos del gen unc-13 de Caenorhabditis elegans definen una nueva familia de proteínas con dominio C2". The Journal of Biological Chemistry . 270 (42): 25273–80. doi : 10.1074/jbc.270.42.25273 . PMID 7559667.
- ^ Davletov BA, Südhof TC (diciembre de 1993). "Un único dominio C2 de la sinaptotagmina I es suficiente para la unión de alta afinidad Ca2+/fosfolípido". The Journal of Biological Chemistry . 268 (35): 26386–90. doi : 10.1016/S0021-9258(19)74326-9 . PMID 8253763.
- ^ Nalefski EA, Wisner MA, Chen JZ, Sprang SR, Fukuda M, Mikoshiba K, Falke JJ (marzo de 2001). "Los dominios C2 de diferentes vías de señalización de Ca2+ muestran diversidad funcional y mecanística". Bioquímica . 40 (10): 3089–100. doi :10.1021/bi001968a. PMC 3862187 . PMID 11258923.
- ^ Sutton RB, Davletov BA, Berghuis AM, Südhof TC, Sprang SR (marzo de 1995). "Estructura del primer dominio C2 de la sinaptotagmina I: un nuevo pliegue de unión Ca2+/fosfolípido". Cell . 80 (6): 929–38. doi : 10.1016/0092-8674(95)90296-1 . PMID 7697723. S2CID 18981505.
Enlaces externos
- Familia de la fosfoinosítido 3-quinasa C2 en Pfam
- Orientación de proteínas en membranas de la Universidad de Michigan (UMich) familias/superfamilia-47 - Orientaciones de dominios C2 en membranas (OPM)