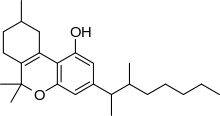
Dimetilheptilpirano
 | |
| Datos clínicos | |
|---|---|
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Vida media de eliminación | 20–39 horas |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
| Fórmula | C25H38O2 |
| Masa molar | 370,577 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
El dimetilheptilpirano ( DMHP , 3-(1,2-dimetilheptil)-Δ 6a(10a) -THC , 1,2-dimetilheptil-Δ 3 -THC , A-40824 o EA-2233 ) es un análogo sintético del THC , que se inventó en 1949 durante los intentos de dilucidar la estructura del Δ 9 -THC, uno de los componentes activos del cannabis . [2] El DMHP es un aceite viscoso de color amarillo pálido que es insoluble en agua pero se disuelve en alcohol o disolventes no polares.
Efectos
El DMHP es similar en estructura al THC, diferenciándose solo en la posición de un doble enlace y en la sustitución de la cadena 3-pentilo por una cadena 3-(1,2-dimetilheptilo). [3] Produce una actividad similar al THC, como efectos sedantes , pero es considerablemente más potente, [4] especialmente teniendo efectos analgésicos y anticonvulsivos mucho más fuertes que el THC, aunque comparativamente efectos psicológicos más débiles. Se cree que actúa como un agonista CB 1 , de manera similar a otros derivados de cannabinoides . [5] [6] Si bien el DMHP en sí ha sido objeto de relativamente pocos estudios desde la caracterización de los receptores de cannabinoides, se ha demostrado que el isómero estructural 1,2-dimetilheptil-Δ 8 -THC es un agonista cannabinoide altamente potente, y la actividad de sus enantiómeros se ha estudiado por separado. [7]
Investigación como agente incapacitante no letal
El DMHP y su éster O - acetato fueron ampliamente investigados por el programa de armas químicas militares de EE. UU. en los experimentos del Arsenal Edgewood , como posibles agentes incapacitantes no letales. [8]
El DMHP tiene tres estereocentros y, en consecuencia, tiene ocho estereoisómeros posibles , que difieren considerablemente en potencia. La mezcla de los ocho isómeros del éster O -acetilo recibió el código EA-2233, y los ocho isómeros individuales se numeraron EA-2233-1 a EA-2233-8. El isómero más potente es EA-2233-2, con un rango de dosis activa en humanos de 0,5 a 2,8 μg/kg (es decir, ~35 a 200 μg para un adulto de 70 kg). Las dosis activas variaron notablemente entre individuos, pero cuando la dosis de EA-2233 se elevó a 1-2 mg, todos los voluntarios fueron considerados incapaces de realizar tareas militares, y los efectos duraron hasta 2-3 días.
El DMHP se metaboliza de manera similar al THC, produciendo el metabolito activo 11-hidroxi-DMHP, pero la lipofilicidad del DMHP es incluso mayor que la del propio THC, lo que le confiere una larga duración de acción y una vida media extendida en el cuerpo de entre 20 y 39 horas, siendo la vida media del metabolito 11-hidroxi-DMHP superior a 48 horas.
El DMHP y sus ésteres producen sedación y efectos alucinógenos leves similares a las dosis elevadas de THC . Sin embargo, también causan hipotensión pronunciada (presión arterial baja), que se presenta en dosis muy inferiores a la dosis alucinógena, lo que puede provocar mareos intensos , desmayos , ataxia y debilidad muscular , suficientes para dificultar mantenerse en pie o realizar cualquier tipo de actividad física vigorosa. [9]
Se ha demostrado que la toxicidad aguda del DMHP es baja en estudios realizados en animales y en humanos, y que el índice terapéutico medido como la relación entre la DE50 y la LD50 en animales es de alrededor de 2000 veces. No se han registrado muertes causadas por ninguno de los estereoisómeros 1 a 8 del DMHP EA-2233, solo síntomas que son totalmente consistentes con los niveles más altos conocidos de intoxicación por THC. [ 9] El DMHP tiene una LD50 intravenosa de 63 mg/kg en ratones y una dosis letal mínima intravenosa de 10 mg/kg en perros. [10]
No apto para aplicaciones militares
La combinación de fuertes efectos incapacitantes y un margen de seguridad favorable llevó al equipo de Edgewood Arsenal a concluir que el DMHP y sus derivados, especialmente el éster O-acetílico del isómero más activo, EA-2233-2, estaban entre los agentes incapacitantes no letales más prometedores surgidos de su programa de investigación.
Sin embargo, el DMHP tenía la desventaja de producir a veces hipotensión severa en dosis pre-incapacitantes, lo que no ocurrió con los agentes anticolinérgicos belladonnoides más ampliamente estudiados y publicitados , como el 3-quinuclidinil bencilato (BZ), que fue descubierto y posteriormente convertido en arma. [11] Las aplicaciones militares del cannabis sintético fueron limitadas porque la droga era ilegal y políticamente tóxica para estudiar mediante la administración de laboratorio a los militares alistados. Tanto el EA-2233-2 como el predecesor destilado de THC de aceite rojo (llamado EA-1476) recibieron un presupuesto y recursos limitados en comparación con el estudio de otros agentes incapacitantes de derivados de BZ y EA 1729 ( LSD ) (que se creía ampliamente en ese momento que era un suero de la verdad y control mental viable útil en una variedad de aplicaciones de la Guerra Fría). [9] Inicialmente, los 8 estereoisómeros del EA-2233 no se podían separar; Más tarde, se aislaron y probaron dos de los isómeros individuales del EA 2233, pero se descubrió que causaban hipotensión ortostática y efectos mínimos en el rendimiento en las dosis muy bajas utilizadas. El EA 2233 no parecía tener suficiente potencia para ser de interés militar, ya que una dosis oral de 60 mcg/kg causó una disminución máxima de solo el 40% (como máximo) en el rendimiento en tareas de procesamiento de números y lenguaje. Más tarde se publicó un estudio [ cita requerida ] que mostró que los efectos orales del THC ordinario eran solo alrededor de un tercio de los del THC fumado como marihuana. El estudio sugiere que la eficacia del EA 2233 en aerosol podría ser mucho mayor que por vía oral, pero esto nunca se ha verificado de forma independiente utilizando DMHP EA 2233. El EA 2233 nunca se ha utilizado fuera del Edgewood Arsenal, donde no causó ninguna muerte en voluntarios sanos del ejército, pero se ha teorizado que supone un riesgo para personas muy jóvenes o muy mayores, o que posiblemente cause pérdida de habilidades motoras en personas con hipotensión preexistente. En todos los casos, se informó que después de 72 horas, los sujetos no mostraron efectos residuales detectables, flashbacks, etc.
Arsenal de Edgewood y EA 2233
El presupuesto y la planificación fiscal del Edgewood Arsenal (establecido en 1948) lo consideraron principalmente como una instalación de investigación defensiva. El ejército estadounidense, en ese momento, sabía que la URSS estaba gastando 10 veces más que los EE. UU. en el desarrollo de armas químicas. Edgewood inicialmente disfrutó de un mandato [ aclaración necesaria ] y falta de supervisión. El Cuerpo Químico del Arsenal de Edgewood tenía la tarea de garantizar que Estados Unidos estuviera preparado con contratácticas adecuadas en caso de ser necesario y que pudiera montar su propio ataque psicoquímico de represalia contra la URSS en caso necesario. Edgewood realizó análisis y presentó datos a los comandantes militares que luego podían optar por incorporarlos a su estrategia. En la práctica, sin embargo, fue principalmente para informar a los estrategas sobre armas y tácticas especiales que el enemigo podría implementar en su lugar.
El Laboratorio Edgewood fue fundado originalmente en 1948. El destilado cannabinoide original (el precursor del EA 2233, llamado EA-1476 o "aceite rojo"), conocido hoy como THC Delta-9 , fue creado por primera vez en 1949, y el estudio de laboratorio del EA-1476 ocurrió a mediados de la década de 1950. Un solo lote de EA 2233 fue preparado por el químico Harry Pars de AD Little Labs en 1962 bajo un contrato gubernamental de alto secreto. Fue administrado a grupos de militares alistados que consintieron e informaron [ cita requerida ] en 1962. El laboratorio Edgewood fue cerrado en 1975. Faltaba financiación gubernamental para el desarrollo militar continuo del cannabis sintético y el programa de investigación de cannabinoides fue suspendido indefinidamente junto con el resto de los experimentos del Arsenal Edgewood a fines de la década de 1970 por una variedad de razones. Hubo una creciente desconfianza pública hacia los militares y el gobierno, y había pocas razones para seguir desarrollando agentes químicos incapacitantes durante y después de la era de Vietnam. [9]
Varios periódicos criticaron los experimentos con EA 2233. Desde la década de 1930, el cannabis y los cannabinoides habían sido considerados constantemente por el público como drogas peligrosas y adictivas. El DMHP fue comparado con BZ, una sustancia química no relacionada con el cannabis que se consideró inútil entre los planificadores militares y que solo se probó una vez en una operación organizada a toda prisa llamada "Proyecto Dork" (parte del Proyecto 112 ). [12]
Isomería

| 7 isómeros de doble enlace del dimetilheptilpirano y sus 120 estereoisómeros | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Numeración de dibenzopiranos | Numeración de monoterpenoides | Centros quirales adicionales en la cadena lateral | Número de estereoisómeros | Ocurrencia natural | Lista del Convenio sobre Sustancias Sicotrópicas | ||||
| Nombre corto | Centros quirales en la estructura principal del dibenzopirano | Nombre completo | Nombre corto | Centros quirales en la estructura principal del dibenzopirano | Numeración de 1,2-dimetilheptilo | Numeración de 3-metiloctan-2-ilo | |||
| Δ6a (7) -DMHP | 9 y 10a | 3-(1,2-dimetilheptil)-8,9,10,10a-tetrahidro-6,6,9-trimetil-6 H -dibenzo[ b , d ]piran-1-ol | Δ4 - DMHP | 1 y 3 | 1 y 2 | 2 y 3 | 16 | No | no programado |
| Δ7 - DMHP | 6a, 9 y 10a | 3-(1,2-dimetilheptil)-6a,9,10,10a-tetrahidro-6,6,9-trimetil-6H - dibenzo[ b , d ]piran-1-ol | Δ5 - DMHP | 1, 3 y 4 | 1 y 2 | 2 y 3 | 32 | No | no programado |
| Δ8 - DMHP | 6a y 10a | 3-(1,2-dimetilheptil)-6a,7,10,10a-tetrahidro-6,6,9-trimetil-6H - dibenzo[ b , d ]piran-1-ol | Δ6 - DMHP | 3 y 4 | 1 y 2 | 2 y 3 | 16 | No | no programado |
| Δ9,11 - DMHP | 6a y 10a | 3-(1,2-dimetilheptil)-6a,7,8,9,10,10a-hexahidro-6,6-dimetil-9-metileno-6H - dibenzo[ b , d ]piran-1-ol | Δ 1(7) -DMHP | 3 y 4 | 1 y 2 | 2 y 3 | 16 | No | no programado |
| Δ9 - DMHP | 6a y 10a | 3-(1,2-dimetilheptil)-6a,7,8,10a-tetrahidro-6,6,9-trimetil-6H - dibenzo[ b , d ]piran-1-ol | Δ1 - DMHP | 3 y 4 | 1 y 2 | 2 y 3 | 16 | No | no programado |
| Δ10 - DMHP | 6a y 9 | 3-(1,2-dimetilheptil)-6a,7,8,9-tetrahidro-6,6,9-trimetil-6H - dibenzo[ b , d ]piran-1-ol | Δ2 - DMHP | 1 y 4 | 1 y 2 | 2 y 3 | 16 | No | no programado |
| Δ6a (10a) -DMHP | 9 | 3-(1,2-dimetilheptil)-7,8,9,10-tetrahidro-6,6,9-trimetil-6 H -dibenzo[ b , d ]piran-1-ol | Δ3 - DMHP | 1 | 1 y 2 | 2 y 3 | 8 | No | Anexo I |
Téngase en cuenta que 6 H -dibenzo[ b , d ]piran-1-ol es lo mismo que 6 H -benzo[ c ]cromen-1-ol.
Véase también
- Tinabinol
- Nabitán
- Menabitano
- A-40174
- A-41988
- Δ-3-tetrahidrocannabinol
- Tetrahidrocannabinol
- Tetrahidrocannabiforol
- THCP-O-acetato
- Cannabinoides sintéticos
- Efectos del cannabis
Referencias
- ^ Anvisa (24 de julio de 2023). "RDC Nº 804 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial" [Resolución del Consejo Colegiado N° 804 - Listas de Sustancias Estupefacientes, Psicotrópicas, Precursoras y Otras Sustancias Bajo Control Especial] (en portugués brasileño). Diario Oficial da União (publicado el 25 de julio de 2023). Archivado desde el original el 27 de agosto de 2023 . Consultado el 27 de agosto de 2023 .
- ^ Adams R, Harfenist M, Loewe S (1949). "Nuevos análogos del tetrahidrocannabinol. XIX". Revista de la Sociedad Química Americana . 71 (5): 1624–1628. doi :10.1021/ja01173a023.
- ^ Razdan RK (1980). "La síntesis total de cannabinoides". Síntesis total de productos naturales . Vol. 4. Wiley-Interscience. págs. 185-262. doi :10.1002/9780470129678.ch2. ISBN . 978-0-471-05460-3.
- ^ Wilkison DM, Pontzer N, Hosko MJ (julio de 1982). "Reducción de la actividad somatosensorial cortical provocada por delta 9-tetrahidrocannabinol y dimetilheptilpirano en gatos anestesiados con alfa-cloralosa". Neurofarmacología . 21 (7): 705–9. doi :10.1016/0028-3908(82)90014-4. PMID 6289158. S2CID 35663464.
- ^ Winn M, Arendsen D, Dodge P, Dren A, Dunnigan D, Hallas R, Hwang K, Kyncl J, Lee YH, Plotnikoff N, Young P, Zaugg H (abril de 1976). "Fármacos derivados de cannabinoides. 5. delta6a,10a-tetrahidrocannabinol y análogos heterocíclicos que contienen cadenas laterales aromáticas". Journal of Medicinal Chemistry . 19 (4): 461–71. doi :10.1021/jm00226a003. PMID 817021.
- ^ Parker LA, Mechoulam R (2003). "Los agonistas y antagonistas de los cannabinoides modulan la apertura condicionada de la boca inducida por litio en ratas". Integrative Physiological and Behavioral Science . 38 (2): 133–45. doi :10.1007/BF02688831. PMID 14527182. S2CID 38974868.
- ^ Huffman JW, Duncan Jr SG, Wiley JL, Martin BR (1997). "Síntesis y farmacología de los isómeros 1',2'-dimetilheptil-Δ8-THC: cannabinoides excepcionalmente potentes". Bioorganic & Medicinal Chemistry Letters . 7 (21): 2799–2804. doi :10.1016/S0960-894X(97)10086-5.
- ^ "Posibles efectos a largo plazo sobre la salud de la exposición a corto plazo a agentes químicos". Reactivadores de la colinesterasa, sustancias psicoquímicas e irritantes y vesicantes . Vol. 2. Comisión de Ciencias de la Vida. The National Academies Press. 1984. págs. 79-99. doi :10.17226/9136. ISBN. 978-0-309-07772-9.
- ^ abcd Ketchum JS (2006). "Capítulo 5". Guerra química: secretos casi olvidados . Santa Rosa, CA: ChemBooks Inc. p. 38. ISBN 978-1-4243-0080-8.
- ^ Posibles efectos a largo plazo sobre la salud de la exposición a corto plazo a agentes químicos, volumen 2. 1984. doi :10.17226/9136. ISBN 978-0-309-07772-9.
- ^ Ketchum JS (2006). Secretos de la guerra química casi olvidados . ChemBooks Inc. ISBN 978-1-4243-0080-8.
- ^ Khatchadourian R (12 de diciembre de 2012). "Guerra de la mente". The New Yorker . Consultado el 8 de mayo de 2021 .