Diastereómero
This article needs additional citations for verification. (September 2021) |
| Diastereómeros que también son epímeros | |
|---|---|
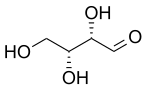 | 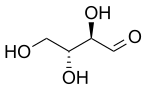 |
 |  |
| D -treosa | D -eritrosa |
En estereoquímica , los diastereómeros (a veces llamados diastereoisómeros ) son un tipo de estereoisómero . [1] Los diastereómeros se definen como estereoisómeros no idénticos y no imagen especular. Por lo tanto, se producen cuando dos o más estereoisómeros de un compuesto tienen diferentes configuraciones en uno o más (pero no todos) de los estereocentros equivalentes (relacionados) y no son imágenes especulares entre sí. [2] Cuando dos diastereoisómeros difieren entre sí en un solo estereocentro, son epímeros . Cada estereocentro da lugar a dos configuraciones diferentes y, por lo tanto, generalmente aumenta el número de estereoisómeros en un factor de dos.
Los diastereómeros se diferencian de los enantiómeros en que estos últimos son pares de estereoisómeros que difieren en todos los estereocentros y, por lo tanto, son imágenes especulares entre sí. [3] Los enantiómeros de un compuesto con más de un estereocentro también son diastereómeros de los otros estereoisómeros de ese compuesto que no son su imagen especular (es decir, excluyendo el enantiómero opuesto). Los diastereómeros tienen diferentes propiedades físicas (a diferencia de la mayoría de los aspectos de los enantiómeros) y, a menudo, diferente reactividad química .
Los diastereómeros difieren no solo en sus propiedades físicas, sino también en su reactividad química (cómo reacciona un compuesto con otros). La glucosa y la galactosa , por ejemplo, son diastereómeros. Aunque comparten el mismo peso molar, la glucosa es más estable que la galactosa. Esta diferencia de estabilidad hace que la galactosa se absorba ligeramente más rápido que la glucosa en el cuerpo humano. [4] [5]
La diastereoselectividad es la preferencia por la formación de uno o más diastereómeros sobre otros en una reacción orgánica . En general, la estereoselectividad se atribuye a interacciones torsionales y estéricas en el estereocentro resultantes de los electrófilos que se acercan al estereocentro en la reacción. [6]
Sin / anti
Cuando el enlace simple entre los dos centros es libre de rotar, los descriptores cis/trans dejan de ser válidos. Dos prefijos ampliamente aceptados que se utilizan para distinguir diastereómeros en enlaces hibridados sp³ en una molécula de cadena abierta son syn y anti . Masamune propuso los descriptores que funcionan incluso si los grupos no están unidos a átomos de carbono adyacentes. También funciona independientemente de las prioridades de CIP . Syn describe grupos en la misma cara mientras que anti describe grupos en caras opuestas. El concepto se aplica solo a la proyección en zigzag. Los descriptores solo describen la estereoquímica relativa en lugar de la estereoquímica absoluta. Todos los isómeros son iguales.
Eritro / treo
Dos prefijos más antiguos que todavía se usan comúnmente para distinguir diastereoisómeros son treo y eritro . En el caso de los sacáridos, cuando se dibuja en la proyección de Fischer, el isómero eritro tiene dos sustituyentes idénticos en el mismo lado y el isómero treo los tiene en lados opuestos. [7] Cuando se dibuja como una cadena en zigzag, el isómero eritro tiene dos sustituyentes idénticos en diferentes lados del plano (anti). Los nombres se derivan de las aldosas diastereoméricas de cuatro carbonos eritrosa y treosa . No se recomienda el uso de estos prefijos fuera del ámbito de los sacáridos porque sus definiciones pueden dar lugar a interpretaciones conflictivas. [8]
Otro compuesto treonina es uno de los aminoácidos esenciales. Su diastereómero eritro es la alotreonina .
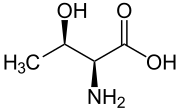  |
| L -Treonina (2 S , 3 R ) y D -Treonina (2 R , 3 S ) |
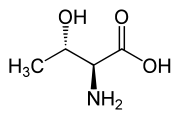  |
| L -alotreonina (2 S , 3 S ) y D - alotreonina (2 R , 3 R ) |
Estereocentros múltiples
Si una molécula contiene dos centros asimétricos, existen hasta cuatro configuraciones posibles, y no todas ellas pueden ser imágenes especulares no superponibles entre sí. Las posibilidades de diferentes isómeros continúan multiplicándose a medida que se añaden más estereocentros a una molécula. En general, el número de estereoisómeros de una molécula se puede determinar calculando 2 n , donde n = el número de centros quirales en la molécula. Esto es cierto excepto en los casos en que la molécula tiene formas meso . Estos compuestos meso son moléculas que contienen estereocentros , pero poseen un plano interno de simetría que le permite superponerse a su imagen especular. Estas configuraciones equivalentes no pueden considerarse diastereómeros. [9]
Para n = 3, hay ocho estereoisómeros. Entre ellos, hay cuatro pares de enantiómeros: R,R,R y S,S,S; R,R,S y S,S,R; R,S,S y S,R,R; y R,S,R y S,R,S. Hay muchos más pares de diastereómeros, porque cada una de estas configuraciones es un diastereómero con respecto a cualquier otra configuración excluyendo su propio enantiómero (por ejemplo, R,R,R es un diastereómero de R,R,S; R,S,R; y R,S,S). Para n = 4, hay dieciséis estereoisómeros, u ocho pares de enantiómeros. Los cuatro pares enantioméricos de aldopentosas y los ocho pares enantioméricos de aldohexosas (subconjuntos de los azúcares de cinco y seis carbonos) son ejemplos de conjuntos de compuestos que difieren de esta manera.
Diastereomerismo en un doble enlace
Los isómeros de doble enlace siempre se consideran diastereómeros, no enantiómeros. La diastereomería también puede ocurrir en un doble enlace , donde las posiciones relativas cis y trans de los sustituyentes dan dos isómeros no superponibles. Muchos isómeros conformacionales también son diastereómeros.
En el caso de diastereomerismo que ocurre en un doble enlace, se utiliza EZ , o entgegen y zusammen (en alemán), para indicar la nomenclatura de los alquenos . [10]
Aplicaciones
Como se dijo anteriormente, dos diastereoisómeros no tendrán propiedades químicas idénticas. Este conocimiento se aprovecha en la síntesis quiral para separar una mezcla de enantiómeros. Este es el principio detrás de la resolución quiral . Después de preparar los diastereoisómeros, se separan mediante cromatografía o recristalización . Observe también el ejemplo de la estereoquímica de la cetonización de enoles y enolatos .
Véase también
- Reglas de prioridad de Cahn-Ingold-Prelog para la nomenclatura.
Referencias
- ^ Diasteroisomería del "Libro de Oro" de la IUPAC doi :10.1351/goldbook.D01679
- ^ Garrett, RH; Grisham, CM (2005), Bioquímica 3.ª ed. , Belmont CA: Thomson, pág. 205, ISBN 0-534-41020-0.
- ^ Enantiómero del "Libro de Oro" de la IUPAC doi :10.1351/goldbook.E02069
- ^ McCance, Robert Alexander; Madders, Kate (1930). "Tasas comparativas de absorción de azúcares en el intestino humano". Revista bioquímica . 24 (3): 795–804. doi :10.1042/bj0240795. ISSN 0264-6021. PMC 1254520 . PMID 16744419.
- ^ Chao, Hsi-Chun; McLuckey, Scott A. (6 de octubre de 2020). "Diferenciación y cuantificación de pares diastereoméricos de glicoesfingolípidos mediante química iónica en fase gaseosa". Química analítica . 92 (19): 13387–13395. doi :10.1021/acs.analchem.0c02755. ISSN 0003-2700. PMC 7544660 . PMID 32883073.
- ^ Lavinda, Olga; Witt, Collin H.; Woerpel, KA (28 de marzo de 2022). "Origen de la alta diastereoselectividad en reacciones de enolatos de anillo de siete miembros". Angewandte Chemie International Edition en inglés . 61 (14): e202114183. doi :10.1002/anie.202114183. ISSN 1521-3773. PMC 8940697. PMID 35076978 .
- ^ Química orgánica física moderna Eric V. Anslyn, Dennis A. Dougherty 2006
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "erythro, threo". doi :10.1351/goldbook.E02212
- ^ Merad, Jérémy; Candy, Mathieu; Pons, Jean-Marc; Bressy, Cyril (mayo de 2017). "Desimetrización enantioselectiva catalítica de compuestos meso en la síntesis total de productos naturales: hacia una economía de reactivos quirales". Síntesis . 49 (9): 1938–1954. doi :10.1055/s-0036-1589493. ISSN 0039-7881. S2CID 99010495.
- ^ Brown, William (2018). Química orgánica (8.ª ed.). Estados Unidos: Cengage Learning. pp. 138–142. ISBN 9781305580350.
