Sarcómero
| Sarcómero | |
|---|---|
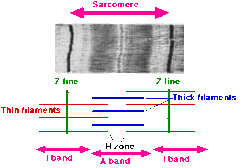 Imagen del sarcómero | |
| Detalles | |
| Parte de | Músculo estriado |
| Identificadores | |
| latín | sarcómero |
| Malla | D012518 |
| EL | H2.00.05.0.00008 |
| FMA | 67895 |
| Términos anatómicos de microanatomía [editar en Wikidata] | |
Un sarcómero (del griego σάρξ sarx "carne", μέρος meros "parte") es la unidad funcional más pequeña del tejido muscular estriado . [1] Es la unidad repetitiva entre dos líneas Z. Los músculos esqueléticos están compuestos de células musculares tubulares (llamadas fibras musculares o miofibras) que se forman durante la miogénesis embrionaria . Las fibras musculares contienen numerosas miofibrillas tubulares . Las miofibrillas están compuestas por secciones repetidas de sarcómeros, que aparecen bajo el microscopio como bandas oscuras y claras alternas. Los sarcómeros están compuestos de proteínas largas y fibrosas como filamentos que se deslizan uno sobre el otro cuando un músculo se contrae o se relaja. El costámero es un componente diferente que conecta el sarcómero al sarcolema .
Dos de las proteínas importantes son la miosina , que forma el filamento grueso, y la actina , que forma el filamento delgado. La miosina tiene una cola fibrosa larga y una cabeza globular que se une a la actina. La cabeza de miosina también se une al ATP , que es la fuente de energía para el movimiento muscular. La miosina solo puede unirse a la actina cuando los sitios de unión de la actina están expuestos por iones de calcio.
Las moléculas de actina están unidas a la línea Z, que forma los límites del sarcómero. Otras bandas aparecen cuando el sarcómero está relajado. [2]
Las miofibrillas de las células musculares lisas no están dispuestas en sarcómeros.
Alzacuello

Los sarcómeros dan al músculo esquelético y cardíaco su apariencia estriada , [2] que fue descrita por primera vez por Van Leeuwenhoek . [3]
- Un sarcómero se define como el segmento entre dos líneas Z vecinas (o discos Z). En las micrografías electrónicas de músculo estriado cruzado, la línea Z (del alemán "zwischen", que significa entre ) aparece entre las bandas I como una línea oscura que ancla los miofilamentos de actina .
- Alrededor de la línea Z se encuentra la región de la banda I (para isotrópico ). La banda I es la zona de filamentos delgados que no está superpuesta por filamentos gruesos (miosina).
- Después de la banda I se encuentra la banda A (de anisotrópico ). Se llama así por sus propiedades bajo un microscopio de luz polarizada . Una banda A contiene toda la longitud de un solo filamento grueso. La banda anisotrópica contiene filamentos gruesos y delgados.
- Dentro de la banda A hay una región más pálida llamada zona H (del alemán "heller", más brillante ). Se llama así por su apariencia más clara bajo un microscopio de polarización. La banda H es la zona de los filamentos gruesos que no tiene actina.
- Dentro de la zona H hay una delgada línea M (del alemán "mittel", que significa medio ), que aparece en el medio del sarcómero y está formada por elementos de conexión cruzada del citoesqueleto.

La relación entre las proteínas y las regiones del sarcómero es la siguiente:
- Los filamentos de actina , los filamentos delgados, son el componente principal de la banda I y se extienden hasta la banda A.
- Los filamentos de miosina , los filamentos gruesos, son bipolares y se extienden a lo largo de la banda A. Están reticulados en el centro por la banda M.
- La proteína gigante titina (connectina) se extiende desde la línea Z del sarcómero, donde se une al sistema de filamentos gruesos (miosina), hasta la banda M, donde se cree que interactúa con los filamentos gruesos. La titina (y sus isoformas de empalme) es la proteína altamente elástica más grande que se encuentra en la naturaleza. Proporciona sitios de unión para numerosas proteínas y se cree que desempeña un papel importante como regla sarcomérica y como modelo para el ensamblaje del sarcómero.
- Se cree que otra proteína gigante, la nebulina , se extiende a lo largo de los filamentos delgados y de toda la banda I. De manera similar a la titina, se cree que actúa como una regla molecular a lo largo del ensamblaje de los filamentos delgados.
- En la línea Z así como en la banda M del sarcómero se encuentran varias proteínas importantes para la estabilidad de la estructura sarcomérica.
- Los filamentos de actina y las moléculas de titina están reticulados en el disco Z a través de la proteína de la línea Z alfa-actinina.
- Las proteínas de banda M, miomesina y proteína C, reticulan el sistema de filamentos gruesos (miosinas) y la parte de banda M de la titina (los filamentos elásticos).
- La línea M también se une a la creatina quinasa, lo que facilita la reacción de ADP y fosfocreatina en ATP y creatina.
- La interacción entre los filamentos de actina y miosina en la banda A del sarcómero es responsable de la contracción muscular (según el modelo de filamento deslizante ). [2]
Contracción
La proteína tropomiosina cubre los sitios de unión de la miosina de las moléculas de actina en la célula muscular. Para que una célula muscular se contraiga, la tropomiosina debe moverse para descubrir los sitios de unión en la actina. Los iones de calcio se unen a las moléculas de troponina C (que están dispersas por toda la proteína tropomiosina) y alteran la estructura de la tropomiosina, obligándola a revelar el sitio de unión del puente cruzado en la actina.
La concentración de calcio dentro de las células musculares está controlada por el retículo sarcoplásmico , una forma única de retículo endoplásmico en el sarcoplasma .
Las células musculares se estimulan cuando una neurona motora libera el neurotransmisor acetilcolina , que viaja a través de la unión neuromuscular (la sinapsis entre el botón terminal de la neurona y la célula muscular). La acetilcolina se une a un receptor nicotínico de acetilcolina postsináptico . Un cambio en la conformación del receptor permite una afluencia de iones de sodio y el inicio de un potencial de acción postsináptico . El potencial de acción luego viaja a lo largo de los túbulos T (túbulos transversales) hasta que alcanza el retículo sarcoplásmico. Aquí, la membrana despolarizada activa los canales de calcio de tipo L dependientes de voltaje , presentes en la membrana plasmática. Los canales de calcio de tipo L están en estrecha asociación con los receptores de rianodina presentes en el retículo sarcoplásmico. El flujo entrante de calcio desde los canales de calcio de tipo L activa los receptores de rianodina para liberar iones de calcio del retículo sarcoplásmico. Este mecanismo se llama liberación de calcio inducida por calcio (CICR). No se sabe si la apertura física de los canales de calcio de tipo L o la presencia de calcio provocan la apertura de los receptores de rianodina. La salida de calcio permite que las cabezas de miosina accedan a los sitios de unión de los puentes cruzados de actina, lo que permite la contracción muscular. [4]
La contracción muscular termina cuando los iones de calcio son bombeados nuevamente al retículo sarcoplásmico, lo que permite que el aparato contráctil y, por lo tanto, la célula muscular se relajen.
Al contraerse el músculo, las bandas A no cambian su longitud (1,85 micrómetros en el músculo esquelético de los mamíferos), [4] mientras que las bandas I y la zona H se acortan. Esto hace que las líneas Z se acerquen.
Descansar
En reposo, la cabeza de miosina está unida a una molécula de ATP en una configuración de baja energía y no puede acceder a los sitios de unión del puente cruzado en la actina. Sin embargo, la cabeza de miosina puede hidrolizar el ATP en difosfato de adenosina (ADP) y un ion fosfato inorgánico. Una parte de la energía liberada en esta reacción cambia la forma de la cabeza de miosina y la promueve a una configuración de alta energía. A través del proceso de unión a la actina, la cabeza de miosina libera ADP y un ion fosfato inorgánico, cambiando su configuración nuevamente a una de baja energía. La miosina permanece unida a la actina en un estado conocido como rigor mortis causa , hasta que un nuevo ATP se une a la cabeza de miosina. Esta unión de ATP a la miosina libera la actina por disociación del puente cruzado. La miosina asociada al ATP está lista para otro ciclo, comenzando con la hidrólisis del ATP.
La banda A es visible como líneas transversales oscuras a través de las miofibras; la banda I es visible como líneas transversales ligeramente teñidas y la línea Z es visible como líneas oscuras que separan los sarcómeros a nivel del microscopio óptico.
Almacenamiento de energía
La mayoría de las células musculares sólo pueden almacenar suficiente ATP para una pequeña cantidad de contracciones musculares. Si bien las células musculares también almacenan glucógeno , la mayor parte de la energía necesaria para la contracción se deriva de los fosfágenos . Uno de estos fosfágenos, el fosfato de creatina , se utiliza para proporcionar ADP con un grupo fosfato para la síntesis de ATP en los vertebrados . [4]
Estructura comparativa
La estructura del sarcómero afecta a su función de varias maneras. La superposición de actina y miosina da lugar a la curva de longitud-tensión , que muestra cómo la fuerza de salida del sarcómero disminuye si el músculo se estira de modo que se puedan formar menos puentes cruzados o se comprime hasta que los filamentos de actina interfieren entre sí. La longitud de los filamentos de actina y miosina (tomados en conjunto como longitud del sarcómero) afecta a la fuerza y la velocidad: los sarcómeros más largos tienen más puentes cruzados y, por lo tanto, más fuerza, pero tienen un rango reducido de acortamiento. Los vertebrados muestran un rango muy limitado de longitudes de sarcómero, con aproximadamente la misma longitud óptima (longitud en el pico de longitud-tensión) en todos los músculos de un individuo, así como entre especies. Los artrópodos , sin embargo, muestran una enorme variación (más de siete veces) en la longitud del sarcómero, tanto entre especies como entre músculos de un solo individuo. Las razones de la falta de variabilidad sustancial del sarcómero en los vertebrados no se conocen por completo. [ cita requerida ]
Referencias
- ^ Biga, Lindsay M.; Dawson, Sierra; Harwell, Amy (2019). "10.2 Músculo esquelético". Anatomía y fisiología . OpenStax/Universidad Estatal de Oregón . Consultado el 22 de mayo de 2021 .
- ^ abc Reece, Jane; Campbell, Neil (2002). Biología . San Francisco: Benjamin Cummings . ISBN 0-8053-6624-5.
- ^ Martonosi, AN (1 de enero de 2000). "Electricidad animal, Ca2+ y contracción muscular. Una breve historia de la investigación muscular". Acta Biochimica Polonica . 47 (3): 493–516. doi : 10.18388/abp.2000_3974 . ISSN 0001-527X. PMID 11310955.
- ^ abc Lieber (2002). Estructura, función y plasticidad del músculo esquelético: la base fisiológica de la rehabilitación (2.ª ed.). Lippincott Williams & Wilkins. ISBN 978-0781730617.
Enlaces externos
- MBInfo: Sarcómero
- MBInfo: Fibra contráctil
- Vídeos sobre tejidos musculares
- Imagen de histología: 21601ooa – Sistema de aprendizaje de histología de la Universidad de Boston - "Ultraestructura de la célula: sarcoplasma del músculo esquelético"
- Mnemónicos médicos .com : 50 379 107
- Imágenes creadas por anticuerpos contra estrías.
- Contracción muscular para principiantes
- Representación modelo del sarcómero
