Alótropos del oxígeno
Existen varios alótropos conocidos del oxígeno . El más conocido es el oxígeno molecular ( O2 ), presente en niveles significativos en la atmósfera terrestre y también conocido como dioxígeno u oxígeno triplete . Otro es el ozono altamente reactivo ( O3 ). Otros son:
- Oxígeno atómico ( O 1 ), un radical libre .
- Oxígeno singlete ( O*
2), uno de los dos estados metaestables del oxígeno molecular. - Tetraoxígeno ( O 4 ), otra forma metaestable.
- Oxígeno sólido , existente en seis fases de distintos colores, de las cuales una es octaoxígeno ( O 8 , oxígeno rojo) y otra metálica (ζ-oxígeno).
Oxígeno atómico
El oxígeno atómico, denominado O u O 1 , es muy reactivo, ya que los átomos individuales de oxígeno tienden a unirse rápidamente con las moléculas cercanas. Su estado electrónico de menor energía es un triplete de espín , designado por el símbolo 3 P. En la superficie de la Tierra, existe de forma natural durante un tiempo muy corto. En el espacio exterior , la presencia de abundante radiación ultravioleta da como resultado una atmósfera de órbita terrestre baja en la que el 96% del oxígeno se presenta en forma atómica. [1]
Se ha detectado oxígeno atómico en Marte mediante las sondas Mariner , Viking y el observatorio SOFIA . [2]
Dioxígeno
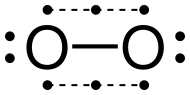
El alótropo común del oxígeno elemental en la Tierra, O 2 , se conoce generalmente como oxígeno, pero puede llamarse dioxígeno , oxígeno diatómico , oxígeno molecular , dioxígeno o gas oxígeno para distinguirlo del elemento en sí y del alótropo triatómico ozono , O 3 . Como componente principal (alrededor del 21% en volumen) de la atmósfera de la Tierra , el oxígeno elemental se encuentra más comúnmente en forma diatómica. Los organismos aeróbicos utilizan el dioxígeno atmosférico como oxidante terminal en la respiración celular para obtener energía química . El estado fundamental del dioxígeno se conoce como oxígeno triplete , 3 [O 2 ] , porque tiene dos electrones desapareados. El primer estado excitado, oxígeno singlete , 1 [O 2 ] , no tiene electrones desapareados y es metaestable . El estado doblete requiere un número impar de electrones y, por lo tanto, no puede ocurrir en el dioxígeno sin ganar o perder electrones, como en el ion superóxido ( O −2) o el ion dioxigenilo ( O+2).
El estado fundamental del O 2 tiene una longitud de enlace de 121 pm y una energía de enlace de 498 kJ/mol. [3] Es un gas incoloro con un punto de ebullición de -183 °C (90 K; -297 °F). [4] Se puede condensar a partir del aire enfriándolo con nitrógeno líquido, que tiene un punto de ebullición de -196 °C (77 K; -321 °F). El oxígeno líquido es de color azul pálido y es bastante marcadamente paramagnético debido a los electrones desapareados; el oxígeno líquido contenido en un matraz suspendido por una cuerda es atraído por un imán.
Oxígeno singlete
El oxígeno singlete es el nombre común utilizado para los dos estados metaestables del oxígeno molecular ( O2 ) con mayor energía que el oxígeno triplete en estado fundamental. Debido a las diferencias en sus capas electrónicas, el oxígeno singlete tiene diferentes propiedades químicas y físicas que el oxígeno triplete, incluida la absorción y emisión de luz en diferentes longitudes de onda. Puede generarse en un proceso fotosensibilizado por transferencia de energía a partir de moléculas de colorante como el rosa de Bengala , el azul de metileno o las porfirinas , o por procesos químicos como la descomposición espontánea del trióxido de hidrógeno en agua o la reacción del peróxido de hidrógeno con hipoclorito .
Ozono
El oxígeno triatómico (ozono, O 3 ) es un alótropo muy reactivo del oxígeno que es un gas azul pálido a temperatura y presión estándar . El O 3 líquido y sólido tiene un color azul más profundo que el O 2 ordinario , y son inestables y explosivos. [5] [6] En su fase gaseosa, el ozono es destructivo para materiales como el caucho y la tela y es dañino para el tejido pulmonar . [7] Se pueden detectar rastros de él como un olor penetrante, similar al cloro, [4] proveniente de motores eléctricos , impresoras láser y fotocopiadoras , ya que se forma siempre que el aire se somete a una descarga eléctrica. Fue nombrado "ozón" en 1840 por Christian Friedrich Schönbein , [8] del griego antiguo ὄζειν (ozein: "oler") más el sufijo -on , comúnmente usado en ese momento para designar un compuesto derivado y anglicanizado como -one . [9]
El ozono es termodinámicamente inestable y tiende a reaccionar hacia la forma más común de dioxígeno. Se forma por la reacción del O2 intacto con el oxígeno atómico producido cuando la radiación UV en la atmósfera superior divide el O2 . [5] El ozono se absorbe fuertemente en el ultravioleta y en la estratosfera funciona como un escudo para la biosfera contra los efectos mutagénicos y otros efectos dañinos de la radiación UV solar (ver capa de ozono ). [5] El ozono troposférico se forma cerca de la superficie de la Tierra por la desintegración fotoquímica del dióxido de nitrógeno en el escape de los automóviles . [10] El ozono a nivel del suelo es un contaminante del aire que es especialmente dañino para las personas mayores, los niños y las personas con afecciones cardíacas y pulmonares como enfisema , bronquitis y asma . [11] El sistema inmunológico produce ozono como antimicrobiano (ver a continuación). [12]
Ozono cíclico
El ozono cíclico es una molécula de O3 predicha teóricamente en la que sus tres átomos de oxígeno se unen formando un triángulo equilátero en lugar de un ángulo abierto.
Tetraoxígeno
Se sospechaba que el tetraoxígeno existía desde principios del siglo XX, cuando se lo conocía como oxozono. Fue identificado en 2001 por un equipo dirigido por Fulvio Cacace en la Universidad de Roma. [13] Se pensaba que la molécula O 4 se encontraba en una de las fases del oxígeno sólido que luego se identificó como O 8 . El equipo de Cacace sugirió que el O 4 probablemente consiste en dos moléculas de O 2 con forma de mancuerna unidas de forma flexible por fuerzas de dispersión dipolar inducida.
Fases del oxígeno sólido
Se conocen seis fases distintas del oxígeno sólido. Una de ellas es un grupo O 8 de color rojo oscuro. Cuando el oxígeno se somete a una presión de 96 GPa, se vuelve metálico , de manera similar al hidrógeno , [14] y se vuelve más similar a los calcógenos más pesados , como el selenio (que exhibe un color rojo rosado en su estado elemental), el telurio y el polonio , los cuales muestran un carácter metálico significativo. A temperaturas muy bajas, esta fase también se vuelve superconductora .
Referencias
- ^ "De la nada" Archivado el 23 de junio de 2017 en Wayback Machine.NASA.gov . 17 de febrero de 2011.
- ^ Bell, Kassandra (6 de mayo de 2016). «Observatorio volante detecta oxígeno atómico en la atmósfera marciana». NASA . Archivado desde el original el 8 de noviembre de 2020. Consultado el 30 de septiembre de 2021 .
- ^ Chieh, Chung. "Longitudes y energías de los enlaces". Universidad de Waterloo. Archivado desde el original el 14 de diciembre de 2007. Consultado el 16 de diciembre de 2007 .
- ^ Tutorial de química: alótropos Archivado el 17 de noviembre de 2021 en Wayback Machine desde AUS-e-TUTE.com.au
- ^abc Mellor 1939
- ^ Cotton, F. Albert y Wilkinson, Geoffrey (1972). Química inorgánica avanzada: un texto completo . (3.ª edición). Nueva York, Londres, Sydney, Toronto: Interscience Publications. ISBN 0-471-17560-9 .
- ^ Stwertka 1998, pág. 48
- ↑ Christian Friedrich Schönbein, Über die Erzeugung des Ozons auf chemischen Wege Archivado el 30 de junio de 2020 en Wayback Machine , p. 3, Basilea: Schweighauser'sche Buchhandlung, 1844.
- ^ "Ozono", Oxford English Dictionary en línea, consultado el 29 de junio de 2020.
- ^ Stwertka 1998, pág. 49
- ^ "¿Quiénes corren mayor riesgo por el ozono?". airnow.gov. Archivado desde el original el 17 de enero de 2008. Consultado el 6 de enero de 2008 .
- ^ Paul Wentworth Jr.; Jonathan E. McDunn; Anita D. Wentworth; Cindy Takeuchi; Jorge Nieva; Teresa Jones; Cristina Bautista; Julie M. Ruedi; Abel Gutierrez; Kim D. Janda; Bernard M. Babior ; Albert Eschenmoser; Richard A. Lerner (13 de diciembre de 2002). "Evidencia de la formación de ozono catalizada por anticuerpos en la destrucción bacteriana y la inflamación". Science . 298 (5601): 2195–2199. Bibcode :2002Sci...298.2195W. doi : 10.1126/science.1077642 . PMID 12434011. S2CID 36537588.
- ^ Cacace, Fulvio (2001). "Detección experimental de tetraoxígeno". Angewandte Chemie International Edition . 40 (21): 4062–4065. doi :10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID 12404493.
- ^ Peter P. Edwards; Friedrich Hensel (14 de enero de 2002). "Oxígeno metálico". ChemPhysChem . 3 (1): 53–56. doi :10.1002/1439-7641(20020118)3:1<53::AID-CPHC53>3.0.CO;2-2. PMID 12465476.
Lectura adicional
- Parks, GD; Mellor, JW (1939). Química inorgánica moderna de Mellor (6.ª ed.). Londres: Longmans, Green and Co.
- Stwertka, Albert (1998). Guía de los elementos (edición revisada). Oxford University Press. ISBN 0-19-508083-1.
- Análisis teórico de algunos y referencia principal para otros: Gadzhiev, Oleg B.; Ignatov, Stanislav K.; Kulikov, Mikhail Yu.; Feigin, Alexander M.; Razuvaev, Alexey G.; Sennikov, Peter G.; Schrems, Otto (2013). "Estructura, energía y frecuencias vibracionales de alótropos de oxígeno en (n ≤ 6) en las formas covalentemente enlazadas y de van der Waals: estudio ab initio en el nivel CCSD(T)" (PDF) . J. Chem. Theory Comput . 9 (1): 247–262. doi :10.1021/ct3006584. PMID 26589027.