Canal SK
| Canal de potasio SK activado por calcio | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Canal SK | |||||||||
| Identificadores | |||||||||
| Símbolo | Canal SK | ||||||||
| Pfam | PF03530 | ||||||||
| Interprofesional | IPR015449 | ||||||||
| |||||||||
Los canales SK ( canales de potasio activados por calcio de pequeña conductancia ) son una subfamilia de canales de potasio activados por calcio . [1] Se denominan así debido a su pequeña conductancia de canal único del orden de 10 pS . [2] Los canales SK son un tipo de canal iónico que permite que los cationes de potasio crucen la membrana celular y se activan (abren) por un aumento en la concentración de calcio intracelular a través de canales de calcio de tipo N. Su activación limita la frecuencia de disparo de los potenciales de acción y es importante para regular la poshiperpolarización en las neuronas del sistema nervioso central , así como en muchos otros tipos de células eléctricamente excitables . Esto se logra a través de la fuga hiperpolarizante de iones de potasio cargados positivamente a lo largo de su gradiente de concentración hacia el espacio extracelular. Esta hiperpolarización hace que el potencial de membrana se vuelva más negativo. [3] Se cree que los canales SK están involucrados en la plasticidad sináptica y, por lo tanto, juegan papeles importantes en el aprendizaje y la memoria. [4]
Función
Los canales SK se expresan en todo el sistema nervioso central . Están altamente conservados en mamíferos, así como en otros organismos como Drosophila melanogaster y Caenorhabditis elegans . [5] Los canales SK están específicamente involucrados en el potencial posthiperpolarizante medio (mAHP). Afectan tanto a la excitabilidad intrínseca de las neuronas como a la transmisión sináptica. También están involucrados en la señalización de calcio. [6] La activación del canal SK puede mediar la neuroprotección en varios modelos de muerte celular. [6] [7] [8] Los canales SK controlan la frecuencia de descarga del potencial de acción en neuronas del hipocampo, neuronas dopaminérgicas del mesencéfalo, neuronas vagales dorsales, neuronas simpáticas, neuronas talámicas del núcleo reticular, neuronas olivares inferiores, neuronas motoras espinales e hipoglosas, células mitrales en el bulbo olfatorio y neuronas corticales. [3]
Estructura
Los canales de potasio SK comparten la misma arquitectura básica con los canales de potasio dependientes de voltaje tipo Shaker . [9] Cuatro subunidades se asocian para formar un tetrámero . Cada una de las subunidades tiene seis dominios helicoidales alfa hidrófobos transmembrana (S1-S6). Un bucle entre S5 y S6, llamado bucle P , proporciona la región formadora de poros que siempre mira hacia el centro del canal. [10] Cada una de las subunidades tiene seis dominios helicoidales alfa hidrófobos que se insertan en la membrana celular. Un bucle entre el quinto y el sexto dominio transmembrana forma el filtro de selectividad de iones de potasio . Los canales SK pueden ensamblarse como canales homotetraméricos o como canales heterotetraméricos, que consisten en más de un subtipo de canal SK. Además, los canales de potasio SK están estrechamente asociados con la proteína calmodulina , que explica la sensibilidad al calcio de estos canales. [9] [11] La calmodulina participa como una subunidad del propio canal, unida a la región C-terminal citoplasmática del péptido llamado dominio de unión de calmodulina (CaMBD). [12]
La asociación adicional de la quinasa fosforilante CK2 y la fosfatasa desfosforilante PP2A en la cara citoplasmática de la proteína permite una mayor sensibilidad al Ca2 + y, por lo tanto, una modulación cinética. [13] CK2 sirve para fosforilar el CaM unido a SKCa en el residuo T80, en lugar de las hélices del canal en sí, para reducir la sensibilidad al calcio. Esto solo se puede lograr cuando el poro del canal está cerrado. PP2A desfosforila este residuo tras la inhibición de CK2. [12] El filtro de selectividad de todos los subtipos de canales SK (ya sea SK1, SK2, SK3 o SK4) está altamente conservado y refleja la selectividad observada en cualquier canal de potasio , una secuencia de residuos de aminoácidos GYGD en el bucle formador de poros. [14] Se considera que estos canales son independientes del voltaje, ya que poseen solo dos de los siete residuos de aminoácidos cargados positivamente que normalmente se ven en un canal de potasio dependiente de voltaje prototípico . [10]
Clasificación
La familia de canales SK contiene 4 miembros: SK1 , SK2 , SK3 y SK4 . A menudo se hace referencia a SK4 como IK (conductancia intermedia) debido a su mayor conductancia de 20 a 80 pS. [15]
| Canal | Gene | Alias | Subunidades asociadas |
| SK1 | KCNN1 | K aproximadamente 2,1 | calmodulina , PP2A , CK2 |
| SK2 | KCNN2 | K aproximadamente 2,2 | calmodulina , PP2A , CK2 |
| SK3 | KCNN3 | K aproximadamente 2,3 | calmodulina , PP2A , CK2 |
| SK4 | KCNN4 | K aproximadamente 3,1 | calmodulina , PP2A , CK2 |
Mecanismo de compuerta
El mecanismo de activación del canal SK está controlado por los niveles intracelulares de calcio. [5] El calcio entra en la célula a través de canales de calcio activados por voltaje, así como a través de receptores NMDA. [3] El calcio no se une directamente al canal SK. Incluso en ausencia de calcio, el canal SK se une al lóbulo C de la proteína calmodulina (CaM). Cuando el lóbulo N se une al calcio, atrapa el conector S4-S5 en la subunidad intracelular del canal SK. Cuando cada uno de los cuatro conectores S4-S5 se unen al lóbulo N de la calmodulina, el canal SK cambia de conformación. La calmodulina empuja al conector S4-S5 para permitir la expansión del cruce del haz S6, lo que conduce a la apertura del poro. La idea de que esto hace que el canal pase de ser un tetrámero de monómeros a un dímero plegado de dímeros, lo que da como resultado la rotación de los dominios de unión a CaM, ahora se ha abandonado, y las observaciones más recientes no son compatibles con la propuesta de que esta rotación causa la apertura mecánica de la compuerta del canal. [5] La constante de tiempo de activación del canal SK es de aproximadamente 5 ms. Cuando los niveles de calcio se agotan, la constante de tiempo para la desactivación del canal varía entre 15 y 60 ms. [16]
Bloqueadores
Todos los canales SK pueden bloquearse farmacológicamente con sales de amonio cuaternario de una neurotoxina derivada de plantas, la bicuculina . [17] Además, los canales SK (SK1-SK3), pero no SK4 (IK), son sensibles al bloqueo por la toxina de abeja apamina , [18] y los venenos de escorpión tamapina y caribdotoxina (ChTx), todos a través del antagonismo competitivo para acceder a la boca de la formación del poro. [19] Todos los bloqueadores conocidos compiten por aproximadamente el mismo sitio de unión, el poro, en todos los subtipos. Esto proporciona un bloqueo físico al poro del canal. [20] Dado que todos los bloqueadores son universales para los tres tipos de canales SK, existe una ventana terapéutica increíblemente estrecha que no permite el bloqueo de un subtipo específico de canal SK. [13] Las sales de amonio cuaternario como la bicuculina y el tetraetilamonio (TEA) ingresan al poro a través del filtro de selectividad actuando como un imitador de potasio en el paso de deshidratación de la permeación del poro. [20]
Las siguientes moléculas son otras toxinas y compuestos orgánicos que también inhiben los tres subtipos de canales SK pequeños en cualquier grado (incluso mínimo): [13]
- Decualinio
- d-Tubocurarina
- Licenciatura en Derecho 1684
- Licenciatura en Derecho 1848
- Ciproheptadina
- Fluoxetina , el ingrediente activo del Prozac
- NS8593
- Escilatoxina (Leiurotoxina-I)
- Lei-Dab7
- N-metil-laudanosina
- N-Me-bicuculina
- Pancuronio
- Atracurio
- 1-etil-1H-benzo[d]imidazol-2(3H)-on
- 6,7-dicloro-3-(hidroxiimino)indolin-2-ona
- N-ciclohexil-2-(3,5-dimetil-1H-pirazol-1-il)-6-metilpirimidin-4-amina
- (R)-N-(1,2,3,4-tetrahidronaftalen-1-il)-1H-benzo[d]imidazol-2-amina
Moduladores
Los moduladores alostéricos de los canales SK pequeños funcionan modificando la sensibilidad aparente de los canales al calcio. Algunos ejemplos son:
- Riluzol
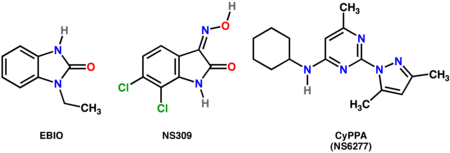
- Moduladores positivos no selectivos de los canales SK: EBIO (1 - Etil-2- Benzima Dazolina O ) , [ 21] NS309 (6,7-dicloro-1H-indol-2,3-diona 3-oxima) [22]
- Moduladores positivos selectivos de SK-2 y SK-3: CyPPA (NS6277; ciclohexil- (2-(3,5-dimetil - pirazol-1-il)-6-metil - pirimidin-4-il) -amina ) [23]
Plasticidad sináptica y potenciación a largo plazo
En las espinas dendríticas, los canales SK están acoplados directamente a los receptores NMDA . Además de ser activados por el flujo de calcio a través de los canales de calcio dependientes del voltaje, los canales SK pueden ser activados por el calcio que fluye a través de los receptores NMDA, lo que ocurre después de la despolarización de la membrana postsináptica. [12] Los experimentos con apamina han demostrado que bloquear específicamente los canales SK puede aumentar el aprendizaje y la potenciación a largo plazo . Además, el factor neurotrófico derivado del cerebro (BDNF) provoca la regulación negativa de los canales SK, lo que facilita la potenciación a largo plazo. El aumento de la actividad del canal SK tiene el efecto opuesto y sirve para perjudicar el aprendizaje . [5] Un aumento en la actividad del canal SK que ocurre con el tiempo puede estar relacionado con la disminución de la plasticidad y la memoria que se observa con el envejecimiento. [24]
Papel en la enfermedad de Parkinson
Se cree que la disfunción de los canales de potasio, incluidos los canales SK, desempeña un papel en la patogénesis de la enfermedad de Parkinson (EP), un trastorno neurodegenerativo progresivo .
Los bloqueadores del canal SK controlan la tasa de disparo (la cantidad de potenciales de acción producidos por una neurona en un tiempo determinado) y el patrón de disparo (la forma en que se asignan los potenciales de acción a lo largo del tiempo) a través de su producción de m-AHP. Los activadores del canal SK disminuyen la tasa de disparo, la sensibilidad de la neurona a los estímulos excitatorios, mediando la neuroprotección, mientras que los bloqueadores del canal SK aumentan la tasa de disparo y la sensibilidad a los estímulos excitatorios. [25] Esto tiene implicaciones importantes en cuanto a la función de las neuronas dopaminérgicas. [25] Por ejemplo, la cantidad de dopamina liberada por las neuronas dopaminérgicas del mesencéfalo es mucho mayor cuando la frecuencia de disparo aumenta que cuando se disparan a una tasa constante.
Los canales SK se expresan ampliamente en las neuronas dopaminérgicas del mesencéfalo . Se han utilizado múltiples técnicas farmacológicas para ajustar la afinidad de SK por los iones de calcio, modulando así la excitabilidad de las neuronas dopaminérgicas de la sustancia negra . El bloqueo de los canales SK in vivo aumenta la tasa de activación de las células de la sustancia negra, lo que aumenta la cantidad de dopamina liberada desde las terminales sinápticas. [25] Cuando se acumula una gran cantidad de dopamina en el citosol, se induce daño celular debido a la acumulación de radicales libres y daño a las mitocondrias. Además, se han utilizado técnicas para modular los canales SK con el fin de alterar el fenotipo de dopamina de las neuronas. Después de la pérdida de neuronas TH+ ( tirosina hidroxilasa -positivas) de la sustancia negra compacta (SNc) debido a la neurodegeneración inducida por el Parkinson, el número de estas neuronas puede recuperarse parcialmente a través de un "cambio" del fenotipo celular de TH- (tirosina hidroxilasa-negativo) a TH+. El número de neuronas TH+ puede alterarse mediante la modulación del canal SK; para ser más específicos, la infusión de agonistas de SK en la sustancia negra aumenta el número de neuronas TH+, mientras que la infusión de antagonistas de SK disminuye el número de neuronas TH+. La razón de esta relación entre los canales SK y la expresión de TH puede deberse a la neuroprotección contra la toxicidad de la dopamina . [25]
Se han sugerido dos métodos contradictorios como opciones terapéuticas para la mejora de los síntomas de la EP:
Inhibición de los canales SK
- La inhibición de los canales SK, en concreto el bloqueo de los canales SK3, aumenta la frecuencia de activación de las neuronas dopaminérgicas, aumentando así la liberación de dopamina . Por tanto, se cree que la aplicación de bloqueadores de los canales SK3 en pacientes con EP puede aliviar los síntomas motores a corto plazo.
- Sin embargo, la inhibición también produce una disminución del número de neuronas TH+ de la sustancia negra compacta (SNc) en la célula, lo que produce una disminución de la síntesis de dopamina a largo plazo.
Facilitación de canales SK
- La mejora de la función de los canales SK aumenta el número de neuronas TH+ de la sustancia negra compacta (SNc) en la célula, manteniendo así la síntesis de dopamina a largo plazo.
- Sin embargo, la facilitación de los canales SK disminuye la frecuencia de activación de las neuronas dopaminérgicas a corto plazo.
Referencias
- ^ Bond CT, Maylie J, Adelman JP (abril de 1999). "Canales de potasio activados por calcio de pequeña conductancia". Anales de la Academia de Ciencias de Nueva York . 868 (1): 370–8. Código Bibliográfico :1999NYASA.868..370B. doi :10.1111/j.1749-6632.1999.tb11298.x. PMID 10414306. S2CID 22930702.
- ^ Köhler M, Hirschberg B, Bond CT, Kinzie JM, Marrion NV, Maylie J, Adelman JP (septiembre de 1996). "Canales de potasio activados por calcio de pequeña conductancia del cerebro de mamíferos". Science . 273 (5282): 1709–14. Bibcode :1996Sci...273.1709K. doi :10.1126/science.273.5282.1709. PMID 8781233. S2CID 11603552.
- ^ abc Faber ES, Sah P (octubre de 2007). "Funciones de los canales SK en neuronas centrales". Farmacología y fisiología clínica y experimental . 34 (10): 1077–83. doi :10.1111/j.1440-1681.2007.04725.x. PMID 17714097. S2CID 5553791.
- ^ Stackman RW, Hammond RS, Linardatos E, Gerlach A, Maylie J, Adelman JP, Tzounopoulos T (diciembre de 2002). "Los canales de K+ activados por Ca2+ de pequeña conductancia modulan la plasticidad sináptica y la codificación de la memoria". The Journal of Neuroscience . 22 (23): 10163–71. doi : 10.1523/JNEUROSCI.22-23-10163.2002 . PMC 6758766 . PMID 12451117.
- ^ abcd Adelman JP, Maylie J, Sah P (2012). "Canales de K + activados por Ca2 + de pequeña conductancia : forma y función". Revisión anual de fisiología . 74 : 245–69. doi :10.1146/annurev-physiol-020911-153336. PMID 21942705.
- ^ ab Dolga AM, Terpolilli N, Kepura F, Nijholt IM, Knaus HG, D'Orsi B, et al. (abril de 2011). "La activación de los canales KCa2 previene la desregulación de [Ca2+]i y reduce la muerte neuronal tras la toxicidad del glutamato y la isquemia cerebral". Muerte celular y enfermedad . 2 (e147): e147. doi :10.1038/cddis.2011.30. PMC 3122061 . PMID 21509037.
- ^ Honrath B, Matschke L, Meyer T, Magerhans L, Perocchi F, Ganjam GK, et al. (mayo de 2017). "Los canales SK2 regulan la respiración mitocondrial y la captación mitocondrial de Ca2+". Muerte celular y diferenciación . 24 (5): 761–773. doi :10.1038/cdd.2017.2. PMC 5423111 . PMID 28282037.
- ^ Allen D, Nakayama S, Kuroiwa M, Nakano T, Palmateer J, Kosaka Y, et al. (diciembre de 2011). "Los canales SK2 son neuroprotectores de la muerte celular neuronal inducida por isquemia". Journal of Cerebral Blood Flow and Metabolism . 31 (12): 2302–12. doi :10.1038/jcbfm.2011.90. PMC 3323193 . PMID 21712833.
- ^ ab Maylie J, Bond CT, Herson PS, Lee WS, Adelman JP (enero de 2004). "Canales de K+ activados por Ca2+ de pequeña conductancia y calmodulina". The Journal of Physiology . 554 (Pt 2): 255–61. doi :10.1113/jphysiol.2003.049072. PMC 1664776 . PMID 14500775.
- ^ ab Stocker M (octubre de 2004). "Canales de K + activados por Ca(2+) : determinantes moleculares y función de la familia SK". Nature Reviews. Neuroscience . 5 (10): 758–70. doi :10.1038/nrn1516. PMID 15378036. S2CID 22211829.
- ^ Schumacher MA, Rivard AF, Bächinger HP, Adelman JP (abril de 2001). "Estructura del dominio de activación de un canal de K + activado por Ca2 + en complejo con Ca2 + /calmodulina". Nature . 410 (6832): 1120–4. Bibcode :2001Natur.410.1120S. doi :10.1038/35074145. PMID 11323678. S2CID 205016620.
- ^ abc Luján R, Maylie J, Adelman JP (julio de 2009). "Nuevos sitios de acción para los canales GIRK y SK". Nature Reviews. Neuroscience . 10 (7): 475–80. doi :10.1038/nrn2668. PMID 19543219. S2CID 5137151.
- ^ abc Weatherall KL, Goodchild SJ, Jane DE, Marrion NV (julio de 2010). "Canales de potasio activados por calcio de pequeña conductancia: de la estructura a la función". Progress in Neurobiology . 91 (3): 242–55. doi :10.1016/j.pneurobio.2010.03.002. PMID 20359520. S2CID 32565287.
- ^ Bernèche S, Roux B (abril de 2005). "Una compuerta en el filtro de selectividad de los canales de potasio". Structure . 13 (4): 591–600. doi : 10.1016/j.str.2004.12.019 . PMID 15837197.
- ^ Vergara C, Latorre R, Marrion NV, Adelman JP (junio de 1998). "Canales de potasio activados por calcio". Current Opinion in Neurobiology . 8 (3): 321–9. doi :10.1016/S0959-4388(98)80056-1. PMID 9687354. S2CID 40840564.
- ^ Berkefeld H, Fakler B, Schulte U (octubre de 2010). " Canales de K + activados por Ca2 + : de los complejos proteicos a la función". Physiological Reviews . 90 (4): 1437–59. doi :10.1152/physrev.00049.2009. PMID 20959620.
- ^ Khawaled R, Bruening-Wright A, Adelman JP, Maylie J (agosto de 1999). "Bloqueo bicuculina de canales de potasio activados por calcio de pequeña conductancia". Pflügers Archiv . 438 (3): 314–21. doi :10.1007/s004240050915. PMID 10398861. S2CID 7033568.
- ^ Blatz AL, Magleby KL (1986). "Canales de K + activados por Ca bloqueados por apamina de pequeña conductancia en músculo esquelético de rata cultivado". Nature . 323 (6090): 718–20. Bibcode :1986Natur.323..718B. doi :10.1038/323718a0. PMID 2430185. S2CID 4270667.
- ^ Pedarzani P, D'hoedt D, Doorty KB, Wadsworth JD, Joseph JS, Jeyaseelan K, et al. (noviembre de 2002). "Tamapin, un péptido venenoso del escorpión rojo indio (Mesobuthus tamulus) que actúa sobre los canales de K+ activados por Ca2+ de pequeña conductancia y las corrientes de posthiperpolarización en las neuronas centrales". The Journal of Biological Chemistry . 277 (48): 46101–9. doi : 10.1074/jbc.M206465200 . PMID 12239213.
- ^ ab Dilly S, Lamy C, Marrion NV, Liégeois JF, Seutin V (agosto de 2011). "Moduladores de canales iónicos: más diversidad de lo que se pensaba anteriormente". ChemBioChem . 12 (12): 1808–12. doi :10.1002/cbic.201100236. PMID 21726033. S2CID 3303526.
- ^ Pedarzani P, Mosbacher J, Rivard A, Cingolani LA, Oliver D, Stocker M, et al. (marzo de 2001). "Control de la actividad eléctrica en neuronas centrales mediante la modulación de la activación de canales de K+ activados por Ca2+ de pequeña conductancia". The Journal of Biological Chemistry . 276 (13): 9762–9. doi : 10.1074/jbc.M010001200 . PMID 11134030.
- ^ Strøbaek D, Teuber L, Jørgensen TD, Ahring PK, Kjaer K, Hansen RS y otros. (octubre de 2004). "Activación de canales de K + activados por Ca2 + IK y SK humanos por NS309 (6,7-dicloro-1H-indol-2,3-diona 3-oxima)". Biochimica et Biophysica Acta (BBA) - Biomembranas . 1665 (1–2): 1–5. doi : 10.1016/j.bbamem.2004.07.006 . PMID 15471565.
- ^ Hougaard C, Eriksen BL, Jørgensen S, Johansen TH, Dyhring T, Madsen LS, et al. (julio de 2007). "Modulación positiva selectiva de los subtipos SK3 y SK2 de canales de K+ activados por Ca2+ de pequeña conductancia". British Journal of Pharmacology . 151 (5): 655–65. doi :10.1038/sj.bjp.0707281. PMC 2014002 . PMID 17486140.
- ^ Tzounopoulos T, Stackman R (diciembre de 2003). "Mejora de la plasticidad sináptica y la memoria: un papel para los canales de K + activados por Ca2 + de pequeña conductancia ". The Neuroscientist . 9 (6): 434–9. doi :10.1177/1073858403259282. PMID 14678575. S2CID 32595023.
- ^ abcd Liu XK, Wang G, Chen SD (junio de 2010). "Modulación de la actividad de las neuronas dopaminérgicas por los canales SK: ¿un objetivo potencial para el tratamiento de la enfermedad de Parkinson?". Neuroscience Bulletin . 26 (3): 265–71. doi :10.1007/s12264-010-1217-4. PMC 5560298 . PMID 20502506.
Enlaces externos
- Canales de potasio SK en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- "Canales de potasio activados por calcio". Base de datos de receptores y canales iónicos de la IUPHAR . Unión Internacional de Farmacología Básica y Clínica.
- John Adelman. «Intereses de investigación: canales de potasio activados por calcio de pequeña conductancia (canales SK)». Universidad de Ciencias y Salud de Oregón. Archivado desde el original el 2007-09-30 . Consultado el 2008-01-22 .