Síndrome de Wolff-Parkinson-White
| Síndrome de Wolff-Parkinson-White | |
|---|---|
| Otros nombres | Patrón WPW, preexcitación ventricular con arritmia, síndrome de la vía accesoria auriculoventricular [1] [2] |
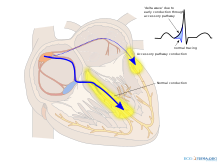 | |
| La conducción a través de la vía accesoria da como resultado una onda delta. | |
 | |
| Se observa una "onda delta" característica (flecha) en una persona con síndrome de Wolff-Parkinson-White. Nótese el intervalo PR corto . | |
| Especialidad | Cardiología |
| Síntomas | Ritmo cardíaco anormalmente rápido , palpitaciones , dificultad para respirar , mareos, pérdida del conocimiento [1] [2] |
| Complicaciones | Miocardiopatía , accidente cerebrovascular , muerte súbita cardíaca [2] |
| Inicio habitual | Nacimiento [1] |
| Causas | Vía accesoria en el corazón [1] |
| Método de diagnóstico | El electrocardiograma muestra un intervalo PR corto y un complejo QRS ancho a partir de una onda delta [3] |
| Tratamiento | Espera vigilante , medicamentos, ablación con catéter de radiofrecuencia [4] [5] |
| Pronóstico | Sin síntomas 0,5% (niños), 0,1% (adultos) riesgo de muerte por año [5] |
| Frecuencia | 0,2% [1] |
El síndrome de Wolff-Parkinson-White ( WPWS ) es un trastorno debido a un tipo específico de problema con el sistema eléctrico del corazón que involucra una vía accesoria capaz de conducir corriente eléctrica entre las aurículas y los ventrículos , evitando así el nódulo auriculoventricular . [2] [3] Alrededor del 60% de las personas con el problema eléctrico desarrollaron síntomas, [5] que pueden incluir un latido cardíaco anormalmente rápido , palpitaciones , dificultad para respirar , mareos o síncope . [1] En raras ocasiones, puede ocurrir un paro cardíaco . [1] El tipo más común de latido cardíaco irregular que ocurre se conoce como taquicardia supraventricular paroxística . [1]
La causa del síndrome de WPW es generalmente desconocida y probablemente se deba a una combinación de factores genéticos y de azar. [2] Un pequeño número de casos se deben a una mutación del gen PRKAG2 que puede heredarse de forma autosómica dominante . [2] El mecanismo subyacente implica una vía de conducción eléctrica accesoria entre las aurículas y los ventrículos . [1] Se asocia con otras afecciones como la anomalía de Ebstein y la parálisis periódica hipocalémica . [1] El diagnóstico de WPW se produce con una combinación de palpitaciones y cuando un electrocardiograma (ECG) muestra un intervalo PR corto y una onda delta. [3] Es un tipo de síndrome de preexcitación . [3]
El síndrome de WPW puede ser controlado o tratado con medicamentos o una ablación (destrucción de los tejidos) como la ablación con catéter de radiofrecuencia . [4] Afecta entre el 0,1 y el 0,3% de la población. [1] El riesgo de muerte en aquellos que no presentan síntomas es de alrededor del 0,5% por año en niños y del 0,1% por año en adultos. [5] En algunos casos, el monitoreo no invasivo puede ayudar a estratificar con más cuidado a los pacientes en una categoría de riesgo menor. [6] En aquellos que no presentan síntomas, la observación continua puede ser razonable. [5] En aquellos con WPW complicado por fibrilación auricular , se puede utilizar cardioversión o el medicamento procainamida . [7] La afección recibe su nombre de Louis Wolff , John Parkinson y Paul Dudley White , quienes describieron los hallazgos del ECG en 1930. [3]
Signos y síntomas
Las personas con WPW suelen ser asintomáticas cuando no tienen una frecuencia cardíaca rápida. Sin embargo, las personas pueden experimentar palpitaciones , mareos , falta de aire o, con poca frecuencia, síncope (desmayo o casi desmayo) durante episodios de taquicardia supraventricular . El WPW también se asocia con un riesgo muy pequeño de muerte súbita debido a alteraciones más peligrosas del ritmo cardíaco. [8]
Fisiopatología

La actividad eléctrica del corazón humano normal comienza cuando surge un potencial de acción cardíaca en el nódulo sinoauricular (SA), que se encuentra en la aurícula derecha . Desde allí, el estímulo eléctrico se transmite a través de vías internodales hasta el nódulo auriculoventricular (AV). Después de un breve retraso en el nódulo AV, el estímulo viaja a través del haz de His hasta las ramas izquierda y derecha del haz y luego a las fibras de Purkinje y al endocardio en el vértice del corazón, y finalmente al miocardio ventricular . [ cita requerida ]
El nodo AV cumple una importante función como "guardián", limitando la actividad eléctrica que llega a los ventrículos. En situaciones en las que las aurículas generan una actividad eléctrica excesivamente rápida (como la fibrilación auricular o el aleteo auricular ), el nodo AV limita la cantidad de señales que se conducen a los ventrículos. Por ejemplo, si las aurículas se activan eléctricamente a 300 latidos por minuto, la mitad de esos impulsos eléctricos pueden ser bloqueados por el nodo AV, de modo que los ventrículos se estimulan a solo 150 latidos por minuto, lo que da como resultado un pulso de 150 latidos por minuto. Otra propiedad importante del nodo AV es que ralentiza los impulsos eléctricos individuales. Esto se manifiesta en el electrocardiograma como el intervalo PR (el tiempo desde la activación eléctrica de las aurículas hasta la activación eléctrica de los ventrículos ), que generalmente se acorta a menos de 120 milisegundos de duración. [ cita requerida ]
Las personas con WPW tienen una vía accesoria que comunica las aurículas y los ventrículos, además del nódulo AV. [6] Esta vía accesoria se conoce como haz de Kent. Esta vía accesoria no comparte las propiedades de desaceleración de la frecuencia del nódulo AV y puede conducir la actividad eléctrica a una frecuencia significativamente mayor que la del nódulo AV. Por ejemplo, en el ejemplo anterior, si una persona tuviera una frecuencia auricular de 300 latidos por minuto, el haz accesorio puede conducir todos los impulsos eléctricos desde las aurículas hasta los ventrículos, lo que hace que los ventrículos se contraigan a 300 latidos por minuto. Las frecuencias cardíacas extremadamente rápidas como esta pueden provocar inestabilidad hemodinámica o shock cardiogénico . En algunos casos, la combinación de una vía accesoria y ritmos cardíacos anormales puede desencadenar fibrilación ventricular , una de las principales causas de muerte cardíaca súbita. [ cita requerida ]
El WPW puede estar asociado con PRKAG2 , una enzima proteína quinasa codificada por el gen PRKAG2 . [9]
Paquete de Kent

El haz de Kent es una vía de conducción accesoria o extra-anormal entre las aurículas y los ventrículos que está presente en un pequeño porcentaje (entre el 0,1 y el 0,3 %) de la población general. [10] [11] [12] Esta vía puede comunicar entre la aurícula izquierda y el ventrículo izquierdo, en cuyo caso se denomina "preexcitación de tipo A", o entre la aurícula derecha y el ventrículo derecho, en cuyo caso se denomina "preexcitación de tipo B" en una clasificación antigua, actualmente abandonada. [13] Los problemas surgen cuando esta vía crea un circuito eléctrico que pasa por alto el nódulo AV. El nódulo AV es capaz de reducir la velocidad de conducción de los impulsos eléctricos a los ventrículos, mientras que el haz de Kent carece de esta capacidad. Cuando se realiza una conexión eléctrica aberrante a través del haz de Kent, pueden producirse taquiarritmias. [ cita requerida ]
Diagnóstico

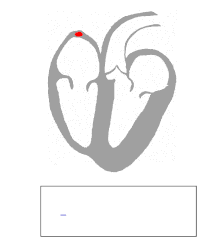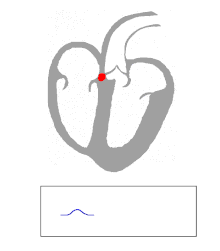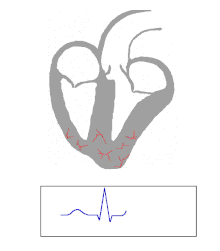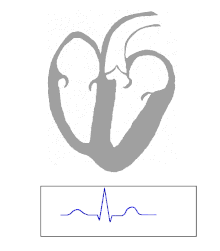
El WPW se diagnostica comúnmente en base al electrocardiograma en un individuo asintomático. En este caso, se manifiesta como una onda delta, que es un trazo ascendente arrastrado en el complejo QRS que se asocia con un intervalo PR corto. El intervalo PR corto y el arrastre del complejo QRS reflejan que el impulso llega a los ventrículos de manera temprana (a través de la vía accesoria) sin el retraso habitual que se experimenta en el nódulo AV. [ cita requerida ]
Si una persona con síndrome de WPW presenta episodios de fibrilación auricular, el ECG muestra una taquicardia polimórfica rápida de complejos anchos (sin torsades de pointes ). Esta combinación de fibrilación auricular y síndrome de WPW se considera peligrosa y la mayoría de los fármacos antiarrítmicos están contraindicados. [ cita requerida ]
Cuando un individuo está en ritmo sinusal normal , las características del ECG de WPW son un intervalo PR corto (de menos de 120 milisegundos de duración), un complejo QRS ensanchado (de más de 120 milisegundos de duración) con ascenso arrastrado del complejo QRS y cambios de repolarización secundaria (reflejados en cambios en el segmento ST y la onda T ). [ cita requerida ]
En las personas con WPW, la actividad eléctrica que se inicia en el nódulo SA viaja a través de la vía accesoria, así como a través del nódulo AV para activar los ventrículos a través de ambas vías. Dado que la vía accesoria no tiene las propiedades de desaceleración del impulso del nódulo AV, el impulso eléctrico activa primero los ventrículos a través de la vía accesoria, e inmediatamente después a través del nódulo AV. Esto produce el intervalo PR corto y el ascenso arrastrado del complejo QRS conocido como onda delta. [ cita requerida ]
En el caso de preexcitación tipo A (conexiones auriculoventriculares izquierdas), se observa una onda R positiva en V1 ("delta positiva") en las derivaciones precordiales del electrocardiograma, mientras que en la preexcitación tipo B (conexiones auriculoventriculares derechas), se observa una onda delta predominantemente negativa en la derivación V1 ("delta negativa"). [13]
Las personas con WPW pueden tener más de una vía accesoria; en algunos casos, se han encontrado hasta ocho vías anormales. Esto se ha observado en individuos con anomalía de Ebstein . [14]
El síndrome de Wolff–Parkinson–White a veces se asocia con la neuropatía óptica hereditaria de Leber , una forma de enfermedad mitocondrial . [15]
Estratificación de riesgos

El WPW conlleva un pequeño riesgo de muerte súbita, probablemente debido a una fibrilación auricular de conducción rápida que causa fibrilación ventricular. Si bien el riesgo general es de aproximadamente 2,4 por 1000 personas al año, el riesgo en un individuo depende de las propiedades de la vía accesoria que causa la preexcitación. [8]
Una historia de síncope puede sugerir una vía accesoria de mayor riesgo, pero la mejor manera de estratificar el riesgo es evaluando la frecuencia con la que una vía puede conducir impulsos a los ventrículos, generalmente mediante estimulación eléctrica programada (PES) en el laboratorio de electrofisiología cardíaca . Se trata de un procedimiento invasivo, pero generalmente de bajo riesgo, durante el cual se estimulan las aurículas para intentar inducir una taquicardia. Si se puede desencadenar una taquicardia que afecte a la vía accesoria, el cardiólogo puede evaluar la rapidez con la que la vía accesoria puede conducir. Cuanto más rápido pueda conducir, mayor será la probabilidad de que la vía accesoria pueda conducir lo suficientemente rápido como para desencadenar una taquicardia letal. [ cita requerida ]
Las características de alto riesgo que pueden estar presentes durante la PES incluyen un período refractario efectivo de la vía accesoria menor a 250 ms, vías múltiples, ubicación septal de la vía e inducibilidad de taquicardia supraventricular ( AVRT , fibrilación auricular). Las personas con cualquiera de estas características de alto riesgo generalmente se consideran en mayor riesgo de MSC o taquicardia sintomática, y deben ser tratadas en consecuencia (es decir: ablación con catéter). [16]
No está claro si la estratificación de riesgo invasiva (con PES) es necesaria en el individuo asintomático. [17] Mientras que algunos grupos abogan por la PES para la estratificación de riesgo en todos los individuos menores de 35 años, otros solo la ofrecen a individuos que tienen antecedentes sugestivos de taquiarritmia, ya que la incidencia de muerte súbita cardíaca es muy baja (menos del 0,6% en algunos informes). [12] [18] [19]
Otros métodos de estratificación del riesgo incluyen la observación de la frecuencia ventricular durante la fibrilación auricular espontánea en un ECG de 12 derivaciones. Los intervalos RR de menos de 250 ms sugieren una vía de mayor riesgo. Durante la prueba de esfuerzo, la pérdida abrupta de la preexcitación a medida que aumenta la frecuencia cardíaca también sugiere una vía de menor riesgo. [8] Sin embargo, este enfoque se ve obstaculizado por la mejora normal en la conducción del nodo AV durante el ejercicio, que también puede enmascarar la preexcitación a pesar de la conducción continua por la vía accesoria. [20]
Tratamiento
Según el protocolo ACLS , las personas con WPW que presentan ritmos cardíacos anormales rápidos ( taquiarritmias ) pueden requerir cardioversión eléctrica sincronizada si presentan signos o síntomas graves (por ejemplo, presión arterial baja o letargo con estado mental alterado ). Si están relativamente estables, se puede utilizar medicación. [21]
Medicamentos
El patrón de WPW con estabilidad hemodinámica y taquicardia supraventricular ortodrómica que conduce a una taquicardia regular de complejo estrecho puede manejarse de manera similar a otras taquicardias supraventriculares regulares de complejo estrecho: primero con maniobras vagales seguidas de una prueba con adenosina (tratamiento de primera línea). Las pautas ACC/AHA/HRS de 2015 recomiendan betabloqueantes o bloqueadores de los canales de calcio como agentes de segunda línea; la cardioversión eléctrica se reserva para arritmias refractarias. Sin embargo, si existe alguna duda sobre el diagnóstico de taquicardia supraventricular ortodrómica o si se observa una conducción aberrante que conduce a un QRS de complejo ancho, puede ser prudente manejarla como una taquicardia de complejo ancho indiferenciada. [22]
Las personas con fibrilación auricular y respuesta ventricular rápida pueden recibir tratamiento con amiodarona [7] o procainamida [23] para estabilizar su frecuencia cardíaca. La procainamida y la cardioversión son tratamientos aceptados para la conversión de la taquicardia que se encuentra en el síndrome de WPW. [24] La amiodarona en la fibrilación auricular con síndrome de WPW está relacionada con la fibrilación ventricular y, por lo tanto, puede ser peor que la procainamida. [7]
Los bloqueadores del nódulo AV deben evitarse en la fibrilación auricular y el aleteo auricular con WPW o antecedentes de este; esto incluye adenosina , diltiazem , verapamilo , otros bloqueadores de los canales de calcio y betabloqueantes . [25] Pueden exacerbar el síndrome al bloquear la vía eléctrica normal del corazón (favoreciendo así la conducción auricular a ventrículo 1:1 a través de la vía de preexcitación, lo que puede conducir a arritmias ventriculares inestables). [22]
Ablación con catéter
El tratamiento definitivo del WPW es la destrucción de la vía eléctrica anormal mediante ablación con catéter . Los dos tipos principales de ablación con catéter incluyen la ablación por radiofrecuencia con calor o la crioablación con energía fría. [6] Este procedimiento lo realizan electrofisiólogos cardíacos y tiene una alta tasa de éxito en manos de un electrofisiólogo experimentado. [26] Los hallazgos de 1994 indican tasas de éxito de hasta el 95% en personas tratadas con ablación con catéter por radiofrecuencia para WPW. [27] Si la ablación con catéter por radiofrecuencia se realiza con éxito, la afección generalmente se considera curada. Las tasas de recurrencia suelen ser inferiores al 5% después de una ablación exitosa. [26] Algunos pacientes, como los que tienen anomalía de Ebstein subyacente y miocardiopatías hereditarias , pueden tener múltiples vías accesorias. [28]
Historia
El haz de Kent debe su nombre al fisiólogo británico Albert Frank Stanley Kent (1863-1958), quien describió las ramas laterales en el surco auriculoventricular del corazón de mono (creyendo erróneamente que éstas constituían el sistema de conducción auriculoventricular normal). [29] [30]
En 1915, Frank Norman Wilson (1890-1952) fue el primero en describir la enfermedad que más tarde se denominó síndrome de Wolff-Parkinson-White. [31] Alfred M. Wedd (1887-1967) fue el siguiente en describir la enfermedad en 1921. [32] A los cardiólogos Louis Wolff (1898-1972), John Parkinson (1885-1976) y Paul Dudley White (1886-1973) se les atribuye la descripción definitiva del trastorno en 1930. [33]
Casos notables
- LaMarcus Aldridge , jugador de baloncesto estadounidense [34]
- Michael Cera , actor canadiense [35]
- Max Duggan , jugador de fútbol americano [36]
- Nathan Eagleton , ex jugador de fútbol australiano [37]
- Jeff Garlin , actor, escritor y comediante estadounidense [38]
- Quentin Groves , jugador de fútbol americano que murió de un ataque cardíaco a los 32 años [39]
- Dan Hardy , luchador de peso welter británico de la UFC , [40] convertido en analista y comentarista
- Alicia Hoskin , piragüista olímpica neozelandesa. [41]
- Mitch Hurwitz , guionista y productor de televisión estadounidense, creador de Arrested Development [38]
- Jessie J , músico británico [42]
- Marilyn Manson , músico, pintor y actor estadounidense [43]
- Meat Loaf , músico estadounidense [44]
- Michael Montgomery , jugador de fútbol americano [45]
- Montel Vontavious Porter , luchador profesional [46]
- Michael Rupp , jugador de hockey sobre hielo estadounidense [47]
Véase también
Referencias
- ^ abcdefghijk «Síndrome de Wolff-Parkinson-White». Genetics Home Reference . Biblioteca Nacional de Medicina de EE. UU. Marzo de 2017. Archivado desde el original el 27 de abril de 2017. Consultado el 30 de abril de 2017 .
- ^ abcdef «Síndrome de Wolff-Parkinson-White». rarediseases.info.nih.gov . 31 de diciembre de 2012. Archivado desde el original el 21 de abril de 2017 . Consultado el 30 de abril de 2017 .
- ^ abcde Bhatia A, Sra J, Akhtar M (marzo de 2016). "Síndromes de preexcitación". Problemas actuales en cardiología . 41 (3): 99–137. doi :10.1016/j.cpcardiol.2015.11.002. PMID 26897561.
- ^ ab Liu A, Pusalkar P (junio de 2011). "Síndrome de Wolff-Parkinson-White asintomático: diagnóstico incidental mediante ECG y revisión de la literatura sobre el tratamiento actual". BMJ Case Reports . 2011 : bcr0520114192. doi :10.1136/bcr.05.2011.4192. PMC 3128358. PMID 22693197 .
- ^ abcde Kim SS, Knight BP (mayo de 2017). "Riesgo a largo plazo del patrón y síndrome de Wolff-Parkinson-White". Tendencias en medicina cardiovascular . 27 (4): 260–268. doi :10.1016/j.tcm.2016.12.001. PMID 28108086.
- ^ abc "Clínica del síndrome de Wolff-Parkinson-White". UWHealthkids.org . Hospitales y clínicas de la Universidad de Wisconsin. 29 de marzo de 2019. Archivado desde el original el 30 de noviembre de 2020 . Consultado el 22 de marzo de 2021 .
- ^ abc Simonian SM, Lotfipour S, Wall C, Langdorf MI (octubre de 2010). "Cuestionando la superioridad de la amiodarona para el control de la frecuencia cardíaca en pacientes con enfermedad de Wolff-Parkinson-White y fibrilación auricular". Medicina interna y de urgencias . 5 (5): 421–426. doi :10.1007/s11739-010-0385-6. PMID 20437113. S2CID 25283602.
- ^ abc Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomström-Lundqvist C, et al. (febrero de 2020). "Guía de la ESC de 2019 para el tratamiento de pacientes con taquicardia supraventricular. Grupo de trabajo para el tratamiento de pacientes con taquicardia supraventricular de la Sociedad Europea de Cardiología (ESC)". Revista Europea del Corazón . 41 (5): 655–720. doi : 10.1093/eurheartj/ehz467 . hdl : 1887/3232621 . PMID 31504425.
- ^ Gollob MH (enero de 2008). "Modulación de la expresión fenotípica del síndrome cardíaco PRKAG2". Circulation . 117 (2): 134–135. doi :10.1161/CIRCULATIONAHA.107.747345. PMID 18195183. S2CID 7581082.
- ^ Rosner MH, Brady WJ, Kefer MP, Martin ML (noviembre de 1999). "Electrocardiografía en el paciente con síndrome de Wolff-Parkinson-White: cuestiones diagnósticas y terapéuticas iniciales". The American Journal of Emergency Medicine . 17 (7): 705–714. doi :10.1016/S0735-6757(99)90167-5. PMID 10597097.
- ^ Sorbo MD, Buja GF, Miorelli M, Nistri S, Perrone C, Manca S, et al. (junio de 1995). "[La prevalencia del síndrome de Wolff-Parkinson-White en una población de 116.542 hombres jóvenes]". Giornale Italiano di Cardiologia (en italiano). 25 (6): 681–687. PMID 7649416.
- ^ ab Munger TM, Packer DL, Hammill SC, Feldman BJ, Bailey KR, Ballard DJ, et al. (marzo de 1993). "Un estudio poblacional de la historia natural del síndrome de Wolff-Parkinson-White en el condado de Olmsted, Minnesota, 1953-1989". Circulation . 87 (3): 866–873. doi : 10.1161/01.CIR.87.3.866 . PMID 8443907.
- ^ ab "Cambios en la despolarización auricular y ventricular". americanheart.org . 24 de noviembre de 2008. Archivado desde el original el 17 de septiembre de 2010.
- ^ "Anomalía de Ebstein". Biblioteca de conceptos médicos de Lecturio . Consultado el 25 de agosto de 2021 .
- ^ Mashima Y, Kigasawa K, Hasegawa H, Tani M, Oguchi Y (diciembre de 1996). "Alta incidencia del síndrome de preexcitación en familias japonesas con neuropatía óptica hereditaria de Leber". Clinical Genetics . 50 (6): 535–537. doi :10.1111/j.1399-0004.1996.tb02732.x. PMID 9147893. S2CID 11057255.
- ^ Pappone C, Santinelli V, Manguso F, Augello G, Santinelli O, Vicedomini G, et al. (noviembre de 2003). "Un estudio aleatorizado de ablación profiláctica con catéter en pacientes asintomáticos con el síndrome de Wolff-Parkinson-White". The New England Journal of Medicine . 349 (19): 1803–1811. doi : 10.1056/NEJMoa035345 . PMID 14602878.
- ^ Campbell RM, Strieper MJ, Frias PA, Collins KK, Van Hare GF, Dubin AM (marzo de 2003). "Encuesta sobre la práctica actual de electrofisiólogos pediátricos para el síndrome de Wolff-Parkinson-White asintomático". Pediatrics . 111 (3): e245–e247. doi :10.1542/peds.111.3.e245. PMID 12612279. Archivado desde el original el 30 de enero de 2011.
- ^ Fitzsimmons PJ, McWhirter PD, Peterson DW, Kruyer WB (septiembre de 2001). "La historia natural del síndrome de Wolff-Parkinson-White en 228 aviadores militares: un seguimiento a largo plazo de 22 años". American Heart Journal . 142 (3): 530–536. doi :10.1067/mhj.2001.117779. PMID 11526369.
- ^ Kenyon J (24 de noviembre de 2014). "Síndrome de Wolff-Parkinson-White y riesgo de muerte cardíaca súbita". Sitio web de Doctors Lounge . Archivado desde el original el 10 de octubre de 2010. Consultado el 7 de octubre de 2010 .
- ^ Josephson ME (2015). Electrofisiología cardíaca clínica de Josephson: técnicas e interpretaciones (Quinta edición). Baltimore, MD: Wolters Kluwer. ISBN 978-1-4963-2661-4. OCLC 938434294.[ página necesaria ]
- ^ Page RL, Joglar JA, Caldwell MA, Calkins H, Conti JB, Deal BJ, et al. (abril de 2016). "Guía ACC/AHA/HRS de 2015 para el tratamiento de pacientes adultos con taquicardia supraventricular: un informe del grupo de trabajo sobre guías de práctica clínica del Colegio Estadounidense de Cardiología/Asociación Estadounidense del Corazón y la Heart Rhythm Society". Circulation . 133 (14): e506–e574. doi : 10.1161/CIR.0000000000000311 . PMID 26399663.
- ^ ab Chhabra L, Goyal A, Benham MD (agosto de 2022). "Síndrome de Wolff-Parkinson-White". StatPearls [Internet] . Treasure Island (FL): StatPearls Publishing. PMID 32119324. Consultado el 15 de febrero de 2022 .
- ^ Fengler BT, Brady WJ, Plautz CU (junio de 2007). "Fibrilación auricular en el síndrome de Wolff-Parkinson-White: reconocimiento y tratamiento mediante ECG en urgencias". The American Journal of Emergency Medicine . 25 (5): 576–583. doi :10.1016/j.ajem.2006.10.017. PMID 17543664.
- ^ Ritchie JV, Juliano ML, Thurman RJ. "23: Anormalidades en el ECG". En Knoop KJ, Stack LB, Storrow AB, Thurman RJ (eds.). Atlas de Medicina de Urgencias, 3.ª edición .
- ^ Wald DA (2009). "Resuscitation" (Reanimación) . En Lex J (ed.). Preguntas y respuestas sobre medicina de urgencias (3.ª ed.). McGraw–Hill. pág. 4. ISBN 978-0-7216-5944-2.
- ^ ab Pappone C, Lamberti F, Santomauro M, Stabile G, De Simone A, Turco P, et al. (Diciembre de 1993). "[Ablación de taquicardia paroxística en el síndrome de Wolff-Parkinson-White]". Cardiología (en italiano). 38 (12 Suplemento 1): 189–197. PMID 8020017.
- ^ Thakur RK, Klein GJ, Yee R (septiembre de 1994). "Ablación con catéter de radiofrecuencia en pacientes con síndrome de Wolff-Parkinson-White". CMAJ . 151 (6): 771–776. PMC 1337132 . PMID 8087753.
- ^ Zachariah JP, Walsh EP, Triedman JK, Berul CI, Cecchin F, Alexander ME, Bevilacqua LM (enero de 2013). "Vías accesorias múltiples en los jóvenes: el impacto de la cardiopatía estructural". American Heart Journal . 165 (1): 87–92. doi :10.1016/j.ahj.2012.10.025. PMC 3523339 . PMID 23237138.
- ^ Kent AF (mayo de 1893). "Investigaciones sobre la estructura y función del corazón de los mamíferos". The Journal of Physiology . 14 (4–5): i2-254. doi :10.1113/jphysiol.1893.sp000451. PMC 1514401 . PMID 16992052.
- ^ Kent AF (1914). "Un camino conductor entre la aurícula derecha y la pared externa del ventrículo derecho en el corazón del mamífero". Journal of Physiology . 48 : 57.
- ^ Wilson FN (1915). "Un caso en el que el vago influyó en la forma del complejo ventricular del electrocardiograma". Archivos de Medicina Interna . 16 (6): 1008–27. doi :10.1001/archinte.1915.00080060120009.
- ^ Wedd AM (1921). "Taquicardia paroxística, con referencia a la taquicardia nomotrópica y el papel de los nervios cardíacos extrínsecos". Archivos de Medicina Interna . 27 (5): 571–90. doi :10.1001/archinte.1921.00100110056003.
- ^ Wolff L, Parkinson J, White PD (1930). "Bloqueo de rama con intervalo PR corto en personas jóvenes sanas propensas a taquicardia paroxística". American Heart Journal . 5 (6): 685–704. doi :10.1016/S0002-8703(30)90086-5.
- ^ "Aldridge fuera por el síndrome de Wolff-Parkinson-White". ESPN.com . Associated Press. 2007-04-10. Archivado desde el original el 2012-11-05 . Consultado el 2007-04-10 .
- ^ Hedegaard E (19 de agosto de 2010). «Michael Cera: Nerdchild in the Promised Land». Rolling Stone . Archivado desde el original el 27 de febrero de 2015. Consultado el 11 de marzo de 2015 .
- ^ "Cirugía cardíaca, lesiones en los pies, un descenso a reserva: Max Duggan los superó todos". Texas Monthly . 2 de diciembre de 2022 . Consultado el 9 de diciembre de 2022 .
- ^ Landsberger S (17 de abril de 2008). «Perro valiente y de gran corazón». Archivado desde el original el 22 de diciembre de 2008. Consultado el 17 de abril de 2008 .
- ^ ab "Por cierto, en conversación con Jeff Garlin, episodio n.° 5 del podcast". Archivado desde el original el 11 de marzo de 2013.
- ^ Werner B (15 de octubre de 2016). "Quentin Groves, ex jugador de los Jaguars procedente de Auburn, falleció a los 32 años". FOX Sports . Archivado desde el original el 16 de octubre de 2016.
- ^ O'Regan JJ (22 de marzo de 2013). "Dan Hardy "tiene corazón de lobo"". Fighters Only . Archivado desde el original el 23 de marzo de 2013. Consultado el 10 de mayo de 2013 .
- ^ "Alicia Hoskinn". Eventos y medallas, información biográfica . Comité Olímpico Internacional (COI). Archivado desde el original el 2021-08-05 . Consultado el 2021-08-13 .
- ^ Annie D. (21 de noviembre de 2014). "Jessie J comparte su batalla contra la enfermedad cardíaca". International Business Times . Archivado desde el original el 1 de julio de 2015.
- ^ Lannak E. "Enfermedad cardíaca de Wolff Parkinson-White". Living Healthy 360. Archivado desde el original el 2014-07-02 . Consultado el 2014-12-05 .
- ^ "Meat Loaf recuerda el desplome del escenario". BBC News . 2003-11-28. Archivado desde el original el 2009-01-11 . Consultado el 2007-04-17 .
- ^ Cessna R (8 de octubre de 2004). "La defensa de Texas A&M recibe todo el apoyo". aggiesports.com . Archivado desde el original el 2015-04-02 . Consultado el 2015-03-27 .
- ^ Robinson J (24 de mayo de 2007). "Montel Vontavious Porter habla de Benoit, su atuendo y de cómo se incendió". Entrevista a MVP . IGN. Archivado desde el original el 13 de octubre de 2007. Consultado el 6 de octubre de 2007 .
- ^ Chere R (25 de septiembre de 2008). "Rupp, de los New Jersey Devils, ha estado en el lugar de su compañero Tallackson". NJ.com . Archivado desde el original el 5 de diciembre de 2008. Consultado el 21 de noviembre de 2008 .
Enlaces externos
- Referencia Genética Home: Síndrome de Wolff-Parkinson-White ( Biblioteca Nacional de Medicina de los Estados Unidos , Bethesda, Maryland)
- Clínica del síndrome de Wolff-Parkinson-White, Universidad de Wisconsin-Madison