Química del organoaluminio

La química de organoaluminio es el estudio de compuestos que contienen enlaces entre carbono y aluminio . Es uno de los temas principales dentro de la química organometálica . [1] [2] Los compuestos de organoaluminio ilustrativos son el dímero trimetilaluminio , el monómero triisobutilaluminio y el compuesto de titanio-aluminio llamado reactivo de Tebbe . El comportamiento de los compuestos de organoaluminio se puede entender en términos de la polaridad del enlace C-Al y la alta acidez de Lewis de las especies tricoordinadas. Industrialmente, estos compuestos se utilizan principalmente para la producción de poliolefinas .
Historia
El primer compuesto de organoaluminio (C 2 H 5 ) 3 Al 2 I 3 se descubrió en 1859. [3] Sin embargo, los compuestos de organoaluminio eran poco conocidos hasta la década de 1950, cuando Karl Ziegler y sus colegas descubrieron la síntesis directa de compuestos de trialquilaluminio y aplicaron estos compuestos a la polimerización catalítica de olefinas . Esta línea de investigación finalmente resultó en el Premio Nobel para Ziegler.
Estructura y unión
Compuestos de aluminio (III)
Los compuestos de organoaluminio generalmente presentan centros de Al de tres y cuatro coordenadas, aunque se observan números de coordinación más altos con ligandos inorgánicos como el fluoruro . De acuerdo con las tendencias habituales, el Al de cuatro coordenadas prefiere ser tetraédrico. A diferencia del boro, el aluminio es un átomo más grande y acomoda fácilmente cuatro ligandos de carbono. Los compuestos de triorganoaluminio son, por lo tanto, generalmente diméricos con un par de ligandos de alquilo puente , por ejemplo, Al 2 (C 2 H 5 ) 4 (μ-C 2 H 5 ) 2 . Por lo tanto, a pesar de su nombre común de trietilaluminio, este compuesto contiene dos centros de aluminio y seis grupos etilo . Cuando el compuesto de organoaluminio contiene hidruro o haluro , estos ligandos más pequeños tienden a ocupar los sitios de puente. La triple coordinación ocurre cuando los grupos R son voluminosos, por ejemplo , Al(Mes) 3 (Mes = 2,4,6-Me3C6H2 o mesitilo ) o isobutilo. [ 4]

Intercambio de ligandos en compuestos de trialquilaluminio
Los dímeros de trialquilaluminio a menudo participan en equilibrios dinámicos, lo que resulta en el intercambio de ligandos puente y terminales, así como el intercambio de ligandos entre dímeros. Incluso en disolventes no coordinantes , el intercambio Al-Me es rápido, como lo confirma la espectroscopia de RMN de protones . Por ejemplo, a −25 °C, el espectro de RMN 1 H de Me 6 Al 2 comprende dos señales en una proporción de 1:2, como se esperaba de la estructura del estado sólido. A 20 °C, solo se observa una señal porque el intercambio de grupos metilo terminales y puente es demasiado rápido para ser resuelto por RMN. [5] La alta acidez de Lewis de las especies monoméricas está relacionada con el tamaño del centro Al (III) y su tendencia a lograr una configuración de octeto .
Compuestos de organoaluminio de bajo estado de oxidación
El primer compuesto de organoaluminio con un enlace Al-Al se informó en 1988 como (((Me 3 Si) 2 CH) 2 Al) 2 (un dialano). Se preparan típicamente por reducción de los cloruros de dialquilaluminio con potasio metálico: [6]
- ( R2AlCl ) 2 +2K → R2Al - AlR2 + 2KCl
Otro grupo notable de alanos son los tetraalanos que contienen cuatro centros Al(I). Estos compuestos adoptan un núcleo tetraédrico , como lo ilustran ( Cp* Al) 4 y ((Me 3 Si 3 C)Al) 4 . El grupo [Al 12 ( i-Bu ) 12 ] 2− se obtuvo a partir de investigaciones relacionadas con la reducción de compuestos de organoaluminio. Este dianión adopta una estructura icosaédrica que recuerda al dodecaborato ([B 12 H 12 ] 2− ). Su estado de oxidación formal es menor que uno.
Preparación
A partir de haluros de alquilo y aluminio
Industrialmente, los alquil- aluminios simples del tipo Al2R6 ( R = Me, Et) se preparan en un proceso de dos pasos que comienza con la alquilación del polvo de aluminio:
- 2Al + 3CH3CH2Cl → ( CH3CH2 ) 3Al2Cl3
La reacción se asemeja a la síntesis de reactivos de Grignard . El producto, (CH3CH2 ) 3Al2Cl3 , se llama sesquicloruro de etilaluminio . El término sesquicloruro se refiere al hecho de que, en promedio, la relación Cl :Al es 1,5. Estos sesquicloruros se pueden convertir en derivados de triorganoaluminio por reducción:
- 2 (CH 3 CH 2 ) 3 Al 2 Cl 3 + 6 Na → (CH 3 CH 2 ) 6 Al 2 + 2 Al + 6 NaCl
Este método se utiliza para la producción de trimetilaluminio y trietilaluminio . [7]
La reacción general para la producción de estos compuestos simples de alquilaluminio es la siguiente:
- 2Al + 6RX + 6M → Al 2 R 6 + 6MX (donde M es un metal alcalino y X es un halógeno)
Hidroaluminización
El polvo de aluminio reacciona directamente con ciertos alquenos terminales en presencia de hidrógeno. El proceso consta de dos pasos, el primero de los cuales produce hidruros de dialquilaluminio. Estas reacciones suelen realizarse a temperaturas elevadas y requieren la activación mediante reactivos de trialquilaluminio:
- 6 Al + 3 H 2 + 12 CH 2 = CHR → 2 [HAl(CH 2 CHR) 2 ] 3
En el caso de los grupos R no voluminosos, los hidruros de organoaluminio suelen ser triméricos. En un paso posterior, estos hidruros se tratan con más alqueno para lograr la hidroaluminización:
- 2[HAl(CH2CHR ) 2 ] 3 + 3CH2 = CHR → 3[ Al2 ( CH2CHR ) 3
El hidruro de diisobutilaluminio , que es dimérico, se prepara mediante eliminación de hidruro a partir de triisobutilaluminio:
- 2 i -Bu 3 Al → ( i -Bu 2 AlH) 2 + 2 (CH 3 ) 2 C=CH 2
Carboaluminización
Los compuestos de organoaluminio pueden reaccionar con alquenos y alquinos, lo que da como resultado la adición neta de un grupo organilo y el fragmento metálico a través del enlace múltiple (carboaluminización). Este proceso puede realizarse de manera puramente térmica o en presencia de un catalizador de metal de transición. Para el proceso no catalizado, la monoadición solo es posible cuando se sustituye el alqueno. Para el etileno, la carboaluminización conduce a una distribución de Poisson de especies de alquilaluminio superiores. La reacción es regioselectiva para 1-alquenos . [8] La llamada reacción ZACA informada por primera vez por Ei-ichi Negishi es un ejemplo de una carboaluminización asimétrica de alquenos catalizada por un catalizador de zirconoceno quiral. [9]
La metilaluminación de alquinos en presencia de Cp2ZrCl2 [ 10 ] [11] se emplea para la síntesis de fragmentos de olefina trisustituidos estereodefinidos, una subestructura común en productos naturales de terpenos y policétidos. La síntesis de ( E ) -4-yodo-3-metilbut-3-en-1-ol [12] que se muestra a continuación es una aplicación típica de esta reacción:
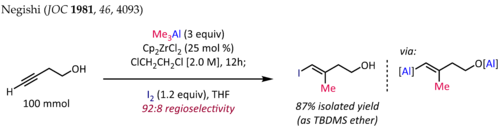
En el caso de los alquinos terminales, la reacción generalmente se desarrolla con buena regioselectividad (>90:10 rr) y selectividad syn completa , incluso en presencia de sustituyentes heteroátomos propargílicos u homopropargílicos. Desafortunadamente, la extensión de la metilaluminación catalizada por zirconoceno a la alquilaluminación con alquilos superiores da como resultado rendimientos más bajos y regioselectividades deficientes.
Preparaciones de laboratorio
Aunque los miembros simples están disponibles comercialmente a bajo costo, se han desarrollado muchos métodos para su síntesis en el laboratorio, incluida la metátesis o la transmetalación .
- La metátesis del tricloruro de aluminio con RLi o RMgX da el trialquilo:
- AlCl 3 + 3 BuLi → Bu 3 Al + 3 LiCl
- Transmetalación:
- 2Al + 3HgPh2 → 2AlPh3 + 3Hg
Reacciones
La alta reactividad de los compuestos organoaluminios hacia los electrófilos se atribuye a la separación de carga entre el átomo de aluminio y el de carbono .
Acidez de Lewis
Los compuestos de organoaluminio son ácidos duros y forman fácilmente aductos con bases como la piridina , el THF y las aminas terciarias . Estos aductos son tetraédricos en Al.
Electrofilos
El enlace Al–C está polarizado de modo que el carbono es muy básico. Los ácidos reaccionan para formar alcanos. Por ejemplo, los alcoholes forman alcóxidos :
- AlR' 3 + ROH → 1/n (R' 2 Al−OR) n + R'H
Además de los ácidos minerales simples, se puede emplear una amplia variedad de ácidos. Las aminas dan derivados amido. Con dióxido de carbono , los compuestos de trialquilaluminio dan carboxilato de dialquilaluminio y, posteriormente, dicarboxilatos de alquil aluminio:
- AlR3 + CO2 → R2AlO2CR
- R2AlO2CR + CO2 → RAl ( O2CR ) 2
La conversión recuerda a la carbonatación de los reactivos de Grignard . [13] [14] [15]
De manera similar, la reacción entre compuestos de trialquilaluminio y dióxido de carbono se ha utilizado para sintetizar alcoholes, olefinas [13] o cetonas. [16]
Con oxígeno se obtienen los correspondientes alcóxidos, que pueden hidrolizarse a los alcoholes:
- AlR3 +3/2O2 → Al (OR) 3
Un peróxido de aluminio orgánico caracterizado estructuralmente es [{HC[C(Me)NC 6 H 5 ] 2 }Al(R)-OO-CMe 3 ] [R=CH(SiMe 3 ) 2 ]. [17]
La reacción entre compuestos de trialquilaluminio puro y agua , alcoholes , fenoles , aminas , dióxido de carbono , óxidos de azufre , óxidos de nitrógeno , halógenos e hidrocarburos halogenados puede ser violenta. [18] [19]
Aplicaciones
Los compuestos de organoaluminio se utilizan ampliamente en la producción de alquenos, alcoholes y polímeros. Algunos procesos relevantes incluyen el Proceso Ziegler para la producción de alcoholes a partir de etileno. Existen varias tecnologías para la oligomerización de etileno para dar alfa-olefinas. [20] Los compuestos de organoaluminio se utilizan como catalizadores para la polimerización de alquenos a poliolefinas , por ejemplo, el catalizador metilaluminoxano .
Referencias
- ^ DF Shriver; PW Atkins (2006). Química inorgánica . Oxford University Press. ISBN 978-0199264636.
- ^ M. Witt; HW Roesky (2000). "La química del organoaluminio en la vanguardia de la investigación y el desarrollo" (PDF) . Curr. Sci . 78 (4): 410. Archivado desde el original (PDF) el 2014-10-06.
- ^ Hallwachs, W.; Schafarik, A. (1859). "Ueber die Verbindungen der Erdmetalle mit organischen Radicalen". Liebigs Ann. química . 109 (2): 206–209. doi :10.1002/jlac.18591090214.
- ^ Elschenbroich, C. (2006). Organometálicos (3ª ed.). Weinheim: Wiley-VCH. ISBN 978-3-527-29390-2.
- ^ Algodón, Frank Albert; Wilkinson, Geoffrey (1980). Química inorgánica avanzada . pág. 343. ISBN 978-0-471-02775-1.
- ^ Uhl, W. (2004). Compuestos organoelementales que poseen enlaces sencillos Al---Al, Ga---Ga, In---In y Tl---Tl . Avances en química organometálica. Vol. 51. págs. 53–108. doi :10.1016/S0065-3055(03)51002-4. ISBN 9780120311514.
- ^ Michael J. Krause, Frank Orlandi, Alfred T. Saurage y Joseph R. Zietz "Compuestos de aluminio, orgánicos" en Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi :10.1002/14356007.a01_543
- ^ Barry M. Trost; Martin F. Semmelhack; Ian Fleming (1992). Síntesis orgánica integral: adiciones y sustituciones en enlaces CC[pi] . Pergamon. ISBN 9780080405957.
- ^ Negishi, Ei-ichi (2011). "Descubrimiento de la reacción ZACA: carboaluminización asimétrica de alquenos catalizada por Zr". Arkivoc . 2011 (viii): 34–53. doi : 10.3998/ark.5550190.0012.803 . hdl : 2027/spo.5550190.0012.803 .
- ^ Negishi, Ei-ichi; Wang, Guangwei; Rao, Honghua; Xu, Zhaoqing (14 de mayo de 2010). "Acoplamiento cruzado catalizado por Pd mediante elementometalación de alquinos. Hacia la síntesis de todos los tipos concebibles de alquenos acíclicos con altos rendimientos, de manera eficiente, selectiva, económica y segura: la vía "verde"". The Journal of Organic Chemistry . 75 (10): 3151–3182. doi :10.1021/jo1003218. PMC 2933819 . PMID 20465291.
- ^ Negishi, Ei-ichi (2002). Organometálicos en síntesis: un manual (Ed. M. Schlosser) . Chichester, West Sussex, Reino Unido: Wiley. págs. 963–975. ISBN. 978-0471984160.
- ^ Rand, Cynthia L.; Horn, David E. Van; Moore, Mark W.; Negishi, Eiichi (1 de mayo de 2002). "Una ruta versátil y selectiva para sintones de (E)-alquenos trisustituidos difuncionales mediante carboaluminización de alquinos catalizada por circonio". The Journal of Organic Chemistry . 46 (20): 4093–4096. doi :10.1021/jo00333a041.
- ^ ab Yur'ev, VP; Kuchin, AV; Tolstikov, GA (1974). "Reacción de trialquilos de aluminio con dióxido de carbono". Química orgánica y biológica . 23 (4): 817–819. doi :10.1007/BF00923507.
- ^ Ziegler, K. (1956). "Neue Entwicklungen der metallorganischen Synthese". Angélica. química . 68 (23): 721–729. Código bibliográfico : 1956AngCh..68..721Z. doi : 10.1002/ange.19560682302.
- ^ Zajarkin, LI; Gavrilenko, VV; Ivanov, LL (1967). Zh. Obshch. Jim . 377 : 992.
{{cite journal}}: Falta o está vacío|title=( ayuda ) - ^ David W. Marshall, patente estadounidense US3168570, asignada a Continental Oil
- ^ W. Uhl; B. Jana (2008). "Un peróxido de alquilaluminio persistente: Estabilidad sorprendente de una molécula con fuertes funciones reductoras y oxidantes en estrecha proximidad". Chem. Eur. J. 14 ( 10): 3067–71. doi :10.1002/chem.200701916. PMID 18283706.
- ^ Hoja de datos de seguridad de productos químicos Cameo
- ^ Manejo seguro de productos químicos 1980. p. 929
- ^ Schmidt, Roland; Griesbaum, Karl; Behr, Arno; Biedenkapp, Dieter; Voges, Heinz-Werner; Garbe, Dorotea; Paetz, cristiano; Collin, Gerd; Mayer, Dieter; Höke, Hartmut (2014). "Hidrocarburos". Enciclopedia de química industrial de Ullmann . págs. 1–74. doi :10.1002/14356007.a13_227.pub3. ISBN 9783527306732.