Placa neural
| Placa neural | |
|---|---|
 Cresta neural | |
| Detalles | |
| Escenario Carnegie | 9 |
| Días | 19 |
| Precursor | Ectodermo |
| Da lugar a | Pliegues neurales |
| Sistema | Sistema nervioso central |
| Identificadores | |
| latín | lámina neural |
| Malla | D054258 |
| ESO | placa_por_E5.13.1.0.1.0.1 E5.13.1.0.1.0.1 |
| Terminología anatómica [editar en Wikidata] | |
En embriología , la placa neural es una estructura clave del desarrollo que sirve como base para el sistema nervioso . Craneal al nodo primitivo de la línea primitiva embrionaria , el tejido ectodérmico se engrosa y se aplana para convertirse en la placa neural. La región anterior al nodo primitivo puede denominarse generalmente placa neural. Las células adquieren una apariencia columnar en el proceso a medida que continúan alargándose y estrechándose. Los extremos de la placa neural, conocidos como pliegues neurales , empujan los extremos de la placa hacia arriba y juntos, plegándose en el tubo neural , una estructura fundamental para el desarrollo del cerebro y la médula espinal . Este proceso en su conjunto se denomina neurulación primaria . [1]
Las proteínas de señalización también son importantes en el desarrollo de la placa neural y ayudan a diferenciar el tejido destinado a convertirse en la placa neural. Entre los ejemplos de dichas proteínas se incluyen las proteínas morfogenéticas óseas y las cadherinas . La expresión de estas proteínas es esencial para el plegamiento de la placa neural y la posterior formación del tubo neural.
Participación en la neurulación primaria
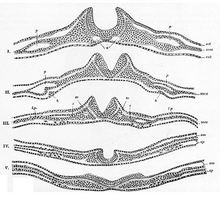
Generalmente dividido en cuatro, el proceso de neurulación primaria involucra a la placa neural en los primeros tres pasos. La formación y el plegamiento de la placa neural es el primer paso en la neurulación primaria . A esto le sigue el refinamiento y el crecimiento de las células de la placa neural. El tercer paso de la neurulación primaria no involucra a la placa neural per se, sino más bien a los bordes de la placa neural, que se unen, convirtiendo la placa en el inicio del tubo neural . Una vez que la placa neural se ha plegado en un tubo, los pliegues neurales se unen para completar la fusión del tubo neural. Este proceso se ilustra en la figura de la derecha, donde la placa neural se muestra en violeta. El verde lima marca los bordes de la placa neural, que se convierten en los pliegues neurales, involucrados en el plegamiento de la placa para crear el tubo neural. La figura demuestra el desarrollo de la placa neural en el tubo neural, que es de donde también se derivan las células de la cresta neural . [1]
En la neurulación primaria, la capa de ectodermo se divide en tres conjuntos de células: el tubo neural (futuro cerebro y médula espinal), la epidermis (piel) y las células de la cresta neural (conecta la epidermis y el tubo neural y migrará para producir neuronas , glía y pigmentación de células de la piel). [1]
Desarrollo
Durante la etapa de formación de la placa neural, el embrión consta de tres capas celulares : el ectodermo , que finalmente forma la piel y los tejidos neurales; el mesodermo , que forma los músculos y los huesos; y el endodermo , que formará las células que recubren los tractos digestivo y respiratorio. Las células progenitoras que forman los precursores de los tejidos neurales en la placa neural se denominan células neuroepiteliales . [ cita requerida ]
Las células ectodérmicas de la porción dorsal del embrión, que se extienden sobre la notocorda , son las que finalmente forman la placa neural. Aproximadamente la mitad de esas células serán inducidas a permanecer como ectodermo, mientras que la otra mitad formará la placa neural. [2] [3]
La formación de la placa neural y del tubo neural se produce en cuatro etapas: formación, curvatura, convergencia y cierre. La formación de la placa neural comienza cuando el mesodermo dorsal envía señales a las células ectodérmicas situadas por encima de ella para que se alarguen y se conviertan en células de la placa neural columnar. [4] Esta forma diferente distingue a las células de la presunta placa neural de otras células preepidérmicas. Si la placa neural se separa por sí sola, se desarrollará para formar una placa más delgada, pero no formará un tubo neural. Si se aísla la región que contiene la presunta epidermis y el tejido de la placa neural, se formarán pequeños pliegues neurales . La elongación que se produce durante la formación de la placa neural y el cierre del tubo neural es vital; se observa que las áreas de cierre del tubo neural tienen una actividad de elongación muy aumentada en la línea media en comparación con las áreas ya cerradas cuando la placa estaba empezando a tomar la forma de un tubo. [5]

La curvatura de la placa neural implica la formación de bisagras, donde la placa neural se conecta a los tejidos circundantes. La línea media de la placa neural se conoce como punto de bisagra medial (MHP). Las células en esta área, conocidas como células del punto de bisagra medial debido a su participación en esta estructura, se estabilizan y se conectan a la notocorda. Se derivan del área de la placa neural anterior al nudo primitivo. La notocorda comenzará los cambios de forma en las células MHP. Estas células disminuirán en altura y adquirirán forma de cuña. Otro tipo de punto de bisagra se produce dorsalmente-lateralmente, conocido como punto de bisagra dorso-lateral (DLHP). Estas regiones se surcan y cambian de forma de la misma manera que lo hacen las células MHP antes de conectarse entre sí para formar el tubo neural. Se vio en un experimento que sin la notocorda, las características del MHP no se desarrollaron correctamente, por lo que la formación de la placa neural y el tubo neural no se produjo correctamente. [6] La comunicación entre la placa neural y la notocorda es importante para la futura inducción y formación del tubo neural.
El cierre del tubo neural se completa cuando los pliegues neurales se juntan, adhiriéndose entre sí. Mientras que las células que permanecen como tubo neural forman el cerebro y la médula espinal, las otras células que formaban parte de la placa neural migran fuera del tubo como células de la cresta neural. Después de una transición epitelial-mesenquimal , estas células forman el sistema nervioso autónomo y ciertas células del sistema nervioso periférico . [7]
Señalización celular y proteínas esenciales
La N-cadherina, un tipo de proteína asociada al sistema nervioso, es fundamental para el plegamiento y funcionamiento adecuados de la placa neural . La N-cadherina es fundamental para mantener unidas las células de la placa neural. Además, las células destinadas a convertirse en células de la placa neural expresan la molécula de adhesión celular nerviosa (NCAM) para fomentar la cohesión de la placa neural. Otra cadherina, la E-cadherina, es expresada por las células ectodérmicas en el proceso de desarrollo de la placa neural. [1]

La proteína morfogenética ósea 4 , o BMP4, es un factor de crecimiento transformante que hace que las células del ectodermo se diferencien en células de la piel. Sin BMP4, las células del ectodermo se desarrollarían en células neuronales. Las células del mesodermo axial debajo del ectodermo secretan señales inhibidoras llamadas cordina , noggin y folistatina . Estas señales inhibidoras impiden la acción de BMP4, que normalmente convertiría a las células en ectodermo; como resultado, las células suprayacentes siguen su curso normal y se desarrollan en células neuronales. Las células del ectodermo que circunscriben estas células neuronales no reciben las señales inhibidoras de BMP4 y, como resultado, BMP4 induce a estas células a desarrollarse en células de la piel. [8]
Los especificadores del borde de la placa neural se inducen como un conjunto de factores de transcripción. Distalless-5, PAX3 y PAX7 evitan que la región del borde se convierta en placa neural o epidermis. [1] Estos inducen un segundo conjunto de factores de transcripción llamados especificadores de la cresta neural, que hacen que las células se conviertan en células de la cresta neural .
En una placa neural recién formada, el ARNm de PAX3, el ARNm de MSX1 y las proteínas MSX1/MSX2 se expresan mediolateralmente. [9] Cuando la placa neural comienza a plegarse, las áreas rostrales de la placa neural no expresan las proteínas Pax3 y MSX. Las áreas caudales al cierre del tubo neural tienen la expresión de PAX3 y MSX restringida a las regiones laterales de los pliegues neurales. [9] Estas fluctuaciones en la expresión de ARNm y proteínas aluden a cómo desempeñan un papel en la diferenciación de las células de la placa neural.
Los niveles bajos de pSMAD 1, 5, 8 permiten una mayor movilidad en el punto de articulación medio que en las células de la placa neural lateral. [10] Esta flexibilidad permite el pivoteo y la articulación que permiten el pandeo y la elevación de la placa neural al formatear el tubo neural. La placa neural tiene que ser lo suficientemente rígida para que se produzcan movimientos morfogénicos y lo suficientemente flexible para sufrir cambios de forma y posición para la transformación al tubo neural.
Otros animales
El cierre del tubo neural varía según la especie, siendo las diferencias entre humanos y pollos unas de las más estudiadas. En los humanos, el tubo neural se fusiona a partir de una región central del embrión y se desplaza hacia el exterior. En los pollos, el cierre del tubo neural comienza en la futura región del mesencéfalo y se cierra en ambas direcciones. [1] En las aves y los mamíferos, el cierre no se produce al mismo tiempo.
En los embriones de tritón y de anfibios en general, la división celular no es un factor determinante en la morfogénesis. Las células embrionarias de tritón son mucho más grandes y presentan pigmentación ovoide para distinguirlas entre sí. La placa neural del tritón duplica su longitud, disminuye su anchura apical y aumenta su grosor. [5] Los bordes de la placa se elevan dorsalmente y se pliegan hacia la línea media para formar el tubo neural. La superficie apical disminuye.
En los embriones de pollo, mientras que la placa neural aumenta en longitud y disminuye en anchura apical, el grosor de la placa no cambia drásticamente. A medida que la placa neural progresa a través de las etapas de Hamburger-Hamilton , la placa se engrosa hasta aproximadamente HH6-7, cuando la placa neural comienza a plegarse en forma de tubo. La superficie apical aumenta durante la neurulación, a diferencia de los embriones de anfibios. [5] En los embriones de ratón, hay una gran curva de forma convexa a cada lado de la mitad de la placa. Esta curva tiene que invertirse a medida que la placa se enrolla para formar el tubo neural. [5]
Investigación
La investigación sobre la placa neural comenzó en serio con el estudio de la determinación del ectodermo y su compromiso con la ruta neuronal. Con el desarrollo de la investigación y las técnicas de laboratorio, se han producido avances importantes en el estudio de la neurulación y el desarrollo y el papel de la placa neural en un embrión en crecimiento. El uso de dichas técnicas varía según la etapa de desarrollo y los objetivos generales de la investigación, pero incluye métodos como el marcado y el injerto de células . [11]
Etiquetado celular
El proceso de hibridación in situ (ISH) consiste en etiquetar una secuencia de ADN o ARN para que sirva como sonda de ARNm antisentido , complementaria a una secuencia de ARNm dentro del embrión. El etiquetado con un colorante fluorescente o una etiqueta radiactiva permite visualizar la sonda y su ubicación dentro del embrión. Esta técnica es útil porque revela áreas específicas de expresión génica en un tejido, así como en todo el embrión mediante hibridación in situ de montaje completo. [12] Esta técnica se utiliza a menudo para determinar la expresión génica necesaria para el desarrollo adecuado del embrión. El marcado de ciertos genes en un embrión en desarrollo permite determinar el momento y el lugar exactos en los que se activa el gen, lo que ofrece información sobre el papel del gen en particular en el desarrollo.
De manera similar al proceso de hibridación in situ, la inmunofluorescencia (IF) también permite determinar el papel de elementos celulares particulares en el desarrollo. Sin embargo, a diferencia de la hibridación in situ, la inmunofluorescencia utiliza un fluoróforo unido a un anticuerpo con una biomolécula diana, como proteínas, en lugar de secuencias de ADN y ARN. Esto permite la visualización de elementos biomoleculares de la célula. En el estudio de la embriogénesis, la inmunofluorescencia se puede utilizar con fines similares a la hibridación, para el seguimiento de las proteínas que participan en el desarrollo del embrión y su tiempo y lugar específicos de producción y uso. [13] La investigación actual ha ampliado la técnica de inmunofluorescencia para combinarla con los métodos de hibridación in situ, ya sea fluorescente o radiactiva. Se cree que esta combinación aumenta la especificidad y elimina las limitaciones de cada técnica individual. Por ejemplo, este método mejora la contratinción en un tejido y el etiquetado de múltiples proteínas. [12]
Injerto de células
El injerto de células en las primeras etapas del desarrollo embrionario ha proporcionado información crucial sobre el destino de las células y los procesos de determinación. El injerto en etapas específicas de la neurulación ha hecho avanzar la investigación sobre la señalización necesaria para el desarrollo adecuado de la placa neural y otras estructuras. El injerto del ectodermo y las estructuras neurales es un procedimiento muy especializado y delicado, que requiere la extracción y el marcado de un grupo deseado de células, seguido de su trasplante, por ejemplo, en una nueva zona del embrión. [14]
Los experimentos de injerto realizados en embriones de Xenopus y de pollo muestran la capacidad de la placa neural para inducir otras regiones de células, incluida la región preplacodal, un grupo de células ectodérmicas esenciales para el funcionamiento de los órganos sensoriales. [15]
Referencias
![]() Este artículo incorpora texto de dominio público de la 20.ª edición de Anatomía de Gray (1918).
Este artículo incorpora texto de dominio público de la 20.ª edición de Anatomía de Gray (1918).
- ^ abcdef Gilbert, Scott F. (2010). Biología del desarrollo (novena edición). Sunderland, Mass.: Sinauer Associates. págs. 333–338. ISBN 978-0878933846.
- ^ Browder, Leon (1980). Biología del desarrollo . Filadelfia: Saunders College. pág. 457. ISBN. 0-03-056748-3.
- ^ Embriología humana, Módulo 7, Sección 7.2, http://www.embryology.ch/anglais/hdisqueembry/triderm10.html Archivado el 16 de enero de 2013 en Wayback Machine .
- ^ Keller, Ray; Shih, John; Sater, Amy K (1 de marzo de 1992). "Inducción planar de convergencia y extensión de la placa neural por el organizador Xenopus". Dinámica del desarrollo . 193 (3): 218–234. doi :10.1002/aja.1001930303. PMID 1600241. S2CID 39722561.
- ^ abcd Jacobson, Antone G. (1991). "Análisis experimentales de la conformación de la placa y el tubo neural". Zoólogo estadounidense . 31 (4): 628–643. doi : 10.1093/icb/31.4.628 . JSTOR 3883562.
- ^ Smith, Jodi L.; Schoenwolf, Gary C. (1 de abril de 1989). "Inducción notocordal del acuñamiento celular en la placa neural del pollo y su papel en la formación del tubo neural". Journal of Experimental Zoology . 250 (1): 49–62. doi :10.1002/jez.1402500107. PMID 2723610.
- ^ Wolpert, Lewis (1998). Principios del desarrollo . Londres: Current Biology. pág. 345. ISBN. 0-19-850263-X.
- ^ Wilson, PA; Lagna, G; Suzuki, A; Hemmati-Brivanlou, A (agosto de 1997). "Modelación dependiente de la concentración del ectodermo de Xenopus por BMP4 y su transductor de señales Smad1". Desarrollo . 124 (16): 3177–84. doi :10.1242/dev.124.16.3177. PMID 9272958.
- ^ ab Liem, Karel F; Tremml, Gabi; Roelink, Henk; Jessell, Thomas M (1 de septiembre de 1995). "Diferenciación dorsal de células de la placa neural inducida por señales mediadas por BMP del ectodermo epidérmico". Cell . 82 (6): 969–979. doi : 10.1016/0092-8674(95)90276-7 . PMID 7553857. S2CID 17106597.
- ^ Eom, Dae S; Amarnath, Smita; Agarwala, Seema (20 de diciembre de 2012). "Polaridad apicobasal y cierre del tubo neural". Desarrollo, crecimiento y diferenciación . 55 (1): 164–172. doi :10.1111/dgd.12030. PMC 3540145 . PMID 23277919.
- ^ de Vellis J, Carpenter E. Desarrollo general del sistema nervioso. En: Siegel GJ, Agranoff BW, Albers RW, et al., editores. Neuroquímica básica: aspectos moleculares, celulares y médicos. 6.ª edición. Filadelfia: Lippincott-Raven; 1999. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK28253/
- ^ ab Pineau, Isabelle (2006). "Un nuevo método para el etiquetado múltiple que combina la hibridación in situ con inmunofluorescencia". Journal of Histochemistry & Cytochemistry . 54 (11): 1303–1313. doi : 10.1369/jhc.6a7022.2006 . PMID 16899759.
- ^ Sadler, TW (1986). "Un papel potencial para la espectrina durante la neurulación". J. Embryol . 94 (1): 73–82 . Consultado el 27 de abril de 2013 .
- ^ Tan, SS (1986). "Análisis de la migración de células de la cresta neural craneal y destinos tempranos en quimeras de rata postimplantación". J. Embryol . 98 (1): 21–58. PMID 3655649 . Consultado el 27 de abril de 2013 .
- ^ Bailey, Andrew P.; Andrea Streit (2006). "Órganos sensoriales: creación y destrucción de la región preplacódica". Temas actuales en biología del desarrollo . 72 : 177. doi :10.1016/s0070-2153(05)72003-2. ISBN 9780121531720. Número de identificación personal 16564335.
Enlaces externos
- Embriología suiza (de UL , UB y UF ) hdisqueembry/triderm10
- Embriología en Temple EMBIII97/sld010
- Descripción general y diagrama en umich.edu
