Epímero
En estereoquímica , un epímero es uno de un par de diastereómeros . [1] Los dos epímeros tienen una configuración opuesta en solo un centro estereogénico de al menos dos. [2] Todos los demás centros estereogénicos en las moléculas son iguales en cada uno. La epimerización es la interconversión de un epímero en el otro epímero.
La doxorrubicina y la epirrubicina son dos epímeros que se utilizan como medicamentos.
 |
Comparación de doxorrubicina y epirrubicina |
Ejemplos
Los estereoisómeros β- D - glucopiranosa y β- D - manopiranosa son epímeros porque difieren solo en la estereoquímica en la posición C-2. El grupo hidroxi en β-D-glucopiranosa es ecuatorial (en el "plano" del anillo), mientras que en β-D-manopiranosa el grupo hidroxi C-2 es axial (arriba del "plano" del anillo). Estas dos moléculas son epímeros pero, debido a que no son imágenes especulares una de la otra, no son enantiómeros . (Los enantiómeros tienen el mismo nombre, pero difieren en la clasificación D y L ). Tampoco son anómeros de azúcar , ya que no es el carbono anomérico involucrado en la estereoquímica. De manera similar, β- D -glucopiranosa y β- D -galactopiranosa son epímeros que difieren en la posición C-4, siendo el primero ecuatorial y el segundo axial.
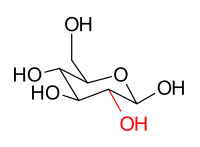 |  |
β- D -glucopiranosa | β- D -manopiranosa |
En el caso en que la diferencia sean los grupos -OH en C-1, el carbono anomérico, como en el caso de la α- D -glucopiranosa y la β- D -glucopiranosa, las moléculas son a la vez epímeros y anómeros (como lo indican las designaciones α y β ). [3]
 |  |
α- D -glucopiranosa | β- D -glucopiranosa |
Otros compuestos estrechamente relacionados son el epi -inositol y el inositol y la lipoxina y la epilipoxina.
 | 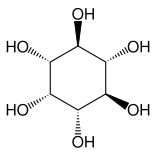 | 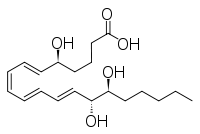 | 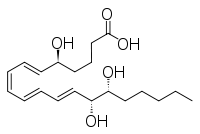 |
epi -inositol | Inositol | Lipoxina | Epilipoxina |
Epimerización
La epimerización es un proceso químico en el que un epímero se convierte en su contraparte diastereomérica. [1] Puede ocurrir en reacciones de despolimerización de taninos condensados . La epimerización puede ser espontánea (generalmente un proceso lento) o catalizada por enzimas, por ejemplo, la epimerización entre los azúcares N -acetilglucosamina y N -acetilmanosamina , que es catalizada por la proteína transportadora de renina .
El penúltimo paso en la síntesis clásica de epibatidina de Zhang y Trudell es un ejemplo de epimerización. [4] Los ejemplos farmacéuticos incluyen la epimerización de los isómeros eritro del metilfenidato a los isómeros treo farmacológicamente preferidos y de menor energía, y la epimerización in vivo no deseada de tesofensina a brasofensina .
Referencias
- ^ ab Clayden, Jonathan ; Greeves, Nick; Warren, Stuart (2012). Química orgánica (2.ª ed.). Oxford University Press. pág. 1112.
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "Epimers". doi :10.1351/goldbook.E02167
- ^ Estructura de la molécula de glucosa
- ^ Zhang, Chunming; Trudell, Mark L. (1996). "Una síntesis total breve y eficiente de (±)-epibatidina". Revista de química orgánica . 61 (20): 7189–7191. doi :10.1021/jo9608681. ISSN 0022-3263. PMID 11667626.