Núcleo accumbens
| Núcleo accumbens | |
|---|---|
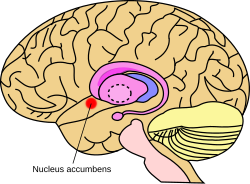 Ubicación aproximada del núcleo accumbens en el cerebro | |
 Núcleo accumbens del cerebro del ratón | |
| Detalles | |
| Parte de | Vía mesolímbica Ganglios basales ( Estriado ventral ) |
| Regiones | Capa del núcleo accumbens Núcleo del núcleo accumbens |
| Identificadores | |
| latín | núcleo accumbens septi |
| Acrónimo(s) | NAc o NAcc |
| Malla | D009714 |
| Nombres neuronales | 277 |
| Identificación de NeuroLex | birnlex_727 |
| TA98 | A14.1.09.440 |
| TA2 | 5558 |
| FMA | 61889 |
| Términos anatómicos de neuroanatomía [editar en Wikidata] | |
El núcleo accumbens ( NAc o NAcc ; también conocido como núcleo accumbens , o anteriormente como núcleo accumbens septi , en latín ' núcleo adyacente al tabique ') es una región en el prosencéfalo basal rostral al área preóptica del hipotálamo . [1] El núcleo accumbens y el tubérculo olfatorio forman colectivamente el cuerpo estriado ventral . El cuerpo estriado ventral y el cuerpo estriado dorsal forman colectivamente el cuerpo estriado , que es el componente principal de los ganglios basales . [2] Las neuronas dopaminérgicas de la vía mesolímbica se proyectan sobre las neuronas espinosas medianas GABAérgicas del núcleo accumbens y el tubérculo olfatorio. [3] [4] Cada hemisferio cerebral tiene su propio núcleo accumbens, que se puede dividir en dos estructuras: el núcleo del núcleo accumbens y la cubierta del núcleo accumbens. Estas subestructuras tienen diferente morfología y funciones.
Diferentes subregiones del NAcc (núcleo vs. capa) y subpoblaciones neuronales dentro de cada región ( neuronas espinosas medianas tipo D1 vs. tipo D2 ) son responsables de diferentes funciones cognitivas . [5] [6] En conjunto, el núcleo accumbens tiene un papel significativo en el procesamiento cognitivo de la motivación , la aversión , la recompensa (es decir, la prominencia del incentivo , el placer y el refuerzo positivo ) y el aprendizaje de refuerzo (por ejemplo, la transferencia pavloviana-instrumental ); [4] [7] [8] [9] [10] por lo tanto, tiene un papel significativo en la adicción . [4] [8] Además, parte del núcleo del núcleo accumbens está involucrado centralmente en la inducción del sueño de ondas lentas . [11] [12] [13] [14] El núcleo accumbens juega un papel menor en el procesamiento del miedo (una forma de aversión), la impulsividad y el efecto placebo . [15] [16] [17] También participa en la codificación de nuevos programas motores . [4]
Estructura
El núcleo accumbens es un agregado de neuronas que se describe como poseedor de una capa externa y un núcleo interno. [4]
Aporte
Las principales entradas glutamatérgicas al núcleo accumbens incluyen la corteza prefrontal (particularmente la corteza prelímbica y la corteza infralímbica ), la amígdala basolateral , el hipocampo ventral , los núcleos talámicos (específicamente los núcleos talámicos de la línea media y los núcleos intralaminares del tálamo ) y las proyecciones glutamatérgicas del área tegmental ventral (ATV). [18] El núcleo accumbens recibe entradas dopaminérgicas del área tegmental ventral, que se conectan a través de la vía mesolímbica . El núcleo accumbens a menudo se describe como una parte de un bucle cortico-ganglios basales-tálamo-cortical . [19]
Las entradas dopaminérgicas del ATV modulan la actividad de las neuronas GABAérgicas dentro del núcleo accumbens. Estas neuronas se activan directa o indirectamente por drogas euforizantes (p. ej., anfetaminas , opiáceos , etc.) y por participar en experiencias gratificantes (p. ej., sexo, música, ejercicio, etc.). [20] [21]
Otra fuente importante de información proviene del CA1 y del subículo ventral del hipocampo hacia el área dorsomedial del núcleo accumbens. Las despolarizaciones leves de las células del núcleo accumbens se correlacionan con la positividad de las neuronas del hipocampo, lo que las hace más excitables. Las células correlacionadas de estos estados excitados de las neuronas espinosas medianas del núcleo accumbens se comparten equitativamente entre el subículo y el CA1. Se ha descubierto que las neuronas del subículo se hiperpolarizan (incrementan la negatividad) mientras que las neuronas del CA1 "ondulan" (se activan a > 50 Hz) para lograr esta preparación. [22]
El núcleo accumbens es una de las pocas regiones que recibe una alta densidad de proyecciones histaminérgicas del núcleo tuberomamilar (la única fuente de neuronas de histamina en el cerebro). [23]
Producción
Las neuronas de salida del núcleo accumbens envían proyecciones axónicas a los ganglios basales y al análogo ventral del globo pálido , conocido como pálido ventral (VP). El VP, a su vez, proyecta al núcleo dorsal medial del tálamo dorsal , que se proyecta a la corteza prefrontal, así como de regreso al cuerpo estriado ventral y dorsal . Otras eferencias del núcleo accumbens incluyen conexiones con la cola del área tegmental ventral , [24] la sustancia negra y la formación reticular de la protuberancia . [1]
Caparazón
La capa del núcleo accumbens ( capa NAcc ) es una subestructura del núcleo accumbens. La capa y el núcleo juntos forman el núcleo accumbens en su totalidad.
Ubicación: La capa es la región externa del núcleo accumbens y, a diferencia del núcleo, se considera parte de la amígdala extendida , ubicada en su polo rostral.
Tipos de células: Las neuronas en el núcleo accumbens son en su mayoría neuronas espinosas medianas (MSN) que contienen principalmente receptores de dopamina de tipo D1 (es decir, DRD1 y DRD5 ) o de tipo D2 (es decir, DRD2 , DRD3 y DRD4 ) . Una subpoblación de MSN contiene receptores de tipo D1 y de tipo D2, y aproximadamente el 40 % de las MSN estriatales expresan ARNm de DRD1 y DRD2 . [19] [25] [26] Estas MSN NAcc de tipo mixto con receptores de tipo D1 y de tipo D2 se limitan principalmente a la capa NAcc. [19] Las neuronas de la capa, en comparación con el núcleo, tienen una menor densidad de espinas dendríticas , menos segmentos terminales y menos segmentos de ramificación que las del núcleo. Las neuronas de la cubierta se proyectan a la parte subcomisural del pálido ventral , así como al área tegmental ventral y a extensas áreas en el hipotálamo y la amígdala extendida. [27] [28] [29]
Función: La capa del núcleo accumbens está involucrada en el procesamiento cognitivo de la recompensa , incluyendo reacciones subjetivas de "agrado" a ciertos estímulos placenteros , prominencia motivacional y refuerzo positivo . [4] [5] [30] [31] También se ha demostrado que esa capa NAcc media la transferencia pavloviana-instrumental específica , un fenómeno en el que un estímulo condicionado clásicamente modifica el comportamiento operante . [32] [9] [10] Un "punto caliente hedónico" o centro de placer que es responsable del componente placentero o de "agrado" de algunas recompensas intrínsecas también se encuentra en un pequeño compartimento dentro de la capa medial NAcc. [30] [33] [34] Las drogas adictivas tienen un mayor efecto sobre la liberación de dopamina en la capa que en el núcleo. [4]
Centro
El núcleo del núcleo accumbens ( núcleo NAcc ) es la subestructura interna del núcleo accumbens.
Ubicación: El núcleo del núcleo accumbens es parte del cuerpo estriado ventral , ubicado dentro de los ganglios basales. Tipos de células: El núcleo del NAcc está formado principalmente por neuronas espinosas medianas que contienen principalmente receptores de dopamina de tipo D1 o tipo D2. Las neuronas espinosas medianas de tipo D1 median los procesos cognitivos relacionados con la recompensa, [5] [35] [36] mientras que las neuronas espinosas medianas de tipo D2 median la cognición relacionada con la aversión. [6] Las neuronas en el núcleo, en comparación con las neuronas en la cubierta, tienen una mayor densidad de espinas dendríticas, segmentos de ramificación y segmentos terminales. Desde el núcleo, las neuronas se proyectan a otras áreas subcorticales como el globo pálido y la sustancia negra. El GABA es uno de los principales neurotransmisores en el NAcc, y los receptores de GABA también son abundantes. [27] [29]
Función: El núcleo accumbens está involucrado en el procesamiento cognitivo de la función motora relacionada con la recompensa y el refuerzo y la regulación del sueño de ondas lentas . [4] [11] [12] [13] Específicamente, el núcleo codifica nuevos programas motores que facilitan la adquisición de una recompensa dada en el futuro. [4] Las neuronas de la vía indirecta (es decir, tipo D2) en el núcleo NAcc que coexpresan receptores de adenosina A 2A promueven de manera dependiente de la activación el sueño de ondas lentas. [11] [12] [13] También se ha demostrado que el núcleo NAcc media la transferencia pavloviana-instrumental general , un fenómeno en el que un estímulo condicionado clásicamente modifica el comportamiento operante. [32] [9] [10]
Tipos de células
Aproximadamente el 95% de las neuronas en el NAcc son neuronas espinosas medianas (MSN) GABAérgicas que expresan principalmente receptores de tipo D1 o de tipo D2; [20] alrededor del 1-2% de los tipos neuronales restantes son interneuronas colinérgicas aespinosas grandes y otro 1-2% son interneuronas GABAérgicas. [20] En comparación con las MSN GABAérgicas en la capa, las del núcleo tienen una mayor densidad de espinas dendríticas, segmentos de ramificación y segmentos terminales. Desde el núcleo, las neuronas se proyectan a otras áreas subcorticales como el globo pálido y la sustancia negra. El GABA es uno de los principales neurotransmisores en el NAcc, y los receptores de GABA también son abundantes. [27] [29] Estas neuronas también son las principales neuronas de proyección o salida del núcleo accumbens.
Neuroquímica
Algunos de los neurotransmisores, neuromoduladores y hormonas que envían señales a través de receptores dentro del núcleo accumbens incluyen:
Dopamina : La dopamina se libera en el núcleo accumbens después de la exposición a estímulos gratificantes , incluidas drogas recreativas como anfetaminas sustituidas , cocaína , nicotina y morfina . [37] [38]
Fenetilamina y tiramina : La fenetilamina y la tiramina son aminas traza que se sintetizan en neuronas que expresan la enzima hidroxilasa de aminoácidos aromáticos (AADC), que incluye todas las neuronas dopaminérgicas. [39] Ambos compuestos funcionan como neuromoduladores dopaminérgicos que regulan la recaptación y liberación de dopamina en el Nacc a través de interacciones con VMAT2 y TAAR1 en la terminal axónica de las neuronas dopaminérgicas mesolímbicas.
Glucocorticoides y dopamina: Los receptores de glucocorticoides son los únicos receptores de corticosteroides en la capa del núcleo accumbens. Actualmente se sabe que la L-DOPA , los esteroides y, específicamente, los glucocorticoides son los únicos compuestos endógenos conocidos que pueden inducir problemas psicóticos, por lo que comprender el control hormonal sobre las proyecciones dopaminérgicas con respecto a los receptores de glucocorticoides podría conducir a nuevos tratamientos para los síntomas psicóticos. Un estudio reciente demostró que la supresión de los receptores de glucocorticoides condujo a una disminución en la liberación de dopamina, lo que puede conducir a futuras investigaciones que involucren medicamentos antiglucocorticoides para aliviar potencialmente los síntomas psicóticos. [40]
GABA: Un estudio reciente en ratas que utilizaron agonistas y antagonistas de GABA indicó que los receptores GABA A en la capa NAcc tienen un control inhibitorio sobre el comportamiento de giro influenciado por la dopamina, y los receptores GABA B tienen un control inhibitorio sobre el comportamiento de giro mediado por la acetilcolina . [27] [41]
Glutamato : Los estudios han demostrado que el bloqueo local de los receptores glutamatérgicos NMDA en el núcleo NAcc afecta el aprendizaje espacial. [42] Otro estudio demostró que tanto NMDA como AMPA (ambos receptores de glutamato ) desempeñan papeles importantes en la regulación del aprendizaje instrumental. [43]
Serotonina (5-HT): En general, las sinapsis 5-HT son más abundantes y tienen un mayor número de contactos sinápticos en la capa NAcc que en el núcleo. También son más grandes y más gruesas, y contienen más vesículas densas y grandes que sus contrapartes en el núcleo.
Función
Recompensa y refuerzo
El núcleo accumbens, al ser una parte del sistema de recompensa, desempeña un papel importante en el procesamiento de estímulos gratificantes, estímulos reforzantes (p. ej., comida y agua) y aquellos que son tanto gratificantes como reforzantes (drogas adictivas, sexo y ejercicio). [4] [44] La respuesta predominante de las neuronas en el núcleo accumbens a la sacarosa de recompensa es la inhibición; lo opuesto es cierto en respuesta a la administración de quinina aversiva . [45] Evidencia sustancial de manipulación farmacológica también sugiere que reducir la excitabilidad de las neuronas en el núcleo accumbens es gratificante, como, por ejemplo, sería cierto en el caso de la estimulación del receptor μ-opioide . [46] La señal dependiente del nivel de oxígeno en sangre (BOLD) en el núcleo accumbens aumenta selectivamente durante la percepción de imágenes agradables y emocionalmente excitantes y durante la imaginería mental de escenas agradables y emocionales. Sin embargo, como se piensa que BOLD es una medida indirecta de la excitación neta regional a la inhibición, se desconoce hasta qué punto BOLD mide el procesamiento dependiente de la valencia. [47] [48] Debido a la abundancia de entradas de NAcc desde las regiones límbicas y fuertes salidas de NAcc a las regiones motoras, Gordon Mogensen ha descrito el núcleo accumbens como la interfaz entre el sistema límbico y el motor. [49] [50]

El núcleo accumbens está relacionado causalmente con la experiencia del placer. Las microinyecciones de agonistas opioides μ, agonistas opioides δ o agonistas opioides κ en el cuadrante rostrodorsal de la capa medial mejoran el "gusto", mientras que las inyecciones más caudales pueden inhibir las reacciones de disgusto, las reacciones de gusto o ambas. [30] Las regiones del núcleo accumbens a las que se les puede atribuir un papel causal en la producción de placer son limitadas tanto anatómica como químicamente, ya que además de los agonistas opioides, solo los endocannabinoides pueden mejorar el gusto. En el núcleo accumbens en su conjunto, la dopamina, el agonista del receptor GABA o los antagonistas de AMPA modifican únicamente la motivación, mientras que lo mismo es cierto para los opioides y los endocannabinoides fuera del punto caliente en la capa medial. Existe un gradiente rostro-caudal para la mejora de las respuestas apetitivas frente a las temerosas, de las cuales se cree tradicionalmente que la última requiere solo la función del receptor D1, y la primera requiere tanto la función D1 como la D2. Una interpretación de este hallazgo, la hipótesis de la desinhibición, postula que la inhibición de las MSN accumbens (que son GABAérgicas) desinhibe las estructuras posteriores, lo que permite la expresión de conductas apetitivas o consumatorias. [52] Los efectos motivacionales de los antagonistas de AMPA, y en menor medida de los agonistas de GABA, son anatómicamente flexibles. Las condiciones estresantes pueden expandir las regiones que inducen el miedo, mientras que un entorno familiar puede reducir el tamaño de la región que induce el miedo. Además, la entrada cortical de la corteza orbitofrontal (COF) sesga la respuesta hacia la del comportamiento apetitivo, y la entrada infralímbica , equivalente a la corteza cingulada subgenual humana, suprime la respuesta independientemente de la valencia. [30]
El núcleo accumbens no es necesario ni suficiente para el aprendizaje instrumental, aunque las manipulaciones pueden afectar el desempeño en tareas de aprendizaje instrumental. Una tarea en la que el efecto de las lesiones del NAcc es evidente es la transferencia instrumental-pavloviana (PIT), en la que una señal emparejada con una recompensa específica o general puede mejorar la respuesta instrumental. Las lesiones en el núcleo del NAcc perjudican el desempeño después de la devaluación e inhiben el efecto de la PIT general. Por otro lado, las lesiones en la corteza solo perjudican el efecto de la PIT específica. Se cree que esta distinción refleja respuestas condicionadas consumatorias y apetitivas en la corteza del NAcc y el núcleo del NAcc, respectivamente. [53]
En el cuerpo estriado dorsal, se ha observado una dicotomía entre las D1-MSN y las D2-MSN, siendo las primeras reforzantes y potenciadoras de la locomoción, y las segundas aversivas y reductoras de la locomoción. Tradicionalmente, se ha asumido que esta distinción también se aplica al núcleo accumbens, pero la evidencia de los estudios farmacológicos y optogenéticos es contradictoria. Además, un subconjunto de las MSN del NAcc expresan tanto las D1 como las D2, y la activación farmacológica de los receptores D1 frente a los D2 no tiene por qué activar necesariamente las poblaciones neuronales de forma exacta. Aunque la mayoría de los estudios no muestran ningún efecto de la estimulación optogenética selectiva de las MSN D1 o D2 sobre la actividad locomotora, un estudio ha informado de una disminución de la locomoción basal con la estimulación de las D2-MSN. Aunque dos estudios han informado de una reducción de los efectos reforzantes de la cocaína con la activación de las D2-MSN, un estudio no ha informado de ningún efecto. También se ha informado que la activación del NAcc D2-MSN mejora la motivación, según lo evaluado por PIT, y la actividad del receptor D2 es necesaria para los efectos de refuerzo de la estimulación del VTA. [54] Un estudio de 2018 informó que la activación del D2 MSN mejoró la motivación al inhibir el pálido ventral, desinhibiendo así el VTA. [55]
Comportamiento maternal
Un estudio de fMRI realizado en 2005 descubrió que cuando las ratas madres estaban en presencia de sus crías, las regiones del cerebro involucradas en el reforzamiento, incluido el núcleo accumbens, estaban altamente activas. [56] Los niveles de dopamina aumentan en el núcleo accumbens durante el comportamiento maternal, mientras que las lesiones en esta área alteran el comportamiento maternal. [57] Cuando a las mujeres se les presentan imágenes de bebés no relacionados, las fMRI muestran una mayor actividad cerebral en el núcleo accumbens y el núcleo caudado adyacente, proporcional al grado en que las mujeres encuentran a estos bebés "lindos". [58]
Aversión
La activación de MSN de tipo D1 en el núcleo accumbens está involucrada en la recompensa, mientras que la activación de MSN de tipo D2 en el núcleo accumbens promueve la aversión . [6]
Sueño de ondas lentas
A finales de 2017, estudios en roedores que utilizaron métodos optogenéticos y quimiogenéticos encontraron que las neuronas espinosas medianas de la vía indirecta (es decir, tipo D2) en el núcleo accumbens que coexpresan receptores de adenosina A 2A y se proyectan al pálido ventral están involucradas en la regulación del sueño de ondas lentas . [11] [12] [13] [14] En particular, la activación optogenética de estas neuronas del núcleo NAcc de la vía indirecta induce el sueño de ondas lentas y la activación quimiogenética de las mismas neuronas aumenta el número y la duración de los episodios de sueño de ondas lentas. [12] [13] [14] La inhibición quimiogenética de estas neuronas del núcleo NAcc suprime el sueño. [12] [13] Por el contrario, las neuronas espinosas medianas de tipo D2 en la capa NAcc que expresan receptores de adenosina A 2A no tienen ningún papel en la regulación del sueño de ondas lentas. [12] [13]
Importancia clínica
Adicción
Los modelos actuales de adicción por uso crónico de drogas implican alteraciones en la expresión génica en la proyección mesocorticolímbica . [20] [59] [60] Los factores de transcripción más importantes que producen estas alteraciones son ΔFosB , la proteína de unión al elemento de respuesta al monofosfato de adenosina cíclico ( cAMP ) ( CREB ) y el factor nuclear kappa B ( NFκB ). [20] ΔFosB es el factor de transcripción génica más significativo en la adicción, ya que su sobreexpresión viral o genética en el núcleo accumbens es necesaria y suficiente para muchas de las adaptaciones neuronales y efectos conductuales (p. ej., aumentos dependientes de la expresión en la autoadministración y sensibilización a la recompensa ) observados en la adicción a las drogas. [20] [35] [61] La sobreexpresión de ΔFosB se ha relacionado con las adicciones al alcohol (etanol) , cannabinoides , cocaína , metilfenidato , nicotina , opioides , fenciclidina , propofol y anfetaminas sustituidas , entre otros. [20] [59] [ 61] [62] [63] Los aumentos en la expresión de ΔJunD en el núcleo accumbens pueden reducir o, con un gran aumento, incluso bloquear la mayoría de las alteraciones neuronales observadas en el abuso crónico de drogas (es decir, las alteraciones mediadas por ΔFosB). [20]
ΔFosB también desempeña un papel importante en la regulación de las respuestas conductuales a las recompensas naturales, como la comida sabrosa, el sexo y el ejercicio. [20] [21] Las recompensas naturales, como las drogas de abuso, inducen ΔFosB en el núcleo accumbens, y la adquisición crónica de estas recompensas puede resultar en un estado adictivo patológico similar a través de la sobreexpresión de ΔFosB. [20] [21] [44] En consecuencia, ΔFosB es el factor de transcripción clave involucrado también en las adicciones a las recompensas naturales; [20] [21] [44] en particular, ΔFosB en el núcleo accumbens es fundamental para los efectos de refuerzo de la recompensa sexual. [21] La investigación sobre la interacción entre las recompensas naturales y las drogas sugiere que los psicoestimulantes y el comportamiento sexual actúan sobre mecanismos biomoleculares similares para inducir ΔFosB en el núcleo accumbens y poseen efectos de sensibilización cruzada que están mediados por ΔFosB. [44] [64]
De manera similar a las recompensas de drogas, las recompensas no drogas también aumentan el nivel de dopamina extracelular en la capa NAcc. La liberación de dopamina inducida por drogas en la capa NAcc y el núcleo NAcc normalmente no es propensa a la habituación (es decir, el desarrollo de tolerancia a las drogas : una disminución en la liberación de dopamina a partir de la exposición futura a drogas como resultado de la exposición repetida a las mismas); por el contrario, la exposición repetida a drogas que inducen la liberación de dopamina en la capa y el núcleo NAcc normalmente resulta en sensibilización (es decir, la cantidad de dopamina que se libera en el NAcc a partir de la exposición futura a drogas aumenta como resultado de la exposición repetida a las mismas). La sensibilización de la liberación de dopamina en la capa NAcc después de la exposición repetida a drogas sirve para fortalecer las asociaciones estímulo-droga (es decir, el condicionamiento clásico que ocurre cuando el consumo de drogas se empareja repetidamente con estímulos ambientales) y estas asociaciones se vuelven menos propensas a la extinción (es decir, "desaprender" estas asociaciones condicionadas clásicamente entre el consumo de drogas y los estímulos ambientales se vuelve más difícil). Después de un emparejamiento repetido, estos estímulos ambientales clásicamente condicionados (por ejemplo, contextos y objetos que se asocian frecuentemente con el consumo de drogas) a menudo se convierten en señales de drogas que funcionan como reforzadores secundarios del consumo de drogas (es decir, una vez que se establecen estas asociaciones, la exposición a un estímulo ambiental emparejado desencadena un ansia o deseo de consumir la droga con la que se han asociado ). [27] [38]
A diferencia de las drogas, la liberación de dopamina en la capa NAcc por muchos tipos de estímulos gratificantes no relacionados con drogas generalmente experimenta habituación después de una exposición repetida (es decir, la cantidad de dopamina que se libera a partir de una exposición futura a un estímulo gratificante no relacionado con drogas normalmente disminuye como resultado de la exposición repetida a ese estímulo). [27] [38]
| Forma de neuroplasticidad o plasticidad conductual | Tipo de reforzador | Fuentes | |||||
|---|---|---|---|---|---|---|---|
| Opiáceos | Psicoestimulantes | Alimentos ricos en grasas o azúcar | Relaciones sexuales | Ejercicio físico (aeróbico) | Enriquecimiento ambiental | ||
| Expresión de ΔFosB en MSN de tipo D1 del núcleo accumbens Descripción de herramientas de neuronas espinosas medianas | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [44] |
| Plasticidad conductual | |||||||
| Aumento de la ingesta | Sí | Sí | Sí | [44] | |||
| Sensibilización cruzada a psicoestimulantes | Sí | No aplicable | Sí | Sí | Atenuado | Atenuado | [44] |
| Autoadministración de psicoestimulantes | ↑ | ↑ | ↓ | ↓ | ↓ | [44] | |
| Preferencia de lugar condicionada por psicoestimulantes | ↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [44] |
| Restablecimiento de la conducta de búsqueda de drogas | ↑ | ↑ | ↓ | ↓ | [44] | ||
| Plasticidad neuroquímica | |||||||
| CREBProteína de unión al elemento de respuesta de AMPc fosforilación en el núcleo accumbens | ↓ | ↓ | ↓ | ↓ | ↓ | [44] | |
| Respuesta dopaminérgica sensibilizada en el núcleo accumbens | No | Sí | No | Sí | [44] | ||
| Señalización dopaminérgica estriatal alterada | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | [44] | |
| Señalización opioide estriatal alterada | Sin cambios o ↑ receptores μ-opioides | ↑ receptores opioides μ ↑ receptores opioides κ | ↑ Receptores μ-opioides | ↑ Receptores μ-opioides | Sin cambios | Sin cambios | [44] |
| Cambios en los péptidos opioides estriatales | ↑ dinorfina Sin cambios: encefalina | ↑ dinorfina | ↓ encefalina | ↑ dinorfina | ↑ dinorfina | [44] | |
| Plasticidad sináptica mesocorticolímbica | |||||||
| Número de dendritas en el núcleo accumbens | ↓ | ↑ | ↑ | [44] | |||
| Densidad de espinas dendríticas en el núcleo accumbens | ↓ | ↑ | ↑ | [44] | |||
Depresión
En abril de 2007, dos equipos de investigación informaron haber insertado electrodos en el núcleo accumbens para utilizar la estimulación cerebral profunda para tratar la depresión grave . [65] En 2010, los experimentos informaron que la estimulación cerebral profunda del núcleo accumbens tuvo éxito en la disminución de los síntomas de depresión en el 50% de los pacientes que no respondieron a otros tratamientos como la terapia electroconvulsiva . [ 66] El núcleo accumbens también se ha utilizado como objetivo para tratar pequeños grupos de pacientes con trastorno obsesivo-compulsivo refractario a la terapia. [67]
Ablación
Para tratar la adicción y en un intento de tratar las enfermedades mentales, se ha realizado la ablación por radiofrecuencia del núcleo accumbens. Los resultados no son concluyentes y son controvertidos. [68] [69]
Efecto placebo
Se ha demostrado que la activación del NAcc ocurre en anticipación de la efectividad de un fármaco cuando a un usuario se le da un placebo , lo que indica un papel contribuyente del núcleo accumbens en el efecto placebo . [16] [70]
Imágenes adicionales
- Dopamina y serotonina
- Corte coronal de resonancia magnética que muestra el núcleo accumbens delineado en rojo
- Corte sagital de resonancia magnética con resaltado (rojo) que indica el núcleo accumbens
- El núcleo accumbens se destaca en verde en las imágenes coronales de resonancia magnética T1
- El núcleo accumbens se destaca en verde en las imágenes de resonancia magnética T1 sagitales
- El núcleo accumbens se destaca en verde en las imágenes de resonancia magnética T1 transversales
Véase también
Referencias
- ^ ab Carlson NR (2013). Fisiología del comportamiento (11.ª ed.). Boston: Pearson. [ página necesaria ]
- ^ Núcleo accumbens
- ^ Ikemoto S (noviembre de 2010). "Circuitos de recompensa cerebral más allá del sistema de dopamina mesolímbico: una teoría neurobiológica". Neuroscience and Biobehavioral Reviews . 35 (2): 129–50. doi :10.1016/j.neubiorev.2010.02.001. PMC 2894302 . PMID 20149820.
Estudios recientes sobre la autoadministración intracraneal de neuroquímicos (fármacos) encontraron que las ratas aprenden a autoadministrarse varios fármacos en las estructuras de dopamina mesolímbicas: el área tegmental ventral posterior, el núcleo accumbens de la capa medial y el tubérculo olfatorio medial. ... En la década de 1970 se reconoció que el tubérculo olfatorio contiene un componente estriatal, que está lleno de neuronas espinosas medianas GABAérgicas que reciben entradas glutamatérgicas de regiones corticales y entradas dopaminérgicas del ATV y se proyectan al pálido ventral al igual que el núcleo accumbens.
Figura 3: El estriado ventral y la autoadministración de anfetamina - ^ abcdefghij Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 147–148, 367, 376. ISBN 978-0-07-148127-4Las neuronas DA del VTA
desempeñan un papel fundamental en la motivación, la conducta relacionada con la recompensa (Capítulo 15), la atención y múltiples formas de memoria. Esta organización del sistema DA, amplia proyección desde un número limitado de cuerpos celulares, permite respuestas coordinadas a nuevas y potentes recompensas. Así, actuando en diversos campos terminales, la dopamina confiere prominencia motivacional ("deseo") a la recompensa misma o a las señales asociadas (región de la corteza del núcleo accumbens), actualiza el valor asignado a diferentes metas a la luz de esta nueva experiencia (corteza prefrontal orbital), ayuda a consolidar múltiples formas de memoria (amígdala e hipocampo) y codifica nuevos programas motores que facilitarán la obtención de esta recompensa en el futuro (región central del núcleo accumbens y estriado dorsal). En este ejemplo, la dopamina modula el procesamiento de la información sensoriomotora en diversos circuitos neuronales para maximizar la capacidad del organismo de obtener futuras recompensas. ...
El circuito de recompensa cerebral que es el objetivo de las drogas adictivas normalmente media el placer y el fortalecimiento de las conductas asociadas con reforzadores naturales, como la comida, el agua y el contacto sexual. Las neuronas dopaminérgicas en el ATV se activan con la comida y el agua, y la liberación de dopamina en el NAc es estimulada por la presencia de reforzadores naturales, como la comida, el agua o una pareja sexual. ...
El NAc y el ATV son componentes centrales del circuito subyacente a la recompensa y la memoria de la recompensa. Como se mencionó anteriormente, la actividad de las neuronas dopaminérgicas en el ATV parece estar vinculada a la predicción de la recompensa. El NAc está involucrado en el aprendizaje asociado con el refuerzo y la modulación de las respuestas motoras a los estímulos que satisfacen las necesidades homeostáticas internas. La cubierta del NAc parece ser particularmente importante para las acciones iniciales de la droga dentro del circuito de recompensa; las drogas adictivas parecen tener un mayor efecto en la liberación de dopamina en la cubierta que en el núcleo del NAc. - ^ abc Saddoris MP, Cacciapaglia F, Wightman RM, Carelli RM (agosto de 2015). "La dinámica diferencial de liberación de dopamina en el núcleo accumbens y la corteza revelan señales complementarias para la predicción de errores y la motivación de incentivos". The Journal of Neuroscience . 35 (33): 11572–82. doi :10.1523/JNEUROSCI.2344-15.2015. PMC 4540796 . PMID 26290234.
Aquí, hemos descubierto que la liberación de dopamina en tiempo real dentro del núcleo accumbens (un objetivo principal de las neuronas dopaminérgicas del mesencéfalo) varía sorprendentemente entre las subregiones del núcleo y la corteza. En esencia, la dinámica de la dopamina es consistente con las teorías basadas en el aprendizaje (como el error de predicción de recompensa), mientras que en esencia, la dopamina es consistente con las teorías basadas en la motivación (por ejemplo, la prominencia del incentivo).
- ^ abc Calipari ES, Bagot RC, Purushothaman I, Davidson TJ, Yorgason JT, Peña CJ, Walker DM, Pirpinias ST, Guise KG, Ramakrishnan C, Deisseroth K, Nestler EJ (marzo de 2016). "La imagenología in vivo identifica la firma temporal de las neuronas espinosas medianas D1 y D2 en la recompensa de la cocaína". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 113 (10): 2726–31. Bibcode :2016PNAS..113.2726C. doi : 10.1073/pnas.1521238113 . PMC 4791010 . PMID 26831103.
El aumento de la actividad del sistema dopaminérgico mesolímbico es un mecanismo central que subyace a las acciones de refuerzo y recompensa de las drogas de abuso, incluida la cocaína, así como a la búsqueda compulsiva de la droga que se desarrolla con el tiempo y caracteriza un estado adictivo (10-12). La acción de la dopamina en el NAc está mediada predominantemente a través de la activación de los receptores de dopamina D1 o D2 que se expresan en poblaciones en gran medida no superpuestas de neuronas espinosas medianas (MSN) (13). Estos dos subtipos de MSN ejercen efectos opuestos sobre el comportamiento, con la activación optogenética de las neuronas de tipo D1 que promueve el refuerzo positivo y aumenta la formación de asociaciones de contexto de recompensa de cocaína y la activación de las neuronas de tipo D2 que son aversivas y disminuyen la recompensa de cocaína (14, 15); se observan diferencias relacionadas en las respuestas conductuales en respuesta a los agonistas o antagonistas del receptor D1 frente a los D2 (16). ... Trabajos anteriores han demostrado que la estimulación optogenética de MSN D1 promueve la recompensa, mientras que la estimulación de MSN D2 produce aversión.
- ^ Wenzel JM, Rauscher NA, Cheer JF, Oleson EB (enero de 2015). "Un papel para la liberación fásica de dopamina dentro del núcleo accumbens en la codificación de la aversión: una revisión de la literatura neuroquímica". ACS Chemical Neuroscience . 6 (1): 16–26. doi :10.1021/cn500255p. PMC 5820768 . PMID 25491156.
Por lo tanto, los estímulos que evocan miedo son capaces de alterar de manera diferencial la transmisión fásica de dopamina en las subregiones del NAcc. Los autores proponen que la mejora observada en la dopamina de la capa del NAcc probablemente refleje una prominencia motivacional general, tal vez debido al alivio de un estado de miedo inducido por el EC cuando no se administra el EI (descarga eléctrica en el pie). Este razonamiento está respaldado por un informe de Budygin y colegas
112
que muestra que, en ratas anestesiadas, la terminación del pellizco de la cola da como resultado una mayor liberación de dopamina en el caparazón.
- ^ ab Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 10: Control neural y neuroendocrino del medio interno". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. pág. 266. ISBN 978-0-07-148127-4
La dopamina actúa en el núcleo accumbens para otorgar significado motivacional a los estímulos asociados con la recompensa
. - ^ abc Salamone JD, Pardo M, Yohn SE, López-Cruz L, SanMiguel N, Correa M (2016). "La dopamina mesolímbica y la regulación del comportamiento motivado". Temas actuales en neurociencias del comportamiento . 27 : 231–57. doi :10.1007/7854_2015_383. ISBN 978-3-319-26933-7. PMID 26323245.
Evidencia considerable indica que la DA accumbens es importante para el enfoque pavloviano y la transferencia pavloviana a instrumental [(PIT)] ... PIT es un proceso conductual que refleja el impacto de los estímulos condicionados pavlovianos (EC) en la respuesta instrumental. Por ejemplo, la presentación de un EC pavloviano emparejado con comida puede aumentar la producción de conductas instrumentales reforzadas con comida, como presionar una palanca. El PIT específico del resultado ocurre cuando el estímulo incondicionado pavloviano (EI) y el reforzador instrumental son el mismo estímulo, mientras que se dice que el PIT general ocurre cuando el EI pavloviano y el reforzador son diferentes. ... Evidencia más reciente indica que el núcleo y la cubierta de accumbens parecen mediar diferentes aspectos del PIT; las lesiones de la cubierta y la inactivación redujeron el PIT específico del resultado, mientras que las lesiones del núcleo y la inactivación suprimieron el PIT general (Corbit y Balleine 2011). Estas diferencias entre el núcleo y la corteza probablemente se deban a las diferentes entradas anatómicas y salidas pálidas asociadas con estas subregiones del accumbens (Root et al. 2015). Estos resultados llevaron a Corbit y Balleine (2011) a sugerir que el núcleo del accumbens media los efectos excitatorios generales de las señales relacionadas con la recompensa. El PIT proporciona un proceso conductual fundamental por el cual los estímulos condicionados pueden ejercer efectos activadores sobre las respuestas instrumentales.
- ^ abc Corbit LH, Balleine BW (2016). "Procesos de aprendizaje y motivación que contribuyen a la transferencia pavloviana-instrumental y sus bases neuronales: dopamina y más allá". Temas actuales en neurociencias del comportamiento . 27 : 259–89. doi :10.1007/7854_2015_388. ISBN 978-3-319-26933-7. PMID 26695169.
Tales efectos sugieren que estados motivacionales específicos regulan los efectos excitantes de los procesos de incentivos pavlovianos sobre el desempeño instrumental... Los hallazgos conductuales están respaldados por evidencia de que circuitos neuronales distintos centrados en el núcleo y la capa del NAc median las formas generales y específicas de transferencia, respectivamente, y el trabajo en curso está comenzando a explicar cómo los procesos de aprendizaje pavloviano e instrumental que ocurren independientemente y en momentos separados se integran dentro de los circuitos neuronales que gobiernan el control conductual.
- ^ abcd Cherasse Y, Urade Y (noviembre de 2017). "Dietary Zinc Acts as a Sleep Modulator". International Journal of Molecular Sciences . 18 (11): 2334. doi : 10.3390/ijms18112334 . PMC 5713303 . PMID 29113075.
Más recientemente, el laboratorio de Fuller también descubrió que el sueño puede ser promovido por la activación de una población de neuronas ácido gamma-aminobutírico-érgicas (GABAérgicas) ubicadas en la zona parafacial [11,12], mientras que el papel de las neuronas que expresan A2AR GABAérgicas del núcleo accumbens [13] y el cuerpo estriado acaba de ser revelado [14,15].
- ^ abcdefg Valencia Garcia S, Fort P (febrero de 2018). "Núcleo Accumbens, una nueva área reguladora del sueño a través de la integración de estímulos motivacionales". Acta Pharmacologica Sinica . 39 (2): 165–166. doi :10.1038/aps.2017.168. PMC 5800466 . PMID 29283174.
El núcleo accumbens comprende un contingente de neuronas que expresan específicamente el subtipo del receptor postsináptico A2A (A2AR), lo que las hace excitables por la adenosina, su agonista natural dotado de potentes propiedades promotoras del sueño[4]. ... En ambos casos, la gran activación de neuronas que expresan A2AR en NAc promueve el sueño de ondas lentas (SWS) al aumentar el número y la duración de los episodios. ... Después de la activación optogenética del núcleo, se observó una promoción similar de SWS, mientras que no se indujeron efectos significativos al activar las neuronas que expresaban A2AR dentro de la capa.
- ^ abcdefg Oishi Y, Xu Q, Wang L, Zhang BJ, Takahashi K, Takata Y, Luo YJ, Cherasse Y, Schiffmann SN, de Kerchove d'Exaerde A, Urade Y, Qu WM, Huang ZL, Lazarus M (septiembre de 2017). "El sueño de ondas lentas está controlado por un subconjunto de neuronas centrales del núcleo accumbens en ratones". Nature Communications . 8 (1): 734. Bibcode :2017NatCo...8..734O. doi :10.1038/s41467-017-00781-4. PMC 5622037 . PMID 28963505.
En este trabajo, demostramos que la activación quimiogenética u optogenética de las neuronas de la vía indirecta que expresan el receptor excitatorio de adenosina A2A en la región central del NAc induce fuertemente el sueño de ondas lentas. La inhibición quimiogenética de las neuronas de la vía indirecta del NAc previene la inducción del sueño, pero no afecta el rebote homeostático del sueño.
- ^ abc Yuan XS, Wang L, Dong H, Qu WM, Yang SR, Cherasse Y, Lazarus M, Schiffmann SN, d'Exaerde AK, Li RX, Huang ZL (octubre de 2017). "Las neuronas receptoras 2A controlan el sueño del período activo a través de las neuronas de parvalbúmina en el globo pálido externo". eVida . 6 : e29055. doi : 10.7554/eLife.29055 . PMC 5655138 . PMID 29022877.
- ^ Schwienbacher I, Fendt M, Richardson R, Schnitzler HU (noviembre de 2004). "La inactivación temporal del núcleo accumbens altera la adquisición y expresión del sobresalto potenciado por el miedo en ratas". Brain Research . 1027 (1–2): 87–93. doi :10.1016/j.brainres.2004.08.037. PMID 15494160. S2CID 18338111.
- ^ ab Zubieta JK, Stohler CS (marzo de 2009). "Mecanismos neurobiológicos de las respuestas al placebo". Anales de la Academia de Ciencias de Nueva York . 1156 (1): 198–210. Bibcode :2009NYASA1156..198Z. doi :10.1111/j.1749-6632.2009.04424.x. PMC 3073412 . PMID 19338509.
- ^ Basar K, Sesia T, Groenewegen H, Steinbusch HW, Visser-Vandewalle V, Temel Y (diciembre de 2010). "Núcleo accumbens e impulsividad". Avances en Neurobiología . 92 (4): 533–57. doi :10.1016/j.pneurobio.2010.08.007. PMID 20831892. S2CID 16964212.
- ^ Gipson CD, Kupchik YM, Kalivas PW (enero de 2014). "Plasticidad sináptica rápida y transitoria en la adicción". Neurofarmacología . 76 Pt B: 276–86. doi :10.1016/j.neuropharm.2013.04.032. PMC 3762905 . PMID 23639436.
Dentro de un circuito PFC-NAc-VTA simplificado, el NAc sirve como una "puerta de entrada" a través de la cual se procesa la información sobre la dirección de la salida conductual desde la corteza límbica hasta los subcircuitos motores. Se cree que la transición a la búsqueda compulsiva de drogas surge de una capacidad deteriorada de este subcircuito para procesar eficazmente la información sobre las contingencias ambientales negativas, lo que conduce a una incapacidad para inhibir las respuestas predominantes asociadas a la droga; por lo tanto, el adicto se vuelve propenso a la recaída.
Figura 1: Aferencias glutamatérgicas al núcleo accumbens implicadas en la conducta adictiva - ^ abc Yager LM, Garcia AF, Wunsch AM, Ferguson SM (agosto de 2015). "Los entresijos del cuerpo estriado: papel en la adicción a las drogas". Neurociencia . 301 : 529–541. doi :10.1016/j.neuroscience.2015.06.033. PMC 4523218 . PMID 26116518.
[El cuerpo estriado] recibe entradas dopaminérgicas del área tegmental ventral (ATV) y la sustancia negra (SNr) y entradas glutamatérgicas de varias áreas, incluida la corteza, el hipocampo, la amígdala y el tálamo (Swanson, 1982; Phillipson y Griffiths, 1985; Finch, 1996; Groenewegen et al., 1999; Britt et al., 2012). Estas entradas glutamatérgicas hacen contacto en las cabezas de las espinas dendríticas de las neuronas de proyección espinosa media GABAérgicas (MSN) estriatales, mientras que las entradas dopaminérgicas hacen sinapsis en el cuello de la espina, lo que permite una interacción importante y compleja entre estas dos entradas en la modulación de la actividad de MSN ... También debe notarse que hay una pequeña población de neuronas en el NAc que coexpresan receptores D1 y D2, aunque esto está en gran medida restringido a la capa del NAc (Bertran-González et al., 2008). ... Las neuronas en las subdivisiones del núcleo y la capa del NAc también difieren funcionalmente. El núcleo del NAc está involucrado en el procesamiento de estímulos condicionados, mientras que la capa del NAc es más importante en el procesamiento de estímulos no condicionados; Clásicamente, se piensa que estas dos poblaciones de MSN estriatales tienen efectos opuestos en la salida de los ganglios basales. La activación de las dMSN causa una excitación neta del tálamo que resulta en un ciclo de retroalimentación cortical positivo; actuando así como una señal de "ir" para iniciar la conducta. Sin embargo, la activación de las iMSN provoca una inhibición neta de la actividad talámica que da lugar a un bucle de retroalimentación cortical negativo y, por tanto, sirve como un "freno" para inhibir la conducta... también hay cada vez más pruebas de que las iMSN desempeñan un papel en la motivación y la adicción (Lobo y Nestler, 2011; Grueter et al., 2013). ... En conjunto, estos datos sugieren que las iMSN normalmente actúan para restringir la conducta de consumo de drogas y que el reclutamiento de estas neuronas puede, de hecho, ser protector contra el desarrollo del consumo compulsivo de drogas.
- ^ abcdefghijk Robison AJ, Nestler EJ (octubre de 2011). "Mecanismos transcripcionales y epigenéticos de la adicción". Nature Reviews. Neuroscience . 12 (11): 623–37. doi :10.1038/nrn3111. PMC 3272277 . PMID 21989194.
ΔFosB se ha relacionado directamente con varias conductas relacionadas con la adicción ... Es importante destacar que la sobreexpresión genética o viral de ΔJunD, un mutante negativo dominante de JunD que antagoniza la actividad transcripcional mediada por ΔFosB y otras AP-1, en el NAc o el OFC bloquea estos efectos clave de la exposición a drogas
14,22–24
. Esto indica que ΔFosB es necesario y suficiente para muchos de los cambios provocados en el cerebro por la exposición crónica a drogas. ΔFosB también se induce en las MSN NAc de tipo D1 por el consumo crónico de varias recompensas naturales, incluyendo sacarosa, alimentos ricos en grasas, sexo, correr en rueda, donde promueve ese consumo
14,26–30
. Esto implica a ΔFosB en la regulación de las recompensas naturales en condiciones normales y quizás durante estados patológicos similares a adicciones. ... El 95% de las neuronas NAc son MSN GABAérgicas (neuronas espinosas medianas), que pueden diferenciarse además en aquellas MSN que expresan el receptor de dopamina D1 (MSN de tipo D1) y expresan dinorfina y sustancia P y aquellas que expresan el receptor de dopamina D2 (MSN de tipo D2) y expresan encefalina
132
. La inducción de ΔFosB por el fármaco
133,134
y los efectos de ΔFosB y G9a en la morfología y el comportamiento celular difieren entre las MSN de tipo D1 y de tipo D2
135
, y la actividad neuronal de estos dos tipos de células provoca efectos opuestos en las propiedades gratificantes de la cocaína
131
. ... Alrededor del 1-2% de las neuronas NAc son interneuronas colinérgicas grandes espinosas, que han demostrado desempeñar un papel importante en la recompensa de la cocaína
130
, y un número similar son interneuronas GABAérgicas, cuya función se entiende menos bien.
- ^ abcde Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, Oscar-Berman M, Gold M (2012). "Sexo, drogas y rock 'n' roll: hipótesis de activación mesolímbica común como función de polimorfismos de genes de recompensa". Journal of Psychoactive Drugs . 44 (1): 38–55. doi :10.1080/02791072.2012.662112. PMC 4040958 . PMID 22641964.
Se ha descubierto que el gen deltaFosB en el NAc es fundamental para reforzar los efectos de la recompensa sexual. Pitchers y colegas (2010) informaron que se demostró que la experiencia sexual causa acumulación de DeltaFosB en varias regiones cerebrales límbicas, incluyendo el NAc, la corteza prefrontal medial, el VTA, el caudado y el putamen, pero no el núcleo preóptico medial. A continuación, se midió la inducción de c-Fos, un objetivo descendente (reprimido) de DeltaFosB, en animales sexualmente experimentados y no sexualmente experimentados. El número de células c-Fos-IR inducidas por el apareamiento disminuyó significativamente en animales sexualmente experimentados en comparación con los controles sexualmente experimentados. Finalmente, los niveles de DeltaFosB y su actividad en el NAc se manipularon utilizando transferencia de genes mediada por virus para estudiar su papel potencial en la mediación de la experiencia sexual y la facilitación inducida por la experiencia del desempeño sexual. Los animales con sobreexpresión de DeltaFosB mostraron una facilitación mejorada del desempeño sexual con la experiencia sexual en relación con los controles. Por el contrario, la expresión de DeltaJunD, un socio de unión dominante negativo de DeltaFosB, atenuó la facilitación del desempeño sexual inducida por la experiencia sexual y retrasó el mantenimiento a largo plazo de la facilitación en comparación con el grupo que sobreexpresó DeltaFosB. En conjunto, estos hallazgos respaldan un papel crítico para la expresión de DeltaFosB en el NAc en los efectos de refuerzo de la conducta sexual y la facilitación del desempeño sexual inducida por la experiencia sexual. ... tanto la adicción a las drogas como la adicción sexual representan formas patológicas de neuroplasticidad junto con la aparición de comportamientos aberrantes que involucran una cascada de cambios neuroquímicos principalmente en el circuito de recompensa del cerebro.
- ^ Goto Y, O'Donnell P (febrero de 2001). "Actividad sincrónica en el hipocampo y el núcleo accumbens in vivo". The Journal of Neuroscience . 21 (4): RC131. doi :10.1523/jneurosci.21-04-j0003.2001. PMC 6762233 . PMID 11160416.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 6: Sistemas de proyección amplia: monoaminas, acetilcolina y orexina". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 175-176. ISBN 978-0-07-148127-4.
Dentro del cerebro, la histamina es sintetizada exclusivamente por neuronas con sus cuerpos celulares en el núcleo tuberomamilar (NTM) que se encuentra dentro del hipotálamo posterior. Hay aproximadamente 64000 neuronas histaminérgicas por lado en los humanos. Estas células se proyectan por todo el cerebro y la médula espinal. Las áreas que reciben proyecciones especialmente densas incluyen la corteza cerebral, el hipocampo, el neoestriado, el núcleo accumbens, la amígdala y el hipotálamo. ... Si bien la función mejor caracterizada del sistema de la histamina en el cerebro es la regulación del sueño y la excitación, la histamina también está involucrada en el aprendizaje y la memoria ... También parece que la histamina está involucrada en la regulación de la alimentación y el equilibrio energético.
- ^ Barrot M, Sesack SR, Georges F, Pistis M, Hong S, Jhou TC (octubre de 2012). "Frenado de los sistemas de dopamina: una nueva estructura maestra de GABA para las funciones mesolímbicas y nigroestriatales". The Journal of Neuroscience . 32 (41): 14094–101. doi :10.1523/JNEUROSCI.3370-12.2012. PMC 3513755 . PMID 23055478.
- ^ Ferré S, Lluís C, Justinova Z, Quiroz C, Orru M, Navarro G, Canela EI, Franco R, Goldberg SR (junio de 2010). "Adenosine-cannabinoid receptor interactions. Implications for striatal function". Br. J. Pharmacol . 160 (3): 443–453. doi :10.1111/j.1476-5381.2010.00723.x. PMC 2931547 . PMID 20590556.
Se pueden diferenciar dos clases de MSN, que se distribuyen de forma homogénea en el cuerpo estriado, por su conectividad de salida y su expresión de receptores de dopamina y adenosina y neuropéptidos. En el estriado dorsal (representado mayoritariamente por el núcleo caudado-putamen), las MSN encefalinérgicas conectan el estriado con el globo pálido (globo pálido lateral) y expresan el péptido encefalina y una alta densidad de receptores de dopamina D2 y adenosina A2A (también expresan receptores de adenosina A1), mientras que las MSN dinorfinérgicas conectan el estriado con la sustancia negra (pars compacta y reticulata) y el núcleo entopeduncular (globo pálido medial) y expresan los péptidos dinorfina y sustancia P y receptores de dopamina D1 y adenosina A1 pero no A2A ... Estos dos fenotipos diferentes de MSN también están presentes en el estriado ventral (representado mayoritariamente por el núcleo accumbens y el tubérculo olfatorio). Sin embargo, aunque son fenotípicamente iguales a sus contrapartes dorsales, tienen algunas diferencias en términos de conectividad. En primer lugar, no sólo las MSN encefalinérgicas sino también las dinorfinérgicas proyectan hacia la contraparte ventral del globo pálido lateral, el pálido ventral, que, de hecho, tiene características tanto del globo pálido lateral como del medial en su conectividad aferente y eferente. Además del pálido ventral, el globo pálido medial y la sustancia negra-ATV, el estriado ventral envía proyecciones a la amígdala extendida, el hipotálamo lateral y el núcleo tegmental pedunculopontino. ... También es importante mencionar que un pequeño porcentaje de MSN tienen un fenotipo mixto y expresan receptores tanto D1 como D2 (Surmeier et al., 1996).
- ^ Nishi A, Kuroiwa M, Shuto T (julio de 2011). "Mecanismos para la modulación de la señalización del receptor de dopamina d(1) en neuronas estriatales". Front Neuroanat . 5 : 43. doi : 10.3389/fnana.2011.00043 . PMC 3140648 . PMID 21811441.
La dopamina desempeña papeles críticos en la regulación de las funciones psicomotoras en el cerebro (Bromberg-Martin et al., 2010; Cools, 2011; Gerfen y Surmeier, 2011). Los receptores de dopamina son una superfamilia de receptores acoplados a proteína G heptahelicoidales, y se agrupan en dos categorías, receptores tipo D1 (D1, D5) y tipo D2 (D2, D3, D4), según sus propiedades funcionales para estimular la adenilato ciclasa (AC) a través de Gs/olf e inhibir la AC a través de Gi/o, respectivamente... Se ha demostrado que los receptores D1 forman el heterooligómero con los receptores D2, y que el heterooligómero del receptor D1–D2 se acopla preferentemente a la señalización Gq/PLC (Rashid et al., 2007a,b). La expresión de los receptores de dopamina D1 y D2 se segrega en gran medida en neuronas de la vía directa e indirecta en el cuerpo estriado dorsal, respectivamente (Gerfen et al., 1990; Hersch et al., 1995; Heiman et al., 2008). Sin embargo, se sabe que una cierta proporción de neuronas espinosas medianas expresan tanto receptores D1 como D2 (Hersch et al., 1995). El análisis de la expresión génica mediante la técnica RT-PCR de una sola célula estimó que el 40% de las neuronas espinosas medianas expresan ARNm de los receptores D1 y D2 (Surmeier et al., 1996).
- ^ abcdef Shirayama Y, Chaki S (octubre de 2006). "Neuroquímica del núcleo accumbens y su relevancia para la depresión y la acción antidepresiva en roedores". Neurofarmacología actual . 4 (4): 277–91. doi :10.2174/157015906778520773. PMC 2475798. PMID 18654637 .
- ^ Meredith GE, Agolia R, Arts MP, Groenewegen HJ, Zahm DS (septiembre de 1992). "Diferencias morfológicas entre las neuronas de proyección del núcleo y la corteza en el núcleo accumbens de la rata". Neurociencia . 50 (1): 149–62. doi :10.1016/0306-4522(92)90389-j. PMID 1383869. S2CID 11278705.
- ^ abc Meredith GE, Pennartz CM , Groenewegen HJ (1993). "El marco celular para la señalización química en el núcleo accumbens". Señalización química en los ganglios basales . Progreso en la investigación cerebral. Vol. 99. págs. 3–24. doi :10.1016/s0079-6123(08)61335-7. ISBN 978-0-444-81562-0. Número de identificación personal 7906426.
- ^ abcd Berridge KC, Kringelbach ML (mayo de 2015). "Sistemas de placer en el cerebro". Neuron . 86 (3): 646–64. doi :10.1016/j.neuron.2015.02.018. PMC 4425246 . PMID 25950633.
- ^ Baliki MN, Mansour A, Baria AT, Huang L, Berger SE, Fields HL, Apkarian AV (octubre de 2013). "La división del accumbens humano en un núcleo y una cubierta putativos disocia la codificación de valores para la recompensa y el dolor". The Journal of Neuroscience . 33 (41): 16383–93. doi :10.1523/JNEUROSCI.1731-13.2013. PMC 3792469 . PMID 24107968.
Evidencias recientes indican que la inactivación de los receptores D2, en la vía estriatopalida indirecta en roedores, es necesaria tanto para la adquisición como para la expresión de la conducta aversiva, y la activación del receptor D1 de la vía directa controla el aprendizaje basado en la recompensa (Hikida et al., 2010; Hikida et al., 2013). Parece que podemos concluir que las vías directas e indirectas del NAc, a través de los receptores D1 y D2, sirven para funciones distintas de anticipación y valoración en la capa y el núcleo del NAc, lo que es consistente con las observaciones sobre la segregación espacial y la diversidad de respuestas de las neuronas dopaminérgicas del mesencéfalo para condiciones gratificantes y aversivas, algunas codificando valor motivacional, otras saliencia motivacional, cada una conectada con redes cerebrales distintas y teniendo funciones distintas en el control motivacional (Bromberg-Martin et al., 2010; Cohen et al., 2012; Lammel et al., 2013). ... Por lo tanto, los resultados anteriores, junto con las observaciones actuales, implican que la respuesta pshell del NAc refleja una señal de predicción/anticipación o saliencia, y la respuesta pcore del NAc es una respuesta de valoración (señal predictiva de recompensa) que señala el valor de refuerzo negativo del cese del dolor (es decir, analgesia anticipada).
- ^ ab Cartoni E, Puglisi-Allegra S, Baldassarre G (noviembre de 2013). "Los tres principios de la acción: una hipótesis de transferencia pavloviana-instrumental". Frontiers in Behavioral Neuroscience . 7 : 153. doi : 10.3389/fnbeh.2013.00153 . PMC 3832805 . PMID 24312025.
- ^ Richard JM, Castro DC, Difeliceantonio AG, Robinson MJ, Berridge KC (noviembre de 2013). "Mapeo de los circuitos cerebrales de recompensa y motivación: siguiendo los pasos de Ann Kelley". Neuroscience and Biobehavioral Reviews . 37 (9 Pt A): 1919–31. doi :10.1016/j.neubiorev.2012.12.008. PMC 3706488 . PMID 23261404.
- Figura 3: Circuitos neuronales subyacentes al “deseo” motivado y al “gusto” hedónico.
- ^ Berridge KC, Robinson TE, Aldridge JW (febrero de 2009). "Disección de los componentes de la recompensa: 'gusto', 'deseo' y aprendizaje". Current Opinion in Pharmacology . 9 (1): 65–73. doi :10.1016/j.coph.2008.12.014. PMC 2756052 . PMID 19162544.
- ^ ab Nestler EJ (diciembre de 2013). "Bases celulares de la memoria para la adicción". Diálogos en neurociencia clínica . 15 (4): 431–43. doi :10.31887/DCNS.2013.15.4/enestler. PMC 3898681 . PMID 24459410.
A PESAR DE LA IMPORTANCIA DE NUMEROSOS FACTORES PSICOSOCIALES, EN SU BASE, LA ADICCIÓN A LAS DROGAS IMPLICA UN PROCESO BIOLÓGICO: la capacidad de la exposición repetida a una droga de abuso para inducir cambios en un cerebro vulnerable que impulsan la búsqueda y el consumo compulsivo de drogas, y la pérdida de control sobre el consumo de drogas, que definen un estado de adicción. ... Una gran cantidad de literatura ha demostrado que dicha inducción de ΔFosB en las neuronas NAc de tipo D1 aumenta la sensibilidad de un animal al fármaco, así como a las recompensas naturales, y promueve la autoadministración del fármaco, presumiblemente a través de un proceso de refuerzo positivo... Por ejemplo, las subregiones de la cubierta y el núcleo del NAc muestran diferencias en la plasticidad sináptica inducida por el fármaco, al igual que las neuronas espinosas medianas de tipo D1 frente a las de tipo D2 dentro de cada subregión.
60,63,64,67
- ^ Dumitriu D, Laplant Q, Grossman YS, Dias C, Janssen WG, Russo SJ, Morrison JH, Nestler EJ (mayo de 2012). "Especificidad del subtipo de espina, compartimento dendrítico y subregional en la regulación de las espinas dendríticas en el núcleo accumbens por la cocaína". The Journal of Neuroscience . 32 (20): 6957–66. doi :10.1523/JNEUROSCI.5718-11.2012. PMC 3360066 . PMID 22593064.
El cambio duradero de la densidad de las espinas en el núcleo pero no en la corteza encaja bien con la idea establecida de que la corteza está preferentemente involucrada en el desarrollo de la adicción, mientras que el núcleo media la ejecución a largo plazo de las conductas aprendidas relacionadas con la adicción (Ito et al., 2004; Di Chiara, 2002; Meredith et al., 2008). En consonancia con la idea de que el núcleo del NAc es el lugar de la neuroplasticidad inducida por drogas de larga duración, varios estudios han demostrado que los cambios electrofisiológicos en el núcleo persisten más tiempo que sus contrapartes de la corteza. ... Además, los datos presentados aquí respaldan la idea de que la corteza del NAc está preferentemente involucrada en la recompensa inmediata de la droga, mientras que el núcleo podría desempeñar un papel más explícito en los aspectos a largo plazo de la adicción.
- ^ Pontieri FE, Tanda G, Di Chiara G (diciembre de 1995). "La cocaína intravenosa, la morfina y la anfetamina aumentan preferentemente la dopamina extracelular en la "capa" en comparación con el "núcleo" del núcleo accumbens de la rata". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 92 (26): 12304–8. Bibcode :1995PNAS...9212304P. doi : 10.1073/pnas.92.26.12304 . JSTOR 2369093. PMC 40345 . PMID 8618890.
- ^ abc Di Chiara G (diciembre de 2002). "Dopamina en el núcleo y la corteza del núcleo accumbens: papel diferencial en la conducta y la adicción". Behavioural Brain Research . 137 (1–2): 75–114. doi :10.1016/s0166-4328(02)00286-3. PMID 12445717. S2CID 54410118.
- ^ Eiden LE, Weihe E (enero de 2011). "VMAT2: un regulador dinámico de la función neuronal monoaminérgica cerebral que interactúa con drogas de abuso". Anales de la Academia de Ciencias de Nueva York . 1216 (1): 86–98. Bibcode :2011NYASA1216...86E. doi :10.1111/j.1749-6632.2010.05906.x. PMC 4183197 . PMID 21272013.
VMAT2 es el transportador vesicular del SNC no solo para las aminas biógenas DA, NE, EPI, 5-HT y HIS, sino probablemente también para las aminas traza TYR, PEA y tironamina (THYR) ... Las neuronas [traza aminérgicas] en el SNC de los mamíferos serían identificables como neuronas que expresan VMAT2 para almacenamiento y la enzima biosintética descarboxilasa de aminoácidos aromáticos (AADC).
- ^ Barrot M, Marinelli M, Abrous DN, Rougé-Pont F, Le Moal M, Piazza PV (marzo de 2000). "La hiperreactividad dopaminérgica de la capa del núcleo accumbens depende de las hormonas". Revista Europea de Neurociencia . 12 (3): 973–9. doi :10.1046/j.1460-9568.2000.00996.x. PMID 10762327. S2CID 6111417.
- ^ Akiyama G, Ikeda H, Matsuzaki S, Sato M, Moribe S, Koshikawa N, Cools AR (junio de 2004). "Los receptores GABAA y GABAB en la cubierta del núcleo accumbens modulan de manera diferencial el comportamiento de giro mediado por los receptores de dopamina y acetilcolina". Neurofarmacología . 46 (8): 1082–8. doi :10.1016/j.neuropharm.2004.02.007. PMID 15111014. S2CID 25631633.
- ^ Smith-Roe SL, Sadeghian K, Kelley AE (agosto de 1999). "El aprendizaje espacial y el rendimiento en el laberinto de brazos radiales se ven afectados tras el bloqueo del receptor N-metil-D-aspartato (NMDA) en las subregiones estriatales". Neurociencia del comportamiento . 113 (4): 703–17. doi :10.1037/0735-7044.113.4.703. PMID 10495079.
- ^ Giertler C, Bohn I, Hauber W (marzo de 2005). "Participación de los receptores NMDA y AMPA/KA en el núcleo accumbens en el aprendizaje instrumental guiado por señales predictivas de recompensa". The European Journal of Neuroscience . 21 (6): 1689–702. doi :10.1111/j.1460-9568.2005.03983.x. PMID 15845096. S2CID 14206373.
- ^ abcdefghijklmnopq Olsen CM (diciembre de 2011). "Recompensas naturales, neuroplasticidad y adicciones no farmacológicas". Neurofarmacología . 61 (7): 1109–22. doi :10.1016/j.neuropharm.2011.03.010. PMC 3139704 . PMID 21459101.
La sensibilización cruzada también es bidireccional, ya que un historial de administración de anfetaminas facilita el comportamiento sexual y mejora el aumento asociado en NAc DA ... Como se describió para la recompensa de comida, la experiencia sexual también puede conducir a la activación de cascadas de señalización relacionadas con la plasticidad. El factor de transcripción delta FosB aumenta en el NAc, PFC, estriado dorsal y VTA después de un comportamiento sexual repetido (Wallace et al., 2008; Pitchers et al., 2010b). Este aumento natural de delta FosB o la sobreexpresión viral de delta FosB dentro del NAc modula el desempeño sexual, y el bloqueo delta FosB por parte del NAc atenúa este comportamiento (Hedges et al., 2009; Pitchers et al., 2010b). Además, la sobreexpresión viral de delta FosB mejora la preferencia condicionada por un entorno asociado con la experiencia sexual (Hedges et al., 2009). ...
Tabla 1
- ^ Day JJ, Carelli RM (abril de 2007). "El núcleo accumbens y el aprendizaje pavloviano de recompensa". The Neuroscientist . 13 (2): 148–59. doi :10.1177/1073858406295854. PMC 3130622 . PMID 17404375.
En consonancia con otros informes (Nicola y otros 2004; Taha y Fields 2006), la respuesta predominante de las neuronas NAc a las infusiones de sacarosa fue una disminución de la actividad (Fig. 2). Como es evidente en la Figura 2, las mismas neuronas exhibieron respuestas opuestas cuando se administró una solución de quinina aversiva por vía intraoral. Una hipótesis sugiere que las inhibiciones observadas durante la administración de la recompensa ocurren entre las neuronas NAc que contienen GABA que se proyectan a áreas motoras importantes como el pálido ventral (VP).
- ^ Carlezon WA, Thomas MJ (2009). "Sustratos biológicos de recompensa y aversión: una hipótesis de actividad del núcleo accumbens". Neurofarmacología . 56 (Supl 1): 122–32. doi :10.1016/j.neuropharm.2008.06.075. PMC 2635333 . PMID 18675281.
Cuando se consideran en conjunto, estos estudios proporcionaron dos piezas críticas de evidencia que han jugado un papel destacado en la formulación de nuestra hipótesis de trabajo actual: primero, que la recompensa dependiente de la dopamina se atenúa mediante el bloqueo de los receptores similares a D2, que son receptores inhibidores expresados predominantemente en el NAc en los MSN de la vía indirecta; y segundo, que los eventos que se esperaría que redujeran la excitabilidad general del NAc (por ejemplo, estimulación de los receptores opioides acoplados a Gi, estimulación reducida de los receptores NMDA excitatorios, entrada excitatoria reducida) son suficientes para la recompensa. Esta interpretación condujo al desarrollo de un modelo de recompensa en el que el evento crítico es la activación reducida de MSN en el NAc.
- ^ Costa VD, Lang PJ, Sabatinelli D, Versace F, Bradley MM (septiembre de 2010). "Imágenes emocionales: evaluación del placer y la excitación en el circuito de recompensa del cerebro". Mapeo cerebral humano . 31 (9): 1446–57. doi :10.1002/hbm.20948. PMC 3620013 . PMID 20127869.
- ^ Sabatinelli D, Bradley MM, Lang PJ, Costa VD, Versace F (septiembre de 2007). "El placer, en lugar de la prominencia, activa el núcleo accumbens humano y la corteza prefrontal medial". Journal of Neurophysiology . 98 (3): 1374–9. doi :10.1152/jn.00230.2007. PMID 17596422. S2CID 14938485.
- ^ Mogenson GJ, Jones DL, Yim CY (1980). "De la motivación a la acción: interfaz funcional entre el sistema límbico y el sistema motor". Progreso en neurobiología . 14 (2–3): 69–97. doi :10.1016/0301-0082(80)90018-0. PMID 6999537. S2CID 14029796.
- ^ Hart G, Leung BK, Balleine BW (febrero de 2014). "Corrientes dorsales y ventrales: el papel distintivo de las subregiones estriatales en la adquisición y ejecución de acciones dirigidas a objetivos". Neurobiología del aprendizaje y la memoria . 108 : 104–18. doi :10.1016/j.nlm.2013.11.003. PMC 4661143 . PMID 24231424.
- ^ Castro DC, Cole SL, Berridge KC (2015). "Funciones del hipotálamo lateral, el núcleo accumbens y el pálido ventral en la alimentación y el hambre: interacciones entre los circuitos homeostáticos y de recompensa". Frontiers in Systems Neuroscience . 9 : 90. doi : 10.3389/fnsys.2015.00090 . PMC 4466441 . PMID 26124708.
- ^ Berridge KC, Kringelbach ML (junio de 2013). "Neurociencia del afecto: mecanismos cerebrales del placer y el displacer". Current Opinion in Neurobiology . 23 (3): 294–303. doi :10.1016/j.conb.2013.01.017. PMC 3644539 . PMID 23375169.
- ^ Yin HH, Ostlund SB, Balleine BW (octubre de 2008). "Aprendizaje guiado por recompensas más allá de la dopamina en el núcleo accumbens: las funciones integradoras de las redes de ganglios corticobasales". The European Journal of Neuroscience . 28 (8): 1437–48. doi :10.1111/j.1460-9568.2008.06422.x. PMC 2756656 . PMID 18793321.
- ^ Soares-Cunha C, Coimbra B, Sousa N, Rodrigues AJ (septiembre de 2016). "Reevaluación de las neuronas D1 y D2 del cuerpo estriado en recompensa y aversión" (PDF) . Reseñas de neurociencia y biocomportamiento . 68 : 370–386. doi :10.1016/j.neubiorev.2016.05.021. hdl : 1822/47044 . PMID 27235078. S2CID 207092810.
- ^ Soares-Cunha C, Coimbra B, Domingues AV, Vasconcelos N, Sousa N, Rodrigues AJ (19 de abril de 2018). "El microcircuito del núcleo accumbens subyace al aumento de la motivación impulsado por D2-MSN". eNeuro . 5 (2): ENEURO.0386–18.2018. doi :10.1523/ENEURO.0386-18.2018. PMC 5957524 . PMID 29780881.
La activación optogenética de D2-MSN disminuyó la actividad del pallidum ventral (VP), reduciendo el tono inhibidor del VTA, lo que conduce a un aumento de la actividad dopaminérgica. Es importante destacar que la activación optogenética de las terminales D2-MSN en el VP fue suficiente para recapitular la mejora de la motivación.
- ^ Ferris CF, Kulkarni P, Sullivan JM, Harder JA, Messenger TL, Febo M (enero de 2005). "La succión de los cachorros es más gratificante que la cocaína: evidencia de imágenes por resonancia magnética funcional y análisis computacional tridimensional". The Journal of Neuroscience . 25 (1): 149–56. arXiv : 1510.02343 . doi :10.1523/jneurosci.3156-04.2005. PMC 6725197 . PMID 15634776.
- ^ Numan M (enero de 2007). "Sistemas motivacionales y circuitos neuronales del comportamiento maternal en la rata". Psicobiología del desarrollo . 49 (1): 12–21. doi : 10.1002/dev.20198 . PMID 17186513.
- ^ Glocker ML, Langleben DD, Ruparel K, Loughead JW, Valdez JN, Griffin MD, Sachser N, Gur RC (junio de 2009). "El esquema del bebé modula el sistema de recompensa cerebral en mujeres nulíparas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (22): 9115–9. Bibcode :2009PNAS..106.9115G. doi : 10.1073/pnas.0811620106 . JSTOR 40482823. PMC 2690007 . PMID 19451625.
- ^ ab Hyman SE, Malenka RC, Nestler EJ (2006). "Mecanismos neuronales de la adicción: el papel del aprendizaje y la memoria relacionados con la recompensa". Revisión anual de neurociencia . 29 : 565–98. doi :10.1146/annurev.neuro.29.051605.113009. PMID 16776597.
- ^ Steiner H, Van Waes V (enero de 2013). "Regulación genética relacionada con la adicción: riesgos de la exposición a potenciadores cognitivos frente a otros psicoestimulantes". Progress in Neurobiology . 100 : 60–80. doi :10.1016/j.pneurobio.2012.10.001. PMC 3525776 . PMID 23085425.
- ^ ab Ruffle JK (noviembre de 2014). "Neurobiología molecular de la adicción: ¿de qué se trata todo el (Δ)FosB?". The American Journal of Drug and Alcohol Abuse . 40 (6): 428–37. doi :10.3109/00952990.2014.933840. PMID 25083822. S2CID 19157711.
ΔFosB es un factor de transcripción esencial implicado en las vías moleculares y conductuales de la adicción después de la exposición repetida a drogas. La formación de ΔFosB en múltiples regiones cerebrales y la vía molecular que conduce a la formación de complejos AP-1 se entienden bien. El establecimiento de un propósito funcional para ΔFosB ha permitido una mayor determinación de algunos de los aspectos clave de sus cascadas moleculares, que involucran efectores como GluR2 (87,88), Cdk5 (93) y NFkB (100). Además, muchos de estos cambios moleculares identificados ahora están directamente relacionados con los cambios estructurales, fisiológicos y conductuales observados después de la exposición crónica a fármacos (60,95,97,102). Los estudios epigenéticos han abierto nuevas fronteras de investigación que investigan los roles moleculares de ΔFosB, y los avances recientes han ilustrado el papel de ΔFosB al actuar sobre el ADN y las histonas, realmente como un
interruptor molecular
(34).
- ^ Kanehisa Laboratories (29 de octubre de 2014). «Alcoholismo: Homo sapiens (humano)». KEGG Pathway . Consultado el 31 de octubre de 2014 .
- ^ Kim Y, Teylan MA, Baron M, Sands A, Nairn AC, Greengard P (febrero de 2009). "Formación de espinas dendríticas inducida por metilfenidato y expresión de DeltaFosB en el núcleo accumbens". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (8): 2915–20. Bibcode :2009PNAS..106.2915K. doi : 10.1073/pnas.0813179106 . PMC 2650365 . PMID 19202072.
- ^ Pitchers KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (febrero de 2013). "Las recompensas naturales y de drogas actúan sobre mecanismos comunes de plasticidad neuronal con ΔFosB como mediador clave". The Journal of Neuroscience . 33 (8): 3434–42. doi :10.1523/JNEUROSCI.4881-12.2013. PMC 3865508 . PMID 23426671.
Las drogas de abuso inducen neuroplasticidad en la vía de recompensa natural, específicamente el núcleo accumbens (NAc), lo que provoca el desarrollo y la expresión de la conducta adictiva. ... En conjunto, estos hallazgos demuestran que las drogas de abuso y las conductas de recompensa natural actúan sobre mecanismos moleculares y celulares comunes de plasticidad que controlan la vulnerabilidad a la adicción a las drogas, y que esta mayor vulnerabilidad está mediada por ΔFosB y sus objetivos transcripcionales posteriores. ... La conducta sexual es altamente gratificante (Tenk et al., 2009), y la experiencia sexual provoca conductas relacionadas con la droga que sensibilizan, incluyendo la sensibilización cruzada a la actividad locomotora inducida por la anfetamina (Amph) (Bradley y Meisel, 2001; Pitchers et al., 2010a) y una mayor recompensa por Amph (Pitchers et al., 2010a). Además, la experiencia sexual induce plasticidad neuronal en el NAc similar a la inducida por la exposición a psicoestimulantes, incluyendo una mayor densidad de espinas dendríticas (Meisel y Mullins, 2006; Pitchers et al., 2010a), tráfico de receptores de glutamato alterado y una menor fuerza sináptica en las neuronas de la capa del NAc que responden a la corteza prefrontal (Pitchers et al., 2012). Por último, se descubrió que los períodos de abstinencia de la experiencia sexual eran críticos para aumentar la recompensa Amph, la espinogénesis NAc (Pitchers et al., 2010a) y el tráfico del receptor de glutamato (Pitchers et al., 2012). Estos hallazgos sugieren que las experiencias de recompensa naturales y farmacológicas comparten mecanismos comunes de plasticidad neuronal.
- ^ Los electrodos cerebrales ayudan a tratar la depresión Archivado el 16 de marzo de 2012 en Wayback Machine , Technology Review , 26 de abril de 2007
- ^ Bewernick BH, Hurlemann R, Matusch A, Kayser S, Grubert C, Hadrysiewicz B, Axmacher N, Lemke M, Cooper-Mahkorn D, Cohen MX, Brockmann H, Lenartz D, Sturm V, Schlaepfer TE (enero de 2010). "La estimulación cerebral profunda del núcleo accumbens disminuye los índices de depresión y ansiedad en la depresión resistente al tratamiento". Psiquiatría biológica . 67 (2): 110–6. doi :10.1016/j.biopsych.2009.09.013. PMID 19914605. S2CID 26242126.
- ^ Ooms P, Mantione M, Figee M, Schuurman PR, van den Munckhof P, Denys D (febrero de 2014). "Estimulación cerebral profunda para trastornos obsesivo-compulsivos: análisis a largo plazo de la calidad de vida". Revista de neurología, neurocirugía y psiquiatría . 85 (2): 153–8. doi :10.1136/jnnp-2012-302550. PMID 23715912. S2CID 54572260.
- ^ "Una polémica cirugía para tratar la adicción destruye el centro del placer del cerebro", autora Maia Szalavitz, 13 de diciembre de 2012
- ^ "China prohíbe un procedimiento irreversible para el cerebro" Autora: Zamiska Nicholas. 28 de abril de 2008. The Wall Street Journal
- ^ Scott DJ, Stohler CS, Egnatuk CM, Wang H, Koeppe RA, Zubieta JK (julio de 2007). "Las diferencias individuales en la respuesta a la recompensa explican las expectativas y los efectos inducidos por el placebo". Neuron . 55 (2): 325–36. doi : 10.1016/j.neuron.2007.06.028 . PMID 17640532.
- "Identificada una región cerebral clave para el efecto placebo". EurekAlert! (Nota de prensa). 18 de julio de 2007.
Enlaces externos
- El papel del núcleo accumbens en el circuito de recompensa. Parte de "El cerebro de arriba a abajo" en thebrain.mcgill.ca
- Núcleo accumbens: base de datos centrada en las células
- Imágenes de cortes cerebrales teñidos que incluyen el "núcleo accumbens" en el proyecto BrainMaps






