Contraión

En química , un contraión (a veces escrito como " contraión ", pronunciado así) es el ion que acompaña a una especie iónica para mantener la neutralidad eléctrica . En la sal de mesa (NaCl, también conocida como cloruro de sodio), el ion sodio (con carga positiva) es el contraión del ion cloruro (con carga negativa) y viceversa.
Un contraión se denominará más comúnmente anión o catión , dependiendo de si tiene carga negativa o positiva. Por lo tanto, el contraión de un anión será un catión y viceversa.
En bioquímica , los contraiones generalmente se definen de manera vaga. Dependiendo de su carga, las proteínas se asocian con una variedad de aniones y cationes más pequeños. En las células vegetales , el anión malato a menudo se acumula en la vacuola para disminuir el potencial hídrico e impulsar la expansión celular. Para mantener la neutralidad, los iones K + a menudo se acumulan como contraión. La permeación de iones a través de las paredes celulares hidrófobas está mediada por canales de transporte de iones . Los ácidos nucleicos son aniónicos, los cationes correspondientes a menudo son poliaminas protonadas .
Química interfacial
Los contraiones son los iones móviles en polímeros y coloides de intercambio iónico . [1] Las resinas de intercambio iónico son polímeros con una carga neta negativa o positiva. Las resinas de intercambio catiónico consisten en un polímero aniónico con contracationes, típicamente Na + (sodio). La resina tiene una mayor afinidad por los contracationes altamente cargados, por ejemplo por Ca 2+ (calcio) en el caso del ablandamiento del agua . En consecuencia, las resinas de intercambio aniónico se proporcionan típicamente en forma de cloruro Cl − , que es un contraanión altamente móvil.
Los contraiones se utilizan en la catálisis por transferencia de fase . En una aplicación típica, un contracatión lipofílico, como el benzalconio, solubiliza reactivos en disolventes orgánicos.
Química de soluciones
La solubilidad de las sales en disolventes orgánicos es una función tanto del catión como del anión. La solubilidad de los cationes en disolventes orgánicos puede mejorarse cuando el anión es lipofílico. De manera similar, la solubilidad de los aniones en disolventes orgánicos se mejora con cationes lipofílicos. Los cationes lipofílicos más comunes son los cationes de amonio cuaternario , llamados "sales cuaternarias".
- Contraaniones lipofílicos
- El tetrakis(pentafluorofenil)borato de litio es la sal de litio de un anión tetraarilborato altamente lipofílico, a menudo denominado anión de coordinación débil . [2]
- El tetrafenilborato es menos lipofílico que el derivado perfluorado, pero se utiliza ampliamente como agente precipitante.
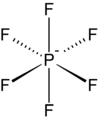
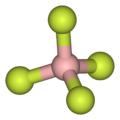
- Como lo ilustra el pequeño contraanión tetrafluoroborato ( BF−
4), los cationes lipofílicos tienden a ser simétricos y tener una sola carga.
- Contracationes lipofílicos
- El cloruro de bis(trifenilfosfina)iminio es la sal de cloruro de un catión fosfonio lipofílico voluminoso [Ph 3 PNPPh 3 ] + .
- El cloruro de tetrafenilfosfonio (C 6 H 5 ) 4 PCl, abreviado Ph 4 PCl o PPh 4 Cl, es el cloruro de un catión fosfonio simétrico que se utiliza a menudo en la química organometálica . La sal de arsonio también es muy conocida.
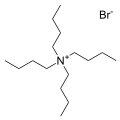
- Sal de bromuro de tetrabutilamonio , uno de los contracationes más comunes. Se conocen muchas "sales de cuaternario" análogas.
- Los cationes de metales alcalinos unidos por éteres corona son contracationes lipofílicos comunes, como lo ilustra [Li(12-corona-4) 2 ] + .
Muchos complejos organometálicos catiónicos se aíslan con contraiones inertes no coordinantes. El tetrafluoroborato de ferrocenio es un ejemplo de ello.
Electroquímica
Para lograr una alta conductividad iónica, las mediciones electroquímicas se realizan en presencia de un exceso de electrolito. En el agua, el electrolito suele ser una sal simple, como el cloruro de potasio . Para las mediciones en soluciones no acuosas, se emplean sales compuestas tanto de cationes lipófilos como de aniones, por ejemplo, hexafluorofosfato de tetrabutilamonio . Incluso en estos casos, los potenciales se ven influenciados por el apareamiento iónico , un efecto que se acentúa en disolventes de baja constante dieléctrica . [3]
Estabilidad de los contraiones
Para muchas aplicaciones, el contraión simplemente proporciona carga y lipofilia que permite la manipulación de su ion asociado. Se espera que el contraión sea químicamente inerte. Para los contraaniones, la inercia se expresa en términos de baja basicidad de Lewis . Los contraiones son idealmente resistentes y no reactivos. Para los contracationes de amonio cuaternario y fosfonio, la inercia está relacionada con su resistencia a la degradación por bases fuertes y nucleófilos fuertes.
Referencias
- ^ IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "contraiones". doi :10.1351/goldbook.C01371
- ^ I. Krossing e I. Raabe (2004). "Aniones no coordinantes: ¿realidad o ficción? Un estudio de posibles candidatos". Angewandte Chemie International Edition . 43 (16): 2066–2090. doi :10.1002/anie.200300620. PMID 15083452.
- ^ Geiger, WE, Barrière, F., "Electroquímica organometálica basada en electrolitos que contienen aniones de fluoroarilborato de coordinación débil", Acc. Chem. Res. 2010, 43, 1030. doi :10.1021/ar1000023
![El tetrakis(pentafluorofenil)borato de litio es la sal de litio de un anión tetraarilborato altamente lipofílico, a menudo denominado anión de coordinación débil.[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png/152px-Lithium-tetrakis%28pentafluorophenyl%29borate-2D-skeletal.png)

![El cloruro de bis(trifenilfosfina)iminio es la sal de cloruro de un catión fosfonio lipofílico voluminoso [Ph3PNPPh3]+.](http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/PPNCl.png/180px-PPNCl.png)

![Los cationes de metales alcalinos unidos por éteres corona son contracationes lipofílicos comunes, como lo ilustra [Li(12-corona-4)2]+.](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png/118px-Bis%2812-crown-4%29lithium-cation-from-xtal-3D-balls-B.png)