Química atmosférica
.jpg/440px-ISS-48_Towering_cumulonimbus_and_other_clouds_over_the_Earth_(2).jpg) |
|
| Meteorología |
|---|
| Climatología |
| Aeronomía |
| Glosarios |
La química atmosférica es una rama de la ciencia atmosférica en la que se estudia la química de la atmósfera de la Tierra y la de otros planetas. [1] Es un enfoque multidisciplinario de investigación y se basa en la química ambiental , la física , la meteorología , la modelización informática , la oceanografía , la geología y la vulcanología y otras disciplinas. La investigación está cada vez más conectada con otras áreas de estudio como la climatología .
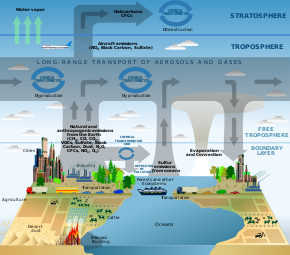
La composición y la química de la atmósfera de la Tierra son importantes por varias razones, pero principalmente debido a las interacciones entre la atmósfera y los organismos vivos . La composición de la atmósfera de la Tierra cambia como resultado de procesos naturales como las emisiones de los volcanes , los rayos y el bombardeo de partículas solares de la corona . También ha sido modificada por la actividad humana y algunos de estos cambios son perjudiciales para la salud humana, los cultivos y los ecosistemas. Algunos ejemplos de problemas que han sido abordados por la química atmosférica incluyen la lluvia ácida , el agotamiento del ozono , el smog fotoquímico , los gases de efecto invernadero y el calentamiento global . Los químicos atmosféricos buscan comprender las causas de estos problemas y, al obtener una comprensión teórica de ellos, permitir que se prueben posibles soluciones y se evalúen los efectos de los cambios en la política gubernamental.
Composición atmosférica


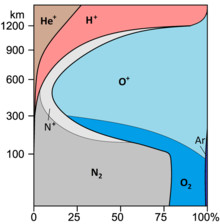
| Composición media de la atmósfera seca ( fracciones molares ) | ||
|---|---|---|
| Gas | Aire seco según la NASA | Aire limpio y seco cerca del nivel del mar (norma ISO 2533 - 1975) |
| Nitrógeno , N2 | 78.084% | 78.084% |
| Oxígeno , O 2 [3] | 20,946% | 20,946% |
| Constituyentes menores (fracciones molares en ppm ) | ||
| Argón , Ar | 9340 | 9340 |
| Dióxido de carbono * [a] , CO 2 | 430 | 430 |
| Neón , Ne | 18.18 | 18.18 |
| Helio , Él | 5.24 | 5.24 |
| Metano [a] , CH 4 | 1.9 | 1.9 |
| Criptón , Kr | 1.14 | 1.14 |
| Hidrógeno , H2 | 0,53 | 0,53 |
| Óxido nitroso , N2O | 0,34 | |
| Xenón , Xe | 0,087 | |
| Dióxido de nitrógeno , NO2 | hasta 0,02 | |
| Ozono *, O 3 , en verano | hasta 0,07 | |
| Ozono *, O 3 , en invierno | hasta 0,02 | |
| Dióxido de azufre *, SO 2 | hasta 1 | |
| Yodo *, I 2 | 0,01 | |
| Agua | ||
| Vapor de agua * | Altamente variable (alrededor del 0 al 3 %); por lo general representa alrededor del 1 % | |
| Notas | ||
| La masa molecular media del aire seco es de 28,97 g/mol. *El contenido del gas puede sufrir variaciones significativas de un momento a otro o de un lugar a otro. [a] La concentración de CO 2 y CH 4 varía según la estación y la ubicación. | ||
Composición de los gases traza
Además de los componentes principales enumerados anteriormente, la atmósfera de la Tierra también tiene muchas especies de gases traza que varían significativamente según las fuentes y los sumideros cercanos. Estos gases traza pueden incluir compuestos como los CFC/HCFC, que son especialmente dañinos para la capa de ozono, y el H
2S , que tiene un olor característico a huevo podrido y se puede oler en concentraciones tan bajas como 0,47 ppb. A continuación se enumeran algunas cantidades aproximadas cerca de la superficie de algunos gases adicionales. Además de los gases, la atmósfera contiene partículas en forma de aerosol , que incluyen, por ejemplo, gotitas, cristales de hielo, bacterias y polvo.
| Composición (ppt por volumen a menos que se indique lo contrario) | ||
|---|---|---|
| Gas | Un continente limpio, Seinfeld & Pandis (2016) [4] | Simpson y otros (2010) [5] |
| Monóxido de carbono , CO | 40-200 ppb p39 | 97 ppb |
| Óxido nítrico , NO | 16 | |
| Etano , C2H6 | 781 | |
| Propano , C3H8 | 200 | |
| Isopreno , C5H8 | 311 | |
| Benceno , C6H6 | 11 | |
| Metanol , CH3OH | 1967 | |
| Etanol , C2H5OH | 75 | |
| Triclorofluorometano , CCl3F | 237 pág. 41 | 252,7 |
| Diclorodifluorometano , CCl2F2 | 530 pág. 41 | 532.3 |
| Clorometano , CH3Cl | 503 | |
| Bromometano , CH3Br | 9–10 pág. 44 | 7.7 |
| Yodometano , CH3I | 0,36 | |
| Sulfuro de carbonilo , OCS | 510 pág. 26 | 413 |
| Dióxido de azufre , SO2 | 70–200 pág. 26 | 102 |
| Sulfuro de hidrógeno , H2S | 15–340 pág. 26 | |
| Disulfuro de carbono , CS2 | 15–45 pág. 26 | |
| Formaldehído , H2CO | 9,1 ppb p37, contaminado | |
| Acetileno , C2H2 | 8,6 ppb p37, contaminado | |
| Eteno , C2H4 | 11,2 ppb p37, contaminado | 20 |
| Hexafluoruro de azufre , SF6 | 7.3 pág. 41 | |
| Tetrafluoruro de carbono , CF4 | 79 pág. 41 | |
| Mercurio gaseoso total , Hg | 0,209 p55 | |
Historia
Los primeros estudios científicos de la composición atmosférica comenzaron en el siglo XVIII, cuando químicos como Joseph Priestley , Antoine Lavoisier y Henry Cavendish realizaron las primeras mediciones de la composición de la atmósfera. [ cita requerida ]
A finales del siglo XIX y principios del XX, el interés se centró en los componentes traza con concentraciones muy pequeñas. Un descubrimiento especialmente importante para la química atmosférica fue el descubrimiento del ozono por parte de Christian Friedrich Schönbein en 1840. [6]
En el siglo XX, la ciencia atmosférica pasó de estudiar la composición del aire a estudiar cómo han cambiado con el tiempo las concentraciones de gases traza en la atmósfera y los procesos químicos que crean y destruyen los compuestos en el aire. Dos ejemplos particularmente importantes de esto fueron la explicación de Sydney Chapman y Gordon Dobson de cómo se crea y mantiene la capa de ozono , y la explicación del smog fotoquímico de Arie Jan Haagen-Smit . Estudios posteriores sobre cuestiones relacionadas con el ozono condujeron a la concesión del Premio Nobel de Química de 1995, compartido entre Paul Crutzen , Mario Molina y Frank Sherwood Rowland . [7]
En el siglo XXI, el enfoque está cambiando de nuevo. La química atmosférica se estudia cada vez más como una parte del sistema terrestre . En lugar de centrarse en la química atmosférica de forma aislada, ahora se centra en verla como parte de un sistema único con el resto de la atmósfera , la biosfera y la geosfera . Un factor especialmente importante para esto son los vínculos entre la química y el clima , como los efectos del cambio climático en la recuperación del agujero de ozono y viceversa, pero también la interacción de la composición de la atmósfera con los océanos y los ecosistemas terrestres . [ cita requerida ]
Metodología
Las observaciones, las mediciones de laboratorio y los modelos son los tres elementos centrales de la química atmosférica. El progreso en la química atmosférica suele estar impulsado por las interacciones entre estos componentes y forman un todo integrado. Por ejemplo, las observaciones pueden indicarnos que existe una mayor cantidad de un compuesto químico de lo que se creía posible. Esto estimulará nuevos modelos y estudios de laboratorio que aumentarán nuestra comprensión científica hasta un punto en el que las observaciones se puedan explicar. [ cita requerida ]
Observación
Las observaciones de la química atmosférica son esenciales para nuestra comprensión. Las observaciones rutinarias de la composición química nos informan sobre los cambios en la composición atmosférica a lo largo del tiempo. Un ejemplo importante de esto es la Curva de Keeling , una serie de mediciones desde 1958 hasta hoy que muestran un aumento constante de la concentración de dióxido de carbono (ver también mediciones en curso de CO 2 atmosférico ). Las observaciones de la química atmosférica se realizan en observatorios como el de Mauna Loa y en plataformas móviles como aviones (por ejemplo, la Instalación para Mediciones Atmosféricas Aerotransportadas del Reino Unido ), barcos y globos. Las observaciones de la composición atmosférica se realizan cada vez más mediante satélites con instrumentos importantes como GOME y MOPITT que brindan una imagen global de la contaminación del aire y la química. Las observaciones de superficie tienen la ventaja de que proporcionan registros a largo plazo con alta resolución temporal, pero están limitadas en el espacio vertical y horizontal desde el que proporcionan observaciones. Algunos instrumentos de superficie, por ejemplo, LIDAR, pueden proporcionar perfiles de concentración de compuestos químicos y aerosoles, pero aún están restringidos en la región horizontal que pueden cubrir. Muchas observaciones están disponibles en línea en Bases de datos de observaciones de química atmosférica . [ cita requerida ]
Estudios de laboratorio
Las mediciones realizadas en el laboratorio son esenciales para comprender las fuentes y los sumideros de contaminantes y compuestos naturales. Estos experimentos se realizan en entornos controlados que permiten la evaluación individual de reacciones químicas específicas o la evaluación de las propiedades de un componente atmosférico particular. [11] Los tipos de análisis que son de interés incluyen tanto los de reacciones en fase gaseosa como las reacciones heterogéneas que son relevantes para la formación y el crecimiento de aerosoles . También es de gran importancia el estudio de la fotoquímica atmosférica que cuantifica la velocidad a la que las moléculas se separan por la luz solar y cuáles son los productos resultantes. Además, también se pueden obtener datos termodinámicos como los coeficientes de la ley de Henry . [ cita requerida ]
Modelado
Para sintetizar y probar la comprensión teórica de la química atmosférica, se utilizan modelos informáticos (como los modelos de transporte químico ). Los modelos numéricos resuelven las ecuaciones diferenciales que rigen las concentraciones de sustancias químicas en la atmósfera. Pueden ser muy simples o muy complicados. Una compensación común en los modelos numéricos es entre la cantidad de compuestos químicos y reacciones químicas modeladas versus la representación del transporte y la mezcla en la atmósfera. Por ejemplo, un modelo de caja puede incluir cientos o incluso miles de reacciones químicas, pero solo tendrá una representación muy burda de la mezcla en la atmósfera. En contraste, los modelos 3D representan muchos de los procesos físicos de la atmósfera, pero debido a las limitaciones de los recursos informáticos tendrán muchas menos reacciones y compuestos químicos. Los modelos se pueden utilizar para interpretar observaciones, probar la comprensión de las reacciones químicas y predecir futuras concentraciones de compuestos químicos en la atmósfera. Estos modelos pueden ser globales (simulando toda la Tierra) o pueden ser regionales (centrados solo en una región específica). La compensación entre los dos enfoques es su resolución, así como la cantidad de detalle que pueden proporcionar; Los modelos globales suelen tener una resolución horizontal menor y representan mecanismos químicos menos complejos, pero simulan un área mayor, mientras que los modelos regionales no simulan todo el globo sino que se centran en un área con mayor resolución y más detalle. Una tendencia actual importante es que los módulos de química atmosférica se conviertan en una parte de los modelos del sistema terrestre en los que se puedan estudiar los vínculos entre el clima, la composición atmosférica y la biosfera. Este tipo de modelos permiten el acoplamiento de diferentes compartimentos de la Tierra, como la atmósfera, la biosfera y la hidrosfera, lo que permite a los usuarios analizar las complejas interacciones entre ellos.
Algunos modelos se construyen mediante generadores de código automáticos (por ejemplo, Autochem o Kinetic PreProcessor ). En este enfoque, se elige un conjunto de constituyentes y el generador de código automático seleccionará las reacciones que involucran esos constituyentes de un conjunto de bases de datos de reacciones. Una vez que se han elegido las reacciones, se pueden construir automáticamente las ecuaciones diferenciales ordinarias que describen su evolución temporal.
Véase también
| Parte de una serie sobre |
| Clima |
|---|
 Weather portal Weather portal |
- Ciclo del oxígeno
- Ciclo ozono-oxígeno
- Paleoclimatología
- Evaluación científica del agotamiento de la capa de ozono
- Eventos de agotamiento del ozono troposférico
Referencias
- ^ "Química atmosférica - Últimas investigaciones y noticias | Nature". www.nature.com . Consultado el 6 de octubre de 2022 .
- ^ Cairns, Iver (23 de septiembre de 1999). «La atmósfera de la Tierra». Universidad de Sydney . Consultado el 7 de abril de 2021 .
- ^ Zimmer, Carl (3 de octubre de 2013). «El oxígeno de la Tierra: un misterio que es fácil dar por sentado». The New York Times . Consultado el 3 de octubre de 2013 .
- ^ Seinfeld, John; Pandis, Spyros (2016). Química y física atmosférica: de la contaminación del aire al cambio climático, 3.ª ed . Hoboken, Nueva Jersey: Wiley . ISBN 9781119221173.
- ^ Simpson, IJ; Blake, NJ; Barletta, B.; Diskin, GS; Fuelberg, HE; Gorham, K.; Huey, LG; Meinardi, S.; Rowland, FS; Vay, SA; Weinheimer, AJ; Yang, M.; Blake, DR (2010). "Caracterización de los gases traza medidos en las operaciones de minería de arenas petrolíferas de Alberta: 76 compuestos orgánicos volátiles (VOC) C2–C10 especiados, CO2, CH4, CO, NO, NO2, NO, O3 y SO2". Química atmosférica y física . 10 (23): 11931–11954. Bibcode :2010ACP....1011931S. doi : 10.5194/acp-10-11931-2010 . ISSN 1680-7324. Número de identificación del sujeto 62782723.
- ^ Shoenbein, C. (1 de enero de 1843). Sobre la producción de ozono por medios químicos. Royal Society de Londres.
- ^ "Comunicado de prensa - Premio Nobel de Química 1995". El Premio Nobel . Organización del Premio Nobel. 11 de octubre de 1995.
- ^ St. Fleur, Nicholas (10 de noviembre de 2015). "Los niveles de gases de efecto invernadero atmosféricos alcanzan un récord, según un informe". The New York Times . Consultado el 11 de noviembre de 2015 .
- ^ Ritter, Karl (9 de noviembre de 2015). «Reino Unido: En primer lugar, la temperatura media mundial podría ser 1 grado C más alta». AP News . Consultado el 11 de noviembre de 2015 .
- ^ Cole, Steve; Gray, Ellen (14 de diciembre de 2015). «Nuevos mapas satelitales de la NASA muestran la huella humana en la calidad del aire global». NASA . Consultado el 14 de diciembre de 2015 .
- ^ Academias Nacionales de Ciencias, Ingeniería y Medicina (2016). El futuro de la investigación atmosférica: Recordando el ayer, comprendiendo el hoy, anticipando el mañana . Washington, DC: The National Academies Press. pág. 15. ISBN 978-0-309-44565-8.
Lectura adicional
- Brasseur, Guy P.; Orlando, John J.; Tyndall, Geoffrey S. (1999). Química atmosférica y cambio global . Oxford University Press. ISBN 0-19-510521-4 .
- Finlayson-Pitts, Barbara J.; Pitts, James N., Jr. (2000). Química de la atmósfera superior e inferior . Academic Press. ISBN 0-12-257060-X .
- Seinfeld, John H.; Pandis, Spyros N. (2006). Química atmosférica y física: de la contaminación del aire al cambio climático (2.ª ed.). John Wiley and Sons, Inc. ISBN 0-471-82857-2 .
- Warneck, Peter (2000). Química de la atmósfera natural (2.ª ed.). Academic Press. ISBN 0-12-735632-0 .
- Wayne, Richard P. (2000). Química de las atmósferas (3.ª ed.). Oxford University Press. ISBN 0-19-850375-X .
- JV Iribarne, HR Cho, Física atmosférica , D. Reidel Publishing Company, 1980
Enlaces externos
- Evaluación científica de la OMM sobre el agotamiento de la capa de ozono: 2006
- IGAC Proyecto Internacional de Química Atmosférica Global
- Entrevista a Paul Crutzen: video gratuito de Paul Crutzen, Premio Nobel por su trabajo sobre la descomposición del ozono, hablando con el Premio Nobel Harry Kroto , Vega Science Trust
- La base de datos de química atmosférica de Cambridge es una gran base de datos de observación de componentes en un formato común.
- La ciencia ambiental publicada para todos en el mundo
- Datos cinéticos químicos y fotoquímicos de la NASA-JPL para su uso en estudios atmosféricos
- Datos cinéticos y fotoquímicos evaluados por el Subcomité de Evaluación de Datos Cinéticos de Gas de la IUPAC
- Glosario de química atmosférica de la Universidad Estatal Sam Houston
- Química troposférica
- Calculadoras para uso en química atmosférica Archivado el 9 de diciembre de 2010 en Wayback Machine.
- Una evaluación elemental ilustrada de la composición del aire
