Carcinoma invasivo sin tipo especial
| Carcinoma invasivo sin tipo especial | |
|---|---|
| Otros nombres | Carcinoma ductal invasivo |
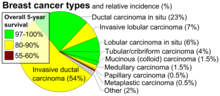 | |
| Tipos histopatológicos de cáncer de mama , con incidencias relativas y pronósticos , con carcinoma ductal invasivo en la parte inferior izquierda | |
| Especialidad | Oncología , Dermatología , Cirugía de mama |
El carcinoma invasivo de tipo no especial ( carcinoma invasivo NST ), carcinoma invasivo de mama de tipo no especial ( IBC-NST ), carcinoma ductal invasivo ( IDC ), carcinoma ductal infiltrante ( IDC ) o carcinoma ductal invasivo, no especificado de otra manera ( NOS ) es una enfermedad. Para el público internacional, este artículo utilizará "carcinoma invasivo NST" porque es el término preferido de la Organización Mundial de la Salud (OMS).
El carcinoma invasivo NST representa la mitad de todos los diagnósticos de cáncer de mama en mujeres y es el tipo más común de cáncer de mama invasivo . También es la forma más comúnmente diagnosticada de cáncer de mama masculino . El carcinoma invasivo NST se clasifica por sus características microscópicas, moleculares y genéticas. Microscópicamente es un carcinoma de mama del tipo adenocarcinoma , que se origina en los conductos mamarios . Muestra características invasivas pero carece de las "características diferenciadoras específicas" de otros tipos de cánceres de mama invasivos. El carcinoma invasivo NST es un diagnóstico de exclusión , lo que significa que para realizar el diagnóstico se deben descartar todos los demás tipos específicos. Hay varios subtipos raros de carcinoma invasivo NST, incluido el carcinoma pleomórfico , el carcinoma con células gigantes del estroma similares a osteoclastos , el carcinoma con características coriocarcinomatosas y el carcinoma con características melanóticas . [1]
Los carcinomas mamarios invasivos son más comunes en mujeres blancas , seguidas de mujeres negras e hispanas . Las mujeres negras tienden a presentar una mayor gravedad de la enfermedad en el momento del diagnóstico y una peor supervivencia general. El cáncer de mama suele ser asintomático y se diagnostica mediante pruebas de detección, pero puede presentarse con síntomas de dolor, masa palpable, cambios en la piel o complicaciones de la metástasis.
La enfermedad clínica o las lesiones sospechosas en la detección pueden evaluarse más a fondo con una muestra de tejido. El análisis diagnóstico incluirá la tipificación histopatológica, la clasificación y el análisis de marcadores de ADN y el estado del receptor . El pronóstico para los pacientes con carcinoma invasivo NST es heterogéneo y difícil de predecir para cada individuo. Sin embargo, los factores generales como el alto grado tumoral, el estadio, la negatividad del receptor, la positividad de BRCA1 sugieren un mayor riesgo de recurrencia y una menor supervivencia general. El tratamiento es individualizado, sin embargo, a la mayoría de los pacientes se les ofrece una combinación de terapias médicas sistémicas neoadyuvantes , quirúrgicas , de radiación y adyuvantes .
Epidemiología
El carcinoma invasivo NST es uno de los tipos más comunes de cáncer de mama y representa el 55 % de la incidencia de cáncer de mama. [2] De los cánceres de mama invasivos, el carcinoma invasivo NST representa hasta el 75 % de los casos. [3] [4] También es la forma más común de cáncer de mama que se presenta en hombres y representa el 85 % de los casos. [5] [6]
La incidencia de carcinomas ductales en general es de 86,3 casos por cada 100.000 mujeres, con un marcado aumento en las mujeres mayores de 40 años y un pico de 285,6 casos por cada 100.000 en las mujeres de entre 70 y 79 años. Esta incidencia ha disminuido ligeramente con el tiempo. La incidencia de casos diagnosticados es más alta entre las mujeres blancas y no hispanas, seguidas de las mujeres negras e hispanas. [7]
Terminología
El carcinoma invasivo NST es un tipo de cáncer de mama. Es uno de los cánceres de mama invasivos que se origina en el sistema ductal mamario, por lo que es un tipo de carcinoma ductal. Una característica definitoria de este carcinoma ductal es que carece de las "características diferenciadoras específicas" de otros tipos de carcinomas ductales. Es importante señalar que el carcinoma ductal invasivo (CDI), el carcinoma ductal invasivo NOS y el carcinoma invasivo NST se refieren al mismo tipo de cáncer de mama. Para mantener la coherencia y servir a un público internacional, en este artículo se utilizará el término NST ductal invasivo.
La terminología del carcinoma invasivo NST ha sufrido cambios desde 2012. Las diferentes opiniones dentro de las comunidades médicas y de salud pública han dado lugar a algunas variaciones en la forma en que se hace referencia a esta enfermedad en los entornos clínicos y de investigación.
En 2012, la Agencia Internacional para la Investigación sobre el Cáncer (IARC) , un subdepartamento de la OMS , publicó la cuarta edición de la Clasificación de la OMS de Tumores de Mama. Anteriormente conocida como "carcinoma ductal invasivo, no especificado de otra manera", estas directrices más recientes abogaban por el uso de "carcinoma invasivo de ningún tipo especial". [8] [9]
Sin embargo, existen diferentes opiniones y prácticas. La literatura de investigación continúa utilizando el término carcinoma ductal invasivo (CDI) o carcinoma ductal invasivo (NOS), [10] [11] y algunos libros de texto médicos han ofrecido su apoyo para continuar utilizando el término CDI o carcinoma ductal invasivo (NOS). [12] [5]
Signos y síntomas
En la mayoría de los casos, los cánceres de mama son asintomáticos y se detectan mediante exámenes clínicos de detección de rutina. En aproximadamente el 30% de los casos, se puede palpar una masa mamaria. [13] [14] La masa no fluctuará con el período menstrual. [15] Se pueden observar cambios en la piel suprayacente, como hoyuelos, pinchazos, textura similar a la cáscara de naranja o retracción del pezón. [16] Se pueden formar úlceras que no cicatrizan en la enfermedad avanzada y eran más comunes históricamente antes de la atención médica moderna.
Las lesiones metastásicas del cáncer de mama pueden producir síntomas según el sistema orgánico. Los sitios más comunes de metástasis son los huesos, los pulmones, el hígado y el cerebro. [17] Las metástasis cutáneas se extienden con mayor frecuencia a la piel que recubre la masa, pero pueden extenderse a la axila o a áreas más distantes. [18] La metástasis a los vasos linfáticos adyacentes puede producir masas palpables en la axila o una textura similar a la cáscara de naranja en la piel de la mama afectada. [18] [19]

Diagnóstico
El proceso de diagnóstico del carcinoma invasivo NST es similar al de otros cánceres de mama. El proceso puede ser provocado por un paciente que presenta una masa palpable o por evidencia de una lesión sospechosa en las pruebas de detección de rutina. [20] Se requiere una muestra de tejido para una clasificación completa que ayudará a determinar el pronóstico y el plan de tratamiento. Las muestras de tejido se examinarán bajo el microscopio para determinar el tipo histopatológico , el grado y el estadio (TNM) . La tinción inmunohistoquímica se utiliza para establecer el estado del receptor , y la presencia o ausencia de genes pertinentes se determina mediante pruebas de ADN .
En este artículo se analizarán las características específicas del carcinoma invasivo de mama no trombótico. Se pueden encontrar análisis más generales y completos en los artículos sobre detección del cáncer de mama y clasificación del cáncer de mama .
Criterios histopatológicos


En la evaluación microscópica, se observan células carcinomatosas debajo de la membrana basal de los conductos galactóforos e invaden el estroma mamario circundante. Por lo demás, no hay características histológicas específicas, lo que hace que sea esencialmente un diagnóstico de exclusión . [21] Las características histopatológicas observadas en estas lesiones son heterogéneas. Las células de una lesión de carcinoma invasivo NST pueden retener >70% de diferenciación ductal o parecer completamente indiferenciadas. Las células tumorales pueden estar dispuestas en láminas, nidos, cordones o distribuidas individualmente. Son pleomórficas (es decir, varían en tamaño y forma). Por lo general, tienen nucléolos prominentes y múltiples células mitóticas por campo de visión ampliado, que son características generalmente consistentes con las células cancerosas. El tejido no ductal circundante, conocido como estroma, puede variar de inexistente a abundante. [22] [23]
Pueden estar presentes pequeñas inclusiones de características especiales dentro de una muestra de tejido de carcinoma invasivo NST, pero serán "limitadas" (es decir, <10%). Los carcinomas de tipo mixto tendrán un patrón especializado o carcinoma lobulillar en la mayoría (es decir, al menos el 50%) del tumor y un patrón no especializado entre el 10 y el 49% de la muestra. Por lo tanto, dichos tumores se denominarán carcinoma invasivo mixto NST y tipo especial o carcinoma invasivo mixto NST y carcinoma lobulillar. [24]
- Muestra de mastectomía que contiene un carcinoma ductal invasivo de mama de gran tamaño. A la derecha, se puede ver el pezón sobre la piel rosada, mientras que en el centro de la imagen se puede ver una gran hinchazón o tumor de color azul y rosa. Se ve tejido graso teñido de sangre en los márgenes del corte.
- Aspecto macroscópico ( bruto ) típico de la superficie cortada de una muestra de mastectomía que contiene un carcinoma ductal invasivo de la mama (área pálida en el centro).
- Carcinoma ductal invasivo de mama analizado con anticuerpo anti-Mucina 1.
- Carcinoma ductal invasivo, con conductos normales atrapados ocasionalmente (flecha)
- Histopatología de carcinoma ductal invasivo de mama que representa un crecimiento escirro. Biopsia con aguja gruesa. Tinción de hematoxilina y eosina.
- Carcinoma ductal invasivo de mama. Tinción H&E.
Puesta en escena
En general, los cánceres se estadifican según el grado de tamaño del tumor, la afectación de los ganglios linfáticos y la evidencia de metástasis. Hay dos tipos: estadificación clínica y estadificación patológica. La estadificación clínica utiliza información derivada del examen físico, las imágenes clínicas y la biopsia. La estadificación patológica se realiza después de que se extirpa quirúrgicamente el tumor, cuando un patólogo puede realizar mediciones más directas de las características del tumor. La estadificación patológica se considera más precisa, pero la estadificación clínica puede brindar información útil para determinar los planes de tratamiento antes de los esfuerzos quirúrgicos. Tanto la estadificación clínica como la patológica utilizan el sistema de estadificación TNM, que tiene en cuenta el tamaño del tumor (T), la afectación de los ganglios linfáticos (N) y la evidencia de metástasis (M). El sistema de estadificación TNM diseñado para el cáncer de mama se muestra en la siguiente tabla. [25]
Tamaño del tumor
En la estadificación clínica, el tamaño del tumor se determina mediante imágenes clínicas. Se puede determinar una medición más precisa del tamaño del tumor y la observación de la extensión a las estructuras adyacentes mediante la estadificación patológica después de la cirugía.
Afectación de los ganglios linfáticos
La ausencia de células cancerosas en los ganglios linfáticos es un buen indicador de que el cáncer no se ha propagado sistémicamente. La presencia de cáncer en los ganglios linfáticos indica que el cáncer puede haberse propagado. En estudios, algunas mujeres han tenido presencia de cáncer en los ganglios linfáticos, no fueron tratadas con quimioterapia y aun así no presentaron una propagación sistémica. Por lo tanto, la afectación de los ganglios linfáticos no es un predictor absoluto de propagación. [26]
| Descripción | |
|---|---|
| Tumor primario (T) | T1=tamaño del tumor ≤20 mm T2=>20 mm pero ≤50 mm T3=>50 mm T4=tumor de cualquier tamaño con extensión directa a la pared torácica y/o piel |
| Ganglios linfáticos regionales (N) | N0 = sin metástasis en ganglios linfáticos regionales N1mi = micrometástasis N1 = metástasis en ganglios linfáticos axilares ipsilaterales móviles N2 = metástasis en ganglios linfáticos axilares ipsilaterales que están clínicamente fijos N3 = metástasis que son más extensas |
| Metástasis a distancia (M) | M0=sin evidencia de metástasis a distancia M1 = metástasis detectables a distancia determinadas por medios clínicos y radiográficos |
| Escenario | |
| 0 | CDIS |
| I | IA=T1, N0, M0 IB=T0, N1mi, M0 o T1, N1mi, M0 |
| II | IIA=T0, N1, M0 o T1, N1, M0 o T2, N0, M0 IIB=T2, N1, M0 o T3, N0, M0 |
| III | Tumores de mayor tamaño con diversas combinaciones de afectación de ganglios linfáticos que son más extensos que el estadio II, pero sin metástasis a distancia |
| IV | Metástasis a distancia (M1) |
Calificación
La apariencia de las células cancerosas bajo el microscopio es otro predictor de la propagación sistémica. Cuanto más diferentes sean las células cancerosas en comparación con las células normales de los conductos, mayor será el riesgo de propagación sistémica. Hay tres características que diferencian a las células cancerosas de las células normales.
- Tendencia a formar estructuras tubulares.
- Tamaño nuclear, forma e intensidad de tinción
- Tasa mitótica - Tasa de división celular
La apariencia histológica de las células cancerosas se puede calificar en función de estos tres parámetros en una escala de uno a tres. La suma de estos grados es un número entre 3 y 9. La puntuación se denomina Grado Bloom Richardson (BR) y se expresa [suma de los grados]/9. Por ejemplo, las células que obtuvieron una calificación de 2 en los tres parámetros darían como resultado un puntaje BR de 6/9.
Una puntuación de 5 o menos se considera baja. De 6 a 7 se considera intermedia. De 8 a 9 se considera alta. [26]
Invasión linfovascular

La invasión linfovascular es la presencia de células cancerosas en los canales linfáticos y/o vasos sanguíneos . La presencia de invasión linfovascular aumenta la probabilidad de propagación sistémica. [26]
Análisis de ADN
El análisis de ADN indica la cantidad de ADN en las células cancerosas y qué tan rápido está creciendo el cáncer.
Las células con una cantidad normal de ADN se denominan diploides. Las células con demasiado o muy poco ADN se denominan aneuploides. Las células aneuploides tienen más probabilidades de propagarse que las células diploides.
La prueba de ADN indica la tasa de crecimiento al determinar la cantidad de células en la fase sintética (fase S). Una fase S > 10% significa una mayor probabilidad de propagación.
Los resultados de las pruebas de ADN se consideran predictores menos confiables de propagación que el tamaño, la histología y la afectación de los ganglios linfáticos. [26]
Pronóstico
Si bien el pronóstico en el carcinoma invasivo NST es difícil de predecir, existen algunos factores pronósticos que ayudan a estimar la supervivencia. Los factores incluidos aquí tienden a ser generalizables a la mayoría de los cánceres de mama, y se puede encontrar más información en los artículos principales sobre cáncer de mama y detección del cáncer de mama.
El pronóstico de los carcinomas ductales en general depende, en parte, de su subtipo histológico. Los carcinomas mucinosos, papilares, cribiformes y tubulares tienen una supervivencia más prolongada y tasas de recurrencia más bajas. El pronóstico de la forma más común de carcinoma invasivo NST es intermedio. Independientemente del subtipo histológico, el pronóstico del CDI depende también del tamaño del tumor, presencia de cáncer en los ganglios linfáticos, grado histológico , presencia de cáncer en vasos pequeños (invasión vascular), expresión de receptores hormonales y de oncogenes como HER2/neu .
Los factores histológicos asociados con un peor pronóstico incluyen un alto grado histológico, negatividad del receptor hormonal y negatividad del HER2. En cuanto a los factores de riesgo genéticos, los cánceres de mama asociados al gen BRCA1 pueden tener tasas más altas de metástasis pulmonares y cerebrales, pero una tasa más baja de metástasis óseas. Los casos detectados mediante cribado tienen una supervivencia favorable en comparación con los casos que se presentan clínicamente. [12]
Las mujeres blancas tienen la tasa más alta de carcinoma de mama, seguidas de las mujeres negras, asiáticas/isleñas del Pacífico e hispanas. Sin embargo, las mujeres negras tienen más probabilidades de presentar una mayor gravedad de la enfermedad y negatividad del triple receptor en el momento del diagnóstico. En comparación con otras poblaciones, tienden a tener una menor probabilidad de curación y una supervivencia más corta después del diagnóstico si no se puede curar. [27] [28] [12]
En 2003, un estudio encontró que la tasa de supervivencia a cinco años del carcinoma invasivo NST era de aproximadamente el 85%. [29] En general, un mayor tamaño del tumor y la presencia de metástasis en los ganglios linfáticos predicen un mayor riesgo de recurrencia después del diagnóstico y tratamiento inicial. En un estudio, el riesgo de recurrencia durante la vida fue del 20% para tumores más pequeños (<2 cm) sin metástasis en los ganglios linfáticos. Los tumores más grandes sin ganglios linfáticos tenían un 38% de riesgo de recurrencia. La presencia de ganglios linfáticos en tumores de cualquier tamaño mostró un 62% y un 86% de riesgo de recurrencia en pacientes con 1-3 y >4 ganglios linfáticos positivos, respectivamente. Otro estudio mostró que "el 90% de las recurrencias ocurrieron dentro de los 9, 7 y 5 años para pacientes con tumores de grados 1, 2 y 3, respectivamente. La tasa de muerte por carcinoma de mama también se vio influenciada por el grado, con un 90 % ocurriendo en 40, 13 y 8 años entre pacientes con tumores de grados 1, 2 y 3, respectivamente”. [12] [30]
- Inmunohistoquímica del cáncer de mama (carcinoma ductal infiltrante de mama) analizada con anticuerpo anti HER-2 (ErbB2).
- Inmunohistoquímica de carcinoma ductal invasivo de mama que representa un crecimiento escirro. Biopsia con aguja gruesa. Expresión de la oncoproteína HER-2/neu mediante el sistema de inmunotinción Ventana.
- Inmunohistoquímica del receptor de estrógeno en cáncer de mama invasivo, que muestra tinción nuclear.
Tratamiento
El tratamiento del carcinoma invasivo NST suele ser similar a los planes de tratamiento para otros carcinomas invasivos de mama. Las opciones de tratamiento que se ofrecen a cada paciente en particular están determinadas por la forma, el estadio y la ubicación del cáncer, y también por la edad, los antecedentes de la enfermedad y la salud general del paciente. No todos los pacientes reciben el mismo tratamiento.
Las opciones de tratamiento para pacientes con carcinomas mamarios invasivos incluyen cirugía, radioterapia y terapia médica adyuvante sistémica. El tratamiento quirúrgico varía desde mastectomía radical hasta procedimientos de conservación de la mama, como lumpectomía. A las pacientes con riesgo de recurrencia local de la enfermedad se les puede ofrecer radioterapia. A las pacientes con riesgo de enfermedad sistémica se les puede ofrecer quimioterapia, y a aquellas cuyos tumores dan positivo para ciertos receptores hormonales o marcadores genéticos se les pueden ofrecer terapias médicas adyuvantes específicas. A las pacientes con tumores con receptores de estrógeno o progesterona se les pueden ofrecer fármacos modificadores selectivos del receptor de estrógeno (p. ej., tamoxifeno) o inhibidores de la aromatasa (p. ej., anastrozol). Los tumores HER2-positivos se pueden tratar con terapia médica dirigida (p. ej., trastuzumab).
El tratamiento del cáncer de mama invasivo no metastásico puede variar según la estadificación, generalmente en etapa temprana (estadios I y II) frente a localmente avanzado (estadio III). A las pacientes con enfermedad en etapa temprana se les puede ofrecer cirugía, incluida la terapia conservadora de la mama. Esto puede ir seguido de radioterapia para aquellas con riesgo de recurrencia local o terapia médica adyuvante sistémica para aquellas con riesgo de metástasis a distancia. A las pacientes con cáncer de mama invasivo localmente avanzado se les puede ofrecer terapia sistémica neoadyuvante y evaluar la respuesta del tumor antes de la cirugía, la radiación y la terapia adyuvante. [31]
El tratamiento profiláctico puede ser una opción para aquellas mujeres con predisposición genética al cáncer de mama. Las directrices de la National Comprehensive Cancer Network (NCCN) recomiendan la mastectomía profiláctica bilateral y la salpingooforectomía bilateral para las mujeres portadoras de la mutación de la línea germinal BRCA1/2. A la edad de 35 a 40 años, o una vez que se ha completado la maternidad, se recomienda el procedimiento con fines de reducción de riesgo. La NCCN afirma que este tratamiento ha llevado a una reducción del riesgo de carcinoma de mama en un 90% en este grupo. [32]
Véase también
Referencias
- ^ Lakhani SR (2012). Clasificación de la OMS de los tumores de mama. Lyon: Agencia Internacional para la Investigación sobre el Cáncer, Organización Mundial de la Salud. ISBN 978-92-832-4488-2.OCLC 956377388 .
- ^ Eheman CR, Shaw KM, Ryerson AB, Miller JW, Ajani UA, White MC (junio de 2009). "La incidencia cambiante de carcinomas mamarios ductales y lobulares in situ e invasivos: Estados Unidos, 1999-2004". Epidemiología del cáncer, biomarcadores y prevención . 18 (6): 1763–1769. doi : 10.1158/1055-9965.epi-08-1082 . PMID 19454615. S2CID 34686873.
- ^ Moinfar F (2007). Fundamentos de la patología diagnóstica de la mama: un enfoque práctico; con 6 tablas. Springer. ISBN 978-3-540-45117-4.OCLC 634182636 .
- ^ Makki J (enero de 2015). "Diversidad del carcinoma de mama: subtipos histológicos y relevancia clínica". Clinical Medicine Insights. Patología . 8 : 23–31. doi :10.4137/cpath.s31563. PMC 4689326. PMID 26740749 .
- ^ ab Zheng G, Leone JP (2022). "Cáncer de mama masculino: una revisión actualizada de la epidemiología, la clinicopatología y el tratamiento". Revista de oncología . 2022 : 1734049. doi : 10.1155/2022/1734049 . PMC 9155932 . PMID 35656339.
- ^ Ottini L, Palli D, Rizzo S, Federico M, Bazan V, Russo A (febrero de 2010). "Cáncer de mama masculino". Critical Reviews in Oncology/Hematology . 73 (2): 141–155. doi :10.1016/j.critrevonc.2009.04.003. hdl : 10447/42635 . PMID 19427229.
- ^ Sinn HP, Kreipe H (mayo de 2013). "Breve descripción general de la clasificación de la OMS de tumores de mama, cuarta edición, con especial atención a los problemas y actualizaciones de la tercera edición". Breast Care . 8 (2): 149–154. doi :10.1159/000350774. PMC 3683948 . PMID 24415964.
- ^ Sinn HP, Kreipe H (mayo de 2013). "Breve descripción general de la clasificación de la OMS de tumores de mama, cuarta edición, con especial atención a los problemas y actualizaciones de la tercera edición". Breast Care . 8 (2): 149–154. doi :10.1159/000350774. PMC 3683948 . PMID 24415964.
- ^ Lakhani SR, et al. (Agencia Internacional para la Investigación sobre el Cáncer, Organización Mundial de la Salud) (2012). Clasificación de la OMS de los tumores de mama. Lyon. ISBN 978-92-832-4488-2.OCLC 956377388 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Watkins EJ (octubre de 2019). "Descripción general del cáncer de mama". JAAPA . 32 (10): 13–17. doi : 10.1097/01.JAA.0000580524.95733.3d . ISSN 1547-1896. PMID 31513033. S2CID 202562564.
- ^ O'Connor DJ, Davey MG, Barkley LR, Kerin MJ (febrero de 2022). "Diferencias en la sensibilidad a la quimioterapia neoadyuvante entre el carcinoma lobulillar y ductal invasivo de mama e implicaciones en la cirugía: una revisión sistemática y un metanálisis". Breast . 61 : 1–10. doi :10.1016/j.breast.2021.11.017. PMC 8649952 . PMID 34864494.
- ^ abcd Hoda SA, Rosen P (2021). Patología mamaria de Rosen Syed A. Hoda (Quinta ed.). Filadelfia. ISBN 978-1-4963-9892-5.OCLC 1224297918 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A (marzo de 2015). "Estadísticas mundiales sobre el cáncer, 2012". California . 65 (2): 87-108. doi : 10.3322/caac.21262 . PMID 25651787. S2CID 34813938.
- ^ Watkins EJ (octubre de 2019). "Descripción general del cáncer de mama". JAAPA . 32 (10): 13–17. doi : 10.1097/01.JAA.0000580524.95733.3d . ISSN 1547-1896. PMID 31513033. S2CID 202562564.
- ^ Colledge NR, Walker BR, Ralston SH, Britton R, eds. (2010). Principios y práctica de la medicina de Davidson (21.ª ed.). Edimburgo: Churchill Livingstone/Elsevier. ISBN 978-0-7020-3084-0.
- ^ Zhang BN, Cao XC, Chen JY, Chen J, Fu L, Hu XC, et al. (mayo de 2012). "Directrices sobre el diagnóstico y el tratamiento del cáncer de mama (edición de 2011)". Cirugía de glándulas . 1 (1): 39–61. doi :10.3978/j.issn.2227-684X.2012.04.07. PMC 4115707 . PMID 25083426.
- ^ Chen MT, Sun HF, Zhao Y, Fu WY, Yang LP, Gao SP, et al. (agosto de 2017). "Comparación de patrones y pronóstico entre pacientes con cáncer de mama metastásico distante por grupos de edad: un análisis poblacional de SEER". Scientific Reports . 7 (1): 9254. Bibcode :2017NatSR...7.9254C. doi :10.1038/s41598-017-10166-8. PMC 5569011 . PMID 28835702.
- ^ ab Milam EC, Rangel LK, Pomeranz MK (abril de 2021). "Secuelas dermatológicas del cáncer de mama: desde la enfermedad, la cirugía y la radiación". Revista Internacional de Dermatología . 60 (4): 394–406. doi :10.1111/ijd.15303. PMID 33226140. S2CID 227134680.
- ^ Patología básica de Robbins . Saunders/Elsevier. 2007. ISBN 978-0-8089-2366-4.
- ^ Mathis KL, Hoskin TL, Boughey JC, Crownhart BS, Brandt KR, Vachon CM, et al. (marzo de 2010). "La presentación palpable del cáncer de mama persiste en la era de la mamografía de detección". Revista del Colegio Americano de Cirujanos . 210 (3): 314–318. doi :10.1016/j.jamcollsurg.2009.12.003. PMID 20193894.
- ^ Abdelmessieh P. "Histología del cáncer de mama". Medscape . Consultado el 4 de octubre de 2019 .Actualizado: 24 de mayo de 2018
- ^ Makki J (enero de 2015). "Diversidad del carcinoma de mama: subtipos histológicos y relevancia clínica". Clinical Medicine Insights. Patología . 8 : 23–31. doi :10.4137/cpath.s31563. PMC 4689326. PMID 26740749 .
- ^ Jaworski R (diciembre de 2004). "Patología quirúrgica de Rosai y Ackerman: novena edición". Patología . 36 (6): 595. doi :10.1080/00313020400010906. ISSN 0031-3025.
- ^ Sinn HP, Kreipe H (mayo de 2013). "Breve descripción general de la clasificación de la OMS de tumores de mama, cuarta edición, con especial atención a los problemas y actualizaciones de la tercera edición". Breast Care . 8 (2): 149–154. doi :10.1159/000350774. PMC 3683948 . PMID 24415964.
- ^ Nelson HD. Detección del cáncer de mama: una revisión sistemática para actualizar la recomendación de 2009 del Grupo de Trabajo de Servicios Preventivos de EE . UU. OCLC 948775981.
- ^ abcd Enlace J. Manual de supervivencia del cáncer de mama (4.ª ed.).
- ^ Edwards, MJ; Gamel, JW; Vaughan, WP; Wrightson, WR (agosto de 1998). "Carcinoma ductal infiltrante de mama: el impacto de la raza en la supervivencia". Journal of Clinical Oncology . 16 (8): 2693–2699. doi :10.1200/JCO.1998.16.8.2693. ISSN 0732-183X. PMID 9704719.
- ^ Yedjou, Clement G.; Sims, Jennifer N.; Miele, Lucio; Noubissi, Felicite; Lowe, Leroy; Fonseca, Duber D.; Alo, Richard A.; Payton, Marinelle; Tchounwou, Paul B. (2019). "Salud y disparidad racial en el cáncer de mama". Metástasis del cáncer de mama y resistencia a los fármacos . Avances en medicina y biología experimental. Vol. 1152. págs. 31–49. doi :10.1007/978-3-030-20301-6_3. ISBN 978-3-030-20300-9. ISSN 0065-2598. PMC 6941147. PMID 31456178 .
- ^ NOTA: El artículo en realidad se refiere al carcinoma ductal invasivo, a pesar del título. Arpino G, Bardou VJ, Clark GM, Elledge RM (2004). "Carcinoma lobulillar infiltrante de mama: características del tumor y resultado clínico". Investigación sobre el cáncer de mama . 6 (3): R149–R156. doi : 10.1186 /bcr767 . PMC 400666. PMID 15084238.
- ^ Heimann, R.; Hellman, S. (febrero de 2000). "Progresión clínica del comportamiento maligno del cáncer de mama: qué esperar y cuándo esperarlo". Journal of Clinical Oncology . 18 (3): 591–599. doi :10.1200/JCO.2000.18.3.591. ISSN 0732-183X. PMID 10653874.
- ^ "UpToDate". www.uptodate.com . Consultado el 3 de febrero de 2023 .
- ^ Telli, Melinda L.; Gradishar, William J.; Ward, John H. (1 de mayo de 2019). "Actualizaciones de las pautas de la NCCN: cáncer de mama". Revista de la Red Nacional Integral del Cáncer . 17 (5.5): 552–555. doi :10.6004/jnccn.2019.5006 (inactivo el 1 de noviembre de 2024). ISSN 1540-1413. PMID 31117035.
{{cite journal}}: CS1 maint: DOI inactivo a partir de noviembre de 2024 ( enlace )
Enlaces externos
- Carcinoma ductal infiltrante




.jpg/440px-Breast_invasive_scirrhous_carcinoma_histopathology_(1).jpg)

.jpg/440px-HER2(2).jpg)
_HER2_expression.JPG/440px-Breast_invasive_scirrhous_carcinoma_histopathology_(2)_HER2_expression.JPG)
.jpg/440px-Metastatic_breast_carcinoma;_pleura-Estrogen_receptor_Case_166_(5477628458).jpg)