Canal de potasio rectificador de entrada
| Canal de potasio rectificador de entrada | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina de un canal rectificador interno de potasio. | |||||||||
| Identificadores | |||||||||
| Símbolo | FASTIDIAR | ||||||||
| Pfam | PF01007 | ||||||||
| Clan Pfam | CL0030 | ||||||||
| Interprofesional | IPR013521 | ||||||||
| SCOP2 | 1n9p / ALCANCE / SUPFAM | ||||||||
| Base de datos de datos termodinámica | 1.A.2 | ||||||||
| Superfamilia OPM | 8 | ||||||||
| Proteína OPM | 3 cañones autopropulsados | ||||||||
| |||||||||
Los canales de potasio rectificadores de entrada ( K ir , IRK ) son un subconjunto específico de canales de potasio regulados por lípidos . Hasta la fecha, se han identificado siete subfamilias en varios tipos de células de mamíferos, [1] plantas, [2] y bacterias. [3] Son activados por fosfatidilinositol 4,5-bisfosfato ( PIP 2 ). El mal funcionamiento de los canales se ha implicado en varias enfermedades. [4] [5] Los canales IRK poseen un dominio de poro, homólogo al de los canales iónicos regulados por voltaje , y segmentos transmembrana flanqueantes (TMS). Pueden existir en la membrana como homo- o heterooligómeros y cada monómero posee entre 2 y 4 TMS. En términos de función, estas proteínas transportan potasio (K + ) , con una mayor tendencia a la captación de K + que a la exportación de K + . [3] El proceso de rectificación interna fue descubierto por Denis Noble en las células del músculo cardíaco en la década de 1960 [6] y por Richard Adrian y Alan Hodgkin en 1970 en las células del músculo esquelético. [7]
Visión general de la rectificación interna
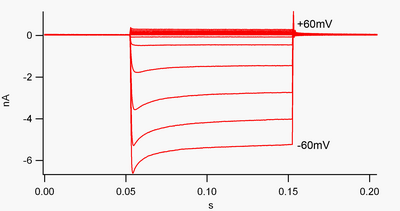
Un canal que "rectifica hacia el interior" es aquel que permite el paso de corriente (carga positiva) con mayor facilidad en dirección hacia el interior (hacia el interior de la célula) que en dirección hacia el exterior (hacia el exterior de la célula). Se cree que esta corriente puede desempeñar un papel importante en la regulación de la actividad neuronal, al ayudar a estabilizar el potencial de membrana en reposo de la célula.
Por convención, la corriente entrante (carga positiva que se mueve hacia dentro de la célula) se muestra en la pinza de voltaje como una desviación hacia abajo, mientras que una corriente saliente (carga positiva que se mueve hacia fuera de la célula) se muestra como una desviación hacia arriba. En potenciales de membrana negativos al potencial de inversión del potasio , los canales de K + rectificadores hacia dentro apoyan el flujo de iones de K + cargados positivamente hacia dentro de la célula, empujando el potencial de membrana de nuevo al potencial de reposo. Esto se puede ver en la figura 1: cuando el potencial de membrana se fija negativo al potencial de reposo del canal (p. ej. -60 mV), fluye corriente entrante (es decir, fluye carga positiva hacia dentro de la célula). Sin embargo, cuando el potencial de membrana se establece positivo al potencial de reposo del canal (p. ej. +60 mV), estos canales pasan muy poca corriente. En pocas palabras, este canal pasa mucha más corriente en la dirección entrante que en la saliente, en su rango de voltaje operativo. Estos canales no son rectificadores perfectos, ya que pueden pasar algo de corriente saliente en el rango de voltaje hasta aproximadamente 30 mV por encima del potencial de reposo.
Estos canales difieren de los canales de potasio que son típicamente responsables de repolarizar una célula después de un potencial de acción , como los canales de potasio rectificadores retardados y de tipo A. Estos canales de potasio más "típicos" transportan preferentemente corrientes de potasio hacia afuera (en lugar de hacia adentro) en potenciales de membrana despolarizados, y pueden considerarse como "rectificadores hacia afuera". Cuando se descubrió por primera vez, la rectificación hacia adentro se denominó "rectificación anómala" para distinguirla de las corrientes de potasio hacia afuera. [8]
Los rectificadores de entrada también difieren de los canales de potasio del dominio de poro en tándem , que son en gran parte responsables de las corrientes de K + de "fuga" . [9] Algunos rectificadores de entrada, denominados "rectificadores de entrada débiles", transportan corrientes de K + de salida medibles a voltajes positivos al potencial de inversión de K + (que corresponden a, pero son mayores que, las pequeñas corrientes por encima de la línea de 0 nA en la figura 1). Estos, junto con los canales de "fuga", establecen el potencial de membrana en reposo de la célula. Otros canales de rectificación de entrada, denominados "rectificadores de entrada fuertes", transportan muy poca corriente de salida y son principalmente activos a voltajes negativos al potencial de inversión de K + , donde transportan corriente de entrada (las corrientes mucho mayores por debajo de la línea de 0 nA en la figura 1). [10]
Mecanismo de rectificación interna
El fenómeno de rectificación interna de los canales de Kirschner es el resultado del bloqueo de alta afinidad por parte de poliaminas endógenas , a saber, espermina , así como iones de magnesio , que taponan el poro del canal a potenciales positivos, lo que resulta en una disminución de las corrientes de salida. Este bloqueo dependiente del voltaje por parte de las poliaminas da como resultado una conducción eficiente de la corriente solo en la dirección interna. Si bien se entiende la idea principal del bloqueo por poliaminas, los mecanismos específicos aún son controvertidos. [11]
Activación por PIP2
Todos los canales de Kirschner requieren fosfatidilinositol 4,5-bisfosfato (PIP 2 ) para su activación. [12] PIP 2 se une a Kirschner 2.2 y lo activa directamente con propiedades similares a las de un agonista. [13] En este sentido, los canales de Kirschner son canales iónicos regulados por el ligando PIP 2 .
Role
Los canales de Kirchner se encuentran en múltiples tipos de células, incluidos los macrófagos , las células cardíacas y renales , los leucocitos , las neuronas y las células endoteliales . Al mediar una pequeña corriente de K + despolarizante en potenciales de membrana negativos, ayudan a establecer el potencial de membrana en reposo y, en el caso del grupo Kirchner 3 , ayudan a mediar las respuestas inhibidoras de los neurotransmisores , pero sus funciones en la fisiología celular varían según los tipos de células:
| Ubicación | Función |
|---|---|
| miocitos cardíacos | Los canales de K ir se cierran tras la despolarización, lo que ralentiza la repolarización de la membrana y ayuda a mantener un potencial de acción cardíaco más prolongado . Este tipo de canal rectificador de entrada es distinto de los canales de K + rectificadores retardados , que ayudan a repolarizar las células nerviosas y musculares después de los potenciales de acción , y de los canales de fuga de potasio , que proporcionan gran parte de la base para el potencial de membrana en reposo . |
| células endoteliales | Los canales Kir están involucrados en la regulación de la óxido nítrico sintasa . |
| riñones | El K ir exporta el exceso de potasio a los túbulos colectores para su eliminación en la orina o, alternativamente, puede participar en la recaptación de potasio en el cuerpo. |
| neuronas y en las células del corazón | Las IRK activadas por proteína G (K ir 3) son importantes reguladores modulados por neurotransmisores. Una mutación en el canal GIRK2 conduce a la mutación del ratón tejedor. Los ratones mutantes "Weaver" son atáxicos y muestran una degeneración mediada por neuroinflamación de sus neuronas dopaminérgicas. [14] En relación con los controles no atáxicos, los mutantes Weaver tienen déficits en la coordinación motora y cambios en el metabolismo cerebral regional. [15] Los ratones Weaver han sido examinados en laboratorios interesados en el desarrollo y la enfermedad neuronal durante más de 30 años. |
| células beta pancreáticas | Los canales K ATP (compuestos por las subunidades K ir 6.2 y SUR1 ) controlan la liberación de insulina. |
Regulación
La dependencia del voltaje puede ser regulada por K + externo , por Mg 2+ interno, por ATP interno y/o por proteínas G. Los dominios P de los canales IRK exhiben una similitud de secuencia limitada con aquellos de la familia VIC. Los rectificadores de entrada juegan un papel en el establecimiento de potenciales de membrana celular, y el cierre de estos canales tras la despolarización permite la ocurrencia de potenciales de acción de larga duración con una fase de meseta. Los rectificadores de entrada carecen de las hélices de detección de voltaje intrínsecas que se encuentran en muchos canales de la familia VIC. En algunos casos, los de Kir1.1a, Kir6.1 y Kir6.2, por ejemplo, se ha propuesto que la interacción directa con un miembro de la superfamilia ABC confiere propiedades funcionales y reguladoras únicas al complejo heteromérico, incluida la sensibilidad al ATP. Estos canales sensibles al ATP se encuentran en muchos tejidos corporales. Hacen que la actividad del canal responda a la relación ATP/ADP citoplasmática (el aumento de ATP/ADP cierra el canal). Los receptores de sulfonilurea humanos SUR1 y SUR2 (spQ09428 y Q15527, respectivamente) son las proteínas ABC que regulan los canales Kir6.1 y Kir6.2 en respuesta al ATP, y CFTR (TC #3.A.1.208.4) puede regular Kir1.1a. [16]
Estructura
Se han determinado la estructura cristalina [17] y la función [18] de los miembros bacterianos de la familia IRK-C. KirBac1.1, de Burkholderia pseudomallei , tiene 333 residuos de aminoacilo (aas) de longitud con dos TMS N-terminales que flanquean un P-loop (residuos 1-150), y la mitad C-terminal de la proteína es hidrófila. Transporta cationes monovalentes con la selectividad: K ≈ Rb ≈ Cs ≫ Li ≈ Na ≈ NMGM ( N -metil- D -glucamina protonada ). La actividad es inhibida por Ba 2+ , Ca 2+ y pH bajo. [18]
Clasificación
Hay siete subfamilias de canales K ir , denominadas K ir 1 – K ir 7. [1] Cada subfamilia tiene múltiples miembros (es decir, K ir 2.1, K ir 2.2, K ir 2.3, etc.) que tienen secuencias de aminoácidos casi idénticas en todas las especies de mamíferos conocidas.
Los canales de Kir se forman a partir de proteínas de membrana homotetraméricas . Cada una de las cuatro subunidades proteicas idénticas está compuesta por dos hélices alfa que atraviesan la membrana (M1 y M2). Se pueden formar heterotetrámeros entre miembros de la misma subfamilia (es decir, Kir 2.1 y Kir 2.3 ) cuando los canales se sobreexpresan.
Diversidad
| Gene | Proteína | Alias | Subunidades asociadas |
|---|---|---|---|
| KCNJ1 | K ir 1.1 | ROMK1 | NHERF2 |
| KCNJ2 | K ir 2.1 | Irk1 | Kir 2.2 , Kir 4.1 , PSD-95 , SAP97 , AKAP79 |
| KCNJ12 | K ir 2.2 | Irk2 | K ir 2.1 y K ir 2.3 forman un canal heteromérico, subunidad auxiliar: SAP97, Veli-1 , Veli-3 , PSD-95 |
| KCNJ4 | K ir 2.3 | IRK3 | K ir 2.1 y K ir 2.3 forman el canal heteromérico PSD-95, Chapsyn-110 /PSD-93 |
| KCNJ14 | K ir 2.4 | IRK4 | K ir 2.1 para formar canal heteromérico |
| KCNJ3 | K ir 3.1 | GIRK1, KG | K ir 3.2, K ir 3.4, K ir 3.5, K ir 3.1 no es funcional por sí mismo |
| KCNJ6 | K ir 3.2 | Chica 2 | K ir 3.1, K ir 3.3, K ir 3.4 para formar un canal heteromérico |
| KCNJ9 | K ir 3.3 | Chica 3 | K ir 3.1, K ir 3.2 para formar un canal heteromérico |
| KCNJ5 | K ir 3.4 | Chica 4 | Kir 3.1 , Kir 3.2 , Kir 3.3 |
| KCNJ10 | K ir 4.1 | K ir 1.2 | K ir 4.2, K ir 5.1 y K ir 2.1 para formar canales heteroméricos |
| KCNJ15 | K ir 4.2 | K ir 1.3 | |
| KCNJ16 | K ir 5.1 | 9º BIR | |
| KCNJ8 | K ir 6.1 | K- ATP | Sur2B |
| KCNJ11 | K ir 6.2 | K- ATP | SUR1 , SUR2A y SUR2B |
| KCNJ13 | K ir 7.1 | Kir 1.4 |
Enfermedades relacionadas con Kircanales
- La hipoglucemia hiperinsulinémica persistente de la infancia está relacionada con mutaciones autosómicas recesivas en K ir 6.2. Ciertas mutaciones de este gen disminuyen la capacidad del canal para regular la secreción de insulina, lo que conduce a la hipoglucemia .
- El síndrome de Bartter puede ser causado por mutaciones en los canales de Kirschner . Esta afección se caracteriza por la incapacidad de los riñones para reciclar el potasio, lo que provoca niveles bajos de potasio en el organismo.
- El síndrome de Andersen es una enfermedad poco frecuente causada por múltiples mutaciones del gen K ir 2.1. Según la mutación, puede ser dominante o recesiva. Se caracteriza por parálisis periódica , arritmias cardíacas yrasgos dismórficos . (Véase también KCNJ2 )
- Es probable que el envenenamiento por bario se deba a su capacidad para bloquear los canales de Kirguistán .
- La aterosclerosis (enfermedad cardíaca) puede estar relacionada con los canales de Kirschner . La pérdida de corrientes de Kirschner en las células endoteliales es uno de los primeros indicadores conocidos de aterogénesis (el comienzo de la enfermedad cardíaca).
- La parálisis periódica hipocalémica tirotóxica se ha relacionado con una alteración de la función de K ir 2.6. [19]
- El síndrome EAST/SeSAME es causado por mutaciones en KCNJ10. [20]
Véase también
- Canal de potasio rectificador interno acoplado a proteína G
- hERG
- Base de datos de clasificación de transportadores
Referencias
- ^ ab Kubo Y, Adelman JP, Clapham DE, Jan LY, Karschin A, Kurachi Y, et al. (diciembre de 2005). "Unión Internacional de Farmacología. LIV. Nomenclatura y relaciones moleculares de los canales de potasio rectificadores internos". Pharmacological Reviews . 57 (4): 509–26. doi :10.1124/pr.57.4.11. PMID 16382105. S2CID 11588492.
- ^ Hedrich R, Moran O, Conti F, Busch H, Becker D, Gambale F, et al. (1995). "Los canales de potasio rectificadores internos en plantas difieren de sus contrapartes animales en respuesta a moduladores de voltaje y canal". Revista Europea de Biofísica . 24 (2): 107–15. doi :10.1007/BF00211406. PMID 8582318. S2CID 12718513.
- ^ ab "1.A.2 Familia de rectificadores internos de canal K (IRK-C)". TCDB . Consultado el 9 de abril de 2016 .
- ^ Hansen SB (mayo de 2015). "Agonismo lipídico: el paradigma PIP2 de los canales iónicos controlados por ligando". Biochimica et Biophysica Acta (BBA) - Biología molecular y celular de los lípidos . 1851 (5): 620–8. doi : 10.1016 /j.bbalip.2015.01.011. PMC 4540326. PMID 25633344.
- ^ Abraham MR, Jahangir A, Alekseev AE, Terzic A (noviembre de 1999). "Canalopatías de los canales de potasio rectificadores internos". FASEB Journal . 13 (14): 1901–10. doi : 10.1096/fasebj.13.14.1901 . PMID 10544173. S2CID 22205168.
- ^ Noble, Denis (diciembre de 1965). "Propiedades eléctricas del músculo cardíaco atribuibles a una rectificación hacia adentro (anómala)". Revista de fisiología celular y comparada . 66 (S2): 127–135. doi :10.1002/jcp.1030660520. ISSN 0095-9898.
- ^ Adrian RH, Chandler WK, Hodgkin AL (julio de 1970). "Cambios lentos en la permeabilidad del potasio en el músculo esquelético". The Journal of Physiology . 208 (3): 645–68. doi :10.1113/jphysiol.1970.sp009140. PMC 1348790 . PMID 5499788.
- ^ Bertil Hille (2001). Canales iónicos de membranas excitables 3.ª ed. (Sinauer: Sunderland, MA), pág. 151. ISBN 0-87893-321-2 .
- ^ Hille, pág. 155.
- ^ Hille, pág. 153.
- ^ Lopatin AN, Makhina EN, Nichols CG (noviembre de 1995). "El mecanismo de rectificación interna de los canales de potasio: 'taponamiento de poros largos' por poliaminas citoplasmáticas". The Journal of General Physiology . 106 (5): 923–55. doi :10.1085/jgp.106.5.923. PMC 2229292 . PMID 8648298.
- ^ Tucker SJ, Baukrowitz T (mayo de 2008). "Cómo los lípidos aniónicos altamente cargados se unen y regulan los canales iónicos". The Journal of General Physiology . 131 (5): 431–8. doi :10.1085/jgp.200709936. PMC 2346576 . PMID 18411329.
- ^ Hansen SB, Tao X, MacKinnon R (agosto de 2011). "Base estructural de la activación de PIP2 del canal rectificador interno clásico de K+ Kir2.2". Nature . 477 (7365): 495–8. Bibcode :2011Natur.477..495H. doi :10.1038/nature10370. PMC 3324908 . PMID 21874019.
- ^ Peng J, Xie L, Stevenson FF, Melov S, Di Monte DA, Andersen JK (noviembre de 2006). "La neurodegeneración dopaminérgica nigroestriatal en el ratón tejedor está mediada por neuroinflamación y aliviada por la administración de minociclina". The Journal of Neuroscience . 26 (45): 11644–51. doi :10.1523/JNEUROSCI.3447-06.2006. PMC 6674792 . PMID 17093086.
- ^ Strazielle C, Deiss V, Naudon L, Raisman-Vozari R, Lalonde R (octubre de 2006). "Variaciones cerebrales regionales de la actividad de la citocromo oxidasa y la coordinación motora en ratones mutantes Girk2(Wv) (Weaver)". Neurociencia . 142 (2): 437–49. doi :10.1016/j.neuroscience.2006.06.011. PMID 16844307. S2CID 33064439.
- ^ Solicitud WO 0190360, Wei MH, Chaturvedi K, Guegler K, Webster M, Ketchum KA, Di Francesco V, Beasley E, "Proteínas transportadoras humanas aisladas, moléculas de ácido nucleico que codifican proteínas transportadoras humanas y usos de las mismas", publicada el 29 de noviembre de 2001, asignada a Apperla Corporation
- ^ Kuo A, Gulbis JM, Antcliff JF, Rahman T, Lowe ED, Zimmer J, et al. (junio de 2003). "Estructura cristalina del canal de potasio KirBac1.1 en estado cerrado". Science . 300 (5627): 1922–6. Bibcode :2003Sci...300.1922K. doi : 10.1126/science.1085028 . PMID 12738871. S2CID 2703162.
- ^ ab Enkvetchakul D, Bhattacharyya J, Jeliazkova I, Groesbeck DK, Cukras CA, Nichols CG (noviembre de 2004). "Caracterización funcional de un canal Kir procariota". The Journal of Biological Chemistry . 279 (45): 47076–80. doi : 10.1074/jbc.C400417200 . PMC 8629170 . PMID 15448150.
- ^ Ryan DP, da Silva MR, Soong TW, Fontaine B, Donaldson MR, Kung AW, et al. (enero de 2010). "Las mutaciones en el canal de potasio Kir2.6 provocan susceptibilidad a la parálisis periódica hipocalémica tirotóxica". Cell . 140 (1): 88–98. doi :10.1016/j.cell.2009.12.024. PMC 2885139 . PMID 20074522.
- ^ Bockenhauer D, Feather S, Stanescu HC, Bandulik S, Zdebik AA, Reichold M, et al. (mayo de 2009). "Epilepsia, ataxia, sordera neurosensorial, tubulopatía y mutaciones de KCNJ10". The New England Journal of Medicine . 360 (19): 1960–70. doi :10.1056/NEJMoa0810276. PMC 3398803 . PMID 19420365.
Lectura adicional
- Hille B (2001). Canales iónicos de membranas excitables (3.ª ed.). Sunderland, MA: Sinauer. pp. 149–154. ISBN 0-87893-321-2.
Enlaces externos
- Canales rectificadores de potasio internos en los Encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- "Canales de potasio que recifican hacia el interior". Base de datos de receptores y canales iónicos de la IUPHAR . Unión Internacional de Farmacología Básica y Clínica.
- Orientación de proteínas en membranas de la UMich familias/familia-85 - Posiciones espaciales de los canales rectificadores de potasio hacia adentro en las membranas.