Proteína morfogenética ósea 4
| BMP4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | BMP4 , BMP2B, BMP2B1, MCOPS6, OFC11, ZYME, proteína morfogenética ósea 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 112262; MGI : 88180; HomoloGene : 7247; GeneCards : BMP4; OMA : BMP4 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La proteína morfogenética ósea 4 es una proteína que en los humanos está codificada por el gen BMP4 . [4] [5] BMP4 se encuentra en el cromosoma 14q22-q23.
BMP4 es un miembro de la familia de proteínas morfogenéticas óseas que forma parte de la superfamilia del factor de crecimiento transformante beta . La superfamilia incluye grandes familias de factores de crecimiento y diferenciación. BMP4 está altamente conservado evolutivamente. BMP4 se encuentra en el desarrollo embrionario temprano en la zona marginal ventral y en la sangre del ojo, el corazón y la vesícula ótica. [6]
Descubrimiento
Las proteínas morfogenéticas óseas se identificaron originalmente por la capacidad del extracto óseo desmineralizado para inducir osteogénesis endocondral in vivo en un sitio extraesquelético.
Función
BMP4 es un polipéptido que pertenece a la superfamilia de proteínas TGF-β . Al igual que otras proteínas morfogenéticas óseas , está involucrado en el desarrollo de los huesos y los cartílagos, específicamente en el desarrollo de los dientes y las extremidades y en la reparación de fracturas. Este miembro particular de la familia desempeña un papel importante en el inicio de la formación ósea endocondral en humanos. Se ha demostrado que está involucrado en el desarrollo muscular, la mineralización ósea y el desarrollo de la yema ureteral . [7]
BMP4 estimula la diferenciación del tejido ectodérmico suprayacente. [8]
Se sabe que las proteínas morfogenéticas óseas estimulan la formación ósea en animales adultos. Se cree que esto induce el compromiso osteoblástico y la diferenciación de células madre como las células madre mesenquimales . [ cita requerida ] Se sabe que las BMP desempeñan un papel importante en el desarrollo embrionario. En el embrión, BMP4 ayuda a establecer la formación del eje dorsoventral en la rana Xenopus mediante la inducción del mesodermo ventral. En ratones, la inactivación dirigida de BMP4 interrumpe la formación del mesodermo . [9] También establece el patrón dorsoventral del tubo neural en desarrollo con la ayuda de BMP7 e induce caracteres dorsales. [ cita requerida ]
BMP4 también limita el grado en que se produce la diferenciación neuronal en los embriones de Xenopus al inducir la formación de epidermis en lugar de tejido neuronal. Pueden ayudar a inducir las características laterales en los somitas. Los somitas son necesarios para el desarrollo de cartílago, hueso, dermis en el lado dorsal del cuerpo, músculos torácicos y músculos dentro de las extremidades. [10] BMP4 ayuda en la formación de patrones de la cabeza en desarrollo al inducir la apoptosis de las células de la cresta neural ; esto se realiza en el rombencéfalo. [11]
En el adulto, BMP4 es importante para la neurogénesis (es decir, la generación de nuevas neuronas) que ocurre a lo largo de la vida en dos nichos neurogénicos del cerebro, el giro dentado del hipocampo y la zona subventricular (SVZ) adyacente a los ventrículos laterales. En estos nichos se generan continuamente nuevas neuronas a partir de células madre. De hecho, se ha demostrado que en el giro dentado BMP4 mantiene a las células madre neuronales en quiescencia, evitando así el agotamiento del pool de células madre. [12] En la SVZ , la señalización mediada por BMP vía Smad4 es necesaria para iniciar la neurogénesis a partir de células madre neuronales adultas y suprimir el destino alternativo de la oligodendrogliogénesis. [13] Además, se ha demostrado que en la SVZ BMP4 tiene un efecto prodiferenciador, ya que rescata un defecto de diferenciación terminal en las neuroesferas de la SVZ donde se ha eliminado el gen Tis21/ BTG2 - requerido para la diferenciación terminal -. [14] Tis21 es un regulador positivo de la expresión de BMP4 en el SVZ. [14]
La BMP4 es importante para el metabolismo de los huesos y el cartílago . Se ha descubierto que la señalización de BMP4 interviene en la formación del mesodermo temprano y de las células germinales. La regulación de los brotes de las extremidades y el desarrollo de los pulmones, el hígado, los dientes y las células mesenquimales faciales son otras funciones importantes atribuidas a la señalización de BMP4. [15] La formación de los dedos está influenciada por BMP4, junto con otras señales de BMP. El mesénquima interdigital exhibe BMP4, que previene la apoptosis de la región. [16] La formación de los dientes depende de la expresión de BMP4, que induce Msx 1 y 2. Estos factores de transcripción convierten el diente en formación en un incisivo.
BMP4 también juega un papel importante en el tejido adiposo: es esencial para la adipogénesis blanca y promueve la diferenciación de los adipocitos . [17] Además, también es importante para la grasa parda , donde induce UCP1 , relacionada con la termogénesis sin escalofríos . [17]
La secreción de BMP4 ayuda a provocar la diferenciación de la yema ureteral en el uréter. [18]
BMP4 antagoniza el tejido organizador y se expresa en el desarrollo temprano en el tejido ectodérmico y mesodérmico. Tras la gastrulación, la transcripción de BMP4 se limita a la zona marginal ventrolateral debido a la inhibición del lado dorsalizante del embrión en desarrollo. BMP4 ayuda a la ventralización del mesodermo, que guía la formación del eje dorsoventral. En Xenopus, se ha descubierto que BMP4 ayuda a la formación de sangre e islotes sanguíneos. [19]
La BMP4, expresada inicialmente en la epidermis, se encuentra en la placa del techo durante la formación del tubo neural. Se encuentra un gradiente de señalización de BMP en oposición a un gradiente de Sonic hedgehog , Shh. Esta expresión de BMP4 modela las neuronas dorsales. [20]
BMP4, en conjunto con FGF2 , promueve la diferenciación de células madre a linajes mesodérmicos. Después de la diferenciación, las células tratadas con BMP4 y FGF2 generalmente producen mayores cantidades de diferenciación osteogénica y condrogénica que las células madre no tratadas. [21] Además, en conjunto con FGF2, puede producir células tiroideas progenitoras a partir de células madre pluripotentes en ratones y humanos. [22]
Se ha demostrado que BMP4 induce la expresión de la familia de genes Msx, que se cree que es parte de la formación de cartílago a partir del mesodermo somítico . [23]
Se ha encontrado BMP4, un factor de crecimiento paracrino , en ovarios de ratas . BMP4, junto con BMP7 , regula el desarrollo temprano del folículo ovárico y la transición de folículo primordial a primario. Además, se ha demostrado que la inhibición de BMP4 con anticuerpos disminuye el tamaño general del ovario. Estos resultados indican que BMP4 puede ayudar a la supervivencia y la prevención de la apoptosis en los ovocitos . [15]
En las aves, se ha demostrado que la BMP4 influye en el tamaño del pico de los pinzones de Darwin . Las cantidades bajas de BMP4 se correlacionan con picos de poca profundidad y anchura. Por el contrario, una expresión alta de BMP4 produce picos de gran profundidad y anchura. La regulación genética de la BMP4 proporciona la base para la selección natural en los picos de las aves. [24]
Estructura de la proteína
El bmp4 humano, que produce un péptido carboxiterminal activo de 116 residuos, se sintetiza inicialmente como una preproteína de cuarenta por ciento de residuos que se escinde postraduccionalmente. El bmp4 tiene siete residuos que se conservan y se glucosilan. [25] Los monómeros se mantienen con puentes disulfuro y tres pares de aminoácidos de cisteína. Esta conformación se denomina "nudo de cistina". El bmp4 puede formar homodímeros o heterodímeros con bmps similares. Un ejemplo de esto es el bmp7. Esta capacidad de formar homodímeros o heterodímeros le confiere la capacidad de tener una mayor actividad osteoinductiva que el bmp4 solo. [26] Aún no se sabe mucho sobre cómo interactúan los bmps con la matriz extracelular. También se sabe poco sobre las vías que degradan el bmp4.
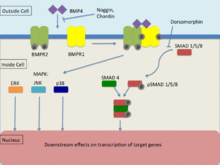
Inhibición
La inhibición de la señal BMP4 (por cordina , noggin o folistatina ) hace que el ectodermo se diferencie en la placa neural . Si estas células también reciben señales de FGF , se diferenciarán en la médula espinal; en ausencia de FGF, las células se convierten en tejido cerebral.
Si bien la sobreexpresión de BMP4 puede conducir a la ventralización, la inhibición con un negativo dominante puede resultar en la dorsalización completa del embrión o la formación de dos ejes. [27]
Es importante señalar que los ratones en los que se inactivó por completo la BMP4 generalmente murieron durante la gastrulación . Se cree que la inactivación de la BMP4 humana probablemente tendría el mismo efecto. Sin embargo, las mutaciones que no inactivan por completo la BMP4 en humanos también pueden tener efectos sutiles fenotípicamente y se las ha relacionado con la agenesia dental y la osteoporosis. [28]
Isoformas
Se ha descrito el empalme alternativo en la región no traducida 5' de este gen y se describen tres variantes, todas ellas codificando una proteína idéntica. [29]
Mecanismos moleculares
BMP4, como miembro de la familia del factor de crecimiento transformante β (TGF-β), se une a dos tipos diferentes de receptores de serina-treonina quinasa, conocidos como BMPR1 y BMPR2. [30] La transducción de señales a través de estos receptores se produce por las vías de Smad y map quinasa para efectuar la transcripción de sus genes diana. Para que se produzca la transducción de señales, ambos receptores deben ser funcionales. BMP es capaz de unirse a BMPR2 sin BMPR1, sin embargo, la afinidad aumenta significativamente en presencia de ambos receptores. BMPR1 se transfosforila a través de BMPR2, lo que induce la señalización descendente dentro de la célula, lo que afecta la transcripción. [30]
Vía de señalización Smad
Los receptores de la familia TGF-β utilizan con mayor frecuencia la vía de señalización Smad para traducir señales. [30] Los receptores de tipo 2 son responsables de activar los receptores de tipo 1 , cuya función implica la fosforilación de los R-Smad (Smad-1, Smad-5, Smad-8). Tras la fosforilación, se produce la formación de un complejo R-SMAD junto con el Smad de pareja común (co-Smad), que migra al núcleo. Esta vía de señalización está regulada por el inhibidor de moléculas pequeñas conocido como dorsomorfina, que evita los efectos posteriores de los R-Smad. [30]
Vías de señalización de la quinasa de mapas (MAPK)
Las proteínas quinasas activadas por mitógenos (MAPK) experimentan fosforilación a través de una cascada de señalización donde MAPKKK fosforila y activa MAPKK y MAPKK fosforila y activa MAPK que luego induce una respuesta intracelular. [31] La activación de MAPKKK se realiza a través de la interacción principalmente de GTPasas u otro grupo de proteínas quinasas. Los receptores TGF-β inducen las vías de señalización MAPK de ERK, JNK y p38. [31] También se sabe que BMP4 activa las vías de señalización MAPK ERK, JNK y p38, aunque se ha descubierto que actúan independientemente de las vías de señalización Smad, son principalmente activas junto con Smad. [32] La activación de las vías ERK y JNK actúa para fosforilar Smad y, por lo tanto, regular su activación. Además de esto, las vías MAPK pueden afectar directamente a los factores de transcripción que interactúan con Smad a través de un sustrato JNK o p38 que induce la convergencia de las dos vías de señalización. Se observa que esta convergencia consiste principalmente en un comportamiento cooperativo; sin embargo, hay evidencia que sugiere que a veces pueden contrarrestarse entre sí. Además, el equilibrio que existe entre la activación directa de estas vías de señalización tiene un efecto significativo en las respuestas celulares inducidas por TGF-β. [32]
Importancia clínica
El aumento de la expresión de BMP4 se ha asociado con una variedad de enfermedades óseas, incluido el trastorno hereditario fibrodisplasia osificante progresiva . [33]
Existe evidencia sólida de estudios de secuenciación de genes candidatos involucrados en el labio leporino y el paladar hendido que indica que las mutaciones en el gen de la proteína morfogenética ósea 4 (BMP4) pueden estar asociadas con la patogénesis del labio leporino y el paladar hendido . [34]
Desarrollo del ojo
Los ojos son esenciales para los organismos, especialmente los vertebrados terrestres , para observar presas y obstáculos; esto es crítico para su supervivencia. La formación de los ojos comienza como vesículas ópticas y lentes derivados del neuroectodermo . Se sabe que las proteínas morfogénicas óseas estimulan la formación del cristalino del ojo. Durante el desarrollo temprano de los ojos, la formación de la vesícula óptica es esencial en ratones y BMP4 se expresa fuertemente en la vesícula óptica y débilmente en el mesénquima circundante y el ectodermo de superficie. Este gradiente de concentración de BMP4 en la vesícula óptica es crítico para la inducción del cristalino. Los investigadores, Dr. Furuta y Dr. Hogan descubrieron que si realizaban una mutación láser en embriones de ratones y causaban una mutación nula homocigótica de BMP4 , este embrión no desarrollaría el cristalino. También hicieron una hibridación in situ del gen BMP4 que mostraba color verde y el gen Sox2 en rojo, que pensaron que también estaba involucrado en la formación del cristalino. Después de realizar estas dos hibridaciones in situ en los embriones de ratones, descubrieron que tanto el color verde como el rojo se encuentran en la vesícula óptica de los embriones de ratones. Esto indicó que BMP4 y Sox2 se expresan en el lugar correcto en el momento correcto de la vesícula óptica y prueban que tienen algunas funciones esenciales para la inducción del cristalino. Además, realizaron un experimento de seguimiento en el que al inyectar BMP4 en los embriones mutantes homocigotos para BMP4 se rescató la formación del cristalino (12). Esto indicó que BMP4 es definitivamente necesario para la formación del cristalino. Sin embargo, los investigadores también descubrieron que algunos de los ratones mutados no pueden ser rescatados. Más tarde descubrieron que esos mutantes carecían de Msx 2 , que es activado por BMP4. El mecanismo que predijeron fue que BMP4 activará Msx 2 en la vesícula óptica y la combinación de concentración de BMP4 y Msx2 activará Sox2 y Sox2 es esencial para la diferenciación del cristalino. [35]
La inyección de Noggin en las células de las fibras del cristalino de ratones reduce significativamente las proteínas BMP4 en las células. Esto indica que Noggin es suficiente para inhibir la producción de BMP4. Además, se encontró otra proteína inhibidora , Alk6, que impedía que BMP4 activara Msx2, lo que detenía la diferenciación del cristalino. [36] Sin embargo, todavía hay mucho que se desconoce sobre el mecanismo de inhibición de BMP4 y la regulación descendente de Sox2. En el futuro, los investigadores apuntan a descubrir una vía más completa del desarrollo de todo el ojo y esperan que algún día puedan encontrar una forma de curar algunas enfermedades oculares de origen genético.
Pérdida de cabello
La pérdida de cabello o conocida como alopecia es causada por el cambio de la morfología del folículo piloso y el ciclo del folículo piloso de una manera anormal. [37] Los ciclos de los folículos pilosos son el de crecimiento, o anágeno , regresión o catágeno , y reposo o telógeno . [38] En los mamíferos, las interacciones epiteliales y mesenquimales recíprocas controlan el desarrollo del cabello. Genes como BMP4 y BMP2 son activos dentro de los precursores del tallo del cabello. Específicamente, BMP4 se encuentra en la papila dérmica . BMP4 es parte de la red de señalización que controla el desarrollo del cabello. Es necesario para la inducción de vías bioquímicas y señalización para regular la diferenciación del tallo del cabello en el folículo piloso anágeno. Esto se hace a través del control de la expresión de los factores de transcripción que regulan la diferenciación del cabello. Sin embargo, todavía no está claro dónde actúan las BMP dentro de la red genética. La señalización de bmp4 puede controlar potencialmente la expresión de moléculas de diferenciación terminal como las queratinas. Se ha demostrado que otros reguladores también controlan el desarrollo del folículo piloso. HOXC13 y FOXN1 se consideran reguladores importantes porque los experimentos de pérdida de función muestran una diferenciación deficiente del tallo piloso que no interfiere en la formación del folículo piloso. [39]
Cuando BMP4 se expresa ectópicamente, dentro de los ratones transgénicos, la vaina de la raíz externa del folículo piloso (ORS) inhibe la proliferación de la matriz celular. BMP4 también activa la expresión del gen de la queratina del cabello , notándose que BMP4 es importante en la diferenciación del tallo piloso. Noggin , un inhibidor conocido de BMP4, se encuentra dentro de las células de la matriz del bulbo piloso. Otros factores importantes a considerar en el desarrollo del cabello son la expresión de Shh ( sonic hedgehog ), BMP7 , BMP2, WNT y β-catenina , ya que estos son necesarios en la morfogénesis de la etapa temprana . [40]
Otros genes que pueden inhibir o interactuar con BMP4 son noggin, follistatin y gremlin , que se expresan en los folículos pilosos en desarrollo. [41] En ratones en los que falta noggin, hay menos folículos pilosos que en un ratón normal y se inhibe el desarrollo del folículo . En embriones de pollo se ha demostrado que la noggin expresada ectópicamente produce folículos agrandados, y la señalización de BMP4 muestra un destino de placa reprimido en las células cercanas. [26] También se ha demostrado durante experimentos in vivo que la noggin induce el crecimiento del cabello en la piel posnatal. [42]
La BMP4 es un componente importante de las vías biológicas que intervienen en la regulación de la diferenciación del tallo piloso dentro del folículo piloso anágeno. Los niveles más altos de BMP4 expresado se encuentran dentro de la médula , las células del tallo piloso, la matriz pilosa distal y los precursores potenciales de la cutícula . Los dos métodos principales por los que la BMP4 inhibe la expresión del cabello son mediante la restricción de la expresión del factor de crecimiento en la matriz pilosa y el antagonismo entre la señalización de crecimiento y diferenciación. [40]
Las vías que regulan la formación de folículos pilosos y el crecimiento del cabello son fundamentales para desarrollar métodos terapéuticos para las afecciones que provocan la caída del cabello. Dichas afecciones incluyen el desarrollo de nuevos folículos, el cambio de la forma de las características de los folículos existentes y la alteración del crecimiento del cabello en los folículos pilosos existentes. Además, la BMP4 y la vía a través de la cual actúa pueden proporcionar objetivos terapéuticos para la prevención de la caída del cabello. [38]
Referencias
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000021835 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ van den Wijngaard A, Weghuis DO, Boersma CJ, van Zoelen EJ, Geurts van Kessel A, Olijve W (noviembre de 1995). "Mapeo preciso del gen de la proteína 4 morfogenética del hueso humano (BMP4) en el cromosoma 14q22-q23 mediante hibridación in situ" (PDF) . Genómica . 27 (3): 559–60. doi :10.1006/geno.1995.1096. hdl : 2066/22049 . PMID 7558046.
- ^ Oida S, Iimura T, Maruoka Y, Takeda K, Sasaki S (noviembre de 1995). "Clonación y secuenciación de la proteína morfogenética ósea 4 (BMP-4) a partir de una biblioteca de ADNc placentario humano". DNA Seq . 5 (5): 273–5. doi :10.3109/10425179509030980. PMID 7579580.
- ^ Knöchel S, Dillinger K, Köster M, Knöchel W (noviembre de 2001). "Estructura y expresión de los genes BMP-2 y BMP-4 de Xenopus tropicalis". Mech. Dev . 109 (1): 79–82. doi : 10.1016/S0925-4773(01)00506-8 . PMID: 11677055. S2CID : 792305.
- ^ Miyazaki Y, Oshima K, Fogo A, Hogan BL, Ichikawa I (abril de 2000). "La proteína morfogenética ósea 4 regula el sitio de gemación y la elongación del uréter del ratón". The Journal of Clinical Investigation . 105 (7): 863–873. doi :10.1172/JCI8256. PMC 377476 . PMID 10749566.
- ^ Biniazan F, Manzari-Tavakoli A, Safaeinejad F, Moghimi A, Rajaei F, Niknejad H (febrero de 2021). "El efecto de diferenciación de la proteína morfogenética ósea (BMP) en las células madre epiteliales amnióticas humanas para expresar marcadores de linaje ectodérmico". Investigación celular y tisular . 383 (2): 751–763. doi :10.1007/s00441-020-03280-z. PMID 32960356. S2CID 221843254.
- ^ Winnier G, Blessing M, Labosky PA, Hogan BL (septiembre de 1995). "La proteína morfogenética ósea 4 es necesaria para la formación y el patrón del mesodermo en el ratón". Genes & Development . 9 (17): 2105–2116. doi : 10.1101/gad.9.17.2105 . PMID 7657163.
- ^ Wolpert L, Tickle C, Arias AM, Lawrence P, Lumsden A, Robertson E, Meyerowitz E, Smith J (2015). "Desarrollo de los vertebrados III: Polluelo y ratón: completando el plan corporal". Principios del desarrollo (quinta edición). Oxford, Reino Unido. pág. 207. ISBN 978-0-19-870988-6.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Graham y otros , 1994
- ^ Mira H, Andreu Z, Suh H, Lie DC, Jessberger S, Consiglio A, San Emeterio J, Hortigüela R, Marqués-Torrejón MA, Nakashima K, Colak D, Götz M, Fariñas I, Gage FH (2010). "La señalización a través de BMPR-IA regula la quiescencia y la actividad a largo plazo de las células madre neuronales en el hipocampo adulto". Cell Stem Cell . 7 (1): 78–89. doi : 10.1016/j.stem.2010.04.016 . PMID 20621052.
- ^ Colak D, Mori T, Brill MS, Pfeifer A, Falk S, Deng C, Monteiro R, Mummery C, Sommer L, Götz M (2008). "La neurogénesis adulta requiere la señalización de la proteína morfogénica ósea mediada por Smad4 en células madre". The Journal of Neuroscience . 28 (2): 434–446. doi :10.1523/JNEUROSCI.4374-07.2008. PMC 6670509 . PMID 18184786.
- ^ ab Farioli-Vecchioli S, Ceccarelli M, Saraulli D, Micheli L, Cannas S, D'Alessandro F, Scardigli R, Leonardi L, Cinà I, Costanzi M, Mattera A, Cestari V, Tirone F (2014). "Tis21 es necesaria para la neurogénesis adulta en la zona subventricular y para la regulación del comportamiento olfativo por ciclinas, BMP4, Hes1/5 e Ids". Front Cell Neurosci . 8 : 98. doi : 10.3389/fncel.2014.00098 . PMC 3977348 . PMID 24744701.
- ^ ab Nilsson EE, Skinner MK (octubre de 2003). "La proteína morfogenética ósea 4 actúa como un factor de supervivencia del folículo ovárico y promueve el desarrollo del folículo primordial". Biol. Reprod . 69 (4): 1265–72. doi :10.1095/biolreprod.103.018671. PMID 12801979. S2CID 2141586.
- ^ Arteaga-Solis E, Gayraud B, Lee SY, Shum L, Sakai L, Ramirez F (julio de 2001). "Regulación de la formación de patrones en las extremidades por microfibrillas extracelulares". J. Cell Biol . 154 (2): 275–81. doi :10.1083/jcb.200105046. PMC 2150751. PMID 11470817 .
- ^ ab Blázquez-Medela AM, Jumabay M, Boström KI (mayo de 2019). "Más allá del hueso: señalización de proteínas morfogenéticas óseas en el tejido adiposo". Obesity Reviews . 20 (5): 648–658. doi :10.1111/obr.12822. PMC 6447448 . PMID 30609449.
- ^ Miyazaki Y, Oshima K, Fogo A , Ichikawa I (marzo de 2003). "Evidencia de que la proteína morfogenética ósea 4 tiene múltiples funciones biológicas durante el desarrollo del riñón y del tracto urinario". Kidney Int . 63 (3): 835–44. doi : 10.1046/j.1523-1755.2003.00834.x . PMID 12631064.
- ^ Hemmati-Brivanlou A, Thomsen GH (1995). "Patrones mesodérmicos ventrales en embriones de Xenopus: patrones de expresión y actividades de BMP-2 y BMP-4". Dev. Genet . 17 (1): 78–89. doi :10.1002/dvg.1020170109. PMID 7554498.
- ^ Selleck MA, García-Castro MI, Artinger KB, Bronner-Fraser M (diciembre de 1998). "Los efectos de Shh y Noggin en la formación de la cresta neural demuestran que BMP es necesaria en el tubo neural pero no en el ectodermo". Desarrollo . 125 (24): 4919–30. doi :10.1242/dev.125.24.4919. PMID 9811576. Archivado desde el original el 20 de mayo de 2022 . Consultado el 22 de agosto de 2021 .
- ^ Lee TJ, Jang J, Kang S, Jin M, Shin H, Kim DW, Kim BS (enero de 2013). "Mejora de la diferenciación osteogénica y condrogénica de células madre embrionarias humanas mediante la inducción del linaje mesodérmico con tratamiento con BMP-4 y FGF2". Biochem. Biophys. Res. Commun . 430 (2): 793–7. doi :10.1016/j.bbrc.2012.11.067. PMID 23206696.
- ^ Kurmann AA, Serra M, Hawkins F, Rankin SA, Mori M, Astapova I, Ullas S, Lin S, Bilodeau M, Rossant J, Jean JC, Ikonomou L, Deterding RR, Shannon JM, Zorn AM, Hollenberg AN, Kotton DN (noviembre de 2015). "Regeneración de la función tiroidea mediante trasplante de células madre pluripotentes diferenciadas". Cell Stem Cell . 17 (5): 527–42. doi :10.1016/j.stem.2015.09.004. PMC 4666682 . PMID 26593959.
- ^ Watanabe Y, Le Douarin NM (junio de 1996). "Un papel para BMP-4 en el desarrollo del cartílago subcutáneo". Mech. Dev . 57 (1): 69–78. doi : 10.1016/0925-4773(96)00534-5 . PMID: 8817454. S2CID : 16858412.
- ^ Abzhanov A, Protas M, Grant BR, Grant PR, Tabin CJ (septiembre de 2004). "Bmp4 y variación morfológica de los picos en los pinzones de Darwin". Science . 305 (5689): 1462–5. Bibcode :2004Sci...305.1462A. doi :10.1126/science.1098095. PMID 15353802. S2CID 17226774.
- ^ Aono A, Hazama M, Notoya K, Taketomi S, Yamasaki H, Tsukuda R, Sasaki S, Fujisawa Y (mayo de 1995). "Potente actividad inductora de hueso ectópico del heterodímero de proteína morfogenética ósea 4/7". Biochem. Biophys. Res. Commun . 210 (3): 670–7. doi :10.1006/bbrc.1995.1712. PMID 7763240.
- ^ ab Botchkarev VA, Botchkareva NV, Roth W, Nakamura M, Chen LH, Herzog W, Lindner G, McMahon JA, Peters C, Lauster R, McMahon AP, Paus R (julio de 1999). "Noggin es un estimulador de origen mesenquimal de la inducción del folículo piloso". Nat. Cell Biol . 1 (3): 158–64. doi :10.1038/11078. PMID 10559902. S2CID 8777441.
- ^ Metz A, Knöchel S, Büchler P, Köster M, Knöchel W (junio de 1998). "Análisis estructural y funcional del promotor BMP-4 en embriones tempranos de Xenopus laevis". Mech. Dev . 74 (1–2): 29–39. doi : 10.1016/S0925-4773(98)00059-8 . PMID: 9651472. S2CID : 14496024.
- ^ Yu M, Wang H, Fan Z, Xie C, Liu H, Liu Y, Han D, Wong SW, Feng H (julio de 2019). "Mutaciones de BMP4 en la agenesia dental y la baja masa ósea". Archivos de biología oral . 103 : 40–46. doi :10.1016/j.archoralbio.2019.05.012. PMC 6639811. PMID 31128441 .
- ^ "Entrez Gene: proteína morfogenética ósea BMP4 4".
- ^ abcd Miyazono K, Kamiya Y, Morikawa M (enero de 2010). "Receptores de proteínas morfogenéticas óseas y transducción de señales". J. Biochem . 147 (1): 35–51. doi : 10.1093/jb/mvp148 . PMID 19762341.
- ^ ab Cell Signaling Technology, Inc. "Cascadas de proteína quinasa activada por mitógeno" . Consultado el 17 de noviembre de 2012 .
- ^ ab Derynck R, Zhang YE (octubre de 2003). "Vías dependientes e independientes de Smad en la señalización de la familia TGF-beta". Nature . 425 (6958): 577–84. Bibcode :2003Natur.425..577D. doi :10.1038/nature02006. PMID 14534577. S2CID 4419607.
- ^ Kan L, Hu M, Gomes WA, Kessler JA (octubre de 2004). "Ratones transgénicos que sobreexpresan BMP4 desarrollan un fenotipo similar a la fibrodisplasia osificante progresiva (FOP)". Am. J. Pathol . 165 (4): 1107–15. doi :10.1016/S0002-9440(10)63372-X. PMC 1618644. PMID 15466378 .
- ^ Dixon MJ, Marazita ML, Beaty TH, Murray JC (marzo de 2011). "Labio leporino y paladar hendido: comprensión de las influencias genéticas y ambientales". Nat. Rev. Genet . 12 (3): 167–78. doi :10.1038/nrg2933. PMC 3086810 . PMID 21331089.
- ^ Furuta Y, Hogan BL (diciembre de 1998). "BMP4 es esencial para la inducción del cristalino en el embrión de ratón". Genes Dev . 12 (23): 3764–75. doi :10.1101/gad.12.23.3764. PMC 317259 . PMID 9851982.
- ^ Faber SC, Robinson ML, Makarenkova HP, Lang RA (agosto de 2002). "La señalización Bmp es necesaria para el desarrollo de las células de las fibras primarias del cristalino". Desarrollo . 129 (15): 3727–37. doi :10.1242/dev.129.15.3727. PMID 12117821.
- ^ Cotsarelis G, Millar SE (julio de 2001). "Hacia una comprensión molecular de la pérdida del cabello y su tratamiento". Trends Mol Med . 7 (7): 293–301. doi :10.1016/S1471-4914(01)02027-5. PMID 11425637.
- ^ ab Millar SE (febrero de 2002). "Mecanismos moleculares que regulan el desarrollo del folículo piloso". J. Invest. Dermatol . 118 (2): 216–25. doi : 10.1046/j.0022-202x.2001.01670.x . PMID 11841536.
- ^ Kulessa H, Turk G, Hogan BL (diciembre de 2000). "La inhibición de la señalización de Bmp afecta el crecimiento y la diferenciación en el folículo piloso anágeno". EMBO J . 19 (24): 6664–74. doi :10.1093/emboj/19.24.6664. PMC 305899 . PMID 11118201.
- ^ ab Huelsken J, Vogel R, Erdmann B, Cotsarelis G, Birchmeier W (mayo de 2001). "La beta-catenina controla la morfogénesis del folículo piloso y la diferenciación de células madre en la piel". Cell . 105 (4): 533–45. doi : 10.1016/S0092-8674(01)00336-1 . PMID 11371349. S2CID 16775006.
- ^ Feijen A, Goumans MJ, van den Eijnden-van Raaij AJ (diciembre de 1994). "La expresión de subunidades de activina, receptores de activina y folistatina en embriones de ratón postimplantación sugiere funciones de desarrollo específicas para diferentes activinas". Desarrollo . 120 (12): 3621–37. doi :10.1242/dev.120.12.3621. PMID 7821227.
- ^ Botchkarev VA, Botchkareva NV, Nakamura M, Huber O, Funa K, Lauster R, Paus R, Gilchrest BA (octubre de 2001). "Noggin es necesaria para la inducción de la fase de crecimiento del folículo piloso en la piel posnatal". FASEB J . 15 (12): 2205–14. doi : 10.1096/fj.01-0207com . PMID 11641247. S2CID 10236217.
Lectura adicional
- Wozney JM, Rosen V, Celeste AJ, Mitsock LM, Whitters MJ, Kriz RW, Hewick RM, Wang EA (1989). "Nuevos reguladores de la formación ósea: clones moleculares y actividades". Science . 242 (4885): 1528–34. Bibcode :1988Sci...242.1528W. doi :10.1126/science.3201241. PMID 3201241.
- Rosenzweig BL, Imamura T, Okadome T, Cox GN, Yamashita H, ten Dijke P, Heldin CH, Miyazono K (1995). "Clonación y caracterización de un receptor humano tipo II para proteínas morfogenéticas óseas". Proc. Natl. Sci. EE. UU . . 92 (17): 7632–6. Bibcode :1995PNAS...92.7632R. doi : 10.1073/pnas.92.17.7632 . PMC 41199 . PMID 7644468.
- Nohno T, Ishikawa T, Saito T, Hosokawa K, Noji S, Wolsing DH, Rosenbaum JS (1995). "Identificación de un receptor humano tipo II para la proteína morfogenética ósea-4 que forma complejos heteroméricos diferenciales con receptores de proteína morfogenética ósea tipo I". J. Biol. Chem . 270 (38): 22522–6. doi : 10.1074/jbc.270.38.22522 . PMID 7673243.
- Yamaji N, Celeste AJ, Thies RS, Song JJ, Bernier SM, Goltzman D, Lyons KM, Nove J, Rosen V, Wozney JM (1995). "Un receptor de serina/treonina quinasa de mamíferos se une específicamente a BMP-2 y BMP-4". Biochem. Biophys. Res. Commun . 205 (3): 1944–51. doi :10.1006/bbrc.1994.2898. PMID 7811286.
- Harris SE, Harris MA, Mahy P, Wozney J, Feng JQ, Mundy GR (1994). "Expresión de ARN mensajeros de proteínas morfogenéticas óseas por células de próstata y cáncer de próstata normales de ratas y humanos". Próstata . 24 (4): 204–11. doi :10.1002/pros.2990240406. PMID 8146069. S2CID 21276656.
- van den Wijngaard A, van Kraay M, van Zoelen EJ, Olijve W, Boersma CJ (1996). "Organización genómica del gen de la proteína 4 morfogenética del hueso humano: base molecular para múltiples transcripciones" (PDF) . Bioquímica. Biofísica. Res. Comunitario . 219 (3): 789–94. doi :10.1006/bbrc.1996.0312. hdl : 2066/23948 . PMID 8645259.
- Nishitoh H, Ichijo H, Kimura M, Matsumoto T, Makishima F, Yamaguchi A, Yamashita H, Enomoto S, Miyazono K (1996). "Identificación de receptores de serina/treonina quinasa de tipo I y tipo II para el factor de crecimiento/diferenciación-5". J. Biol. Chem . 271 (35): 21345–52. doi : 10.1074/jbc.271.35.21345 . PMID: 8702914.
- Bonaldo MF, Lennon G, Soares MB (1997). "Normalización y sustracción: dos enfoques para facilitar el descubrimiento de genes". Genome Res . 6 (9): 791–806. doi : 10.1101/gr.6.9.791 . PMID 8889548.
- Shore EM, Xu M, Shah PB, Janoff HB, Hahn GV, Deardorff MA, Sovinsky L, Spinner NB, Zasloff MA, Wozney JM, Kaplan FS (1998). "El gen de la proteína morfogenética ósea humana 4 (BMP-4): estructura molecular y regulación transcripcional". Calcif. Tissue Int . 63 (3): 221–9. doi :10.1007/s002239900518. PMID 9701626. S2CID 8339465.
- Tucker AS, Matthews KL, Sharpe PT (1998). "Transformación del tipo de diente inducida por inhibición de la señalización de BMP". Science . 282 (5391): 1136–8. Bibcode :1998Sci...282.1136T. doi :10.1126/science.282.5391.1136. PMID 9804553.
- Van den Wijngaard A, Pijpers MA, Joosten PH, Roelofs JM, Van zoelen EJ, Olijve W (1999). "Caracterización funcional de dos promotores en el gen de la proteína 4 morfogenética del hueso humano". J. Minero de huesos. Res . 14 (8): 1432–41. doi : 10.1359/jbmr.1999.14.8.1432 . PMID 10457277.
- Li W, LoTurco JJ (2000). "Noggin es un regulador negativo de la diferenciación neuronal en el neocórtex en desarrollo". Dev. Neurosci . 22 (1–2): 68–73. doi :10.1159/000017428. PMID 10657699. S2CID 35547875.
- Raatikainen-Ahokas A, Hytönen M, Tenhunen A, Sainio K, Sariola H (2000). "BMP-4 afecta la diferenciación del mesénquima metanéfrico y revela un eje anterior-posterior temprano del riñón embrionario". Dev. Dyn . 217 (2): 146–58. doi :10.1002/(SICI)1097-0177(200002)217:2<146::AID-DVDY2>3.0.CO;2-I. PMID 10706139. S2CID 11672134.
- van den Wijngaard A, Mulder WR, Dijkema R, Boersma CJ, Mosselman S, van Zoelen EJ, Olijve W (2000). "Los antiestrógenos regulan específicamente la actividad del promotor de la proteína 4 morfogenética ósea en células osteoblásticas humanas". Mol. Endocrinol . 14 (5): 623–33. doi : 10.1210/mend.14.5.0463 . PMID 10809227.
- Ying Y, Liu XM, Marble A, Lawson KA, Zhao GQ (2000). "Requerimiento de Bmp8b para la generación de células germinales primordiales en el ratón". Mol. Endocrinol . 14 (7): 1053–63. doi : 10.1210/mend.14.7.0479 . PMID 10894154.
- Nakade O, Takahashi K, Takuma T, Aoki T, Kaku T (2001). "Efecto del calcio extracelular en la expresión génica de la proteína morfogenética ósea 2 y 4 de células óseas humanas normales". J. Bone Miner. Metab . 19 (1): 13–9. doi :10.1007/s007740170055. PMID 11156467. S2CID 23873280.
- Hatta T, Konishi H, Katoh E, Natsume T, Ueno N, Kobayashi Y, Yamazaki T (2001). "Identificación del sitio de unión del ligando del receptor de tipo IA de BMP para BMP-4". Biopolymers . 55 (5): 399–406. doi :10.1002/1097-0282(2000)55:5<399::AID-BIP1014>3.0.CO;2-9. PMID 11241215.
- Aoki H, Fujii M, Imamura T, Yagi K, Takehara K, Kato M, Miyazono K (2001). "Efectos sinérgicos de diferentes receptores de proteína morfogenética ósea tipo I en la inducción de la fosfatasa alcalina". J. Cell Sci . 114 (Pt 8): 1483–9. doi :10.1242/jcs.114.8.1483. PMID 11282024.
- Kalinovsky A, Boukhtouche F, Blazeski R, Bornmann C, Suzuki N, Mason CA, Scheiffele P (2011). Polleux F (ed.). "Desarrollo de la especificidad axón-diana de las aferencias pontocerebelosas". PLOS Biology . 9 (2): e1001013. doi : 10.1371/journal.pbio.1001013 . PMC 3035609 . PMID 21346800.
- Cotsarelis G, Millar SE (julio de 2001). "Hacia una comprensión molecular de la pérdida del cabello y su tratamiento". Trends Mol Med . 7 (7): 293–301. doi :10.1016/S1471-4914(01)02027-5. PMID 11425637.
- Feijen A, Goumans MJ, van den Eijnden-van Raaij AJ (diciembre de 1994). "La expresión de subunidades de activina, receptores de activina y folistatina en embriones de ratón postimplantación sugiere funciones de desarrollo específicas para diferentes activinas". Desarrollo . 120 (12): 3621–37. doi :10.1242/dev.120.12.3621. PMID 7821227.
- Graham A, Francis-West P, Brickell P, Lumsden A (diciembre de 1994). "La molécula de señalización BMP4 media la apoptosis en la cresta neural rombencefálica". Nature . 372 (6507): 684–6. Bibcode :1994Natur.372..684G. doi :10.1038/372684a0. PMID 7990961. S2CID 4361935.
- Huelsken J, Vogel R, Erdmann B, Cotsarelis G, Birchmeier W (mayo de 2001). "La beta-catenina controla la morfogénesis del folículo piloso y la diferenciación de células madre en la piel". Cell . 105 (4): 533–45. doi : 10.1016/S0092-8674(01)00336-1 . PMID 11371349. S2CID 16775006.
- Kulessa H, Turk G, Hogan BL (diciembre de 2000). "La inhibición de la señalización de Bmp afecta el crecimiento y la diferenciación en el folículo piloso anágeno". EMBO J . 19 (24): 6664–74. doi :10.1093/emboj/19.24.6664. PMC 305899 . PMID 11118201.
- Leong LM, Brickell PM (diciembre de 1996). "Proteína morfogénica ósea 4". Int. J. Biochem. Cell Biol . 28 (12): 1293–6. doi :10.1016/S1357-2725(96)00075-1. PMID 9022288.
- Liem KF, Tremml G, Roelink H, Jessell TM (septiembre de 1995). "Diferenciación dorsal de células de la placa neural inducida por señales mediadas por BMP del ectodermo epidérmico". Cell . 82 (6): 969–79. doi : 10.1016/0092-8674(95)90276-7 . PMID 7553857. S2CID 17106597.
- Millar SE (febrero de 2002). "Mecanismos moleculares que regulan el desarrollo del folículo piloso". J. Invest. Dermatol . 118 (2): 216–25. doi : 10.1046/j.0022-202x.2001.01670.x . PMID 11841536.
- Pourquié O, Fan CM, Coltey M, Hirsinger E, Watanabe Y, Bréant C, Francis-West P, Brickell P, Tessier-Lavigne M, Le Douarin NM (febrero de 1996). "Señales laterales y axiales implicadas en la formación de patrones de somitas aviares: un papel para BMP4". Cell . 84 (3): 461–71. doi : 10.1016/S0092-8674(00)81291-X . PMID 8608600. S2CID 15824329.
- Wang EA, Israel DI, Kelly S, Luxenberg DP (1993). "La proteína morfogenética ósea 2 provoca compromiso y diferenciación en células C3H10T1/2 y 3T3". Factores de crecimiento . 9 (1): 57–71. doi :10.3109/08977199308991582. PMID 8347351.
- Winnier G, Blessing M, Labosky PA, Hogan BL (septiembre de 1995). "La proteína morfogenética ósea 4 es necesaria para la formación y el patrón del mesodermo en el ratón". Genes Dev . 9 (17): 2105–16. doi : 10.1101/gad.9.17.2105 . PMID 7657163.
Enlaces externos
- BMPedia - Wiki de proteínas morfogenéticas óseas [ enlace muerto permanente ]
- Ubicación del gen humano BMP4 en el navegador del genoma de la UCSC .
- Detalles del gen humano BMP4 en el navegador del genoma de la UCSC .




