Bioequivalencia
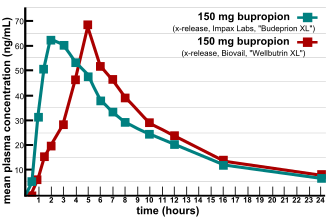
La bioequivalencia es un término farmacocinético que se utiliza para evaluar la equivalencia biológica in vivo esperada de dos preparaciones patentadas de un fármaco. Si se dice que dos productos son bioequivalentes, significa que se esperaría que fueran, a todos los efectos, iguales.
Un artículo definió la bioequivalencia al afirmar que "dos productos farmacéuticos son bioequivalentes si son farmacéuticamente equivalentes y sus biodisponibilidades (velocidad y grado de disponibilidad) después de la administración en la misma dosis molar son similares a tal grado que se puede esperar que sus efectos, con respecto tanto a la eficacia como a la seguridad, sean esencialmente los mismos. La equivalencia farmacéutica implica la misma cantidad de la misma sustancia activa, en la misma forma de dosificación, para la misma vía de administración y cumpliendo con los mismos estándares o estándares comparables". [1]
Para la Organización Mundial de la Salud (OMS) "dos productos farmacéuticos son bioequivalentes si son farmacéuticamente equivalentes o alternativas farmacéuticas, y sus biodisponibilidades, en términos de velocidad (Cmax y tmax) y grado de absorción (área bajo la curva), después de la administración de la misma dosis molar bajo las mismas condiciones, son similares a tal grado que se puede esperar que sus efectos sean esencialmente los mismos". [2]
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha definido la bioequivalencia como "la ausencia de una diferencia significativa en la velocidad y el grado en que el ingrediente activo o la fracción activa en equivalentes farmacéuticos o alternativas farmacéuticas se vuelve disponible en el sitio de acción del fármaco cuando se administra en la misma dosis molar bajo condiciones similares en un estudio diseñado apropiadamente". [3]
Bioequivalencia
Para determinar la bioequivalencia entre dos productos, como un producto de marca disponible comercialmente y un producto genérico que podría comercializarse , se realizan estudios farmacocinéticos mediante los cuales cada una de las preparaciones se administra en un estudio cruzado a sujetos voluntarios, generalmente individuos sanos pero ocasionalmente en pacientes. Se obtienen muestras de suero/plasma a intervalos regulares y se analizan para determinar la concentración del fármaco original (u ocasionalmente del metabolito ). Ocasionalmente, los niveles de concentración en sangre no son factibles ni posibles para comparar los dos productos (por ejemplo, corticosteroides inhalados ), entonces se utilizan los puntos finales farmacodinámicos en lugar de los puntos finales farmacocinéticos (ver a continuación) para la comparación. Para una comparación farmacocinética, los datos de concentración plasmática se utilizan para evaluar parámetros farmacocinéticos clave como el área bajo la curva (AUC), la concentración máxima ( Cmax ), el tiempo hasta la concentración máxima ( tmax ) y el tiempo de retraso de absorción ( tlag ). Las pruebas deben realizarse en varias dosis diferentes, especialmente cuando el fármaco muestra una farmacocinética no lineal.
Además de los datos de los estudios de bioequivalencia, es posible que sea necesario presentar otros datos para cumplir con los requisitos reglamentarios de bioequivalencia. Dichas pruebas pueden incluir:
- Validación de métodos analíticos
- Estudios de correlación in vitro-in vivo ( IVIVC )
Definición reglamentaria
La Organización Mundial de la Salud
La Organización Mundial de la Salud considera que dos formulaciones son bioequivalentes si el intervalo de confianza del 90 % para la relación producto multifuente (genérico)/comparador se encuentra dentro del rango de aceptación del 80,00 al 125,00 % para el AUC 0–t y la Cmax . Para productos farmacéuticos terminados con alta variabilidad, el rango de aceptación aplicable para la Cmax se puede ampliar (hasta el 69,84 al 143,19 %). [4]
Australia
En Australia , la Administración de Productos Terapéuticos (TGA) considera que las preparaciones son bioequivalentes si los intervalos de confianza del 90 % (IC del 90 %) de las razones de velocidad, entre las dos preparaciones, de Cmax y AUC se encuentran en el rango de 0,80 a 1,25. El Tmax también debe ser similar entre los productos. [1]
Existen requisitos más estrictos para los medicamentos con un índice terapéutico estrecho y/o metabolismo saturable; por lo tanto, no existen productos genéricos en el mercado australiano para la digoxina o la fenitoína , por ejemplo.
Europa
Según la normativa aplicable en el Espacio Económico Europeo [5], dos medicamentos son bioequivalentes si son farmacéuticamente equivalentes o alternativas farmacéuticas y si sus biodisponibilidades tras la administración en la misma dosis molar son similares en tal grado que sus efectos, tanto en lo que respecta a la eficacia como a la seguridad, serán esencialmente los mismos. Esto se considera demostrado si los intervalos de confianza del 90% (IC del 90%) de los cocientes de AUC 0–t y Cmax entre las dos preparaciones se encuentran en el rango 80–125%.
Estados Unidos
La FDA considera que dos productos son bioequivalentes si el IC del 90% de la media relativa Cmax , AUC (0–t) y AUC (0–∞) de la prueba (por ejemplo, la formulación genérica) con respecto a la referencia (por ejemplo, la formulación de marca innovadora) debe estar dentro del 80% al 125% en ayunas. Aunque hay algunas excepciones, generalmente una comparación bioequivalente de las formulaciones de prueba con las de referencia también requiere la administración después de una comida apropiada en un momento específico antes de tomar el medicamento, un estudio denominado "con alimentos" o "efecto de los alimentos". Un estudio de efecto de los alimentos requiere la misma evaluación estadística que el estudio en ayunas, descrito anteriormente. [3]
Porcelana

En China no existían requisitos de bioequivalencia para los medicamentos genéricos hasta la publicación de la Opinión sobre la realización de una evaluación coherente de la calidad y eficacia de los medicamentos genéricos (关于开展仿制药质量和疗效一致性评价的意见) de 2016, que estableció las normas básicas para el trabajo futuro de bioequivalencia. Desde julio de 2020, todos los medicamentos genéricos recientemente aprobados deben pasar controles de bioequivalencia; los medicamentos anteriores pueden solicitar ser controlados. Desde 2019, la Contratación Centralizada Nacional Basada en Volumen utiliza "pasar la evaluación de consistencia de los medicamentos genéricos" como uno de los criterios de licitación. [7]
La definición china de "bioequivalencia" implica que la media geométrica Cmax , AUC (0–t) y AUC (0–∞) del fármaco de prueba caiga en el 80%–125% del fármaco de referencia tanto en ayunas como en estado de alimentación. El fármaco de referencia debe ser preferiblemente el fármaco de marca original, luego (si no está disponible) un genérico reconocido internacionalmente aprobado por un país desarrollado, luego (si aún no está disponible) un genérico reconocido internacionalmente aprobado a nivel nacional; esto es para evitar la desviación del fármaco original por el uso en serie de genéricos como referencia. Si los valores farmacocinéticos como Cmax no se aplican al tipo de fármaco (por ejemplo, si el fármaco no se absorbe por vía oral), se pueden hacer comparaciones utilizando otros medios como curvas dosis-respuesta . [7]
Según Wei et al. (2022), la Política de Evaluación de la Consistencia aumentó el gasto en I+D de las empresas farmacéuticas chinas, especialmente entre las privadas y de alto rendimiento. [8] Liu et al. (2023) sostiene que la Política aumentó la calidad de la innovación de la industria farmacéutica china. [9]
Cuestiones de bioequivalencia
Aunque la FDA mantiene que los medicamentos genéricos aprobados son equivalentes a sus contrapartes de marca, los médicos y los pacientes han informado de problemas de bioequivalencia con muchos medicamentos. [10] Se sospecha que ciertas clases de medicamentos son particularmente problemáticas debido a su composición química. Algunos de ellos incluyen medicamentos quirales , medicamentos de mala absorción y medicamentos citotóxicos. Además, los mecanismos de administración complejos pueden causar variaciones de bioequivalencia. [10] Se advierte a los médicos que eviten cambiar a los pacientes de medicamentos de marca a genéricos, o entre diferentes fabricantes de genéricos, cuando prescriban medicamentos antiepilépticos, warfarina y levotiroxina . [11]
Se plantearon importantes problemas en la verificación de la bioequivalencia cuando se descubrió que varias versiones genéricas de medicamentos genéricos aprobados por la FDA no eran equivalentes en cuanto a eficacia y perfiles de efectos secundarios. [12] En 2007, dos proveedores de información al consumidor sobre productos y suplementos nutricionales, ConsumerLab.com y The People's Pharmacy, publicaron los resultados de pruebas comparativas de diferentes marcas de bupropión. [13] The People's Pharmacy recibió múltiples informes de aumento de los efectos secundarios y disminución de la eficacia del bupropión genérico, lo que la impulsó a solicitar a ConsumerLab.com que probara los productos en cuestión. Las pruebas mostraron que algunas versiones genéricas de Wellbutrin XL 300 mg no funcionaron igual que la píldora de marca en las pruebas de laboratorio. [14] La FDA investigó estas quejas y concluyó que la versión genérica es equivalente a Wellbutrin XL en lo que respecta a la biodisponibilidad del bupropión y su principal metabolito activo, el hidroxibupropión. La FDA también afirmó que la variación natural coincidente del estado de ánimo es la explicación más probable del aparente empeoramiento de la depresión después del cambio de Wellbutrin XL a Budeprion XL. [15] Después de varios años de negar los informes de los pacientes, en 2012 la FDA revocó esta opinión, anunciando que "Budeprion XL 300 mg no demuestra equivalencia terapéutica con Wellbutrin XL 300 mg". [16] La FDA no probó la bioequivalencia de ninguna de las otras versiones genéricas de Wellbutrin XL 300 mg, pero solicitó que los cuatro fabricantes presentaran datos sobre esta cuestión a la FDA antes de marzo de 2013. A partir de octubre de 2013, la FDA ha tomado decisiones sobre las formulaciones de algunos fabricantes que no son bioequivalentes. [17]
En 2004, se descubrió que Ranbaxy había falsificado datos sobre los medicamentos genéricos que fabricaba. Como resultado, 30 productos fueron retirados del mercado estadounidense y Ranbaxy pagó 500 millones de dólares en multas. La FDA investigó a muchos fabricantes de medicamentos indios después de que se descubriera esto y, como resultado, al menos 12 empresas han sido prohibidas de enviar medicamentos a los EE. UU. [11]
En 2017, la Agencia Europea de Medicamentos recomendó la suspensión de una serie de medicamentos aprobados a nivel nacional para los cuales Micro Therapeutic Research Labs realizó estudios de bioequivalencia en la India, debido a que las inspecciones identificaron tergiversaciones de los datos del estudio y deficiencias en la documentación y el manejo de los datos. [18]
Véase también
Referencias
- ^ ab Birkett DJ (1 de agosto de 2003). "Medicamentos genéricos: ¿iguales o no?". Australian Prescriber . 26 (4): 85–87. doi : 10.18773/austprescr.2003.063 .
- ^ Guía de la OMS para organizaciones que realizan estudios de bioequivalencia in vivo (PDF) . Serie de informes técnicos de la OMS n.º 996, Anexo 9 (Informe). Organización Mundial de la Salud. 2016.
- ^ ab Centro de Evaluación e Investigación de Medicamentos (2003). "Guía para la industria: estudios de biodisponibilidad y bioequivalencia para productos farmacéuticos administrados por vía oral: consideraciones generales" (PDF) . Administración de Alimentos y Medicamentos de los Estados Unidos.
- ^ Directrices de la OMS sobre productos farmacéuticos multifuente (genéricos): directrices sobre los requisitos de registro para establecer la intercambiabilidad Serie de Informes Técnicos de la OMS, núm. 1003, 2017, Anexo 6
- ^ Comité de Medicamentos de Uso Humano (20 de enero de 2010). «Directrices sobre la investigación de la bioequivalencia» (PDF) . Agencia Europea de Medicamentos . Consultado el 21 de abril de 2011 .
- ^ 总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号) [Anuncio de la Administración General sobre asuntos relacionados con la Evaluación de Consistencia de la Calidad y Eficacia de Medicamentos Genéricos (N° 100 de 2017)]. nmpa.gov.cn. Consultado el 18 de septiembre de 2024 .
- ^ ab 苏华; 郭瑞臣 (2022). 仿制药一致性评价的背景、实施及结局 [Antecedentes, implementación y resultados de la evaluación de la coherencia de los medicamentos genéricos].中国医院药学杂志 [Revista China de Farmacia Hospitalaria] . 42 (14). doi :10.13286/j.1001-5213.2022.14.21.
- ^ Wei, Y; Zhu, J; Qiao, J; Zhang, D; Chen, Y; Suchecki, S (2022). "El impacto de la política de evaluación de la consistencia de los medicamentos genéricos en la intensidad de la inversión en I+D de las empresas farmacéuticas: un estudio empírico basado en el modelo de diferencias en diferencias". Frontiers in Public Health . 10 : 902025. doi : 10.3389/fpubh.2022.902025 . PMC 9218526 . PMID 35757628.
- ^ Liu, Q; Huang, Z; Mao, Z (2023). "¿La política de evaluación de la consistencia de los medicamentos genéricos ha promovido la calidad de la innovación en la industria farmacéutica china? Un estudio empírico basado en el modelo de diferencias en diferencias". Frontiers in Public Health . 11 : 1265756. doi : 10.3389/fpubh.2023.1265756 . PMC 10722264 . PMID 38106910.
- ^ ab Midha KK, McKay G (diciembre de 2009). "Bioequivalencia; su historia, práctica y futuro". The AAPS Journal . 11 (4): 664–70. doi :10.1208/s12248-009-9142-z. PMC 2782076 . PMID 19806461.
- ^ ab Bate R, Mathur A, Lever HM, Thakur D, Graedon J, Cooperman T, et al. (marzo de 2016). "Sustitución de medicamentos genéricos, estándares de bioequivalencia y supervisión internacional: problemas complejos que enfrenta la FDA". Tendencias en ciencias farmacológicas . 37 (3): 184–191. doi :10.1016/j.tips.2015.11.005. PMID 26687297.
- ^ http://www.raps.org/focus-online/news/news-article-view/article/3794/ [ enlace muerto permanente ]
- ^ "Se cuestiona la igualdad de los medicamentos genéricos". Archivado desde el original el 20 de octubre de 2012. Consultado el 13 de octubre de 2007 .
- ^ Stenson J (12 de octubre de 2007). "Informe cuestiona los antidepresivos genéricos". NBC News . Archivado desde el original el 11 de octubre de 2013. Consultado el 13 de octubre de 2007 .
- ^ "Revisión de equivalencia terapéutica: bupropión XL genérico 300 mg y Wellbutrin XL 300 mg". Administración de Alimentos y Medicamentos . Archivado desde el original el 6 de junio de 2011. Consultado el 19 de abril de 2008 .
- ^ "Budeprion XL 300 mg no es terapéuticamente equivalente a Wellbutrin XL 300 mg" (Comunicado de prensa). FDA. 3 de octubre de 2012. Consultado el 23 de marzo de 2013 .
- ^ "Actualización de la FDA". FDA. Octubre de 2013. Consultado el 15 de junio de 2015 .
- ^ "EMA recomienda la suspensión de medicamentos debido a estudios poco fiables de Micro Therapeutic Research Labs". Agencia Europea de Medicamentos . 24 de marzo de 2017 . Consultado el 17 de noviembre de 2020 .
Enlaces externos
- Hussain AS, et al. El sistema de clasificación de productos biofarmacéuticos: aspectos destacados del borrador de orientación de la FDA, Oficina de Ciencias Farmacéuticas, Centro de Evaluación e Investigación de Medicamentos, Administración de Alimentos y Medicamentos.
- Mills D (2005). Las agencias reguladoras no exigen que los ensayos clínicos sean costosos Asociación Biofarmacéutica Internacional: Publicaciones de la IBPA.
- Oficina de Medicamentos Genéricos de la FDA (CDER): más información estadounidense sobre pruebas de bioequivalencia y medicamentos genéricos
- Propuesta de exención de los requisitos de bioequivalencia in vivo para las formas farmacéuticas sólidas orales de liberación inmediata de la Lista Modelo de Medicamentos Esenciales de la OMS. Serie de Informes Técnicos de la OMS, Nº 937, 2006, Anexo 8.
- Guía para organizaciones que realizan estudios de bioequivalencia in vivo (revisión). Serie de informes técnicos 996 de la OMS, 2016, Anexo 9.
- Notas generales y lista de productos farmacéuticos de referencia internacional. Serie de informes técnicos de la OMS 1003, 2017, Anexo 5.
- Lista de productos de comparación internacional de la OMS (septiembre de 2016)