Hipoxia (ambiental)

| Parte de una serie sobre |
| Contaminación |
|---|
 |
La hipoxia ( hipo : "por debajo", oxia : "oxigenado") se refiere a condiciones de bajo nivel de oxígeno . Para los organismos que respiran aire , la hipoxia es problemática, pero para muchos organismos anaeróbicos , la hipoxia es esencial. La hipoxia se aplica a muchas situaciones, pero generalmente se refiere a la atmósfera y las aguas naturales. [3]
Hipoxia atmosférica
La hipoxia atmosférica se produce de forma natural a grandes altitudes . La presión atmosférica total disminuye a medida que aumenta la altitud, lo que provoca una menor presión parcial de oxígeno, que se define como hipoxia hipobárica . El oxígeno permanece en el 20,9% de la mezcla total de gases, a diferencia de la hipoxia hipóxica , donde el porcentaje de oxígeno en el aire (o sangre) disminuye. Esto es común en las madrigueras selladas de algunos animales subterráneos, como los blesmoles . [4] La hipoxia atmosférica también es la base del entrenamiento en altura , que es una parte estándar del entrenamiento para los atletas de élite. Varias empresas imitan la hipoxia utilizando una atmósfera artificial normobárica .
Hipoxia acuática
Un sistema acuático que carece de oxígeno disuelto (0% de saturación) se denomina anaeróbico, reductor o anóxico .
En el agua, los niveles de oxígeno son de aproximadamente 7 ppm o 0,0007 % en agua de buena calidad, pero fluctúan. [5] Muchos organismos requieren condiciones hipóxicas. El oxígeno es venenoso para las bacterias anaeróbicas , por ejemplo. [3]
El agotamiento del oxígeno se expresa típicamente como un porcentaje del oxígeno que se disolvería en el agua a la temperatura y salinidad predominantes. Un sistema con baja concentración, en el rango entre 1 y 30% de saturación, se llama hipóxico o disóxico . La mayoría de los peces no pueden vivir por debajo del 30% de saturación ya que dependen del oxígeno para obtener energía de sus nutrientes. La hipoxia conduce a una reproducción deficiente de los peces restantes a través de la alteración endocrina . [6] Un ambiente acuático "saludable" rara vez debería experimentar menos del 80% de saturación. La zona exaeróbica se encuentra en el límite de las zonas anóxica e hipóxica.
La hipoxia puede ocurrir en toda la columna de agua y también a grandes altitudes, así como cerca de los sedimentos del fondo. Por lo general, se extiende a lo largo del 20-50% de la columna de agua, pero depende de la profundidad del agua y la ubicación de las picnoclinas (cambios rápidos en la densidad del agua con la profundidad). Puede ocurrir en el 10-80% de la columna de agua. Por ejemplo, en una columna de agua de 10 metros, puede alcanzar hasta 2 metros por debajo de la superficie. En una columna de agua de 20 metros, puede extenderse hasta 8 metros por debajo de la superficie. [7]
Matanza estacional
La disminución del oxígeno hipolimnético puede provocar "muertes" tanto en verano como en invierno. Durante la estratificación estival , los aportes de materia orgánica y la sedimentación de los productores primarios pueden aumentar las tasas de respiración en el hipolimnion . Si la disminución del oxígeno se vuelve extrema, los organismos aeróbicos, como los peces, pueden morir, lo que da lugar a lo que se conoce como "muerte de verano". [8] Los mismos fenómenos pueden ocurrir en invierno, pero por diferentes razones. Durante el invierno, la capa de hielo y nieve puede atenuar la luz y, por lo tanto, reducir las tasas de fotosíntesis. La congelación de un lago también impide las interacciones aire-agua que permiten el intercambio de oxígeno. Esto crea una falta de oxígeno mientras continúa la respiración. Cuando el oxígeno se agota gravemente, los organismos anaeróbicos pueden morir, lo que da lugar a una "muerte invernal". [8]
Causas de la hipoxia

El agotamiento del oxígeno puede ser resultado de una serie de factores naturales, pero la mayoría de las veces es una preocupación como consecuencia de la contaminación y la eutrofización en las que los nutrientes de las plantas ingresan a un río, lago u océano, y se fomentan las floraciones de fitoplancton . Si bien el fitoplancton, a través de la fotosíntesis , aumentará la saturación de OD durante las horas del día, la densa población de una floración reduce la saturación de OD durante la noche mediante la respiración . Cuando las células de fitoplancton mueren, se hunden hacia el fondo y son descompuestas por bacterias , un proceso que reduce aún más el OD en la columna de agua. Si el agotamiento del oxígeno progresa a hipoxia, pueden ocurrir muertes de peces y también pueden morir invertebrados como gusanos y almejas en el fondo.

La hipoxia también puede ocurrir en ausencia de contaminantes. En los estuarios, por ejemplo, debido a que el agua dulce que fluye desde un río hacia el mar es menos densa que el agua salada, puede producirse una estratificación en la columna de agua. Por lo tanto, se reduce la mezcla vertical entre los cuerpos de agua, lo que restringe el suministro de oxígeno de las aguas superficiales a las aguas inferiores más salinas. La concentración de oxígeno en la capa inferior puede entonces llegar a ser lo suficientemente baja como para que se produzca hipoxia. Las áreas particularmente propensas a esto incluyen aguas poco profundas de cuerpos de agua semicerrados como el Waddenzee o el Golfo de México , donde la escorrentía terrestre es sustancial. En estas áreas se puede crear una llamada " zona muerta ". Las condiciones de bajo oxígeno disuelto suelen ser estacionales, como es el caso del canal Hood y áreas de Puget Sound , en el estado de Washington. [9] El Instituto de Recursos Mundiales ha identificado 375 zonas costeras hipóxicas en todo el mundo, concentradas en áreas costeras de Europa occidental, las costas oriental y meridional de los EE. UU. y el este de Asia, particularmente en Japón. [10]

La hipoxia también puede ser la explicación de fenómenos periódicos como el jubileo de la bahía de Mobile , donde la vida acuática se precipita repentinamente hacia las aguas poco profundas, tal vez tratando de escapar de las aguas sin oxígeno. Las recientes y generalizadas muertes de mariscos cerca de las costas de Oregón y Washington también se atribuyen a la ecología de zona muerta cíclica . [11]
Descomposición del fitoplancton
El fitoplancton está compuesto principalmente de lignina y celulosa, que se descomponen por mecanismos oxidativos, que consumen oxígeno. [12]
Factores ambientales
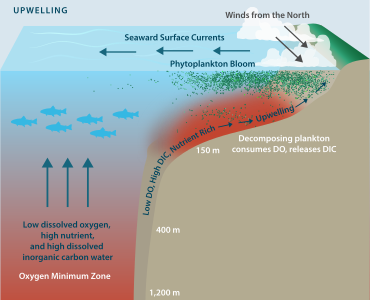
La descomposición del fitoplancton en el medio ambiente depende de la presencia de oxígeno y, una vez que ya no hay oxígeno en los cuerpos de agua, las ligninoperoxidasas no pueden seguir descomponiendo la lignina. Cuando no hay oxígeno en el agua, el tiempo necesario para la descomposición del fitoplancton pasa de 10,7 días a un total de 160 días.
La tasa de descomposición del fitoplancton se puede representar mediante esta ecuación:
En esta ecuación, G(t) es la cantidad total de carbono orgánico particulado (COP) en un momento dado, t. G(0) es la concentración de COP antes de que se produzca la descomposición. k es una constante de velocidad en años-1 y t es el tiempo en años. Para la mayoría del COP del fitoplancton, el k es de alrededor de 12,8 años-1, o unos 28 días para que se descomponga casi el 96% del carbono en estos sistemas. Mientras que para los sistemas anóxicos, la descomposición del COP tarda 125 días, más de cuatro veces más. [15] Se necesitan aproximadamente 1 mg de oxígeno para descomponer 1 mg de COP en el medio ambiente y, por lo tanto, la hipoxia se produce rápidamente ya que el oxígeno se utiliza rápidamente para digerir el COP. Aproximadamente el 9% del COP del fitoplancton se puede descomponer en un solo día a 18 °C. Por lo tanto, se necesitan unos once días para descomponer completamente el fitoplancton. [16]
Una vez descompuesto el POC, este material particulado puede convertirse en otro carbono disuelto, como dióxido de carbono, iones de bicarbonato y carbonato. Hasta un 30% del fitoplancton puede descomponerse en carbono disuelto. Cuando este carbono orgánico particulado interactúa con la luz ultravioleta de 350 nm, se forma carbono inorgánico disuelto, lo que elimina aún más oxígeno del medio ambiente en forma de dióxido de carbono, iones de bicarbonato y carbonato. El carbono inorgánico disuelto se produce a una velocidad de 2,3 a 6,5 mg/(m 3 ⋅día). [17]
A medida que el fitoplancton se descompone, el fósforo y el nitrógeno libres quedan disponibles en el medio ambiente, lo que también fomenta las condiciones hipóxicas. A medida que se produce la descomposición de este fitoplancton, más fósforo se convierte en fosfatos y nitrógeno en nitratos. Esto agota aún más el oxígeno en el medio ambiente, creando aún más zonas hipóxicas en mayores cantidades. A medida que más minerales como el fósforo y el nitrógeno se desplazan hacia estos sistemas acuáticos, el crecimiento del fitoplancton aumenta considerablemente y, después de su muerte, se forman zonas hipóxicas. [18]
Véase también
- Floraciones de algas
- Evento anóxico
- Zona muerta (ecología)
- Floración de cianobacterias
- Desnitrificación
- Eutrofización
- Hipoxia en los peces
- Zona mínima de oxígeno
Referencias
- ^ Breitburg, D., Levin, LA, Oschlies, A., Gregoire, M., Chavez, FP y Conley, DJ (2018) "Disminución del oxígeno en los océanos y aguas costeras del mundo". Science , 359 : eaam7240. doi :10.1126/science.aam7240.
- ^ Benway, HM, Lorenzoni, L., White, AE, Fiedler, B., Levine, NM, Nicholson, DP, DeGrandpre, MD, Sosik, HM, Church, MJ, O'Brien, TD y Leinen, M. (2019) "Observaciones de series temporales oceánicas de ecosistemas marinos cambiantes: una era de integración, síntesis y aplicaciones sociales", Frontiers in Marine Science , 6 (393). doi :10.3389/fmars.2019.00393.
- ^ ab Diaz, Robert J.; Rosenberg, Rutger (2008). "Zonas muertas en expansión y consecuencias para los ecosistemas marinos". Science . 321 (5891): 926–929. Bibcode :2008Sci...321..926D. doi :10.1126/science.1156401. PMID 18703733. S2CID 32818786.
- ^ Roper, TJ; et al. (2001). "Condiciones ambientales en madrigueras de dos especies de rata topo africana, Georychus capensis y Cryptomys damarensis ". Revista de Zoología . 254 (1): 101–07. doi :10.1017/S0952836901000590.
- ^ "Oxígeno disuelto". Calidad del agua . El agua en la Web. Archivado desde el original el 13 de diciembre de 2012 . Consultado el 21 de diciembre de 2012 .
- ^ Wu, R. et al. 2003. La hipoxia acuática es un disruptor endocrino y perjudica la reproducción de los peces
- ^ Rabalais, Nancy; Turner, R. Eugene; Justic´, Dubravko; Dortch, Quay; Wiseman, William J. Jr. Caracterización de la hipoxia: Informe del tema 1 para la evaluación integrada de la hipoxia en el Golfo de México. Cap. 3. Programa de océanos costeros de la NOAA, Serie de análisis de decisiones n.º 15. Mayo de 1999. < http://oceanservice.noaa.gov/products/hypox_t1final.pdf >. Consultado el 11 de febrero de 2009.
- ^ ab Wetzel, RG (2001). Limnología: ecosistemas lacustres y fluviales . San Diego: Academic Press.
- ^ Enciclopedia de Puget Sound: Hipoxia http://www.eopugetsound.org/science-review/section-4-dissolved-oxygen-hypoxia
- ^ Selman, Mindy (2007) Eutrofización: una visión general del estado, las tendencias, las políticas y las estrategias. Instituto de Recursos Mundiales.
- ^ oregonstate.edu Archivado el 1 de septiembre de 2006 en Wayback Machine – Zona muerta que provoca una ola de muerte en la costa de Oregón (9/8/2006)
- ^ Gubernatorova, TN; Dolgonosov, BM (1 de mayo de 2010). "Modelado de la biodegradación de materia orgánica multicomponente en un entorno acuático: 3. Análisis de los mecanismos de degradación de la lignina". Recursos hídricos . 37 (3): 332–346. Bibcode :2010WRes...37..332G. doi :10.1134/S0097807810030085. ISSN 0097-8078. S2CID 98068128.
- ^ Chan, F., Barth, JA, Kroeker, KJ, Lubchenco, J. y Menge, BA (2019) "La dinámica y el impacto de la acidificación de los océanos y la hipoxia". Oceanografía , 32 (3): 62–71. doi :10.5670/oceanog.2019.312.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional.
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional. - ^ Gewin, V. (2010) "Oceanografía: muerta en el agua". Nature , 466 (7308): 812. doi :10.1038/466812a.
- ^ Harvey, H. Rodger (1995). "Cinética de la descomposición del fitoplancton durante la sedimentación simulada: cambios en la composición bioquímica y la actividad microbiana en condiciones óxicas y anóxicas". Geochimica et Cosmochimica Acta . 59 (16): 3367–77. Bibcode :1995GeCoA..59.3367H. doi :10.1016/0016-7037(95)00217-n.
- ^ Jewell, William J. (1971). "Descomposición de malezas acuáticas: utilización de oxígeno disuelto y regeneración de nitrógeno y fósforo". Revista . 43 (7). Water Pollution Control Federation: 1457–67. PMID 5568364.
- ^ Johannessen, Sophia C.; Peña, M. Angelica; Quenneville, Melanie L. (2007). "Producción fotoquímica de dióxido de carbono durante una floración de fitoplancton costero". Ciencia de estuarios, costas y plataformas . 73 (1–2): 236–42. Bibcode :2007ECSS...73..236J. doi :10.1016/j.ecss.2007.01.006.
- ^ Conley, Daniel J.; Paerl, Hans W.; Howarth, Robert W.; Boesch, Donald F.; Seitzinger, Sybil P .; Havens, Karl E.; Lancelot, Christiane; Likens, Gene E. (20 de febrero de 2009). "Control de la eutrofización: nitrógeno y fósforo". Science . 323 (5917): 1014–15. doi :10.1126/science.1167755. ISSN 0036-8075. PMID 19229022. S2CID 28502866.
Fuentes
- Kils, U., U. Waller y P. Fischer (1989). "La mortandad de peces en otoño de 1988 en la bahía de Kiel". Consejo Internacional para la Exploración del Mar. CM 1989/L:14.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - Fischer P.; U. Kils (1990). " Investigaciones in situ sobre la respiración y el comportamiento del pez espinoso Gasterosteus aculeatus y del pez zoaraes viviparus durante situaciones de estrés por falta de oxígeno". Consejo Internacional para la Exploración del Mar. CM 1990/F:23.
- Fischer P.; K. Rademacher; U. Kils (1992). "Investigaciones in situ sobre la respiración y el comportamiento de la anguila Zoarces viviparus en condiciones de hipoxia a corto plazo". Mar Ecol Prog Ser . 88 : 181–84. Bibcode :1992MEPS...88..181F. doi : 10.3354/meps088181 .
Enlaces externos
- Hipoxia en el Golfo de México
- Evaluación científica de la hipoxia en las aguas costeras de Estados Unidos Consejo de Calidad Ambiental
- Zona muerta frente a Atlantic City
- Hipoxia en las aguas de Oregón


