Amidina
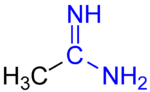
Las amidinas son compuestos orgánicos con el grupo funcional RC(NR)NR 2 , donde los grupos R pueden ser iguales o diferentes. Son los derivados imínicos de las amidas (RC(O)NR 2 ). La amidina más simple es la formamidina, HC(=NH)NH 2 .
Los ejemplos de amidinas incluyen:
Preparación
Una ruta común para obtener amidinas primarias es la reacción de Pinner . La reacción del nitrilo con alcohol en presencia de ácido da un iminoéter . El tratamiento del compuesto resultante con amoníaco completa la conversión a amidina. [1] En lugar de utilizar un ácido de Bronsted , los ácidos de Lewis como el tricloruro de aluminio promueven la aminación directa de nitrilos , [2] o, en ciertos casos excepcionales, de amidas . [3] El acetal de dimetilformamida reacciona con aminas primarias para dar amidinas: [4]
- Me 2 NC (H) (OMe) 2 + RNH 2 → Me 2 NC = NHR + 2 MeOH
Tampoco se requiere catálisis para la aminación directa de un cloruro de imidoilo . [5]
Las amidinas también se preparan mediante la adición de reactivos de organolitio a las diiminas , seguida de protonación o alquilación .
Química ácido-base
Las amidinas son mucho más básicas que las amidas y se encuentran entre las bases no cargadas/ionizadas más fuertes. [6] [7]
La protonación se produce en el nitrógeno hibridado sp2 . Esto ocurre porque la carga positiva puede deslocalizarse en ambos átomos de nitrógeno. La especie catiónica resultante se conoce como ion amidinio [8] y posee longitudes de enlace CN idénticas.

Aplicaciones
Varios fármacos o candidatos a fármacos presentan sustituyentes amidina. Entre los ejemplos se incluyen el antiprotozoario Imidocarb , el insecticida amitraz , el antihelmíntico tribendimidina y la xilamidina , un antagonista del receptor 5HT2A. [9]
El formamidinio (ver más abajo) puede reaccionar con un haluro metálico para formar el material semiconductor que absorbe la luz en las células solares de perovskita . Los cationes o haluros de formamidinio (FA) pueden reemplazar parcial o totalmente a los haluros de metilamonio en la formación de capas absorbentes de perovskita en dispositivos fotovoltaicos .
Nomenclatura
Formalmente, las amidinas son una clase de oxoácidos . El oxoácido del que se deriva una amidina debe ser de la forma R n E(=O)OH, donde R es un sustituyente . El grupo −OH se reemplaza por un grupo −NH 2 y el grupo =O se reemplaza por = N R , dando a las amidinas la estructura general R n E(=NR)NR 2 . [10] [11] [12] Cuando el oxoácido original es un ácido carboxílico , la amidina resultante es una carboxamidina o carboximidamida ( nombre IUPAC ). Las carboxamidinas se denominan con frecuencia simplemente amidinas, ya que son el tipo de amidina más comúnmente encontrado en la química orgánica .
Derivados
Cationes de formamidinio

Una subclase notable de iones amidinio son los cationes formamidinio , que pueden representarse mediante la fórmula química [R
2N−CH=NR
2]+
La desprotonación de estos produce carbenos estables que pueden representarse mediante la fórmula química R
2N−C:−NR
2. [13] [14]
Sales de amidinato

Una sal de amidinato tiene la estructura general M + [RNRCNR] − y se puede acceder a ella mediante la reacción de una carbodiimida con un compuesto organometálico como el metil litio . [16] Se utilizan ampliamente como ligandos en complejos organometálicos.
Véase también
- Guanidinas : un grupo similar de compuestos donde el átomo de carbono central está unido a tres átomos de nitrógeno.
- Las imidazolinas contienen una amidina cíclica.
Referencias
- ^ AW Dox (1928). "Clorhidrato de acetamidina". Síntesis orgánicas . 8 : 1. doi :10.15227/orgsyn.008.0001.
- ^ " N -Fenilbenzamidina". Síntesis orgánicas . 36 : 64. 1956. doi :10.15227/orgsyn.036.0064.
- ^ Taber, Douglass F. (1 de diciembre de 2008). "La síntesis de Takayama de (-)-cernuina". Aspectos destacados de la química orgánica .
- ^ Daniel A. Dickman; Michael Boes; Albert I. Meyers (1989). "(S)-N,N-Dimetil-N'-(1-terc-Butoxi-3-Metil-2-Butil)formamidina". Síntesis orgánicas . 67 : 52. doi :10.15227/orgsyn.067.0052.
- ^ Arthur C. Hontz, CE Wagner (1951). "N, N-difenilbenzamidina". Síntesis orgánicas . 31 : 48. doi : 10.15227/orgsyn.031.0048.
- ^ Roche VF. Mejorar la comprensión y la retención a largo plazo de la química ácido-base por parte de los estudiantes de farmacia. American Journal of Pharmaceutical Education. 2007;71(6):122.
- ^ Clayden; Greeves; Warren (2001). Química orgánica . Oxford University Press. pág. 202. ISBN 978-0-19-850346-0.
- ^ Schrader, Thomas; Hamilton, Andrew D., eds. (2005). Receptores sintéticos funcionales . Wiley-VCH. pág. 132. ISBN 3-527-30655-2.
- ^ Greenhill, John V.; Lue, Ping (1993). 5 Amidinas y guanidinas en la química medicinal . Progreso en química medicinal. Vol. 30. págs. 203–326. doi :10.1016/S0079-6468(08)70378-3. ISBN 9780444899897. Número de identificación personal 7905649.
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "amidinas". doi :10.1351/goldbook.A00267
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "carboxamidinas". doi :10.1351/goldbook.C00851
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "sulfinamidines". doi :10.1351/goldbook.S06107
- ^ Alder, Roger W.; Blake, Michael E.; Bufali, Simone; Butts, Craig P.; Orpen, A. Guy; Schütz, Jan; Williams, Stuart J. (2001). "Preparación de sales de tetraalquilformamidinio y especies relacionadas como precursores de carbenos estables". Journal of the Chemical Society, Perkin Transactions 1 (14): 1586–1593. doi :10.1039/B104110J.
- ^ Eduardo C. Taylor; Wendell A. Ehrhart; M. Kawanisi (1966). "Acetato de formamidina". Síntesis orgánicas . 46 : 39. doi : 10.15227/orgsyn.046.0039.
- ^ Keaton, Richard J.; Jayaratne, Kumudini C.; Henningsen, David A.; Koterwas, Lisa A.; Sita, Lawrence R. (2001). "Mejora espectacular de las actividades de las polimerizaciones vivas de Ziegler−Natta mediadas por iniciadores de acetamidinato de circonio "expuestos": la polimerización viva isoespecífica del vinilciclohexano". Revista de la Sociedad Química Estadounidense . 123 (25): 6197–6198. doi :10.1021/ja0057326. PMID 11414862.
- ^ Ulrich, Henri (2007). Química y tecnología de las carbodiimidas . Chichester, Inglaterra: John Wiley & Sons. ISBN 9780470065105.