Alcalinidad
La alcalinidad (del árabe : القلوية , romanizado : al-qaly , lit. 'cenizas de la salicornia ') [1] es la capacidad del agua para resistir la acidificación . [2] No debe confundirse con la basicidad , que es una medida absoluta en la escala de pH . La alcalinidad es la fuerza de una solución tampón compuesta de ácidos débiles y sus bases conjugadas . Se mide titulando la solución con un ácido como HCl hasta que su pH cambie abruptamente, o alcance un punto final conocido donde eso sucede. La alcalinidad se expresa en unidades de concentración, como meq/L ( miliequivalentes por litro ), μeq/kg (microequivalentes por kilogramo) o mg/L CaCO3 ( miligramos por litro de carbonato de calcio ). [3] Cada una de estas medidas corresponde a una cantidad de ácido añadido como titulante .
En agua dulce , particularmente en terrenos no calizos , las alcalinidades son bajas e involucran muchos iones. En el océano, por otro lado, la alcalinidad está completamente dominada por carbonato y bicarbonato más una pequeña contribución de borato . [4]
Aunque la alcalinidad es un término utilizado principalmente por limnólogos [5] y oceanógrafos [3] , también lo utilizan los hidrólogos para describir la dureza temporal . Además, medir la alcalinidad es importante para determinar la capacidad de un arroyo para neutralizar la contaminación ácida de la lluvia o las aguas residuales . Es una de las mejores medidas de la sensibilidad del arroyo a los aportes ácidos. [6] Puede haber cambios a largo plazo en la alcalinidad de arroyos y ríos en respuesta a perturbaciones humanas como la lluvia ácida generada por las emisiones de SO x y NO x [7]
Historia
En 1884, el profesor Wilhelm (William) Dittmar del Anderson College, hoy Universidad de Strathclyde , analizó 77 muestras de agua marina prístina de todo el mundo traídas por la expedición Challenger . Descubrió que en el agua marina los iones principales se encontraban en una proporción fija, lo que confirmaba la hipótesis de Johan Georg Forchhammer , que hoy se conoce como el Principio de proporciones constantes. Sin embargo, había una excepción. Dittmar descubrió que la concentración de calcio era ligeramente mayor en las profundidades del océano, y denominó a este aumento alcalinidad. [ cita requerida ]
También en 1884, Svante Arrhenius presentó su tesis doctoral en la que defendía la existencia de iones en disolución y definía los ácidos como donantes de iones hidronio y las bases como donantes de iones hidróxido . Por ese trabajo recibió el Premio Nobel de Química en 1903. [ cita requerida ] Véase también Svante Arrhenius#Disociación iónica .
Resumen simplificado
La alcalinidad se refiere aproximadamente a la cantidad molar de bases en una solución que se pueden convertir en especies no cargadas mediante un ácido fuerte. Por ejemplo, 1 mol de HCO−
3en solución representa 1 equivalente molar, mientras que 1 mol de CO2−
3es de 2 equivalentes molares porque se necesitarían el doble de iones H + para equilibrar la carga. La carga total de una solución siempre es igual a cero. [8] Esto conduce a una definición paralela de alcalinidad que se basa en el equilibrio de carga de los iones en una solución.
Ciertos iones, incluidos Na + , K + , Ca2 + , Mg2 + , Cl− y SO2−
4, y NO−
3son " conservadores ", de modo que no se ven afectados por los cambios de temperatura, presión o pH. [8] Otros, como el HCO−
3Se ven afectados por los cambios de pH, temperatura y presión. Al aislar los iones conservadores en un lado de esta ecuación de equilibrio de carga, los iones no conservadores que aceptan o donan protones y, por lo tanto, definen la alcalinidad se agrupan en el otro lado de la ecuación.
Este equilibrio combinado de carga y equilibrio de protones se denomina alcalinidad total . [9] La alcalinidad total no se ve (muy) afectada por la temperatura, la presión o el pH, y por lo tanto es en sí misma una medida conservadora, lo que aumenta su utilidad en los sistemas acuáticos. Todos los aniones excepto HCO−
3y CO2−
3tienen bajas concentraciones en las aguas superficiales de la Tierra (arroyos, ríos y lagos). Por lo tanto, la alcalinidad de los carbonatos , que es igual a [ HCO−
3] + 2[ CO2−
3] también es aproximadamente igual a la alcalinidad total del agua superficial. [8]
Descripción detallada
La alcalinidad mide la capacidad de una solución para neutralizar los ácidos hasta el punto de equivalencia de carbonato o bicarbonato, definido como pH 4,5 para muchos estudios oceanográficos/limnológicos. [10] La alcalinidad es igual a la suma estequiométrica de las bases en solución. En la mayoría de las aguas superficiales de la Tierra, la alcalinidad de carbonato tiende a constituir la mayor parte de la alcalinidad total debido a la aparición y disolución común de rocas carbonatadas y otros procesos geológicos de meteorización que producen aniones carbonato. Otros componentes naturales comunes que pueden contribuir a la alcalinidad incluyen borato , hidróxido , fosfato , silicato , amoníaco disuelto y las bases conjugadas de ácidos orgánicos (p. ej., acetato ). Las soluciones producidas en un laboratorio pueden contener un número prácticamente ilimitado de especies que contribuyen a la alcalinidad. La alcalinidad se da con frecuencia como equivalentes molares por litro de solución o por kilogramo de disolvente. En contextos comerciales (por ejemplo, en la industria de las piscinas) y regulatorios, la alcalinidad también se puede expresar en partes por millón de carbonato de calcio equivalente (ppm CaCO3 ) [ cita requerida ] . A veces, la alcalinidad se usa incorrectamente de manera intercambiable con la basicidad . Por ejemplo, la adición de CO2 reduce el pH de una solución, lo que reduce la basicidad mientras que la alcalinidad permanece inalterada (ver el ejemplo a continuación).
Se especifican diversos titulantes , puntos finales e indicadores para diversos métodos de medición de alcalinidad. Los ácidos clorhídrico y sulfúrico son titulantes ácidos comunes, mientras que la fenolftaleína , el rojo de metilo y el verde de bromocresol son indicadores comunes. [11]
Tratamiento teórico
En aguas subterráneas o de mar típicas , la alcalinidad total medida se establece igual a:
- Una T = [ HCO−
3] T + 2[ CO2−
3] T +[ B(OH)−
4] T +[OH − ] T +2[ PO3−
4] T + [ HPO2−
4] T +[ SiO(OH)−
3] T − [H + ] sws − [ HSO−
4]
(El subíndice T indica la concentración total de la especie en la solución medida. Esto se opone a la concentración libre, que tiene en cuenta la cantidad significativa de interacciones de pares de iones que ocurren en el agua de mar).
La alcalinidad se puede medir titulando una muestra con un ácido fuerte hasta que se consuma toda la capacidad tampón de los iones antes mencionados por encima del pH del bicarbonato o carbonato. Este punto se establece funcionalmente en pH 4,5. En este punto, todas las bases de interés se han protonado a la especie de nivel cero, por lo que ya no causan alcalinidad. En el sistema de carbonato, los iones de bicarbonato [ HCO−
3] y los iones carbonato [ CO2−
3] se han convertido en ácido carbónico [H 2 CO 3 ] a este pH. Este pH también se denomina punto de equivalencia de CO 2 donde el componente principal en el agua es CO 2 disuelto que se convierte en H 2 CO 3 en una solución acuosa. No hay ácidos o bases fuertes en este punto. Por lo tanto, la alcalinidad se modela y cuantifica con respecto al punto de equivalencia de CO 2 . Debido a que la alcalinidad se mide con respecto al punto de equivalencia de CO 2 , la disolución de CO 2 , aunque agrega ácido y carbono inorgánico disuelto, no cambia la alcalinidad. En condiciones naturales, la disolución de rocas básicas y la adición de amoníaco [NH 3 ] o aminas orgánicas conduce a la adición de base a aguas naturales en el punto de equivalencia de CO 2 . La base disuelta en el agua aumenta el pH y titula una cantidad equivalente de CO 2 a ion bicarbonato e ion carbonato. En equilibrio, el agua contiene una cierta cantidad de alcalinidad aportada por la concentración de aniones de ácido débil. Por el contrario, la adición de ácido convierte los aniones de ácido débil en CO2 y la adición continua de ácidos fuertes puede provocar que la alcalinidad sea menor que cero. [12] Por ejemplo, las siguientes reacciones tienen lugar durante la adición de ácido a una solución típica de agua de mar:
- B(OH)−
4+ H + → B( OH ) 3 + H2O
- OH − + H + → H 2 O
- correos3−
4+ 2H + → H
2correos−
4
- OHP2−
4+ H + → H
2correos−
4
- [ SiO(OH)−
3] + H + → [Si(OH) 4 ]
Se puede observar a partir de las reacciones de protonación anteriores que la mayoría de las bases consumen un protón (H + ) para convertirse en una especie neutra, aumentando así la alcalinidad en uno por equivalente. CO2−
3Sin embargo, consumirá dos protones antes de convertirse en una especie de nivel cero (CO 2 ), por lo que aumenta la alcalinidad en dos por mol de CO2−
3. [H + ] y [ HSO−
4] disminuyen la alcalinidad, ya que actúan como fuentes de protones. A menudo se representan colectivamente como [H + ] T .
La alcalinidad se expresa generalmente en mg/L como CaCO 3 . (La conjunción "como" es apropiada en este caso porque la alcalinidad resulta de una mezcla de iones, pero se expresa "como si" todo esto se debiera a CaCO 3 .) Esto se puede convertir en miliequivalentes por litro (meq/L) dividiéndolo por 50 (el PM aproximado de CaCO 3 dividido por 2).
Interacciones del dióxido de carbono
Adición de CO2
La adición (o eliminación) de CO 2 a una solución no cambia su alcalinidad, ya que la reacción neta produce el mismo número de equivalentes de especies que contribuyen positivamente (H + ) que de especies que contribuyen negativamente ( HCO−
3y/o CO2−
3). Agregar CO 2 a la solución reduce su pH, pero no afecta la alcalinidad.
En todos los valores de pH:
- CO2 + H2O ⇌ HCO−
3+H +
Sólo con valores de pH altos (básicos):
- OHC−
3+ H + ⇌ CO2−
3+ 2H +
Disolución de roca carbonatada
La adición de CO2 a una solución en contacto con un sólido puede (con el tiempo) afectar la alcalinidad, especialmente en el caso de los minerales carbonatados en contacto con aguas subterráneas o de mar. La disolución (o precipitación) de la roca carbonatada tiene una fuerte influencia en la alcalinidad. Esto se debe a que la roca carbonatada está compuesta de CaCO3 y su disociación agregará Ca2 + y CO2.2−
3en solución. El Ca 2+ no influirá en la alcalinidad, pero el CO2−
3aumentará la alcalinidad en 2 unidades. El aumento de la disolución de la roca carbonatada por la acidificación de la lluvia ácida y la minería ha contribuido a aumentar las concentraciones de alcalinidad en algunos ríos importantes en todo el este de los EE. UU. [7] La siguiente reacción muestra cómo la lluvia ácida, que contiene ácido sulfúrico, puede tener el efecto de aumentar la alcalinidad del río al aumentar la cantidad de iones de bicarbonato:
- 2 CaCO 3 + H 2 SO 4 → 2 Ca 2+ + 2 HCO−
3+ ASI QUE2−
4
Otra forma de escribir esto es:
- CaCO3 + H + ⇌ Ca2 + + HCO−
3
Cuanto más bajo sea el pH, mayor será la concentración de bicarbonato. Esto demuestra que un pH más bajo puede conducir a una mayor alcalinidad si la cantidad de bicarbonato producido es mayor que la cantidad de H + restante después de la reacción. Esto es así porque la cantidad de ácido en el agua de lluvia es baja. Si esta agua subterránea alcalina entra más tarde en contacto con la atmósfera, puede perder CO 2 , precipitar carbonato y, por lo tanto, volverse menos alcalina nuevamente. Cuando los minerales de carbonato, el agua y la atmósfera están todos en equilibrio, la reacción reversible
- CaCO 3 + 2 H + ⇌ Ca 2+ + CO 2 + H 2 O
muestra que el pH estará relacionado con la concentración de iones calcio, siendo que un pH más bajo corresponde a una concentración más alta de iones calcio. En este caso, cuanto más alto sea el pH, más iones bicarbonato y carbonato habrá, en contraste con la situación paradójica descrita anteriormente, donde no hay equilibrio con la atmósfera.
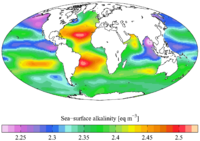
Cambios en la alcalinidad oceánica
En el océano, la alcalinidad está completamente dominada por el carbonato y el bicarbonato más una pequeña contribución del borato . [4]
Así, la ecuación química de la alcalinidad en el agua de mar es:
- Una T = [ HCO3- ] + 2[CO32- ] + [B(OH ) 4- ]
Existen muchos métodos para generar alcalinidad en el océano . Quizás el más conocido sea la disolución del carbonato de calcio para formar Ca 2+ y CO2−
3(carbonato). El ion carbonato tiene el potencial de absorber dos iones de hidrógeno. Por lo tanto, provoca un aumento neto de la alcalinidad del océano. La disolución del carbonato de calcio se produce en regiones del océano que están subsaturadas con respecto al carbonato de calcio.
El aumento del nivel de dióxido de carbono en la atmósfera , debido a las emisiones de dióxido de carbono , da como resultado una mayor absorción de CO2 de la atmósfera en los océanos. [13] Esto no afecta la alcalinidad del océano [14] : 2252 pero sí da como resultado una reducción en el valor del pH (llamada acidificación del océano ). [15] La mejora de la alcalinidad del océano se ha propuesto como una opción para agregar alcalinidad al océano y, por lo tanto, amortiguar los cambios de pH. [16] : 181
Los procesos biológicos tienen un impacto mucho mayor en la alcalinidad oceánica en escalas de tiempo cortas (de minutos a siglos). [17] La desnitrificación y la reducción de sulfato ocurren en ambientes con oxígeno limitado. Ambos procesos consumen iones de hidrógeno (lo que aumenta la alcalinidad) y liberan gases (N 2 o H 2 S), que finalmente escapan a la atmósfera. La nitrificación y la oxidación de sulfuro disminuyen la alcalinidad al liberar protones como subproducto de las reacciones de oxidación. [18]
Variabilidad temporal y espacial global
La alcalinidad del océano varía con el tiempo, sobre todo en escalas de tiempo geológicas (milenios). Los cambios en el equilibrio entre la erosión terrestre y la sedimentación de minerales carbonatados (por ejemplo, en función de la acidificación del océano) son los principales impulsores a largo plazo de la alcalinidad del océano. [19] En escalas de tiempo humanas, la alcalinidad media del océano es relativamente estable. [20] La variabilidad estacional y anual de la alcalinidad media del océano es muy baja. [21]
La alcalinidad varía según la ubicación dependiendo de la evaporación/precipitación, la advección de agua, los procesos biológicos y los procesos geoquímicos. [4]
La mezcla dominada por los ríos también ocurre cerca de la costa; es más fuerte cerca de la desembocadura de un gran río. En este caso, los ríos pueden actuar como fuente o sumidero de alcalinidad. Una T sigue el flujo de salida del río y tiene una relación lineal con la salinidad. [21]
La alcalinidad oceánica también sigue tendencias generales basadas en la latitud y la profundidad. Se ha demostrado que la AT es a menudo inversamente proporcional a la temperatura superficial del mar (TSM). Por lo tanto, generalmente aumenta con latitudes y profundidades altas. Como resultado, las áreas de surgencia (donde el agua del océano profundo es empujada a la superficie) también tienen valores de alcalinidad más altos. [22]
Existen muchos programas para medir, registrar y estudiar la alcalinidad oceánica, junto con muchas de las otras características del agua de mar, como la temperatura y la salinidad. Entre ellos se incluyen: GEOSECS (estudio geoquímico de secciones oceánicas), [23] TTO/NAS (estudio de trazadores transitorios en el océano/Atlántico Norte), JGOFS (estudio conjunto de flujo oceánico global), [24] WOCE (experimento mundial de circulación oceánica), [25] CARINA (dióxido de carbono en el océano Atlántico). [26]
Intervenciones para añadir alcalinidad
Véase también
- Suelos alcalinos
- Base (química)
- Bomba biológica
- Desalcalinización del agua
- Proyecto de análisis de datos oceánicos globales
Referencias
- ^ "álcali". Dictionary.com Unabridged (en línea). sf . Consultado el 30 de septiembre de 2018 .
- ^ "¿Qué es la alcalinidad?". Centro de Investigación del Agua. 2014. Consultado el 5 de febrero de 2018 .
- ^ ab Dickson, Andrew G. (1992). "El desarrollo del concepto de alcalinidad en la química marina". Química marina . 40 (1–2): 49–63. Bibcode :1992MarCh..40...49D. doi :10.1016/0304-4203(92)90047-E.
- ^ abc Chester, R.; Jickells, Tim (2012). "Capítulo 9: Nutrientes, oxígeno, carbono orgánico y el ciclo del carbono en el agua de mar". Geoquímica marina (3.ª ed.). Chichester, West Sussex, Reino Unido: Wiley/Blackwell. ISBN 978-1-118-34909-0.OCLC 781078031 .
- ^ Mattson, MD (1 de enero de 2014), "Alcalinidad del agua dulce☆", Módulo de referencia en sistemas terrestres y ciencias ambientales , Elsevier, doi :10.1016/b978-0-12-409548-9.09397-0, ISBN 978-0-12-409548-9, consultado el 9 de enero de 2023
- ^ "Alcalinidad total". Agencia de Protección Ambiental de los Estados Unidos . Consultado el 6 de marzo de 2013 .
- ^ ab Kaushal, SS; Likens, GE; Utz, RM; Pace, ML; Grese, M.; Yepsen, M. (2013). "Aumento de la alcalinización de los ríos en el este de Estados Unidos". Environmental Science & Technology . 47 (18): 10302–10311. doi :10.1021/es401046s. PMID 23883395.
- ^ abc Drever, James I. (1988). La geoquímica de las aguas naturales, segunda edición . Englewood Cliffs, Nueva Jersey: Prentice Hall. ISBN 0-13-351396-3.
- ^ Wolf-Gladrow, Dieter A.; Zeebe, Richard E.; Klaas, Christine; Körtzinger, Arne; Dickson, Andrew G. (julio de 2007). "Alcalinidad total: la expresión conservadora explícita y su aplicación a los procesos biogeoquímicos". Química marina . 106 (1–2): 287–300. Código Bibliográfico :2007MarCh.106..287W. doi :10.1016/j.marchem.2007.01.006.
- ^ Dickson, AG (junio de 1981). "Una definición exacta de alcalinidad total y un procedimiento para la estimación de la alcalinidad y el carbono inorgánico total a partir de datos de titulación". Investigación en aguas profundas, parte A. Documentos de investigación oceanográfica . 28 (6): 609–623. Código Bibliográfico :1981DSRA...28..609D. doi :10.1016/0198-0149(81)90121-7.
- ^ 2320 alcalinidad, Métodos estándar para el análisis de agua y aguas residuales, Asociación Estadounidense de Salud Pública, 27 de agosto de 2017, doi : 10.2105/smww.2882.023 (inactivo el 12 de septiembre de 2024), ISBN 9780875532998, consultado el 1 de diciembre de 2022
{{citation}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) - ^ Benjamin. Mark M. 2015. Química del agua . 2.ª edición. Long Grove, Illinois: Waveland Press, Inc.
- ^ Doney, Scott C.; Busch, D. Shallin; Cooley, Sarah R.; Kroeker, Kristy J. (17 de octubre de 2020). "Los impactos de la acidificación de los océanos en los ecosistemas marinos y las comunidades humanas dependientes". Revista anual de medio ambiente y recursos . 45 (1): 83–112. doi : 10.1146/annurev-environ-012320-083019 . S2CID 225741986.
 El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional
El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional - ^ IPCC, 2021: Anexo VII: Glosario Archivado el 5 de junio de 2022 en Wayback Machine [Matthews, JBR, V. Möller, R. van Diemen, JS Fuglestvedt, V. Masson-Delmotte, C. Méndez, S. Semenov, A. Reisinger (eds.)]. En Cambio climático 2021: la base de la ciencia física. Contribución del Grupo de Trabajo I al Sexto Informe de Evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático Archivado el 9 de agosto de 2021 en Wayback Machine . [Masson-Delmotte, V., P. Zhai, A. Pirani, SL Connors, C. Péan, S. Berger, N. Caud, Y. Chen, L. Goldfarb, MI Gomis, M. Huang, K. Leitzell, E. Lonnoy, J. B. R. Matthews, T. K. Maycock, T. Waterfield, O. Yelekçi, R. Yu y B. Zhou (eds.)]. Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE.UU.
- ^ Doney, Scott C.; Busch, D. Shallin; Cooley, Sarah R.; Kroeker, Kristy J. (17 de octubre de 2020). "Los impactos de la acidificación de los océanos en los ecosistemas marinos y las comunidades humanas dependientes". Revista anual de medio ambiente y recursos . 45 (1): 83–112. doi : 10.1146/annurev-environ-012320-083019 . S2CID 225741986.
 El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional
El texto fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional - ^ Una estrategia de investigación para la eliminación y el secuestro de dióxido de carbono en los océanos . 2022. doi :10.17226/26278. ISBN 978-0-309-08761-2. Número de identificación personal 35533244. Número de identificación personal 245089649.
- ^ Emerson, Steven; Hedges, John (2008). Oceanografía química y el ciclo del carbono marino. Cambridge: Cambridge University Press. ISBN 978-0-511-64987-5.OCLC 558876135 .
- ^ Stumm, Werner; Morgan, James J. (1996). Química acuática: equilibrios químicos y tasas en aguas naturales (3.ª ed.). Nueva York: Wiley. ISBN 0-471-51184-6.OCLC 31754493 .
- ^ Zeebe, Richard E.; Wolf-Gladrow, Dieter A. (2001). CO2 en agua de mar: equilibrio, cinética, isótopos. Ámsterdam: Elsevier. ISBN 978-0-08-052922-6.OCLC 246683387 .
- ^ Doney, Scott C.; Fabry, Victoria J.; Feely, Richard A.; Kleypas, Joan A. (1 de enero de 2009). "Acidificación de los océanos: el otro problema del CO2". Revista anual de ciencias marinas . 1 (1): 169–192. Bibcode :2009ARMS....1..169D. doi :10.1146/annurev.marine.010908.163834. ISSN 1941-1405. PMID 21141034.
- ^ ab Thomas, H.; Schiettecatte, L.-S.; et al. Almacenamiento mejorado de carbono oceánico a partir de la generación de alcalinidad anaeróbica en sedimentos costeros. Biogeosciences Discussions. 2008, 5, 3575–3591
- ^ Millero, FJ; Lee, K.; Roche, M. Distribución de la alcalinidad en las aguas superficiales de los principales océanos. Química Marina. 1998, 60, 111-130.
- ^ "conjunto de datos: GEOSECS". iridl.ldeo.columbia.edu . Consultado el 28 de marzo de 2023 .
- ^ "Inicio: Instituto Oceanográfico Woods Hole". 14 de marzo de 2012. Archivado desde el original el 14 de marzo de 2012. Consultado el 28 de marzo de 2023 .
- ^ "Recurso de datos global de WOCE". 16 de octubre de 2011. Archivado desde el original el 16 de octubre de 2011. Consultado el 28 de marzo de 2023 .
- ^ "CARINA". www.pmel.noaa.gov . Consultado el 28 de marzo de 2023 .
- ^ ab Una estrategia de investigación para la eliminación y el secuestro de dióxido de carbono en los océanos . 2022. doi :10.17226/26278. ISBN 978-0-309-08761-2. Número de identificación personal 35533244. Número de identificación personal 245089649.
- ^ IPCC (2022) Capítulo 12: Perspectivas intersectoriales Archivado el 13 de octubre de 2022 en Wayback Machine en Cambio climático 2022: mitigación del cambio climático. Contribución del Grupo de trabajo III al sexto informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático Archivado el 2 de agosto de 2022 en Wayback Machine , Cambridge University Press, Cambridge, Reino Unido y Nueva York, NY, EE. UU.
Enlaces externos
- DOE (1994) "[1]", Manual de métodos para el análisis de los diversos parámetros del sistema de dióxido de carbono en agua de mar. Versión 2 , AG Dickson y C. Goyet, eds. ORNL/CDIAC-74.
Calculadoras del sistema de carbonatos
Los siguientes paquetes calculan el estado del sistema de carbonato en agua de mar (incluido el pH):
- CO2SYS Archivado el 14 de octubre de 2011 en Wayback Machine , disponible como ejecutable independiente , hoja de cálculo de Excel o script de MATLAB .
- seacarb, un paquete R para Windows , Mac OS X y Linux (también disponible aquí)
- CSYS, un script de Matlab

![{\displaystyle {\begin{aligned}&\sum ({\text{cationes conservadores}})-\sum ({\text{aniones conservadores}})=\\&\quad [\mathrm {HCO_{3}^ {-}} ]+2[\mathrm {CO_{3}^{2-}} ]+[\mathrm {B(OH)_{4}^{-}} ]+[\mathrm {OH^{- }} ]+[\mathrm {HPO_{4}^{2-}} ]+2[\mathrm {PO_{4}^{3-}} ]+[\mathrm {H_{3}SiO_{4}^ {-}} ]+[\mathrm {NH_{3}} ]+[\mathrm {HS^{-}} ]-[\mathrm {H^{+}} ]-[\mathrm {HSO_{4}^{-}} ]-[\mathrm {HF} ]-[\mathrm {H_{3}PO_{4}} ]-[\mathrm {HNO_{2}} ]\end{aligned} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/742e18e2093af35b756acb9324112b2001709b86)