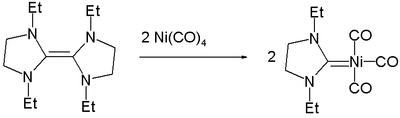
Química del organoníquel

La química de organoníquel es una rama de la química organometálica que se ocupa de los compuestos orgánicos que presentan enlaces níquel - carbono . [1] [2] Se utilizan como catalizador, como bloque de construcción en química orgánica y en la deposición química de vapor . Los compuestos de organoníquel también son intermediarios de corta duración en las reacciones orgánicas. El primer compuesto de organoníquel fue el tetracarbonil de níquel Ni(CO) 4 , descrito en 1890 y rápidamente aplicado en el proceso Mond para la purificación del níquel. Los complejos de organoníquel son prominentes en numerosos procesos industriales, incluidas las carbonilaciones , la hidrocianación y el proceso de olefinas superiores de Shell . [3] [4]
Clases de compuestos
Complejos de alquilo y arilo
Un reactivo popular es Ni(CH 3 ) 2 (tetrametiletilendiamina) . [5]
Se conocen muchos complejos de alquilo y arilo con la fórmula NiR(X)L 2 . Los ejemplos incluyen [(dppf)Ni(cinnamyl)Cl)], trans -(PCy 2 Ph) 2 Ni( o -tolyl)Cl]], (dppf)Ni( o -tolyl)Cl]], (TMEDA)Ni( o -tolyl)Cl y (TMEDA)NiMe 2 .

También existen compuestos de níquel del tipo NiR 2 con solo 12 electrones de valencia. Sin embargo, en solución, el disolvente siempre interactúa con el átomo de metal aumentando el recuento de electrones. Un compuesto de 12 VE es el di(mesitilo)níquel preparado a partir de (alil) 2 Ni 2 Br 2 y el reactivo de Grignard correspondiente .
- ( alil ) 2Ni2Br2 + 4C6H2Me3MgBr → 2 ( alil ) MgBr + 2MgBr2 + 2 ( C6H2Me3 ) 2Ni
Complejos de alquenos
Existen muchos complejos de níquel coordinados a un alqueno . Las aplicaciones prácticas de este tema incluyen la polimerización u oligomerización de alquenos, como en el proceso de olefinas superiores de Shell . [7] En estos compuestos, el níquel es formalmente cerovalente Ni 0 y el enlace se describe con el modelo de Dewar-Chatt-Duncanson . Un representante común es el bis(ciclooctadieno)níquel(0) (Ni(COD) 2 ), que contiene dos ligandos de ciclooctadieno . Es un compuesto 18VE con 10 electrones proporcionados por el propio níquel y 4x2 electrones más por los enlaces dobles. Este sólido, que se funde a 60 °C, se utiliza como catalizador y como precursor de muchos otros compuestos de níquel.
Complejos alílicos

El níquel forma varios complejos alílicos simples . Los haluros de alilo reaccionan con Ni(CO) 4 para formar complejos pi-alílicos, (alil) 2 Ni 2 Cl 2 . [8] Estos compuestos a su vez son fuentes de nucleófilos alílicos . En (alil) 2 Ni 2 Br 2 y (alil) Ni(C 5 H 5 ), al níquel se le asigna un número de oxidación de +2, y los conteos de electrones son 16 y 18, respectivamente. El bis(alil)níquel se prepara a partir de bromuro de magnesio alílico y cloruro de níquel .
Complejos de ciclopentadienilo
El niqueloceno NiCp 2 con estado de oxidación +2 Ni y 20 electrones de valencia es el principal metaloceno del níquel. Puede ser oxidado por un electrón. Se desconocen los correspondientes paladocenos y platinocenos . A partir del niqueloceno se generan muchos derivados, por ejemplo, CpNiLCl, CpNiNO y Cp 2 Ni 2 (CO) 3 .
Complejos de carbeno
El níquel forma complejos de carbeno , que formalmente presentan dobles enlaces C=Ni. [9]
Reacciones
Oligomerizaciones de alquenos/alquinos
Los compuestos de níquel catalizan la oligomerización de alquenos y alquinos . Esta propiedad validó la investigación y el desarrollo de catalizadores Ziegler-Natta en la década de 1950. Ese descubrimiento se demostró por las impurezas de níquel originadas en un autoclave que anuló la reacción de propagación ( Aufbau ) a favor de la reacción de terminación a un alqueno terminal : la polimerización del etileno se detuvo repentinamente en 1-buteno . Este llamado efecto níquel impulsó la búsqueda de otros catalizadores capaces de esta reacción, con resultados en el hallazgo de nuevos catalizadores que técnicamente producían polímeros de alta masa molar, como los modernos catalizadores Ziegler-Natta.
Una implementación práctica de la oligomerización de alquinos es la síntesis de Reppe ; por ejemplo, en la síntesis de ciclooctatetraeno :
Se trata de una cicloadición formal [2+2+2+2] . La oligomerización de butadieno con etileno a trans-1,4-hexadieno fue un proceso industrial en algún momento.
Las [2+2+2]cicloadiciones formales también tienen lugar en la trimerización de alquinos . Esta trimerización extensible generalmente puede incluir bencina . [10] La bencina se genera in situ a partir de un compuesto de benceno unido a un triflato y un sustituyente trimetilsililo en las posiciones orto y reacciona con un di-ino como el 1,7-octadiino junto con un sistema catalizador de bromuro de níquel (II) / zinc (NiBr 2 bis (difenilfosfino) etano / Zn) para sintetizar el derivado de naftaleno correspondiente.
En el ciclo catalítico, el cinc elemental sirve para reducir el níquel(II) a níquel(0), con lo que se pueden coordinar dos enlaces alquinos. A continuación, se produce un paso de ciclometalación para obtener el intermedio de níquel-ciclopentadieno y, a continuación, la coordinación del bencino , lo que da lugar a una reacción de inserción de CH para obtener el compuesto de níquel-cicloheptatrieno. La eliminación reductora libera el compuesto de tetrahidroantraceno.
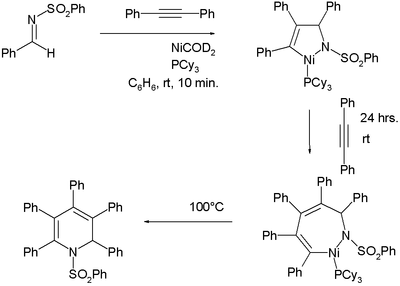
La formación de compuestos organoníquel en este tipo de reacción no siempre es obvia, pero en un experimento cuidadosamente diseñado se forman cuantitativamente dos de estos intermedios: [11] [12]
En un estudio [13] se observa que esta reacción solo funciona con acetileno o con alquinos simples debido a la baja regioselectividad . A partir de un alquino terminal, es posible que haya 7 isómeros que difieran en la posición de los sustituyentes o en las posiciones de los dobles enlaces. Una estrategia para remediar este problema emplea ciertos diinos:
Las condiciones de reacción seleccionadas también minimizan la cantidad formada de producto de cicloadición [2+2+2] que compite con el areno sustituido correspondiente.
Reacciones de acoplamiento
Los compuestos de níquel provocan la reacción de acoplamiento entre haluros de alilo y arilo . Otras reacciones de acoplamiento que involucran níquel en cantidades catalíticas son el acoplamiento de Kumada y el acoplamiento de Negishi .
Carbonilación de níquel
El Ni cataliza la adición de monóxido de carbono a alquenos y alquinos. La producción industrial de ácido acrílico en un tiempo consistió en combinar acetileno , monóxido de carbono y agua a 40-55 atm y 160-200 °C con bromuro de níquel (II) y un haluro de cobre.
Véase también
Lectura adicional
- PW Jolly, G. Wilke, ed. (1974). Química orgánica del níquel, volumen I: complejos de organoníquel . Academic Press. doi :10.1016/B978-0-12-388401-5.X5001-5. ISBN 9780123884015.
Referencias
- ^ FA Carey RJ Sundberg Química orgánica avanzada 2.ª edición ISBN 0-306-41199-7
- ^ Química organometálica integral III Robert Crabtree, Mike Mingos 2006 ISBN 0-08-044590-X
- ^ Ananikov, Valentine P. (2015). "Níquel: el "caballo brioso" de la catálisis de metales de transición". ACS Catalysis . 5 (3): 1964–1971. doi : 10.1021/acscatal.5b00072 .
- ^ Tasker, Sarah Z.; Standley, Eric A.; Jamison, Timothy F. (2014). "Avances recientes en catálisis homogénea de níquel". Nature . 509 (7500): 299–309. Bibcode :2014Natur.509..299T. doi :10.1038/nature13274. PMC 4344729 . PMID 24828188.
- ^ Göttker-Schnetmann, Inigo; Mecking, Stefan (2020). "Una síntesis práctica de [(tmeda)Ni(CH 3 ) 2 ], [(tmeda)Ni( 13 CH 3 ) 2 ] marcado isotópicamente y complejos de níquel-metilo quelado neutro". Organometallics . 39 (18): 3433–3440. doi :10.1021/acs.organomet.0c00500. S2CID 224930545.
- ^ Shields, Jason D.; Gray, Erin E.; Doyle, Abigail G. (1 de mayo de 2015). "Un precatalizador de níquel modular y estable al aire". Cartas orgánicas . 17 (9): 2166–2169. doi :10.1021/acs.orglett.5b00766. PMC 4719147 . PMID 25886092.
- ^ Olivier-Bourbigou, H .; Breuil, PAR; Magna, L.; Michel, T.; Espada Pastor, M. Fernández; Delcroix, D. (2020). "Oligomerización y dimerización de olefinas catalizada por níquel". Reseñas químicas . 120 (15): 7919–7983. doi :10.1021/acs.chemrev.0c00076. PMID 32786672. S2CID 221124789.
- ^ Martin F. Semmelhack y Paul M. Helquist (1988). "Reacción de haluros de arilo con haluros de π-alilníquel: metalilbenceno". Organic Syntheses . 52 : 115; Volúmenes recopilados , vol. 6, pág. 161.
- ^ Danopoulos, Andreas A.; Simler, Thomas; Braunstein, Pierre (2019). "Complejos de carbeno N-heterocíclico de cobre, níquel y cobalto". Chemical Reviews . 119 (6): 3730–3961. doi :10.1021/acs.chemrev.8b00505. PMID 30843688. S2CID 73515728.
- ^ Jen-Chieh Hsieh y Chien-Hong Cheng (2005). "Cociclotrimerización de arinos con diinos catalizada por níquel; un nuevo método para la síntesis de derivados de naftaleno". Chemical Communications . 2005 (19): 2459–2461. doi :10.1039/b415691a. PMID 15886770.
- ^ Formación de un aza-níquelciclo mediante la reacción de una imina y un alquino con níquel(0): ciclización oxidativa, inserción y eliminación reductiva Sensuke Ogoshi Haruo Ikeda y Hideo Kurosawa Angew. Chem. Int. Ed. 2007 , 46, 4930 –4932 doi :10.1002/anie.200700688
- ^ Reacción de la imina N-(bencenosulfonil)benzaldimina con dos equivalentes de difenilacetileno con NiCOD 2 y triciclohexilfosfina, primero para dar niquel-apirrolina y con una segunda inserción una niquel-dihidroazepina y finalmente al calentar una dihidropiridina.
- ^ Cicloadiciones [2 + 2 + 2 + 2] de diinos terminales catalizadas por níquel(0) para la síntesis de ciclooctatetraenos sustituidos Paul A. Wender y Justin P. Christy J. Am. Chem. Soc. ; 2007 ; 129(44) pp 13402 - 13403; (Comunicación) doi :10.1021/ja0763044