Ácido silícico
This article needs additional citations for verification. (July 2022) |
En química , un ácido silícico ( / s ɪ ˈ l ɪ s ɪ k / ) es cualquier compuesto químico que contiene el elemento silicio unido a grupos óxido ( =O ) e hidroxilo ( −OH ), con la fórmula general [H 2 x SiO x +2 ] n o, equivalentemente, [SiO x (OH) 4−2 x ] n . [1] [2] El ácido ortosilícico es un ejemplo representativo. Los ácidos silícicos rara vez se observan de forma aislada, pero se cree que existen en soluciones acuosas , incluida el agua de mar , y desempeñan un papel en la biomineralización . [3] Por lo general, son ácidos débiles incoloros que son escasamente solubles en agua. Al igual que los aniones de silicato , que son sus bases conjugadas más conocidas , se propone que los ácidos silícicos sean oligoméricos o poliméricos . Nunca se ha identificado un ácido silícico simple , ya que estas especies son principalmente de interés teórico.
Según el número de átomos de silicio presentes, existen ácidos mono- y polisilícicos (di-, tri-, tetrasilícicos, etc.). No se han obtenido ácidos silícicos bien definidos en una forma que haya sido caracterizada por cristalografía de rayos X.
Ejemplos
| Fórmula | Nombre | Estructura calculada |
|---|---|---|
| yo 4SiO 4o Si(OH) 4 | ácido ortosilícico |  |
| yo 2SiO 3o SiO(OH) 2 | ácido metasilícico |  |
| yo 6Si 2Oh 7o O(Si(OH) 3) 2 | ácido pirosilícico | 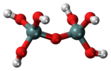 |
| yo 2Si 2Oh 5o si 2Oh 3(OH) 2 | ácido disilícico |  |
Reacciones
Los ácidos silícicos pueden considerarse formas hidratadas de sílice, es decir, 2 H 2 x SiO x +2 = SiO 2 ·(H 2 O) x . De hecho, en soluciones concentradas, los ácidos silícicos generalmente se polimerizan y condensan, y finalmente se degradan a dióxido de silicio y agua . Las etapas intermedias pueden ser líquidos muy espesos o sólidos tipo gel . [4] [5] [6] La deshidratación de este último produce una forma translúcida dura de sílice con poros a escala atómica, llamada gel de sílice , que se usa ampliamente como absorbente de agua y agente secante .
La sílice se disuelve muy poco en agua [ cita requerida ] y está presente en el agua de mar en concentraciones inferiores a 100 partes por millón . En tales soluciones diluidas, se supone que la sílice existe como ácido ortosilícico. Los cálculos teóricos indican que la disolución de la sílice en agua se produce mediante la formación de un complejo SiO 2 ·2H 2 O y luego ácido ortosilícico. [7]
El doble enlace silicio-oxígeno del ácido metasilícico, implícito en la fórmula H 2 SiO 3 , es hipotético o altamente inestable. Dichos dobles enlaces pueden hidratarse en un par de grupos hidroxilo ( −OH ): [4]
Por ejemplo,
o
Alternativamente, el ácido metasilícico es propenso a formar polímeros cíclicos [−SiO(OH) 2 −] n , que pueden abrirse por hidratación para formar polímeros en cadena HO[−SiO(OH) 2 −] n H . De manera similar, el ácido disilícico es propenso a formar polímeros complejos con una unidad tetravalente, [=Si 2 O 3 (OH) 2 =] n . Por el contrario, los ácidos oligoméricos y poliméricos pueden despolimerizarse por hidrólisis de los puentes Si−O−Si , o dichos puentes pueden crearse por condensación :
Al igual que los silanoles orgánicos , los ácidos silícicos son ácidos débiles. El ácido ortosilícico tiene potenciales de disociación calculados p K a 1 = 9,84, p K a 2 = 13,2 a 25 °C.
Los ácidos silícicos y los silicatos en solución reaccionan con aniones de molibdato , produciendo complejos de silicomolibdato de color amarillo. Esta reacción se ha utilizado para titular el contenido de silicio en soluciones acuosas y determinar su naturaleza. En una preparación típica, se descubrió que el ácido ortosilícico monomérico reaccionaba completamente en 75 segundos, el ácido pirosilícico dimérico en 10 minutos y los oligómeros superiores en un tiempo considerablemente más largo. La reacción no se observa con sílice coloidal . [8]
El grado de polimerización de los ácidos silícicos en solución acuosa se puede determinar por su efecto sobre el punto de congelación de la solución ( crioscopia ). [8]
Historia
El ácido silícico fue invocado por Jöns Jacob Berzelius a principios del siglo XIX para explicar la disolución del dióxido de silicio (sílice, cuarzo) en agua, es decir, a través de la reacción de hidratación :
Basándose en las curvas de presión de vapor del gel de sílice , Reinout Willem Van Bemmelen sostuvo que no existían hidratos de sílice , sino solo gel de sílice. Por otro lado, Gustav Tschermak von Seysenegg creía haber observado diferentes ácidos silícicos como productos de descomposición de geles de silicato naturales . [9]
El primer ácido silícico cristalino se preparó a partir del filosilicato natrosilita ( Na 2 Si 2 O 5 ) en 1924. Se conocen más de 15 ácidos cristalinos y comprenden al menos seis modificaciones de H 2 Si 2 O 5 . Algunos ácidos pueden adsorber e intercalar moléculas orgánicas y, por lo tanto, son alternativas interesantes a la sílice. [10]
Preparación
Los ácidos silícicos cristalinos se pueden preparar eliminando los cationes sodio de las soluciones de silicatos de sodio con una resina de intercambio iónico o tratando los silicatos de sodio con ácido sulfúrico concentrado . [10]
Véase también
Referencias
- ^ Greenwood, NN; Earnshaw, A. (2012). Química de los elementos. Elsevier Science. pág. 346. ISBN 978-0-08-050109-3. Consultado el 27 de julio de 2022 .
- ^ Iler, RK (1979). La química de la sílice . Nueva York: Wiley. ISBN 0-471-02404-X.
- ^ Frank Wigglesworth Clarke (1914). "Los ácidos silícicos" (PDF) . Constitución de los silicatos naturales . Págs. 10-19.
- ^ ab WE Gye y WJ Purdy (1922): "Las propiedades venenosas de la sílice coloidal. I: Los efectos de la administración parenteral de grandes dosis". British Journal of Experimental Pathology , volumen 3, número 2, páginas 75-85. PMC 2047780.
- ^ Katsumi Goto (1956): "Efecto del pH en la polimerización del ácido silícico". Journal of Physical Chemistry , volumen 60, número 7, páginas 1007–1008. doi :10.1021/j150541a046.
- ^ Hans Ramberg (1952): "Enlaces químicos y distribución de cationes en silicatos". The Journal of Geology , volumen 60, número 4, páginas 331–355. doi :10.1086/625982.
- ^ Bhaskar Mondal, Deepanwita Ghosh y Abhijit K. Das (2009): "Termoquímica para la reacción de formación de ácido silícico: predicción de una nueva vía de reacción". Chemical Physics Letters , volumen 478, números 4-6, páginas 115-119. doi :10.1016/j.cplett.2009.07.063.
- ^ ab GB Alexander (1953): "La reacción de ácidos silícicos de bajo peso molecular con ácido molíbdico". Journal of the American Chemical Society , volumen 75, número 22, páginas 5655–5657. doi :10.1021/ja01118a054.
- ^ Robert Schwarz; Ernst Menner (1924), "Zur Kenntnis der Kieselsäuren", Ber. Alemán. Química. Ges. (en alemán), 57 (8): 1477–1481, doi :10.1002/cber.19240570850.
- ^ ab "Silicatos", Enciclopedia de química industrial de Ullmann (7.ª ed.), 2007, doi :10.1002/14356007.a23_661.





