Xileno
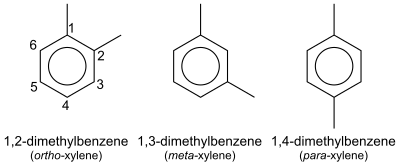
En química orgánica , el xileno o xilol (del griego ξύλον (xylon) 'madera'; [1] [2] nombre IUPAC : dimetilbenceno ) son cualquiera de los tres compuestos orgánicos con la fórmula (CH 3 ) 2 C 6 H 4 . Se derivan de la sustitución de dos átomos de hidrógeno con grupos metilo en un anillo de benceno ; qué hidrógenos se sustituyen determina cuál de los tres isómeros estructurales resulta. Es un líquido incoloro, inflamable, ligeramente grasiento de gran valor industrial. [3]
La mezcla se denomina tanto xileno como, más precisamente, xilenos. Los xilenos mixtos se refieren a una mezcla de xilenos más etilbenceno . Los cuatro compuestos tienen fórmulas moleculares idénticas C 8 H 10 . Por lo general, los cuatro compuestos se producen juntos mediante varios métodos de reformado catalítico y pirólisis . [4]
Ocurrencia y producción
Los xilenos son un importante producto petroquímico producido por reformado catalítico y también por carbonización del carbón en la fabricación de combustible de coque . También se encuentran en el petróleo crudo en concentraciones de aproximadamente 0,5 a 1 %, según la fuente. Se encuentran en pequeñas cantidades en la gasolina y los combustibles para aviones .
Los xilenos se producen principalmente como parte de los aromáticos BTX ( benceno , tolueno y xilenos) extraídos del producto del reformado catalítico conocido como reformado .
Se producen varios millones de toneladas anualmente. [3] En 2011, un consorcio global comenzó la construcción de una de las plantas de xileno más grandes del mundo en Singapur . [5]
Historia
El xileno fue aislado y nombrado por primera vez en 1850 por el químico francés Auguste Cahours (1813-1891), habiendo sido descubierto como un componente del alquitrán de madera . [6]
Producción industrial
Los xilenos se producen por la metilación de tolueno y benceno . [3] [7] El xileno comercial o de grado de laboratorio producido generalmente contiene alrededor de 40–65% de m -xileno y hasta 20% cada uno de o -xileno , p -xileno y etilbenceno . [8] [9] [10] La proporción de isómeros se puede cambiar para favorecer al altamente valorado p -xileno a través del proceso patentado UOP- Isomar [11] o por transalquilación de xileno consigo mismo o con trimetilbenceno. Estas conversiones son catalizadas por zeolitas . [3]
El ZSM-5 se utiliza para facilitar algunas reacciones de isomerización que conducen a la producción en masa de plásticos modernos.
Propiedades
Las propiedades físicas de los isómeros del xileno difieren ligeramente. El punto de fusión varía de −47,87 °C (−54,17 °F) ( m -xileno) a 13,26 °C (55,87 °F) ( p -xileno); como es habitual, el punto de fusión del isómero para es mucho más alto porque se compacta más fácilmente en la estructura cristalina. El punto de ebullición de cada isómero es de alrededor de 140 °C (284 °F). La densidad de cada isómero es de alrededor de 0,87 g/mL (7,3 lb/gal EE. UU.; 8,7 lb/gal imp) y, por lo tanto, es menos denso que el agua . El olor del xileno es detectable en concentraciones tan bajas como 0,08 a 3,7 ppm (partes de xileno por millón de partes de aire) y se puede percibir en agua a 0,53 a 1,8 ppm. [9]
| Isómeros de xileno | ||||
|---|---|---|---|---|
| General | ||||
| Nombre común | Xilenos (mezcla) | o -xileno | m -xileno | p -xileno |
| Nombre sistemático | Dimetilbenceno | 1,2-Dimetilbenceno | 1,3-Dimetilbenceno | 1,4-Dimetilbenceno |
| Otros nombres | Xilol | o -Xilol; Ortoxileno | m -Xilol; Metaxileno | p -Xilol; Paraxileno |
| Fórmula molecular | C8H10 | |||
| SONRISAS | Cc1c(C)cccc1 | Cc1cc(C)ccc1 | Cc1ccc(C)cc1 | |
| Masa molar | 106,16 g/mol | |||
| Apariencia | Líquido transparente e incoloro. | |||
| Número CAS | [1330-20-7] | [95-47-6] | [108-38-3] | [106-42-3] |
| Propiedades | ||||
| Densidad y fase | 0,864 g/mL, líquido | 0,88 g/mL, líquido | 0,86 g/mL, líquido | 0,86 g/mL, líquido |
| Solubilidad en agua | Prácticamente insoluble | |||
| Soluble en disolventes no polares como los hidrocarburos aromáticos. | ||||
| Punto de fusión | -47,4 °C (-53,3 °F; 226 K) | -25 °C (-13 °F; 248 K) | -48 °C (-54 °F; 225 K) | 13 °C (55 °F; 286 K) |
| Punto de ebullición | 138,5 °C (281,3 °F; 412 K) | 144 °C (291 °F; 417 K) | 139 °C (282 °F; 412 K) | 138 °C (280 °F; 411 K) |
| Viscosidad | 0,812 cP a 20 °C (68 °F) | 0,62 cP a 20 °C (68 °F) | 0,34 cP a 30 °C (86 °F) | |
| Peligros | ||||
| Hoja de datos de seguridad | Xilenos | o-xileno | m-xileno | p-xileno |
| Pictogramas de la UE |   
| |||
| Norma NFPA 704 | ||||
| punto de inflamabilidad | 30 °C (86 °F) | 17 °C (63 °F) | 25 °C (77 °F) | 25 °C (77 °F) |
| Frases H & P | H225 , H226 , H304 , H312 , H315 , H319 , H332 , H335 , H412 P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P273 , P280 , P301+P310 , P302+P352 , P303+P361+P353 , P304+P312 , P304+P340 , P305+P351+P338 , P312 , P321 , P322 , P331 , P332+P313 , P337+P313 , P362 , P363 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |||
| Número RTECS | ZE2450000 | ZE2275000 | ZE2625000 | |
| Compuestos relacionados | ||||
Hidrocarburos aromáticos relacionados | Tolueno , mesitileno , benceno , etilbenceno | |||
| Compuestos relacionados | Xilenoles – tipos de fenoles | |||
| A menos que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C, 100 kPa). Descargo de responsabilidad y referencias del cuadro de información | ||||
Los xilenos forman azeótropos con agua y una variedad de alcoholes. El azeótropo con agua consta de un 60% de xilenos y hierve a 94,5 °C. [3] Al igual que con muchos compuestos de alquilbenceno , los xilenos forman complejos con varios halocarbonos . [12] Los complejos de diferentes isómeros a menudo tienen propiedades radicalmente diferentes entre sí. [13]
Aplicaciones
Ácido tereftálico y derivados relacionados
El p -xileno es el principal precursor del ácido tereftálico y del tereftalato de dimetilo , ambos monómeros utilizados en la producción de botellas de plástico de tereftalato de polietileno (PET) y ropa de poliéster . El 98% de la producción de p -xileno, y la mitad de todos los xilenos producidos se consumen de esta manera. [10] [14] El o -xileno es un precursor importante del anhídrido ftálico . La demanda de ácido isoftálico es relativamente modesta, por lo que rara vez se busca m -xileno (y de ahí la utilidad de su conversión a los isómeros o y p ).
Aplicaciones de disolventes y fines industriales
Los xilenos se utilizan como disolventes en las industrias de impresión , caucho y cuero . Es un componente común de la tinta, el caucho y los adhesivos . [15] En la dilución de pinturas y barnices , se puede sustituir por tolueno cuando se desea un secado más lento, y por lo tanto lo utilizan los conservadores de objetos de arte en las pruebas de solubilidad. [16] De manera similar, es un agente de limpieza , por ejemplo, para acero , obleas de silicio y circuitos integrados . En odontología, el xileno se puede utilizar para disolver gutapercha , un material utilizado para endodoncia (tratamientos de conductos radiculares). En la industria del petróleo, el xileno también es un componente frecuente de los disolventes de parafina, que se utilizan cuando los tubos se obstruyen con cera de parafina.
Uso en laboratorio
El xileno se utiliza en el laboratorio para hacer baños con hielo seco para enfriar los recipientes de reacción, [17] y como disolvente para eliminar el aceite de inmersión sintético del objetivo del microscopio en la microscopía óptica . [18] En histología , el xileno es el agente de limpieza más utilizado. [19] El xileno se utiliza para eliminar la parafina de los portaobjetos de microscopio secos antes de la tinción. Después de la tinción, los portaobjetos de microscopio se colocan en xileno antes de montarlos con un cubreobjetos.
Precursor de otros compuestos
En una aplicación a gran escala, el para-xileno se convierte en ácido tereftálico . La principal aplicación del orto-xileno es como precursor de ésteres de ftalato , utilizados como plastificantes . El meta-xileno se convierte en derivados del ácido isoftálico , que son componentes de las resinas alquídicas . [3]
Propiedades químicas
En general, con los xilenos se producen dos tipos de reacciones: las que involucran a los grupos metilo y las que involucran los enlaces C–H del anillo. Al ser bencílicos y, por lo tanto, debilitados, los enlaces C–H de los grupos metilo son susceptibles a reacciones de radicales libres, incluida la halogenación a los correspondientes dicloruros de xileno (bis(clorometil)bencenos), mientras que la monobromación produce bromuro de xililo , un agente gaseoso lacrimógeno . La oxidación y la amoxidación también tienen como objetivo los grupos metilo, lo que produce ácidos dicarboxílicos y dinitrilos. Los electrófilos atacan el anillo aromático, lo que da lugar a cloro- y nitroxilenos. [3]
Salud y seguridad
El xileno es inflamable pero presenta una toxicidad aguda moderada, con una LD50 que oscila entre 200 y 5000 mg/kg para animales. La LD50 oral para ratas es de 4300 mg/kg. El principal mecanismo de desintoxicación es la oxidación a ácido metilbenzoico y la hidroxilación a hidroxileno. [3]
El principal efecto de la inhalación de vapor de xileno es la depresión del sistema nervioso central (SNC), con síntomas como dolor de cabeza, mareos, náuseas y vómitos. Con una exposición de 100 ppm, se pueden experimentar náuseas o dolor de cabeza. Con una exposición entre 200 y 500 ppm, los síntomas pueden incluir sensación de euforia, mareos, debilidad, irritabilidad, vómitos y tiempo de reacción más lento. [20] [21]
Los efectos secundarios de la exposición a bajas concentraciones de xileno ( < 200 ppm ) son reversibles y no causan daño permanente. La exposición a largo plazo puede provocar dolores de cabeza, irritabilidad, depresión, insomnio, agitación, cansancio extremo, temblores, pérdida de audición, problemas de concentración y pérdida de memoria a corto plazo. [22] [ Aclaración necesaria ] Una afección llamada encefalopatía crónica inducida por disolventes , comúnmente conocida como "síndrome de disolventes orgánicos", se ha asociado con la exposición al xileno. Hay muy poca información disponible que aísle el xileno de la exposición a otros disolventes en el examen de estos efectos. [20]
Los trastornos auditivos también se han relacionado con la exposición al xileno, tanto en estudios con animales de experimentación, [23] [24] como en estudios clínicos. [25] [26] [27]
El xileno también es un irritante cutáneo y elimina los aceites de la piel, lo que la hace más permeable a otras sustancias químicas. Se recomienda el uso de guantes y mascarillas impermeables, junto con respiradores cuando sea necesario, para evitar problemas de salud ocupacional derivados de la exposición al xileno. [20]
Los xilenos se metabolizan a ácidos metilhipúricos . [28] [29] La presencia de ácido metilhipúrico se puede utilizar como biomarcador para determinar la exposición al xileno. [29] [30]
Véase también
Referencias
- ^ Fuente: Liddell, Henry George ; Scott, Robert ; Un léxico griego-inglés en el Proyecto Perseo .
- ^ Harper, Douglas. "xileno". Diccionario Etimológico Online .
- ^ abcdefgh Fabri, Jörg; Graeser, Ulrich; Simo, Thomas A. (2000). "Xilenos". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a28_433. ISBN 978-3527306732.
- ^ Cannella, William J. (2000). "Xilenos y etilbenceno". Enciclopedia Kirk-Othmer de tecnología química . doi :10.1002/0471238961.2425120503011414.a01. ISBN 0471238961.
- ^ Tremblay, Jean-François (2011). "Fabricación de aromáticos en Singapur". Archivo de noticias de química e ingeniería . 89 (38): 18–19. doi :10.1021/cen-v089n038.p018.
- ^ Cahours, Auguste (1850) "Recherches sur les huiles légéres obtenues dans la distillation du bois" (Investigaciones de aceites ligeros obtenidos por destilación de madera), Compte rendus , 30 : 319-323; ver especialmente p. 321. De la pág. 321: "Je le désignerai sous le nomme xylène ". (Lo designaré con el nombre de xileno .) Nota: La fórmula empírica de Cahours para el xileno es incorrecta porque los químicos de esa época usaban la masa atómica incorrecta para el carbono (6 en lugar de 12).
- ^ Martindale, David C. y Kuchar, Paul J., Producción de xilenos a partir de hidrocarburos alifáticos ligeros mediante deshidrociclodimerización y metilación, Patente de Estados Unidos N.º 5.043.502, 27 de agosto de 1991. Consultado el 28 de abril de 2012.
- ^ "Xileno (isómeros mixtos), resumen de riesgo tóxico en el aire". Agencia de Protección Ambiental de los Estados Unidos . Consultado el 8 de febrero de 2015 .
- ^ ab Kandyala, Reena; Raghavendra, Sumanth Phani C.; Rajasekharan, Saraswathi T. (2010). "Xileno: una descripción general de sus riesgos para la salud y medidas preventivas". J Oral Maxillofac Pathol . 14 (1): 1–5. doi : 10.4103/0973-029X.64299 . PMC 2996004 . PMID 21180450.
- ^ ab Xylene (archivado el 11 de agosto de 2011 en Wayback Machine ), Agencia Sueca de Productos Químicos, apps.kemi.se, 2010. Consultado el 28 de abril de 2012.
- ^ "Captura de oportunidades para la producción de paraxileno". UOP, A Honeywell Company . Consultado el 8 de febrero de 2015 .
- ^ Clark JE; Luthy, RV (1955). "Separación de xilenos". Ind. Eng. Chem . 47 (2): 250–253. doi :10.1021/ie50542a028.
- ^ Stevenson, Cheryl D.; McElheny, Daniel J.; Kage, David E.; Ciszewski, James T.; Reiter, Richard C. (1998). "Separación de isómeros con punto de ebullición cercano e isotopómeros con punto de ebullición idéntico mediante extracción asistida por transferencia de electrones". Química analítica . 70 (18): 3880. doi :10.1021/ac980221b.
- ^ ICIS, Paraxileno-Ortoxileno | Precios, Noticias y Análisis de Mercado, icis.com, 2012. Consultado el 28 de abril de 2012.
- ^ Bostik, Hoja de datos de seguridad Blu-Tack (archivada el 11 de septiembre de 2011 en Wayback Machine ), n.º 13135, Bostik Corp., junio de 2007. Consultado el 28 de abril de 2012.
- ^ Samet, Wendy, (comp.), Apéndice I, Catálogo de conservación de pinturas, Instituto Americano para la Conservación de Obras Históricas y Artísticas, conservation-wiki.com, septiembre de 1997. Consultado el 28 de abril de 2012.
- ^ "Baños de enfriamiento". Wiki de química de la UC Davis. 2 de octubre de 2013. Archivado desde el original el 8 de febrero de 2015. Consultado el 8 de febrero de 2015 .
- ^ Cargille, John (1985) [1964], "Aceite de inmersión y microscopio", Anuario de la Sociedad Microscópica de Nueva York , archivado desde el original el 11 de septiembre de 2011 , consultado el 10 de marzo de 2011
- ^ Carson, Freida; Hladik, Christa (2009). Histotecnología: un texto autodidacta (3.ª ed.). American Society for Clinical Pathology Press. pág. 35. ISBN 9780891895817.
- ^ abc Kandyala, Reena; Raghavendra, Sumanth Phani C.; Rajasekharan, Saraswathi T. (1 de enero de 2010). "Xileno: una descripción general de sus riesgos para la salud y medidas preventivas". Revista de patología oral y maxilofacial . 14 (1): 1–5. doi : 10.4103/0973-029X.64299 . ISSN 0973-029X. PMC 2996004 . PMID 21180450.
- ^ "RESUMEN DE TOXICIDAD AGUDA: XILENOS" (PDF) . Archivado desde el original (PDF) el 22 de octubre de 2015.
- ^ "Xilenos (EHC 190, 1997)".
- ^ Gagnaire, F.; Marignac, B.; Langlais, C.; Bonnet, P. (julio de 2001). "Ototoxicidad en ratas expuestas a vapores de orto-, meta- y para-xileno durante 13 semanas". Farmacología y toxicología . 89 (1): 6–14. doi :10.1034/j.1600-0773.2001.d01-129.x. ISSN 0901-9928. PMID 11484912.
- ^ Gagnaire, F.; Marignac, B.; Blachère, V.; Grossmann, S.; Langlais, C. (7 de marzo de 2007). "El papel de la toxicocinética en la ototoxicidad inducida por xileno en ratas y cobayas". Toxicología . 231 (2–3): 147–158. doi :10.1016/j.tox.2006.11.075. ISSN 0300-483X. PMID 17210216.
- ^ Fuente, Adrian; McPherson, Bradley; Cardemil, Felipe (septiembre de 2013). "Disfunción auditiva inducida por xileno en humanos". Ear and Hearing . 34 (5): 651–660. doi :10.1097/AUD.0b013e31828d27d7. hdl : 10533/134303 . ISSN 1538-4667. PMID 23598724. S2CID 45206975.
- ^ Draper, THJ; Bamiou, D.-E. (abril de 2009). "Neuropatía auditiva en un paciente expuesto a xileno: informe de caso" (PDF) . The Journal of Laryngology & Otology . 123 (4): 462–465. doi :10.1017/S0022215108002399. ISSN 1748-5460. PMID 18439334. Archivado (PDF) desde el original el 2017-08-09.
- ^ Fuente, Adrian; McPherson, Bradley; Hood, Linda J. (noviembre de 2012). "Pérdida auditiva asociada a la exposición al xileno en un trabajador de laboratorio". Revista de la Academia Americana de Audiología . 23 (10): 824–830. doi :10.3766/jaaa.23.10.7. hdl : 10533/137495 . ISSN 1050-0545. PMID 23169198.
- ^ "ÁCIDOS HIPÚRICO y METIL HIPÚRICO en orina" (PDF) . Manual de métodos analíticos del NIOSH (NMAM) (cuarta edición).
- ^ ab Inoue, O.; Seiji, K.; Kawai, T.; Watanabe, T.; Jin, C.; Cai, SX; Chen, Z.; Qu, QS; Zhang, T.; Ikeda, M. (1993). "Excreción de ácidos metilhipúricos en la orina de trabajadores expuestos a una mezcla de xileno: Comparación entre tres isómeros de xileno y tolueno". Archivos internacionales de salud ocupacional y ambiental . 64 (7): 533–539. doi :10.1007/bf00381104. PMID 8482596. S2CID 21534640.
- ^ Kira S. (1977). "Medición por cromatografía de gases del ácido hipúrico y el ácido metilhipúrico urinarios como índices de exposición al tolueno y al xileno". Medicina ocupacional y ambiental . 34 (305–309): 305–309. doi :10.1136/oem.34.4.305. PMC 1008281 . PMID 588486.
Enlaces externos
- Chisholm, Hugh , ed. (1911). . Encyclopædia Britannica (11.ª ed.). Cambridge University Press.
- Guía de bolsillo del NIOSH sobre peligros químicos ( o -xileno)
- Guía de bolsillo del NIOSH sobre peligros químicos ( m -xileno)
- Guía de bolsillo del NIOSH sobre peligros químicos ( p -xileno)
- Xileno, resumen de riesgos (EPA) (isómeros mixtos)
- Los venenos para los oídos, The Synergist , Asociación Estadounidense de Higiene Industrial , noviembre de 2018

