Máquina de anestesia
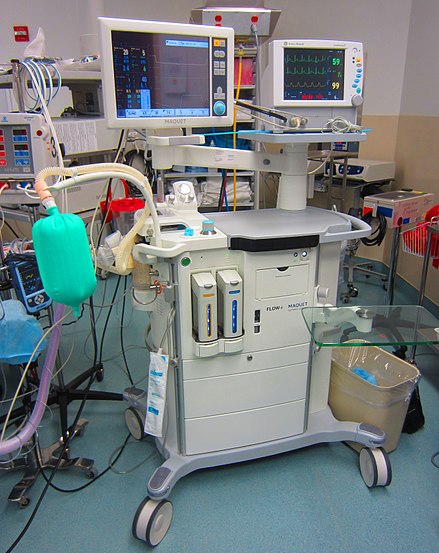 Una máquina de anestesia. Esta máquina en particular es un modelo "Flow-I", fabricado por Maquet , una división de Getinge Group , Getinge , Suecia. | |
| Tipo de proceso | cambio físico |
|---|---|
| Sector(es) industrial(es) | anestesiología ( medicina ) |
| Principales tecnologías o subprocesos | vaporización |
| Materia prima | Agentes anestésicos inhalatorios , principalmente óxido nitroso y anestésicos volátiles. |
| Producto(s) | Transición de fase de la materia prima de la fase líquida a la fase gaseosa . |
| Instalaciones principales | hospitales y centros de cirugía ambulatoria |
Una máquina de anestesia ( inglés británico ) o máquina de anestesia ( inglés americano ) es un dispositivo médico utilizado para generar y mezclar un flujo de gas fresco de gases médicos y agentes anestésicos inhalatorios con el fin de inducir y mantener la anestesia . [1]
La máquina se utiliza habitualmente junto con un respirador mecánico , un sistema de respiración , un equipo de succión y dispositivos de monitorización del paciente ; en sentido estricto, el término "máquina de anestesia" se refiere únicamente al componente que genera el flujo de gas, pero las máquinas modernas suelen integrar todos estos dispositivos en una unidad independiente combinada, a la que se denomina coloquialmente "máquina de anestesia" por motivos de simplicidad. En el mundo desarrollado, el tipo de uso más frecuente es la máquina de anestesia de flujo continuo o " máquina de Boyle ", que está diseñada para proporcionar un suministro preciso de gases médicos mezclados con una concentración precisa de vapor anestésico y para entregarlo de forma continua al paciente a una presión y un flujo seguros. Esto es distinto de las máquinas de anestesia de flujo intermitente , que proporcionan un flujo de gas solo a demanda cuando lo activa la propia inspiración del paciente.
En circunstancias especiales se pueden utilizar aparatos de anestesia más sencillos, como el aparato de anestesia triservicio, un sistema simplificado de administración de anestesia inventado para los Servicios Médicos de Defensa británicos , que es ligero y portátil y puede utilizarse para la ventilación incluso cuando no se dispone de gases médicos. Este dispositivo tiene válvulas unidireccionales que aspiran aire ambiente, que puede enriquecerse con oxígeno de un cilindro, con la ayuda de un conjunto de fuelles.
Historia
El concepto original de las máquinas de flujo continuo fue popularizado por la máquina de anestesia de Boyle, inventada por el anestesista británico Henry Boyle en el Hospital St Bartholomew de Londres , Reino Unido , en 1917, aunque se habían utilizado máquinas similares en Francia y Estados Unidos. [2] Antes de esta época, los anestesiólogos solían llevar consigo todo su equipo, pero el desarrollo de un almacenamiento de cilindros pesado y voluminoso y de un equipo de vías respiratorias cada vez más elaborado hizo que esto ya no fuera práctico para la mayoría de las circunstancias. Las máquinas de anestesia contemporáneas a veces todavía se denominan metonímicamente "máquina de Boyle", y suelen estar montadas sobre ruedas antiestáticas para un transporte cómodo.

Muchas de las primeras innovaciones en equipos de anestesia en los Estados Unidos, incluido el absorbedor de dióxido de carbono de circuito cerrado (también conocido como Guedel-Foregger Midget) y la difusión de dicho equipo entre los anestesiólogos en los Estados Unidos, se pueden atribuir a Richard von Foregger y The Foregger Company.
Caudal
En anestesia, el flujo de gas fresco es la mezcla de gases médicos y agentes anestésicos volátiles que se produce mediante una máquina de anestesia y que no ha sido recirculada. El anestesista determina el caudal y la composición del flujo de gas fresco . Normalmente, el flujo de gas fresco emerge de la salida de gas común, una salida específica en la máquina de anestesia a la que está conectado el accesorio de respiración. [3]
Los equipos de circuito abierto, como el accesorio Magill, requieren un flujo elevado de gas fresco (p. ej., 7 litros/min) para evitar que el paciente vuelva a respirar su propio dióxido de carbono espirado. Los sistemas de recirculación (rebreather) utilizan cal sodada para absorber el dióxido de carbono en el depurador, de modo que el gas espirado se vuelva apto para su reutilización. Con un sistema de recirculación muy eficiente, el flujo de gas fresco se puede reducir a los requisitos mínimos de oxígeno del paciente (p. ej., 250 ml/min), más un poco de volátil según sea necesario para mantener la concentración del agente anestésico.
Aumentar el flujo de gas fresco a un sistema respiratorio con recirculación puede reducir el consumo de absorbente de dióxido de carbono. Existe una relación costo-beneficio entre el flujo de gas y el uso de material adsorbente cuando no se utiliza un agente anestésico inhalatorio, lo que puede tener consecuencias económicas y ambientales. [3]
- La anestesia de alto flujo proporciona un flujo de gas fresco que se aproxima a la ventilación minuto del paciente, que suele ser de unos 3 a 6 litros por minuto en un adulto normal.
- La anestesia de bajo flujo proporciona un flujo de gas fresco de menos de la mitad de la ventilación minuto del paciente, que normalmente es menos de 3,0 litros por minuto en un adulto normal.
- La anestesia de flujo mínimo suministra un flujo de gas fresco de aproximadamente 0,5 litros por minuto.
- La anestesia con sistema cerrado suministra un flujo de gas fresco según sea necesario para completar el volumen de gas recirculado y compensar la necesidad de oxígeno y agentes anestésicos del paciente. [4]
Vaporizador anestésico

Un vaporizador anestésico ( en inglés americano ) o vaporizador anestésico ( en inglés británico ) es un dispositivo generalmente conectado a una máquina de anestesia que suministra una concentración dada de un agente anestésico volátil . Funciona controlando la vaporización de los agentes anestésicos a partir del líquido y luego controlando con precisión la concentración en la que se agregan al flujo de gas fresco. El diseño de estos dispositivos tiene en cuenta la variación de: temperatura ambiente, flujo de gas fresco y presión de vapor del agente . En general, existen dos tipos de vaporizadores: de cámara y de extracción. Ambos tienen distintas ventajas y desventajas. [5] El mezclador de gas-vapor de circuito doble es un tercer tipo de vaporizador utilizado exclusivamente para el agente desflurano .
Vaporizadores de plenum
El vaporizador de cámara de distribución funciona mediante presión positiva de la máquina de anestesia y, por lo general, está montado en la máquina. El rendimiento del vaporizador no cambia independientemente de si el paciente respira espontáneamente o está ventilado mecánicamente. La resistencia interna del vaporizador suele ser alta, pero debido a que la presión de suministro es constante, el vaporizador se puede calibrar con precisión para proporcionar una concentración precisa de vapor anestésico volátil en una amplia gama de flujos de gas fresco. [5] El vaporizador de cámara de distribución es un dispositivo elegante que funciona de manera confiable, sin energía externa, durante cientos de horas de uso continuo y requiere muy poco mantenimiento.
El vaporizador de cámara funciona dividiendo con precisión el gas entrante en dos corrientes. Una de estas corrientes pasa directamente a través del vaporizador en el canal de derivación. La otra se desvía hacia la cámara de vaporización. El gas en la cámara de vaporización se satura completamente con vapor anestésico volátil. Luego, este gas se mezcla con el gas en el canal de derivación antes de salir del vaporizador.
Un agente volátil típico, el isoflurano , tiene una presión de vapor saturado de 32 kPa (aproximadamente 1/3 de una atmósfera). Esto significa que la mezcla de gases que sale de la cámara de vaporización tiene una presión parcial de isoflurano de 32 kPa. A nivel del mar ( la presión atmosférica es de aproximadamente 101 kPa), esto equivale convenientemente a una concentración del 32%. Sin embargo, la salida del vaporizador normalmente se establece en 1-2%, lo que significa que solo una proporción muy pequeña del gas fresco necesita ser desviada a través de la cámara de vaporización (esta proporción se conoce como la relación de división). También se puede ver que un vaporizador de cámara de distribución solo puede funcionar en un sentido: si se conecta al revés, entran volúmenes mucho mayores de gas en la cámara de vaporización y, por lo tanto, se pueden entregar concentraciones de vapor potencialmente tóxicas o letales. (Técnicamente, aunque el dial del vaporizador está calibrado en porcentaje de volumen (por ejemplo, 2%), lo que realmente entrega es una presión parcial de agente anestésico (por ejemplo, 2 kPa)).
El rendimiento del vaporizador de cámara depende en gran medida de la presión de vapor saturado del agente volátil. Esto es exclusivo de cada agente, por lo que se deduce que cada agente debe utilizarse únicamente en su propio vaporizador específico. Se han ideado varios sistemas de seguridad, como el sistema Fraser-Sweatman, de modo que llenar un vaporizador de cámara con el agente incorrecto sea extremadamente difícil. Una mezcla de dos agentes en un vaporizador podría dar como resultado un rendimiento impredecible del vaporizador.
La presión de vapor saturado de cualquier agente varía con la temperatura, y los vaporizadores plenum están diseñados para funcionar dentro de un rango de temperatura específico. Tienen varias características diseñadas para compensar los cambios de temperatura (especialmente el enfriamiento por evaporación ). A menudo tienen una camisa metálica que pesa alrededor de 5 kg, que se equilibra con la temperatura de la habitación y proporciona una fuente de calor. Además, la entrada a la cámara de vaporización está controlada por una tira bimetálica , que admite más gas a la cámara a medida que se enfría, para compensar la pérdida de eficiencia de la evaporación.
El primer vaporizador plenum con compensación de temperatura fue el vaporizador de halotano Cyprane 'FluoTEC' , lanzado al mercado poco después de que el halotano se introdujera en la práctica clínica en 1956.
Vaporizadores Drawover
El vaporizador de extracción funciona gracias a la presión negativa que desarrolla el paciente, por lo que debe presentar una resistencia baja al flujo de gas. Su rendimiento depende del volumen minuto del paciente: su rendimiento disminuye a medida que aumenta la ventilación minuto.
El diseño del vaporizador de extracción es mucho más simple: en general, se trata de un simple depósito de vidrio montado en el accesorio de respiración. Los vaporizadores de extracción se pueden utilizar con cualquier agente volátil líquido (incluidos agentes más antiguos como el éter dietílico o el cloroformo , aunque sería peligroso utilizar desflurano ). Debido a que el rendimiento del vaporizador es tan variable, es imposible realizar una calibración precisa. Sin embargo, muchos diseños tienen una palanca que ajusta la cantidad de gas fresco que ingresa a la cámara de vaporización.
El vaporizador de extracción se puede montar en cualquier dirección y se puede utilizar en circuitos donde se realiza una nueva respiración o dentro del accesorio de respiración circular.
Los vaporizadores de sobrepresión no suelen tener funciones de compensación de temperatura. Con el uso prolongado, el agente líquido puede enfriarse hasta el punto de que se forme condensación e incluso escarcha en el exterior del depósito. Este enfriamiento perjudica la eficiencia del vaporizador. Una forma de minimizar este efecto es colocar el vaporizador en un recipiente con agua.
La relativa ineficiencia del vaporizador de extracción contribuye a su seguridad. Un diseño más eficiente produciría demasiado vapor anestésico. La concentración de salida de un vaporizador de extracción puede superar en gran medida la producida por un vaporizador de cámara de distribución, especialmente con flujos bajos. Para un uso más seguro, la concentración de vapor anestésico en el accesorio de respiración debe controlarse continuamente.
A pesar de sus inconvenientes, el vaporizador de drenaje es económico de fabricar y fácil de usar. Además, su diseño portátil significa que puede usarse en el campo o en anestesia veterinaria .
Mezclador de gas y vapor de doble circuito
La tercera categoría de vaporizador (el mezclador de gas y vapor de doble circuito) se creó específicamente para el agente desflurano . [5] El desflurano hierve a 23,5 °C, que es muy cercano a la temperatura ambiente. Esto significa que a temperaturas de funcionamiento normales , la presión de vapor saturado del desflurano cambia mucho con solo pequeñas fluctuaciones de temperatura. Esto significa que las características de un vaporizador de cámara normal no son suficientes para garantizar una concentración precisa de desflurano. Además, en un día muy cálido, todo el desflurano herviría y concentraciones muy altas (potencialmente letales) de desflurano podrían llegar al paciente.
Un vaporizador de desflurano (por ejemplo, el TEC 6 producido por Datex-Ohmeda) se calienta a 39 °C y se presuriza a 194 kPa. [6] Se monta en la máquina de anestesia de la misma manera que un vaporizador de cámara de distribución, pero su función es bastante diferente. Evapora una cámara que contiene desflurano utilizando calor e inyecta pequeñas cantidades de vapor de desflurano puro en el flujo de gas fresco. Un transductor detecta el flujo de gas fresco. [5]
Es necesario un período de calentamiento después de encenderlo. El vaporizador de desflurano fallará si se pierde la alimentación de la red eléctrica. Suenan alarmas si el vaporizador está casi vacío. Una pantalla electrónica indica el nivel de desflurano en el vaporizador.
El costo y la complejidad del vaporizador de desflurano han contribuido a la relativa falta de popularidad del desflurano, aunque en los últimos años está ganando popularidad.
Vaporizadores históricos
Históricamente, el éter (el primer agente volátil) fue utilizado por primera vez por John Snow en su inhalador (1847), pero fue reemplazado por el cloroformo (1848). Luego, el éter resurgió lentamente (1862-1872) con su uso regular a través de la "máscara" de Curt Schimmelbusch , una máscara de narcosis para gotear éter líquido. Ahora obsoleta, era una máscara construida con alambre y cubierta con tela.
La presión y la demanda de los cirujanos dentales para un método más confiable de administrar éter ayudaron a modernizar su administración. En 1877, Clover inventó un inhalador de éter con una camisa de agua y, a fines de 1899, surgieron alternativas al éter, principalmente debido a la introducción de la anestesia espinal. Posteriormente, esto resultó en la disminución del uso del éter (1930-1956) debido a la introducción del ciclopropano , el tricloroetileno y el halotano . En la década de 1980, el vaporizador anestésico había evolucionado considerablemente; las modificaciones posteriores dieron lugar a una serie de características de seguridad adicionales, como compensación de temperatura, una tira bimetálica , relación de división ajustada a la temperatura y medidas antiderrames.
Componentes de una máquina típica


El circuito de respiración es el conducto a través del cual fluyen los gases respiratorios desde la máquina hasta el paciente y viceversa, e incluye componentes para mezclar, ajustar y monitorear la composición del gas respiratorio y para eliminar el dióxido de carbono.
Una máquina de anestesia moderna incluye como mínimo los siguientes componentes: [2]
- Conexiones a oxígeno canalizado , aire medicinal y óxido nitroso desde un suministro de pared en el centro de atención médica, o cilindros de gas de reserva de oxígeno, aire y óxido nitroso conectados a través de un yugo de sistema de seguridad con índice de pasador con un sello Bodok
- Manómetros, reguladores y válvulas de seguridad para controlar la presión del gas en todo el sistema y proteger los componentes de la máquina y al paciente de aumentos excesivos. Una válvula limitadora de presión ajustable (comúnmente abreviada como válvula APL, y también conocida como válvula espiratoria, válvula de alivio o válvula de derrame) es parte del circuito respiratorio que permite que el exceso de gas salga del sistema mientras evita que entre aire ambiente. [7]
- Medidores de caudal como rotámetros para oxígeno, aire y óxido nitroso.
- Vaporizadores para proporcionar un control preciso de la dosis cuando se utilizan anestésicos volátiles
- Una descarga de oxígeno de alto flujo, que evita los medidores de flujo y los vaporizadores para proporcionar oxígeno puro a 30-75 litros/minuto.
- Sistemas para controlar los gases que se administran y exhalan al paciente, incluido un dispositivo de advertencia de insuficiencia de oxígeno
Se pueden incorporar sistemas para monitorizar la frecuencia cardíaca , el ECG , la presión arterial y la saturación de oxígeno del paciente , en algunos casos con opciones adicionales para monitorizar el dióxido de carbono y la temperatura al final de la espiración . [2] También se incorporan típicamente sistemas de respiración , incluida una bolsa de reservorio manual para ventilación en combinación con una válvula limitadora de presión ajustable , así como un ventilador mecánico integrado, para ventilar con precisión al paciente durante la anestesia. [2]
Características de seguridad de las máquinas modernas
Basándose en la experiencia adquirida a partir del análisis de accidentes, el moderno equipo de anestesia incorpora varios dispositivos de seguridad, entre ellos:
- Una alarma de falla de oxígeno (también conocida como "dispositivo de advertencia de falla de oxígeno" u OFWD). En las máquinas más antiguas, este era un dispositivo neumático llamado silbato Ritchie que suena cuando la presión de oxígeno desciende a 38 psi. Las máquinas más nuevas tienen un sensor electrónico.
- Dispositivo de protección contra falla de oxígeno o corte de nitroso, OFPD: el flujo de óxido nitroso médico depende de la presión de oxígeno. Esto se realiza a nivel del regulador. En esencia, el regulador de óxido nitroso es un "esclavo" del regulador de oxígeno, es decir, si se pierde la presión de oxígeno, los otros gases no pueden fluir más allá de su regulador.
- Alarmas de mezcla hipóxica (protectores de hipoxia o controladores de proporción) para evitar que se administren al paciente mezclas de gases que contengan menos del 21-25 % de oxígeno. En las máquinas modernas es imposible suministrar óxido nitroso al 100 % (o cualquier mezcla hipóxica) al paciente para que respire. El oxígeno se agrega automáticamente al flujo de gas fresco incluso si el anestesiólogo intenta suministrar óxido nitroso al 100 %. Los controladores de proporción generalmente funcionan según el principio neumático o están conectados en cadena (sistema de enlace 25). Ambos se encuentran en el conjunto del rotámetro, a menos que estén controlados electrónicamente.
- Alarmas del ventilador, que advierten de presiones bajas o altas en las vías respiratorias.
- enclavamientos entre los vaporizadores que evitan la administración inadvertida de más de un agente volátil simultáneamente
- Alarmas en todos los monitores fisiológicos anteriores
- El sistema de seguridad Pin Index evita que los cilindros se conecten accidentalmente al yugo incorrecto
- Sistema de seguridad NIST (rosca de tornillo no intercambiable) o sistema de índice de diámetro, DISS para gases de tuberías, que evita que los gases canalizados desde la pared se conecten accidentalmente a la entrada incorrecta de la máquina.
- Las mangueras de gas de tubería tienen conectores de válvula Schrader no intercambiables , lo que evita que las mangueras se conecten accidentalmente a la toma de pared incorrecta.
El funcionamiento de la máquina debe comprobarse al comienzo de cada lista de operaciones en un "simulacro de cabina". Las máquinas y los equipos asociados deben recibir mantenimiento y servicio con regularidad.
Las máquinas más antiguas pueden carecer de algunas de las características de seguridad y mejoras presentes en las máquinas más nuevas. Sin embargo, fueron diseñadas para funcionar sin electricidad de red , utilizando energía de gas comprimido para el respirador y el aparato de succión. Las máquinas modernas suelen tener una batería de respaldo, pero pueden fallar cuando esta se agota.
La máquina de anestesia moderna aún conserva todos los principios de funcionamiento clave de la máquina de Boyle ( nombre comercial de la British Oxygen Company ) en honor al anestesista británico Henry Boyle. En la India, sin embargo, el nombre comercial "Boyle" está registrado en Boyle HealthCare Pvt. Ltd., Indore MP.
Diversos organismos reguladores y profesionales han formulado listas de verificación para diferentes países. [8] Las máquinas deben limpiarse entre casos, ya que corren un riesgo considerable de contaminación con patógenos . [9]
Véase también
- Anestesia : Estado de pérdida temporal de la sensibilidad o la conciencia controlada médicamente.Páginas que muestran descripciones breves de los objetivos de redireccionamiento
- Vaporizador anestésico : dispositivo médico para suministrar una mezcla de gases anestésicos y de soporte vital.Páginas que muestran descripciones breves de los objetivos de redireccionamiento
- Aparato de respiración : Equipo que permite o ayuda al usuario a respirar en un entorno hostil.
- Depurador de dióxido de carbono : dispositivo que absorbe el dióxido de carbono del gas circulante.
- Ether Dome : anfiteatro quirúrgico histórico
- Historia de la anestesia general
- Cal sódica – Mezcla química para absorber dióxido de carbono
- Ventilador : Dispositivo que proporciona ventilación mecánica a los pulmones.
Referencias
- ^ Gurudatt C (septiembre de 2013). "La máquina de anestesia básica". Indian J Anaesth . 57 (5): 438–45. doi : 10.4103/0019-5049.120138 . PMC 3821260 . PMID 24249876.
- ^ abcd Steven M. Yentis, Nicholas P. Hirsch, James K. Ip (2013). "Máquina de anestesia". Anestesia y cuidados intensivos A–Z: una enciclopedia de principios y práctica. Elsevier Health Sciences. pág. 34. ISBN 978-0-7020-4420-5.
- ^ ab Zhong G, Abbas A, Jones J, Kong S, McCulloch T (noviembre de 2020). "Impacto ambiental y económico del uso de un mayor flujo de gas fresco para reducir el consumo de absorbentes de dióxido de carbono en ausencia de anestésicos inhalatorios". British Journal of Anaesthesia . 125 (5): 773–778. doi : 10.1016/j.bja.2020.07.043 . PMID 32859360.
- ^ "Qué y por qué de la anestesia de bajo flujo". clinicalview.gehealthcare.com . Julio de 2020 . Consultado el 12 de octubre de 2023 .
- ^ abcd Chakravarti S, Basu S (septiembre de 2013). "Vaporizadores de anestesia modernos". Indian J Anaesth . 57 (5): 464–71. doi : 10.4103/0019-5049.120142 . PMC 3821263 . PMID 24249879.
- ^ Boumphrey S, Marshall N (2011). "Entendiendo los vaporizadores". Educación continua en anestesia, cuidados críticos y dolor . 11 (6). Elsevier BV: 199–203. doi : 10.1093/bjaceaccp/mkr040 . ISSN 1743-1816.
- ^ Baha Al-Shaikh, Simon Stacey (2013). "Sistemas respiratorios". Fundamentos de los equipos de anestesia. Elsevier Health Sciences. págs. 55-73. ISBN 978-0-7020-4954-5.
- ^ "Recomendaciones internacionales para la verificación de equipos de anestesia - Máquina de anestesia virtual".
- ^ Baillie JK, P. Sultan, E. Graveling, C. Forrest, C. Lafong (2007). "Contaminación de máquinas de anestesia con organismos patógenos". Anestesia . 62 (12): 1257–61. doi : 10.1111/j.1365-2044.2007.05261.x . PMID 17991263. S2CID 24338540.
Lectura adicional
- Boumphrey S, Marshall, N. (10 de noviembre de 2011). "Entender los vaporizadores". Educación continua en anestesia, cuidados críticos y dolor . 11 (6): 199–203. doi : 10.1093/bjaceaccp/mkr040 .
- Eales M, Cooper, Robin (marzo de 2007). "Principios de los vaporizadores anestésicos". Anaesthesia & Intensive Care Medicine . 8 (3): 111–115. doi :10.1016/j.mpaic.2006.12.013.
- Hahn CE, Palayiwa, E, Sugg, BR, Lindsay-Scott, D (octubre de 1986). "Un vaporizador anestésico controlado por microprocesador". British Journal of Anaesthesia . 58 (10): 1161–6. doi : 10.1093/bja/58.10.1161 . PMID 3768229.
- Zuck D (septiembre de 1988). "El desarrollo del vaporizador anestésico". Anesthesia . 43 (9): 773–775. doi : 10.1111/j.1365-2044.1988.tb05754.x . PMID 3052161. S2CID 31549505.
- Sjølie K (30 de marzo de 1989). "[Peligro al volcar los vaporizadores de anestésicos]". Tidsskrift for den Norske Laegeforening (en noruego). 109 (9): 966–7. PMID 2705180.
- Andrew J Davey, Ali Diba (25 de abril de 2012). Equipo de anestesia de sala. Elsevier Health Sciences. pág. 48. ISBN 978-0-7020-4878-4.
- Patrick Magee, Mark Tooley (enero de 2005). Física, medición clínica y equipamiento de la práctica anestésica. Oxford University Press. pág. 51. ISBN 978-0-19-850859-5.
- Baha Al-Shaikh, Simon Stacey (2013). Fundamentos de equipos de anestesia4: Fundamentos de equipos de anestesia. Elsevier Health Sciences. pág. 30. ISBN 978-0-7020-4954-5.
Enlaces externos
- Máquina de anestesia virtual (VAM): una simulación de realidad transparente y gratuita de una máquina de anestesia genérica de la Universidad de Florida
- Diversas simulaciones relacionadas con la anestesia.
- Libro de texto de anestesia virtual
- AnaesthesiaUK.com: recursos para anestesistas británicos en formación
- Historia de Richard von Foregger y la Compañía Foregger: escrita por su hijo, R. Foregger, este sitio web relata la historia de uno de los principales fabricantes y desarrolladores de equipos de anestesiología de principios del siglo XX.
- Equipos e instrumentos de anestesia: definiciones y principios de uso práctico
- Recurso gratuito que explica gráficamente los principios de los vaporizadores de anestesia en howequipmentworks.com
- Máquina de anestesia: una presentación
- La máquina de gas anestésico de Michael P. Dosch
- Vaporizadores de precisión en Anaesthesia.UK
- Instrucciones de funcionamiento y pautas de mantenimiento para vaporizadores de precisión
