Batería redox de vanadio
| Energía específica | 10–20 Wh / kg (36–72 J/g) |
|---|---|
| Densidad de energía | 15–25 Wh/L (54–65 kJ/L) |
| Eficiencia energética | 75–90% [1] [2] |
| Durabilidad en el tiempo | 20–30 años |
| Durabilidad del ciclo | >12.000–14.000 ciclos [3] |
| Voltaje nominal de la celda | 1,15–1,55 V |



La batería redox de vanadio (VRB), también conocida como batería de flujo de vanadio (VFB) o batería de flujo redox de vanadio (VRFB), es un tipo de batería de flujo recargable . Emplea iones de vanadio como portadores de carga . [5] La batería utiliza la capacidad del vanadio de existir en una solución en cuatro estados de oxidación diferentes para hacer una batería con un solo elemento electroactivo en lugar de dos. [6] Por varias razones, incluida su volumen relativo, las baterías de vanadio se utilizan normalmente para el almacenamiento de energía de la red , es decir, conectadas a plantas de energía/redes eléctricas. [7]
Numerosas empresas y organizaciones participan en la financiación y el desarrollo de baterías redox de vanadio.
Historia
Pissoort mencionó la posibilidad de las baterías VRFB en la década de 1930. [8] Los investigadores de la NASA y Pellegri y Spaziante siguieron su ejemplo en la década de 1970, [9] pero ninguno tuvo éxito. Maria Skyllas-Kazacos presentó la primera demostración exitosa de una batería de flujo redox de vanadio que empleaba vanadio disuelto en una solución de ácido sulfúrico en la década de 1980. [10] [11] [12] Su diseño utilizaba electrolitos de ácido sulfúrico y fue patentado por la Universidad de Nueva Gales del Sur en Australia en 1986. [2]
Uno de los avances más importantes logrados por Skyllas-Kazacos y sus colaboradores fue el desarrollo de una serie de procesos para producir electrolitos de vanadio de más de 1,5 M de concentración utilizando el pentóxido de vanadio, un material de partida de menor coste pero insoluble. Estos procesos implicaban una disolución química y electroquímica y fueron patentados por la Universidad de Nueva Gales del Sur en 1989. Durante la década de 1990, el grupo de la UNSW llevó a cabo una amplia investigación sobre la selección de membranas, [13] [14] la activación del fieltro de grafito, [15] [16] la fabricación de electrodos bipolares de plástico conductor, [17] la caracterización y optimización de electrolitos, así como el modelado y la simulación. Se ensamblaron y probaron en campo varias baterías prototipo VFB de 1-5 kW en una casa solar en Tailandia y en un carrito de golf eléctrico en la UNSW. [18]
Las patentes y la tecnología de la batería de flujo redox de vanadio de la UNSW fueron licenciadas a Mitsubishi Chemical Corporation y Kashima-Kita Electric Power Corporation a mediados de la década de 1990 y posteriormente adquiridas por Sumitomo Electric Industries, donde se realizaron pruebas de campo exhaustivas en una amplia gama de aplicaciones a fines de la década de 1990 y principios de la década de 2000. [19]
Para ampliar el rango de temperatura de funcionamiento de la batería y evitar la precipitación de vanadio en el electrolito a temperaturas superiores a 40 ° C en el caso de V(V), o inferiores a 10 ° C en el caso de la solución de la semicelda negativa, Skyllas-Kazacos y sus colaboradores probaron cientos de aditivos orgánicos e inorgánicos como posibles inhibidores de la precipitación. Descubrieron que los compuestos inorgánicos de fosfato y amonio eran eficaces para inhibir la precipitación de soluciones de vanadio 2 M tanto en la semicelda negativa como en la positiva a temperaturas de 5 y 45 °C respectivamente y se seleccionó el fosfato de amonio como el agente estabilizador más eficaz. Se utilizaron aditivos de amonio y fosfato para preparar y probar un electrolito de vanadio 3 M en una celda de flujo con excelentes resultados. [19]

Ventajas y desventajas
Ventajas
Principales ventajas de las VRFB frente a otros tipos de baterías: [21]
- Sin límite de capacidad energética
- Puede permanecer descargado indefinidamente sin sufrir daños.
- La mezcla de electrolitos no causa daños permanentes.
- El estado de carga única en todos los electrolitos evita la degradación de la capacidad.
- Electrolito acuoso seguro y no inflamable.
- Sin ruido ni emisiones
- Se pueden agregar módulos de batería para satisfacer la demanda.
- Amplio rango de temperatura de funcionamiento, incluida refrigeración pasiva [22] [23]
- Larga vida útil del ciclo de carga/descarga: 15 000-20 000 ciclos y 10-20 años.
- bajo costo nivelado (unas pocas decenas de centavos), acercándose al objetivo de $0,05 para 2016 establecido por el Departamento de Energía de los Estados Unidos y el Plan Estratégico de Tecnología Energética de la Comisión Europea, que es de €0,05. [24]
Desventajas
Principales desventajas de las VRFB frente a otros tipos de baterías: [21]
- precios altos y volátiles de los minerales de vanadio (es decir, el costo de la energía VRFB)
- Eficiencia de ida y vuelta relativamente pobre (en comparación con las baterías de iones de litio )
- Peso pesado de electrolito acuoso.
- Relación energía-volumen relativamente pobre en comparación con las baterías de almacenamiento estándar
- que tiene partes móviles en las bombas que producen el flujo de solución electrolítica
- Toxicidad de los compuestos de vanadio (V).
Materiales



Electrodo
Los electrodos en una celda VRB están basados en carbono. Se han reportado varios tipos de electrodos de carbono utilizados en celdas VRB, tales como fieltro de carbono, papel de carbono, tela de carbono y fieltro de grafito. [25] [26] [27] Los materiales basados en carbono tienen las ventajas de bajo costo, baja resistividad y buena estabilidad. Entre ellos, el fieltro de carbono y el fieltro de grafito son los preferidos debido a sus estructuras de red tridimensionales mejoradas y áreas superficiales específicas más altas, así como buena conductividad y estabilidad química y electroquímica. [28] [29] El electrodo basado en carbono prístino exhibe hidrofobicidad y actividad catalítica limitada cuando interactúa con especies de vanadio. Para mejorar su desempeño catalítico y humectabilidad, se han empleado varios enfoques, incluyendo tratamiento térmico, tratamiento ácido, modificación electroquímica y la incorporación de catalizadores. [27] [30] El fieltro de carbono se produce típicamente pirolizando fibras de poliacrilonitrilo (PAN) o rayón a aproximadamente 1500 °C y 1400 °C, respectivamente. Por otra parte, el fieltro de grafito sufre una pirólisis a una temperatura más alta, de unos 2400 °C. Para activar térmicamente los electrodos de fieltro, el material se calienta a 400 °C en una atmósfera que contenga aire u oxígeno. Este proceso aumenta significativamente la superficie del fieltro, mejorándola por un factor de 10. [31] La actividad hacia las especies de vanadio se atribuye al aumento de los grupos funcionales de oxígeno, como el grupo carbonilo (C=O) y el grupo carboxilo (CO), después del tratamiento térmico en aire. [32] Actualmente no hay consenso con respecto a los grupos funcionales específicos y los mecanismos de reacción que dictan la interacción de las especies de vanadio en la superficie del electrodo. Se ha propuesto que la reacción V(II)/V(III) sigue un mecanismo de esfera interna, mientras que la reacción V(IV)/V(V) tiende a proceder a través de un mecanismo de esfera externa. [30]
Electrólito
Ambos electrolitos están basados en vanadio . El electrolito en las semiceldas positivas contiene iones VO 2 + y VO 2+ , mientras que el electrolito en las semiceldas negativas consta de iones V 3+ y V 2+ . Los electrolitos se pueden preparar mediante varios procesos, incluida la disolución electrolítica de pentóxido de vanadio (V 2 O 5 ) en ácido sulfúrico (H 2 SO 4 ). [33] La solución es fuertemente ácida en uso.
Membrana
El material de membrana más común es el ácido sulfónico perfluorado (PFSA o Nafion ). Sin embargo, los iones de vanadio pueden penetrar una membrana de PFSA, un fenómeno conocido como entrecruzamiento, lo que reduce la capacidad energética de la batería. [34] [35] Un estudio de 2021 descubrió que la penetración se reduce con láminas híbridas fabricadas mediante el crecimiento de nanopartículas de trióxido de tungsteno en la superficie de láminas de óxido de grafeno de una sola capa. Estas láminas híbridas luego se incrustan en una membrana de PFSA con estructura tipo sándwich reforzada con politetrafluoroetileno (teflón). Las nanopartículas también promueven el transporte de protones, ofreciendo una alta eficiencia culómbica y una eficiencia energética de más del 98,1 por ciento y el 88,9 por ciento, respectivamente. [36]
Campo de flujo
Las pérdidas resistivas identificadas por la curva de polarización se pueden atribuir a tres áreas principales: pérdida de activación, pérdida óhmica y pérdida de transporte de masa . La pérdida de activación surge de la cinética de transferencia de carga lenta entre la superficie del electrodo y el electrolito. Las pérdidas óhmicas son de la resistencia óhmica del electrolito, el electrodo, la membrana y el colector de corriente. Las pérdidas óhmicas se pueden reducir mediante un diseño de celda mejorado, como un diseño de celda de espacio cero y un espesor de membrana reducido. [37] Las pérdidas de transporte de masa se deben a la falta de especies de vanadio activas que se transportan a la superficie del electrodo. El diseño del campo de flujo que promueve el transporte de masa convectivo es crucial para reducir las pérdidas de transporte de masa. [38] [39] Los diseños de campo de flujo serpentino e interdigitado se produjeron mecanizando una placa bipolar adyacente al electrodo poroso. El electrodo de fieltro también se puede cortar para crear un canal de flujo de electrolito. [40] [41] Se ha demostrado que tanto los campos de flujo serpentinos como los interdigitados mejoran el transporte de masa, lo que reduce la polarización del transporte de masa y, por lo tanto, aumenta la densidad de corriente limitante y la densidad de potencia máxima. A veces se colocan dispensadores de flujo en la celda para distribuir el flujo y reducir los chorros. El campo de flujo también debe estar diseñado para proporcionar una distribución uniforme del electrolito para evitar zonas muertas en la celda y reducir la caída de presión en la pila de celdas. [41] [42]
Operación
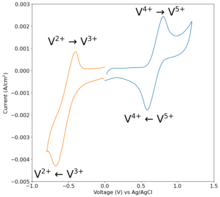
La reacción utiliza las semirreacciones : [43]
- En voz alta+2+ 2H + + e − → VO 2+ + H 2 O ( E° = +1,00 V ) [44]
- V 3+ + mi − → V 2+ ( mi° = −0,26 V ) [45]
Otras propiedades útiles de las baterías de flujo de vanadio son su rápida respuesta a los cambios de carga y su capacidad de sobrecarga. Pueden alcanzar un tiempo de respuesta de menos de medio milisegundo para un cambio de carga del 100% y permiten sobrecargas de hasta el 400% durante 10 segundos. El tiempo de respuesta está limitado principalmente por el equipo eléctrico. A menos que estén diseñadas específicamente para climas más fríos o más cálidos, la mayoría de las baterías de vanadio basadas en ácido sulfúrico funcionan entre aproximadamente 10 y 40 °C. Por debajo de ese rango de temperatura, el ácido sulfúrico infundido con iones cristaliza. [46] La eficiencia de ida y vuelta en aplicaciones prácticas es de alrededor del 70-80%. [47]
Mejoras propuestas
El diseño original de VRFB por Skyllas-Kazacos empleó sulfato (añadido como sulfato(s) de vanadio y ácido sulfúrico) como único anión en soluciones VRFB, lo que limitó la concentración máxima de vanadio a 1,7 M de iones de vanadio. [48] En la década de 1990, Skyllas-Kazacos descubrió el uso de fosfato de amonio y otros compuestos inorgánicos como inhibidores de precipitación para estabilizar soluciones de vanadio 2 M en un rango de temperatura de 5 a 45 ° C y la UNSW presentó una patente de agente estabilizador en 1993. Sin embargo, este descubrimiento fue en gran medida pasado por alto y alrededor de 2010 un equipo del Laboratorio Nacional del Pacífico Noroeste propuso un electrolito mixto de sulfato- cloruro , que permitió el uso en soluciones VRFB con una concentración de vanadio de 2,5 M en todo un rango de temperatura entre −20 y +50 °C. [49] [50] Con base en el potencial de equilibrio estándar del par V 5+ /V 4+ se espera que se oxide el cloruro, y por esta razón se evitaron las soluciones de cloruro en estudios anteriores de VRFB. La sorprendente estabilidad oxidativa (aunque solo en el estado de carga por debajo de ca. 80%) de las soluciones de V 5+ en presencia de cloruro se explicó sobre la base de coeficientes de actividad. [51] Muchos investigadores explican la mayor estabilidad de V(V) a temperaturas elevadas por la mayor concentración de protones en el electrolito ácido mixto que cambia el equilibrio de precipitación térmica de V(V) lejos de V 2 O 5 . Sin embargo, debido a una alta presión de vapor de las soluciones de HCl y la posibilidad de generación de cloro durante la carga, dichos electrolitos mixtos no han sido ampliamente adoptados. [52]
Otra variación es el uso de sales de bromuro de vanadio. Dado que el potencial redox del par Br 2 /2Br - es más negativo que el de V 5+ /V 4+ , el electrodo positivo funciona a través del proceso de bromo . [53] Sin embargo, debido a problemas con la volatilidad y corrosividad de Br 2 , no ganaron mucha popularidad (ver batería de zinc-bromo para un problema similar). También se ha propuesto una batería de flujo de vanadio / cerio . [54]
Energía específica y densidad energética
Las baterías recargables de plomo-ácido alcanzan una energía específica de aproximadamente 20 Wh/kg (72 kJ/kg) de electrolito. Los inhibidores de precipitación pueden aumentar la densidad a aproximadamente 35 Wh/kg (126 kJ/kg), y es posible alcanzar densidades más altas controlando la temperatura del electrolito. La energía específica es baja en comparación con otros tipos de baterías recargables (por ejemplo, las de plomo-ácido, 30-40 Wh/kg (108-144 kJ/kg); y las de iones de litio, 80-200 Wh/kg (288-720 kJ/kg)). [ cita requerida ]
Aplicaciones
La gran capacidad potencial de los VRFB puede ser la más adecuada para amortiguar la producción irregular de sistemas eólicos y solares a gran escala. [21]
Su reducida autodescarga los hace potencialmente apropiados en aplicaciones que requieren almacenamiento de energía a largo plazo con poco mantenimiento, como en equipos militares, como los componentes sensores del sistema de mina GATOR . [55] [21]
Presentan tiempos de respuesta rápidos que los hacen muy adecuados para aplicaciones de sistemas de alimentación ininterrumpida (UPS), donde pueden reemplazar baterías de plomo-ácido o generadores diésel . Un tiempo de respuesta rápido también es beneficioso para la regulación de frecuencia . Estas capacidades hacen que los VRFB sean una solución "todo en uno" eficaz para microrredes , regulación de frecuencia y cambio de carga. [21]
Las baterías de rejilla de vanadio más grandes
| Nombre | Fecha de puesta en servicio | Energía ( MWh ) | Potencia ( MW ) | Duración (horas) | País |
|---|---|---|---|---|---|
| Subestación Minami Hayakita [56] [57] | Diciembre de 2015 | 60 | 15 | 4 | Japón |
| Valle del Pfinz , Baden-Wurtemberg [58] [59] [60] | Septiembre de 2019 | 20 | 2 | 10 | Alemania |
| Woniushi, Liaoning [61] [62] | 10 | 5 | 2 | Porcelana | |
| Parque eólico de Tomamae [63] | 2005 | 6 | 4 | 1:30 | Japón |
| Proyecto Zhangbei [64] | 2016 | 8 | 2 | 4 | Porcelana |
| Proyecto SnoPUD MESA 2 [65] [66] | Marzo de 2017 | 8 | 2 | 4 | EE.UU |
| Subestación San Miguel [67] | 2017 | 8 | 2 | 4 | EE.UU |
| Pullman Washington [68] | Abril de 2015 | 4 | 1 | 4 | EE.UU |
| Batería de Dalian [69] | Octubre de 2022 | 400 (800) | 100 (200) | 4 | Porcelana |
Empresas que financian o desarrollan baterías redox de vanadio
Las empresas que financian o desarrollan baterías redox de vanadio incluyen Sumitomo Electric Industries , [70] CellCube (Enerox), [71] UniEnergy Technologies , [72] StorEn Technologies [73] [74] en Australia, Largo Energy [75] y Ashlawn Energy [76] en los Estados Unidos; H2 en Gyeryong-si, Corea del Sur; [77] Renewable Energy Dynamics Technology, [78] Invinity Energy Systems [79] en el Reino Unido, VoltStorage [80] y Schmalz [81] [82] en Europa; Prudent Energy [83] en China; Australian Vanadium, CellCube y North Harbour Clean Energy [84] [85] en Australia; Yadlamalka Energy Trust e Invinity Energy Systems [86] [87] en Australia; EverFlow Energy JV SABIC SCHMID Group en Arabia Saudita [88] y Bushveld Minerals en Sudáfrica. [89]
Véase también
- Lista de tipos de baterías
- Batería de bromuro de polisulfuro
- Batería eléctrica
- Pila de combustible
- Almacenamiento de energía
Citas
- ^ Skyllas-Kazacos, Maria; Kasherman, D.; Hong, DR; Kazacos, M. (septiembre de 1991). "Características y rendimiento de una batería redox de vanadio de 1 kW de la UNSW". Journal of Power Sources . 35 (4): 399–404. Bibcode :1991JPS....35..399S. doi :10.1016/0378-7753(91)80058-6.
- ^ ab M. Skyllas-Kazacos, M. Rychcik y R. Robins, en la patente AU 575247 (1986), de Unisearch Ltd.
- ^ Almacenamiento de electricidad y energías renovables: costos y mercados hasta 2030. IRENA (2017), Almacenamiento de electricidad y energías renovables: costos y mercados hasta 2030, Agencia Internacional de Energías Renovables, Abu Dhabi.
- ^ Qi, Zhaoxiang; Koenig, Gary M. (julio de 2017). "Artículo de revisión: Sistemas de baterías de flujo con materiales electroactivos sólidos". Journal of Vacuum Science & Technology B, Nanotechnology and Microelectronics: Materials, Processing, Measurement, and Phenomena . 35 (4): 040801. Bibcode :2017JVSTB..35d0801Q. doi : 10.1116/1.4983210 . ISSN 2166-2746.
- ^ Laurence Knight (14 de junio de 2014). "Vanadio: el metal que pronto podría abastecer de energía a su vecindario". BBC . Consultado el 2 de marzo de 2015 .
- ^ Alotto, P.; Guarnieri, M.; Moro, F. (2014). "Baterías de flujo redox para el almacenamiento de energía renovable: una revisión". Renewable & Sustainable Energy Reviews . 29 : 325–335. Bibcode :2014RSERv..29..325A. doi :10.1016/j.rser.2013.08.001. hdl :11577/2682306.
- ^ James Purtill (2 de febrero de 2023). «Las baterías de flujo redox de vanadio pueden proporcionar almacenamiento de energía de red a gran escala y a bajo precio. Así es como funcionan». Australian Broadcasting Corporation . Consultado el 25 de junio de 2023 .
- ^ PA Pissoort, en la patente francesa 754065 (1933)
- ^ A. Pelligri y PM Spaziante, en patente GB 2030349 (1978), a Oronzio de Nori Impianti Elettrochimici SpA
- ^ Rychik, M.; Skyllas-Kazacos, M. (enero de 1988). "Características de una nueva batería de flujo redox de vanadio". Journal of Power Sources . 22 (1): 59–67. Bibcode :1988JPS....22...59R. doi :10.1016/0378-7753(88)80005-3.
- ^ "Descubrimiento e invención: cómo comenzó la historia de las baterías de flujo de vanadio". Noticias sobre almacenamiento de energía . 18 de octubre de 2021. Archivado desde el original el 18 de octubre de 2021.
- ^ "Batería Redox de vanadio | Investigación de la UNSW". research.unsw.edu.au .
- ^ Chieng, SC; Kazacos, M.; Skyllas-Kazacos, M. (1992). "Preparación y evaluación de membranas compuestas para aplicaciones de baterías redox de vanadio". Journal of Power Sources . 39 (1): 11–19. Bibcode :1992JPS....39...11C. doi :10.1016/0378-7753(92)85002-R.
- ^ Chieng, SC; Kazacos, M.; Skyllas-Kazacos, M. (16 de diciembre de 1992). "Modificación de Daramic, separador microporoso, para aplicaciones de baterías de flujo redox". Journal of Membrane Science . 75 (1–2): 81–91. doi :10.1016/0376-7388(92)80008-8.
- ^ Sun, B.; Skyllas-Kazacos, M. (junio de 1992). "Modificación de materiales de electrodos de grafito para aplicaciones de baterías de flujo redox de vanadio—I. Tratamiento térmico". Electrochimica Acta . 37 (7): 1253–1260. doi :10.1016/0013-4686(92)85064-R.
- ^ Sun, Bianting; Skyllas-Kazacos, Maria (octubre de 1992). "Modificación química de materiales de electrodos de grafito para aplicaciones de baterías de flujo redox de vanadio, parte II. Tratamientos ácidos". Electrochimica Acta . 37 (13): 2459–2465. doi :10.1016/0013-4686(92)87084-D.
- ^ Zhong, S.; Kazacos, M.; Burford, RP; Skyllas-Kazacos, M. (octubre de 1991). "Estudios de fabricación y activación de electrodos compuestos de plástico conductor para celdas redox". Journal of Power Sources . 36 (1): 29–43. Bibcode :1991JPS....36...29Z. doi :10.1016/0378-7753(91)80042-V.
- ^ Tang, Ao; McCann, John; Bao, Jie; Skyllas-Kazacos, Maria (noviembre de 2013). "Investigación del efecto de la corriente de derivación en la eficiencia de la batería y la temperatura de la pila en la batería de flujo redox de vanadio". Journal of Power Sources . 242 : 349–356. Bibcode :2013JPS...242..349T. doi :10.1016/j.jpowsour.2013.05.079.
- ^ ab Skyllas-Kazacos, Maria (1 de julio de 2022). "Revisión: aspectos destacados del desarrollo de baterías redox totalmente de vanadio de la UNSW: 1983 hasta la actualidad". Revista de la Sociedad Electroquímica . 169 (7): 070513. Código Bibliográfico :2022JElS..169g0513S. doi :10.1149/1945-7111/ac7bab. S2CID 250007049.
- ^ Tolmachev, Yuriy V. (1 de marzo de 2023). "Revisión: baterías de flujo desde 1879 hasta 2022 y más allá". Revista de la Sociedad Electroquímica . 170 (3): 030505. Código Bibliográfico :2023JElS..170c0505T. doi : 10.1149/1945-7111/acb8de . S2CID 256592096.
- ^ abcde Ragsdale, Rose (mayo de 2020). "El vanadio impulsa la creciente demanda de VRFB". Metal Tech News . Consultado el 15 de noviembre de 2021 .
- ^ "Baterías de flujo redox de vanadio" (PDF) . Laboratorio Nacional del Pacífico Noroeste. Octubre de 2012.
- ^ Miller, Kelsey. UniEnergy Technologies Goes from Molecules to Megawatts Archivado el 31 de enero de 2016 en Wayback Machine , Clean Tech Alliance, 7 de julio de 2014. Consultado el 21 de enero de 2016.
- ^ Spagnuolo, G.; Petrone, G.; Mattavelli, P.; Guarnieri, M. (2016). "Baterías de flujo redox de vanadio: potenciales y desafíos de una tecnología de almacenamiento emergente". Revista de Electrónica Industrial IEEE . 10 (4): 20–31. doi :10.1109/MIE.2016.2611760. hdl : 11577/3217695 . S2CID 28206437.
- ^ Baterías de flujo. Volumen 1 . Weinheim: Wiley-VCH. 2023.ISBN 978-3-527-35171-8.
- ^ Lourenssen, Kyle; Williams, James; Ahmadpour, Faraz; Clemmer, Ryan; Tasnim, Syeda (octubre de 2019). "Baterías de flujo redox de vanadio: una revisión exhaustiva". Journal of Energy Storage . 25 : 100844. Bibcode :2019JEnSt..2500844L. doi :10.1016/j.est.2019.100844.
- ^ ab Él, Zhangxing; Lv, Yanrong; Zhang, Tianao; Zhu, Ye; Dai, Lei; Yao, Shuo; Zhu, Wenjie; Wang, Ling (enero de 2022). "Materiales de electrodos para baterías de flujo redox de vanadio: tratamiento intrínseco e introducción de catalizador". Revista de Ingeniería Química . 427 : 131680. Código bibliográfico : 2022ChEnJ.42731680H. doi :10.1016/j.cej.2021.131680.
- ^ Chakrabarti, MH; Brandon, NP; Hajimolana, SA; Tariq, F.; Yufit, V.; Hashim, MA; Hussain, MA; Low, CTJ; Aravind, PV (mayo de 2014). "Aplicación de materiales de carbono en baterías de flujo redox". Journal of Power Sources . 253 : 150–166. Código Bibliográfico :2014JPS...253..150C. doi :10.1016/j.jpowsour.2013.12.038.
- ^ Singh, Manoj K.; Kapoor, Manshu; Verma, Anil (mayo de 2021). "Avances recientes en electrocatalizadores basados en carbono y metales para baterías de flujo redox de vanadio". WIREs Energy and Environment . 10 (3). Bibcode :2021WIREE..10E.393S. doi :10.1002/wene.393.
- ^ ab Bourke, Andrea; Oboroceanu, Daniela; Quill, Nathan; Lenihan, Catherine; Safi, Maria Alhajji; Miller, Mallory A.; Savinell, Robert F.; Wainright, Jesse S.; SasikumarSP, Varsha; Rybalchenko, Maria; Amini, Pupak; Dalton, Niall; Lynch, Robert P.; Buckley, D. Noel (1 de marzo de 2023). "Revisión: cinética de electrodos y estabilidad de electrolitos en baterías de flujo de vanadio". Revista de la Sociedad Electroquímica . 170 (3): 030504. Código Bibliográfico :2023JElS..170c0504B. doi :10.1149/1945-7111/acbc99.
- ^ Huong Le, Thi Xuan; Bechelany, Mikhael; Cretin, Marc (octubre de 2017). "Electrodos basados en fieltro de carbono para aplicaciones energéticas y medioambientales: una revisión" (PDF) . Carbon . 122 : 564–591. Bibcode :2017Carbo.122..564H. doi :10.1016/j.carbon.2017.06.078.
- ^ Parasuraman, Aishwarya; Lim, Tuti Mariana; Menictas, Chris; Skyllas-Kazacos, María (julio de 2013). "Revisión de la investigación y el desarrollo de materiales para aplicaciones de baterías de flujo redox de vanadio". Acta electroquímica . 101 : 27–40. doi :10.1016/j.electacta.2012.09.067.
- ^ Guo, Yun; Huang, Jie; Feng, Jun-Kai (febrero de 2023). "Avances en la investigación sobre la preparación de electrolitos para baterías de flujo redox de vanadio". Journal of Industrial and Engineering Chemistry . 118 : 33–43. doi :10.1016/j.jiec.2022.11.037. S2CID 253783900.
- ^ Zhang, Yue; Zhang, Denghua; Luan, Chao; Zhang, Yifan; Yu, Wenjie; Liu, Jianguo; Yan, Chuanwei (24 de febrero de 2023). "Una membrana compuesta económica con alta selectividad de iones para baterías de flujo de vanadio". Membranas . 13 (3): 272. doi : 10.3390/membranas13030272 . PMC 10057319 . PMID 36984659.
- ^ Tempelman, CHL; Jacobs, JF; Balzer, RM; Degirmenci, V. (1 de diciembre de 2020). "Membranas para todas las baterías de flujo redox de vanadio". Journal of Energy Storage . 32 : 101754. Bibcode :2020JEnSt..3201754T. doi : 10.1016/j.est.2020.101754 .
- ^ Lavars, Nick (12 de noviembre de 2021). "Baterías de flujo de bordes de membrana híbridas hacia el almacenamiento de energía a escala de red". Nuevo Atlas . Consultado el 14 de noviembre de 2021 .
- ^ Shi, Yu; Eze, Chika; Xiong, Binyu; He, Weidong; Zhang, Han; Lim, TM; Ukil, A.; Zhao, Jiyun (marzo de 2019). "Desarrollo reciente de membrana para aplicaciones de baterías de flujo redox de vanadio: una revisión". Applied Energy . 238 : 202–224. Bibcode :2019ApEn..238..202S. doi :10.1016/j.apenergy.2018.12.087. hdl : 10356/144619 .
- ^ Milshtein, Jarrod D.; Tenny, Kevin M.; Barton, John L.; Drake, Javit; Darling, Robert M.; Brushett, Fikile R. (2017). "Cuantificación de las tasas de transferencia de masa en baterías de flujo redox". Revista de la Sociedad Electroquímica . 164 (11): E3265–E3275. doi : 10.1149/2.0201711jes .
- ^ Aaron, Doug; Tang, Zhijiang; Papandrew, Alexander B.; Zawodzinski, Thomas A. (octubre de 2011). "Análisis de la curva de polarización de baterías de flujo redox de vanadio". Journal of Applied Electrochemistry . 41 (10): 1175–1182. doi :10.1007/s10800-011-0335-7.
- ^ Reed, David; Thomsen, Edwin; Li, Bin; Wang, Wei; Nie, Zimin; Koeppel, Brian; Kizewski, James; Sprenkle, Vincent (2016). "Desarrollos de pilas en una batería de flujo redox de ácido mixto de vanadio de clase kW en el Laboratorio Nacional del Pacífico Noroeste". Revista de la Sociedad Electroquímica . 163 (1): A5211–A5219. doi : 10.1149/2.0281601jes .
- ^ ab Arenas, LF; Ponce de León, C.; Walsh, FC (junio de 2017). "Aspectos de ingeniería del diseño, construcción y rendimiento de baterías modulares de flujo redox para almacenamiento de energía" (PDF) . Journal of Energy Storage . 11 : 119–153. Bibcode :2017JEnSt..11..119A. doi :10.1016/j.est.2017.02.007.
- ^ Yao, Yanxin; Lei, Jiafeng; Shi, Yang; Ai, Fei; Lu, Yi-Chun (11 de febrero de 2021). "Métodos de evaluación y métricas de rendimiento para baterías de flujo redox". Nature Energy . 6 (6): 582–588. Código Bibliográfico :2021NatEn...6..582Y. doi :10.1038/s41560-020-00772-8.
- ^ Jin, Jutao; Fu, Xiaogang; Liu, Qiao; Liu, Yanru; Wei, Zhiyang; Niu, Kexing; Zhang, Junyan (25 de junio de 2013). "Identificación del sitio activo en grafeno dopado con nitrógeno para la reacción redox VO 2+ /VO 2 +". ACS Nano . 7 (6): 4764–4773. doi :10.1021/nn3046709. PMID 23647240.
- ^ Algodón, F. Albert ; Wilkinson, Geoffrey ; Murillo, Carlos A.; Bochmann, Manfred (1999), Química inorgánica avanzada (6.ª ed.), Nueva York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Atkins, Peter (2010). Química inorgánica (5.ª ed.). WH Freeman. pág. 153. ISBN 978-1-42-921820-7.
- ^ DOE/Laboratorio Nacional del Pacífico Noroeste (17 de marzo de 2011). «Electric Grid Reliability: Increasing Energy Storage in Vanadium Redox Batteries by 70 Percent» (Fiabilidad de la red eléctrica: aumento del almacenamiento de energía en baterías de vanadio redox en un 70 por ciento). Science Daily . Consultado el 2 de marzo de 2015 .
- ^ Revankar, Shripad T. (2019). "Capítulo 6. Almacenamiento de energía química". En Bindra, Hitesh y Revankar, Shripad (eds.). Almacenamiento e hibridación de energía nuclear: integración tecnoeconómica de energías renovables y nucleares . Londres: Academic Press. págs. 177–227. doi :10.1016/B978-0-12-813975-2.00006-5. ISBN 9780128139752.S2CID 189154686 .
- ^ M. Skyllas-Kazacos, M. Rychcik y G. Robins Robert, "Batería redox de vanadio". 1986AU-0055562 2 de abril de 1986. M. Skyllas-Kazacos, "Batería redox de vanadio y aditivos". 1988WO-AU00472 9 de diciembre de 19881989AU-0028153 9 de diciembre de 1989. M. Skyllas-Kazacos, M. Kazacos y C. Mcdermott Rodney John, "Celda de carga de vanadio y sistema de batería dual de vanadio". 1989AU-0028152 9 de diciembre de 1989. M. Kazacos y S. Kazacos Maria, "Soluciones de electrolitos de vanadio de alta densidad energética, métodos de preparación de las mismas y celdas y baterías redox totalmente de vanadio que contienen soluciones de electrolitos de vanadio de alta energía". 1996AT-0911853T 1996-05-031996AU-0054914 1996-05-031996US-08945869 1996-05-031996WO-AU00268 1996-05-031996NZ-0306364 1996-05-03 1996ES-0911853T 1996-05-031996EP-0911853 1996-05-031996DE-6030298 1996-05-031996CA-2220075 1996-05-031998HK-0110321 31-08-19982002EE.UU.-10226751 22-08-2002
- ^ Li, L.; Kim, S.; Wang, W.; Vijayakumar, M.; Nie, Z.; Chen, B.; Zhang, J.; Xia, G.; Hu, J.; Graff, G.; Liu, J.; Yang, Z. (2011). "Una batería de flujo redox de vanadio estable con alta densidad de energía para almacenamiento de energía a gran escala". Materiales de energía avanzada . 1 (3): 394–400. Código Bibliográfico :2011AdEnM...1..394L. doi :10.1002/aenm.201100008. S2CID 33277301.
- ^ Yang, Y.; Zhang, Y.; Tang, L.; Liu, T.; Huang, J.; Peng, S.; Yang, X. (septiembre de 2019). "Investigaciones sobre las propiedades fisicoquímicas y el rendimiento electroquímico del electrolito ácido mixto de sulfato-cloruro para la batería de flujo redox de vanadio". Journal of Power Sources . 434 : Artículo 226719. Bibcode :2019JPS...43426719Y. doi :10.1016/j.jpowsour.2019.226719. S2CID 197352614.
- ^ Roznyatovskaya, N.; Noack, J.; Mild, H.; Fühl, M.; Fischer, P.; Pinkwart, K.; Tübke, J.; Skyllas-Kazacos, M. (2019). "Electrolito de vanadio para baterías de flujo redox de vanadio: el efecto del contraión". Baterías . 5 (1): 13. doi : 10.3390/batteries5010013 .
- ^ Yuriy V Tolmachev. Reseña: Baterías de flujo desde 1879 hasta 2022 y más allá. https://iopscience.iop.org/article/10.1149/1945-7111/acb8de/meta
- ^ Vafiadis, Helen; Skyllas-Kazacos, Maria (2006). "Evaluación de membranas para la novedosa celda de flujo redox de vanadio bromo". Journal of Membrane Science . 279 (1–2): 394–402. doi :10.1016/j.memsci.2005.12.028.
- ^ Sankarasubramanian, Shrihari; Zhang, Yunzhu; Ramani, Vijay (2019). "La batería de flujo redox de vanadio-cerio desacoplada de electrodos basada en ácido metanosulfónico exhibe una capacidad y una vida útil significativamente mejoradas". Energía y combustibles sostenibles . 3 (9): 2417–2425. doi :10.1039/C9SE00286C. ISSN 2398-4902. S2CID 199071949.
- ^ Allbright, Greg, et al. Una comparación entre baterías de plomo-ácido y de iones de litio en aplicaciones de almacenamiento estacionario All Cell, marzo de 2012
- ^ Stone, Mike (3 de febrero de 2016). "Una mirada a los proyectos de almacenamiento de energía más grandes construidos en todo el mundo durante el último año" . Consultado el 12 de agosto de 2017 .
- ^ "Base de datos de almacenamiento de energía global del DOE". energystorageexchange.org . Archivado desde el original el 9 de noviembre de 2017 . Consultado el 9 de noviembre de 2017 .
- ^ "Baterías de flujo redox". Archivado desde el original el 14 de marzo de 2014. Consultado el 27 de julio de 2014 .
- ^ Armin Herberger (19 de enero de 2021). "Hybridspeichersystem en Wohnquartier - Planta KIT en Bruchsal Weltpremiere mit Strom-Wärme-Kopplung". Badische Neueste Nachrichten Kraichgau . Consultado el 29 de junio de 2023 .
- ^ "Großprojekt" RedoxWind"". Fraunhofer-Institut für Chemische Technologie.
- ^ "Almacenamiento de energía en China". ees-magazine.com . Consultado el 12 de agosto de 2017 .
- ^ Zonghao, LIU; Huamin, Zhang; Sujun, G. a. O.; Xiangkun, MA; Yufeng, LIU; 刘宗浩, 张华民. "El sistema de almacenamiento de energía de batería de flujo redox totalmente de vanadio más grande del mundo para un parque eólico, 风场配套用全球最大全钒液流电池储能系统".储能科学与技术. 3 (1): 71–77. doi :10.3969/j.issn.2095-4239.2014.01.010. Archivado desde el original el 13 de agosto de 2017 . Recuperado el 12 de agosto de 2017 .
- ^ "Base de datos mundial de almacenamiento de energía del DOE". energystorageexchange.org . Archivado desde el original el 19 de octubre de 2013. Consultado el 9 de noviembre de 2017 .
- ^ "Base de datos mundial de almacenamiento de energía del DOE". energystorageexchange.org . Archivado desde el original el 31 de agosto de 2018 . Consultado el 9 de noviembre de 2017 .
- ^ "UET y Snohomish County PUD inauguran la batería de flujo en contenedores de mayor capacidad del mundo". Noticias sobre almacenamiento de energía . 29 de marzo de 2017. Archivado desde el original el 18 de agosto de 2018. Consultado el 29 de diciembre de 2017 .
- ^ "PUD invierte $11,2 millones en unidades de almacenamiento de energía". Everett Herald . 2 de noviembre de 2016 . Consultado el 29 de diciembre de 2017 .
- ^ "SDG&E y Sumitomo presentan la batería de flujo redox de vanadio más grande de EE. UU." Energy Storage News . 17 de marzo de 2017 . Consultado el 12 de agosto de 2017 .
- ^ Wesoff, Eric, St. John, Jeff. La batería de flujo de mayor capacidad de América del Norte y la UE está en línea, Greentech Media, junio de 2015. Consultado el 21 de enero de 2016.
- ^ "La batería de flujo más grande del mundo conectada a la red en China". New Atlas . 3 de octubre de 2022 . Consultado el 12 de octubre de 2022 .
- ^ "Batería de flujo redox". SumitomoElectric . Consultado el 1 de marzo de 2023 .
- ^ "CellCube: el sistema de almacenamiento de energía versátil del futuro". Cellcube . Consultado el 14 de diciembre de 2022 .
- ^ Steve Wilhelm (3 de julio de 2014). "Batería líquida del tamaño de un camión que cargará las compañías eléctricas". Puget Sound Business Journal . Consultado el 2 de mayo de 2015 .
- ^ Entrepreneur, Oficina del Jefe de Negocios de Queensland (3 de febrero de 2021). "Cómo Queensland puede potenciar el futuro de las baterías". Oficina del Jefe de Negocios de Queensland . Archivado desde el original el 28 de septiembre de 2020. Consultado el 3 de febrero de 2021 .
- ^ "StorEn Tech proporciona la primera batería de flujo de vanadio de su tipo a Australia". CleanTechnica . 19 de diciembre de 2020 . Consultado el 3 de febrero de 2021 .
- ^ "El productor de vanadio Largo prepara una capacidad de fabricación de baterías de flujo de 1,4 GWh". 6 de mayo de 2021.
- ^ BILL HAGSTRAND (23 de agosto de 2013). "Redox de vanadio: potenciando a las comunidades locales". Crain's Cleveland Business . Consultado el 2 de mayo de 2015 .
- ^ Andy Colthorpe (14 de noviembre de 2022). "El fabricante de baterías de flujo surcoreano H2 construye una fábrica de 330 MWh". Noticias sobre almacenamiento de energía . Consultado el 29 de junio de 2023 .
- ^ "Las inversiones estadounidenses en tecnología limpia ascienden a 1.100 millones de dólares. ¿Dónde se encuentra Irlanda?". Silicon Republic. 11 de abril de 2011. Consultado el 2 de mayo de 2015 .
- ^ "El primer sistema de almacenamiento de baterías a escala de red del Reino Unido entra en funcionamiento en Oxford". 24 de junio de 2021.
- ^ "Voltstorage desarrolla una solución de almacenamiento segura y ecológica". 16 de enero de 2018.
- ^ "Lösungen für Energiespeichersysteme: Schmalz baut weiteres Geschäftsfeld auf". Diario Windkraft . 16 de junio de 2016 . Consultado el 28 de mayo de 2023 .
- ^ "Montones de Schmalz". J. Schmalz GmbH . 28 de mayo de 2023 . Consultado el 28 de mayo de 2023 .
- ^ Jeff St. John (2 de marzo de 2010). "Hecho en China: Prudent Energy obtiene 22 millones de dólares para baterías de flujo". GigaOm . Consultado el 2 de mayo de 2015 .
- ^ "Australian Vanadium Ltd envía la primera batería de flujo de vanadio desde Austria". Proactive Investors. 13 de julio de 2016. Consultado el 24 de noviembre de 2017 .
- ^ "Los socios de baterías de flujo de vanadio firman un acuerdo para desarrollar una gigafábrica en Australia". VSUN Energy. 24 de noviembre de 2022. Consultado el 27 de junio de 2023 .
- ^ "Soluciones de tecnología renovable para posibilitar un futuro energético sostenible". Yadlamalka Energy. 2023. Consultado el 27 de junio de 2023 .
- ^ Gabriella Marchant (4 de enero de 2021). "La Agencia Australiana de Energías Renovables respalda el proyecto de baterías de flujo de vanadio en el interior de Australia del Sur". Australian Broadcasting Corporation . Consultado el 27 de junio de 2023 .
- ^ "Se construirá una planta de fabricación de baterías de flujo de 3 GWh en Arabia Saudita". 16 de mayo de 2020.
- ^ "El productor de vanadio Bushveld Minerals comienza a construir una planta de electrolitos para baterías de flujo en Sudáfrica". 15 de junio de 2021.
Referencias generales y citadas
- Ponencia presentada en la conferencia de verano del IEEE de 2001
- Sitio de la UNSW sobre baterías de vanadio
- Informe de World Energy
- Mapa mundial de depósitos globales de vanadio La geología del vanadio es bastante inusual en comparación con un yacimiento de mineral de metales básicos.
- "Baterías de flujo redox mejoradas para coches eléctricos". ScienceDaily / Fraunhofer-Gesellschaft . 13 de octubre de 2009. Consultado el 21 de junio de 2014 .
Enlaces externos
- Estados Unidos hizo un descubrimiento revolucionario en materia de baterías y luego le entregó la tecnología a China Estados Unidos hizo un descubrimiento revolucionario en materia de baterías y luego le entregó la tecnología a China
- Novedades sobre VRFB en la UNSW
- La necesidad de almacenamiento de energía redox de vanadio en generadores de turbinas eólicas: la generación neta de electricidad a partir de todas las formas de energías renovables en Estados Unidos aumentó más del 15% entre 2005 y 2009
- redT y Avalon se han fusionado para formar Invinity Energy Systems, líder mundial en baterías de flujo de vanadio

