Desarrollo de una vacuna contra el VIH
Este artículo necesita ser actualizado . ( Noviembre de 2021 ) |

Una vacuna contra el VIH es una vacuna potencial que podría ser una vacuna preventiva o una vacuna terapéutica , lo que significa que protegería a las personas de ser infectadas con el VIH o trataría a las personas infectadas por el VIH. Se cree que una vacuna contra el VIH podría inducir una respuesta inmunitaria contra el VIH (método de vacunación activa) o consistir en anticuerpos preformados contra el VIH (método de vacunación pasiva). [1]
Dos regímenes de vacunas activas, estudiados en los ensayos RV 144 e Imbokodo, demostraron que pueden prevenir el VIH en algunas personas; sin embargo, la protección se dio en relativamente pocas personas y no fue duradera. Por estas razones, todavía no se ha autorizado la comercialización de ninguna vacuna contra el VIH.
Dificultades en el desarrollo
En 1984, después de que se confirmara que el VIH causaba el SIDA, la Secretaria de Salud y Servicios Humanos de los Estados Unidos , Margaret Heckler, declaró que en dos años habría una vacuna disponible. [2] Sin embargo, preparar el sistema inmunológico adaptativo para que reconociera las proteínas de la envoltura viral no impidió la adquisición del VIH.
Son muchos los factores que hacen que el desarrollo de una vacuna contra el VIH sea diferente de otras vacunas clásicas (a fecha de 1996): [3]
- Las vacunas clásicas imitan la inmunidad natural contra la reinfección, como se observa en individuos recuperados de la infección; hay pocos pacientes de SIDA recuperados.
- La mayoría de las vacunas protegen contra la enfermedad, no contra la infección; la infección por VIH puede permanecer latente durante largos períodos antes de causar el SIDA.
- Las vacunas más eficaces son las que contienen organismos enteros muertos o vivos atenuados; el VIH-1 muerto no retiene la antigenicidad y el uso de una vacuna de retrovirus vivo plantea problemas de seguridad.
Estructura del VIH
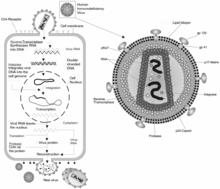
Los epítopos de la envoltura viral son más variables que los de muchos otros virus. Además, los epítopos funcionalmente importantes de la proteína gp120 están enmascarados por la glicosilación , la trimerización y los cambios conformacionales inducidos por el receptor, lo que dificulta su bloqueo con anticuerpos neutralizantes.
La ineficacia de las vacunas desarrolladas hasta ahora se debe principalmente a dos factores relacionados:
- En primer lugar, el VIH es altamente mutable. Debido a la capacidad del virus de responder rápidamente a las presiones selectivas impuestas por el sistema inmunológico, la población de virus en un individuo infectado generalmente evoluciona de manera tal que puede evadir las dos ramas principales del sistema inmunológico adaptativo: la inmunidad humoral ( mediada por anticuerpos ) y la inmunidad celular (mediada por células T ).
- En segundo lugar, los virus aislados del VIH son en sí muy variables. El VIH se puede clasificar en múltiples subtipos con un alto grado de divergencia genética. Por lo tanto, las respuestas inmunitarias generadas por cualquier vacuna deben ser lo suficientemente amplias como para tener en cuenta esta variabilidad. Es poco probable que una vacuna que carezca de esta amplitud sea eficaz.
Las dificultades para estimular una respuesta de anticuerpos confiable han llevado a intentar desarrollar una vacuna que estimule una respuesta de los linfocitos T citotóxicos . [4] [5]
Otra respuesta a este desafío ha sido crear un único péptido que contenga los componentes menos variables de todas las cepas de VIH conocidas. [6]
Se ha observado que algunos, pero no todos, los individuos infectados por el VIH producen naturalmente anticuerpos ampliamente neutralizantes (BNAbs) que mantienen el virus suprimido, y estas personas permanecen asintomáticas durante décadas . Desde la década de 2010, un candidato principal es VRC01 y BNAbs similares, ya que se han encontrado en múltiples personas no relacionadas. [7] Estos anticuerpos imitan a CD4 y compiten por el sitio de unión de CD4 conservado. Todos estos anticuerpos comparten un origen de línea germinal en la cadena V H , donde solo unos pocos alelos humanos del gen IVIG1-2 pueden producir dicho anticuerpo. [8] Env es una proteína en la superficie del VIH que permite infectar células. Env se extiende desde la superficie de la partícula del virus VIH. La proteína en forma de espiga es "trimérica", con 3 moléculas idénticas, cada una con una región similar a una tapa llamada glicoproteína 120 (gp120) y un tallo llamado glicoproteína 41 (gp41) que ancla Env en la membrana viral. Sólo las porciones funcionales de Env permanecen constantes, pero éstas generalmente están ocultas al sistema inmunológico por la estructura de la molécula. Los análisis de rayos X y la microscopía electrónica de baja resolución han revelado la arquitectura general y algunas características críticas de Env. Pero la obtención de imágenes de mayor resolución de la estructura general de la proteína ha sido difícil debido a su estructura compleja y delicada. Tres nuevos artículos utilizan formas estabilizadas de Env para obtener una imagen más clara del trímero intacto. Un equipo de investigación del NCI dirigido por el Dr. Sriram Subramaniam utilizó criomicroscopía electrónica para examinar la estructura de Env. El estudio apareció el 23 de octubre de 2013 en Nature Structural and Molecular Biology . [9]
Modelo animal

El modelo animal típico para la investigación de vacunas es el mono, a menudo el macaco . Los monos pueden ser infectados con SIV o el SHIV quimérico con fines de investigación. Sin embargo, la vía bien probada de intentar inducir anticuerpos neutralizantes mediante vacunación se ha estancado debido a la gran dificultad de estimular anticuerpos que neutralicen los aislados primarios heterólogos del VIH. [10] Algunas vacunas basadas en la envoltura del virus han protegido a los chimpancés o macacos del desafío con virus homólogos, [11] pero en ensayos clínicos, los humanos que fueron inmunizados con construcciones similares se infectaron después de una exposición posterior al VIH-1. [12]
Existen algunas diferencias entre el VIS y el VIH que pueden plantear desafíos en el uso de un modelo animal. El modelo animal puede ser extremadamente útil, pero a veces controvertido. [13]
Existe un nuevo modelo animal muy similar al del VIH en humanos. La activación inmunitaria generalizada como resultado directo de la muerte de células T CD4+ activadas, realizada en ratones, permite nuevas formas de evaluar el comportamiento del VIH. [14] [15]
La investigación sobre el virus de la inmunodeficiencia humana (SIV) financiada por el NIAID ha demostrado que la inoculación de una vacuna contra el SIV basada en el citomegalovirus (CMV) en monos da como resultado la contención del virus. Por lo general, la replicación y diseminación del virus se produce en cuestión de días después de la infección, mientras que la activación y el reclutamiento de células T inducidos por la vacuna a los sitios de replicación viral tardan semanas. Los investigadores plantearon la hipótesis de que las vacunas diseñadas para mantener activadas las células T de memoria efectoras podrían perjudicar la replicación viral en su etapa más temprana. [ cita requerida ]
Las vacunas específicas también pueden necesitar modelos animales especializados. Por ejemplo, las vacunas diseñadas para producir anticuerpos de tipo VRC01 requieren la presencia de alelos V H similares a los humanos. En el caso de organismos como los ratones, el alelo humano debe insertarse en su genoma para producir un imitador útil. [16] Los murinos también son animales experimentales en el SIDA y el SIDA murino y el SIDA humano son similares. El análisis inmunológico y los estudios genéticos revelan genes resistentes en el complejo H-2 de los ratones, lo que indica que las diferencias genéticas en los ratones podrían modificar las características de la enfermedad del VIH. El virus defectuoso de la leucemia murina es el principal agente etiológico del SIDA materno, que parece ser capaz de inducir la enfermedad en ausencia de replicación del virus. La proliferación de células diana y la expansión oligoclonal son inducidas por el virus, lo que sugiere una inmunidad reprimida observada en ratones, por lo que se denomina síndrome paraneoplásico. Esto se ve respaldado además por la buena respuesta de los ratones SIDA materno a los agentes antineoplásicos. Este modelo animal es útil para demostrar el surgimiento de nuevas hipótesis sobre el SIDA, incluyendo el papel del VIH defectuoso y la replicación del VIH en la progresión de la enfermedad, y también la importancia de identificar las células diana del VIH in vivo. [17]
Ensayos clínicos
Varias vacunas candidatas se encuentran en distintas fases de ensayos clínicos .
Fase I
La mayoría de los enfoques iniciales se han centrado en la proteína de la envoltura del VIH . Se han evaluado al menos trece candidatos diferentes de envoltura gp120 y gp160 , en los EE. UU. predominantemente a través del Grupo de Evaluación de Vacunas contra el SIDA. La mayoría de las investigaciones se centraron en gp120 en lugar de gp41/gp160, ya que este último es generalmente más difícil de producir y no ofreció inicialmente ninguna ventaja clara sobre las formas gp120. En general, han sido seguros e inmunogénicos en diversas poblaciones, han inducido anticuerpos neutralizantes en casi el 100% de los receptores, pero rara vez indujeron linfocitos T citotóxicos CD8+ (CTL). Las preparaciones de envoltura derivadas de mamíferos han sido mejores inductores de anticuerpos neutralizantes que los candidatos producidos en levaduras y bacterias. Aunque el proceso de vacunación implicó muchas inyecciones repetidas de " refuerzo ", fue un desafío inducir y mantener los altos títulos de anticuerpos anti-gp120 necesarios para tener alguna esperanza de neutralizar una exposición al VIH. [ cita requerida ]
La disponibilidad de varios vectores recombinantes de la viruela del canario ha proporcionado resultados interesantes que pueden resultar generalizables a otros vectores virales . El aumento de la complejidad de los vectores de la viruela del canario mediante la inclusión de más genes/epítopos ha aumentado el porcentaje de voluntarios que tienen CTL detectables en mayor medida que el aumento de la dosis del vector viral. Los CTL de los voluntarios fueron capaces de matar células mononucleares de sangre periférica infectadas con aislados primarios de VIH, lo que sugiere que los CTL inducidos podrían tener importancia biológica. Además, las células de al menos algunos voluntarios fueron capaces de matar células infectadas con VIH de otros clados, aunque el patrón de reconocimiento no fue uniforme entre los voluntarios. El vector de la viruela del canario es la primera vacuna candidata contra el VIH que ha inducido respuestas de CTL funcionales de clado cruzado. El primer ensayo de fase I de la vacuna candidata en África se lanzó a principios de 1999 con voluntarios ugandeses. El estudio determinó hasta qué punto los voluntarios ugandeses tienen CTL activos contra los subtipos de VIH prevalentes en Uganda, A y D. En 2015, un ensayo de fase I llamado HVTN 100 en Sudáfrica probó la combinación de un vector de viruela del canario ALVAC y una proteína gp120 adaptada para el subtipo C del VIH común en el África subsahariana, con el adyuvante MF59. Aquellos que recibieron el régimen de vacuna produjeron fuertes respuestas inmunitarias desde el principio y el régimen fue seguro. [18]
Otras estrategias que han avanzado hasta la fase I de ensayos en personas no infectadas incluyen péptidos, lipopéptidos , ADN , un vector atenuado de Salmonella , p24, etc. En concreto, se buscan vacunas candidatas que induzcan uno o más de los siguientes efectos:
- anticuerpos neutralizantes activos contra una amplia gama de aislados primarios del VIH;
- respuestas de células T citotóxicas en una gran mayoría de receptores;
- fuertes respuestas inmunes de las mucosas . [19]
En 2011, investigadores del Centro Nacional de Biotecnología de Madrid dieron a conocer los datos del ensayo clínico de fase I de su nueva vacuna, MVA-B . La vacuna indujo una respuesta inmunológica en el 92% de los sujetos sanos. [20]
En 2016, se publicaron los resultados del primer ensayo clínico en fase I en humanos de una vacuna de VIH-1 completa inactivada, SAV001 . El VIH utilizado en la vacuna fue inactivado química y físicamente mediante radiación. El ensayo, realizado en Canadá en 2012, demostró un buen perfil de seguridad y generó anticuerpos contra el VIH-1. [21] Según el Dr. Chil-Yong Kang de la Facultad de Medicina y Odontología Schulich de la Universidad Western en Canadá, el desarrollador de esta vacuna, los anticuerpos contra gp120 y p24 aumentaron a 8 y 64 veces, respectivamente, después de la vacunación. [22]
La línea de investigación VRC01 produjo un antígeno "eOD-GT8" que expone específicamente el sitio de unión de CD4 para la inmunización, refinado con el tiempo para exponer menos de los otros sitios. [23] Como resulta que la mayoría (pero no todos) [8] humanos tienen los alelos necesarios, el problema se trasladó al método de administración. En 2021, después de resultados prometedores en pruebas con ratones y primates, los científicos anunciaron que planean realizar un ensayo de fase 1 de una vacuna de ARNm contra el VIH si se confirma que una vacuna más desarrollada (a través de su "plataforma de ARNm VLP env-gag" que contiene eOD-GT8 [24] ) es segura y eficaz. [25] [26] El 17 de enero de 2022, IAVI y Moderna lanzaron un ensayo de fase I de una vacuna contra el VIH con tecnología de ARNm. [27] El 14 de marzo de 2022, los Institutos Nacionales de Salud informaron que habían lanzado un "ensayo clínico de tres vacunas de ARNm contra el VIH". Se espera que el ensayo de fase uno concluya en julio de 2023. [ cita requerida ]
Fase II
Vacunas preventivas contra el VIH
- Una vacuna recombinante contra el VIH, el adenovirus-5 (llamada V520), se probó en dos estudios de fase 2b, Phambili y STEP. El 13 de diciembre de 2004, comenzó el reclutamiento para el estudio STEP , un ensayo clínico de fase II de 3.000 participantes de una nueva vacuna contra el VIH, en sitios de América del Norte, América del Sur, el Caribe y Australia. [28] El ensayo fue cofinanciado por el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), que es una división de los Institutos Nacionales de Salud (NIH), y la compañía farmacéutica Merck & Co. Merck desarrolló V520 para estimular la inmunidad celular específica del VIH, que incita al cuerpo a producir células T que matan las células infectadas por el VIH. En ensayos previos más pequeños, se encontró que esta vacuna era segura, debido a la falta de efectos adversos en los participantes. La vacuna mostró respuestas inmunitarias celulares inducidas contra el VIH en más de la mitad de los voluntarios. [29] V520 contiene un adenovirus debilitado que sirve como portador de tres genes del subtipo B del VIH ( gag, pol y nef ). El subtipo B es el subtipo de VIH más prevalente en las regiones de los sitios de estudio. Los adenovirus se encuentran entre las principales causas de enfermedades del tracto respiratorio superior, como el resfriado común . Debido a que la vacuna contiene solo tres genes del VIH alojados en un adenovirus debilitado, los participantes del estudio no pueden infectarse con el VIH ni contraer una infección respiratoria a causa de la vacuna. En septiembre de 2007 se anunció que el ensayo de V520 se detendría después de determinar que la vacunación con V520 parecía estar asociada con un mayor riesgo de infección por VIH en algunos receptores. [30] El problema más importante al que se enfrenta el adenovirus recombinante que se utilizó es la alta prevalencia de anticuerpos específicos del adenovirus como resultado de la exposición previa al adenovirus. Los vectores de adenovirus y muchos otros vectores virales que se utilizan actualmente en las vacunas contra el VIH inducirán una respuesta inmunitaria de memoria rápida contra el vector. Esto da como resultado un impedimento para el desarrollo de una respuesta de células T contra el antígeno insertado (antígenos del VIH) [31]. Los resultados del ensayo motivaron la reexaminación de las estrategias de desarrollo de vacunas. [32]
- HVTN 505 , un estudio de fase IIb, se inició en 2009 pero se detuvo en 2013 debido a que no cumplía con los requisitos de inutilidad.
- Se han clonado en el laboratorio anticuerpos potencialmente neutralizantes (anticuerpos monoclonales) y se están probando en ensayos clínicos de vacunación pasiva . [24] En mayo de 2016, se lanzaron los ensayos de prevención mediada por anticuerpos (AMP) (HVTN 703 y HVTN 704), los primeros ensayos de fase IIb de un anticuerpo monoclonal para la prevención del VIH. HVTN 703 y HVTN 704 encontraron que el anticuerpo monoclonal VRC01, que se dirige al sitio de unión de CD4, no fue capaz de prevenir la adquisición del VIH. [33]
- En 2017, Janssen y la HVTN lanzaron el ensayo de fase IIb llamado HVTN 705/Imbokodo, que prueba la vacuna de vector mosaico Ad26.Mos4.HIV y las vacunas Clade C gp140 con adyuvante de fosfato de aluminio, que están diseñadas para prevenir la infección de todos los subtipos de VIH en todo el mundo. [34] En 2021, el NIH anunció que el estudio de fase 2b de Imbokodo no proporcionó una reducción estadísticamente significativa en la infección por VIH. [35]
- En 2019, se determinó que Terevac-VIH, una vacuna de Cuba, había pasado la primera etapa de ensayos clínicos después de dos años y pasó a la segunda etapa de desarrollo. [36] [37]
Vacunas terapéuticas contra el VIH
Biosantech desarrolló una vacuna terapéutica llamada Tat Oyi, que ataca a la proteína tat del VIH. Se probó en Francia en un ensayo de fase I/II a doble ciego con 48 pacientes VIH positivos que habían alcanzado la supresión viral con la terapia antirretroviral de gran actividad y luego dejaron de tomar antirretrovirales después de recibir la vacuna intradérmica Tat Oyi. [38]
Fase III
Vacunas preventivas contra el VIH
Todavía no hay vacunas preventivas pasivas contra el VIH que hayan alcanzado la Fase III, pero algunos candidatos a vacunas preventivas activas contra el VIH ya han entrado en la Fase III.
- En febrero de 2003, VaxGen anunció que su vacuna AIDSVAX B/E había sido un fracaso en América del Norte porque no había una reducción estadísticamente significativa de la infección por VIH dentro de la población estudiada.
- AIDSVAX B/E fue un componente, junto con ALVAC, del ensayo de la vacuna RV 144 en Tailandia que mostró una eficacia parcial en la prevención del VIH. Las vacunas AIDSVAX B/E y ALVAC estaban dirigidas a la parte gp120 de la envoltura del VIH. El estudio involucró a 16.395 participantes que no estaban infectados por el VIH, 8197 de los cuales recibieron un tratamiento que consistía en dos vacunas experimentales dirigidas a los tipos B y E del VIH que prevalecen en Tailandia, mientras que 8198 recibieron un placebo. Los participantes se sometieron a pruebas de VIH cada seis meses durante tres años. Después de tres años, el grupo de la vacuna tuvo tasas de infección por VIH reducidas en aproximadamente un 30% en comparación con las del grupo placebo. Sin embargo, después de tener en cuenta a las siete personas que ya tenían VIH antes de vacunarse (dos en el grupo placebo, cinco en el grupo de la vacuna) la diferencia fue del 26%. [39] Se descubrió que los participantes que recibieron vacunas en el ensayo RV 144 que produjeron anticuerpos IgG contra el bucle V2 de la envoltura externa del VIH tenían un 43% menos de probabilidades de infectarse que los que no las recibieron, mientras que la producción de IgA se asoció con un riesgo de infección un 54% mayor que los que no produjeron los anticuerpos (pero no peor que el placebo). Los virus recolectados de los participantes vacunados tenían mutaciones en la región V2. Las pruebas de una vacuna contra el SIV en monos encontraron una mayor resistencia al SIV en animales que producían anticuerpos contra esta región. Por lo tanto, se espera que la investigación futura se centre en la creación de vacunas diseñadas para provocar una reacción de IgG contra el bucle V2. [40]
- En 2020, el ensayo de fase IIb-IIIEl estudio HVTN 702 /"Uhambo" determinó que las vacunas ALVAC/gp120/MF59 eran seguras y no causaban daño, pero no tenían eficacia en la prevención del VIH enSudáfrica. Las vacunaciones con el régimen de vacunas Uhambo comenzaron a fines de 2016 y se detuvieron a principios de 2020.[41]
- En 2020, el régimen de vacuna Ad26.Mos4.HIV más gp140 del clado C adyuvado entró en un ensayo de fase III llamado HVTN 706/"Mosaico". El régimen es una combinación de una vacuna de vector de adenovirus diseñada contra múltiples cepas globales del VIH y una vacuna proteica. [42] El ensayo finalizó en enero de 2023 debido a su ineficacia. [43]
Vacunas terapéuticas contra el VIH
Ninguna vacuna terapéutica candidata contra el VIH ha llegado aún a la fase 3 de pruebas.
Ciencias económicas
Un informe de julio de 2012 del Grupo de Trabajo de Seguimiento de Recursos sobre Vacunas contra el VIH y Microbicidas estima que en 2011 se invirtieron 845 millones de dólares en investigación sobre vacunas contra el VIH. [44]
Las cuestiones económicas que plantea el desarrollo de una vacuna contra el VIH incluyen la necesidad de un compromiso de compra anticipado (o compromisos de mercado anticipados ) porque, una vez desarrollada una vacuna contra el SIDA, los gobiernos y las ONG pueden estar en condiciones de rebajar el precio hasta el costo marginal . [45]
Clasificación de las posibles vacunas
En teoría, cualquier posible vacuna contra el VIH debe inhibir o detener el ciclo de replicación del virión del VIH. [46] Los objetivos de una vacuna podrían ser las siguientes etapas del ciclo del virión del VIH:
- Estadio I. Estado libre
- Etapa II. Fijación
- Etapa III. Penetración
- Etapa IV. Descubrimiento
- Etapa V. Replicación
- Etapa VI. Ensamblaje
- Etapa VII. Liberación
Por lo tanto, la siguiente lista comprende los posibles enfoques actuales para una vacuna contra el VIH:
Filtración de viriones de la sangre (Etapa I)
- Enfoques biológicos, químicos y/o físicos para eliminar los viriones del VIH de la sangre.
Métodos para capturar el virión (estadios I-III, VI, VII)
- Fagocitosis de los viriones del VIH.
- Captura de viriones del VIH mediante métodos químicos u orgánicos (creación de cualquier piel o membrana adicional alrededor del virión)
- Adhesiones químicas u orgánicas al virión
Enfoques para destruir o dañar el virión o sus partes (estadio I-VII)
Aquí, "daño" significa inhibir o detener la capacidad del virión para procesar cualquiera de las fases II-VII . A continuación, se muestran las diferentes clasificaciones de los métodos:
- Por naturaleza del método:
- Métodos físicos ( Etapa I-VII )
- Métodos químicos y biológicos ( Etapa I-VII )
- Al dañar el objetivo de la estructura del virión del VIH : [47] [48]
- Daño a la glicoproteína de acoplamiento gp120 [49] ( estadio I-III, VI, VII )
- Daño a la glicoproteína transmembrana gp41 [50] ( estadio I-III, VI, VII )
- Daño a la matriz del virión ( estadio I-III, VI, VII )
- Daño a la cápside del virión ( estadio I-III, VI, VII )
- Daño a la transcriptasa inversa ( estadio I-VII )
- Daño al ARN ( Etapa I-VII )
Bloqueo de la replicación (Etapa V)
- Inserción en sangre de compuestos químicos u orgánicos que se unen a la gp120 . Hipotéticamente, pueden ser fragmentos de membranas de células CD4 con receptores. También se puede utilizar cualquier alternativa química y orgánica (con capacidad de unirse a la gp120) de estos receptores.
- Inserción en la sangre de compuestos químicos u orgánicos que se unen a los receptores de las células CD4.
Enfoques biológicos, químicos o físicos para inhibir el proceso de fases.
- Enfoque biológico, químico o físico para inhibir la adhesión, penetración, desprendimiento, integración, replicación, ensamblaje y/o liberación.
Inhibición de la funcionalidad de las células infectadas (estadio VI-VII)
Inhibir las funciones vitales de las células infectadas:
- Inhibir el metabolismo de las células infectadas.
- Inhibir el intercambio de energía de las células infectadas.
Trabajo futuro
Se ha informado de que los pacientes con VIH coinfectados con el virus GBC (GBV-C), también llamado virus de la hepatitis G, pueden sobrevivir más tiempo que aquellos que no tienen GBV-C, pero los pacientes pueden ser diferentes en otros aspectos. El GBV-C es potencialmente útil en el desarrollo futuro de una vacuna contra el VIH. [51]
Las vacunas vivas atenuadas tienen un gran éxito contra la polio, el rotavirus y el sarampión, pero no se han probado contra el VIH en humanos. La reversión al virus vivo ha sido una preocupación teórica de seguridad que hasta la fecha ha impedido el desarrollo clínico de una vacuna viva atenuada contra el VIH-1. Los científicos están investigando nuevas estrategias para desarrollar una vacuna viva atenuada contra el VIH-1 no virulenta. Por ejemplo, se ha creado una forma genéticamente modificada del VIH en la que los codones del virus (una secuencia de tres nucleótidos que forman el código genético) se manipulan para que dependan de un aminoácido no natural para la traducción adecuada de la proteína, lo que le permite replicarse. Debido a que este aminoácido es extraño para el cuerpo humano, el virus no puede reproducirse. [52] Evidencias recientes sugieren el uso de células CAR NK universales contra el VIH [53] [54]
Véase también
- Cabotegravir
- Vacuna para el COVID-19
- Red de ensayos de vacunas contra el VIH
- Día Mundial de la Vacuna contra el SIDA
Referencias
- ^ Gray GE, Laher F, Lazarus E, Ensoli B, Corey L (abril de 2016). "Enfoques para vacunas preventivas y terapéuticas contra el VIH". Current Opinion in Virology . 17 : 104–109. doi :10.1016/j.coviro.2016.02.010. PMC 5020417 . PMID 26985884.
- ^ Shilts, Randy (1987). Y la banda siguió tocando: política, gente y la epidemia del sida (edición de 2007). St. Martin's Press. pág. 451. ISBN 978-0-312-24135-3.
- ^ Fauci AS (1996). "Una vacuna contra el VIH: rompiendo paradigmas". Proc. Am. Assoc. Phys . 108 (1): 6–13. PMID 8834058.
- ^ Kim D, Elizaga M, Duerr A (marzo de 2007). "Ensayos de eficacia de la vacuna contra el VIH: hacia el futuro de la prevención del VIH". Clínicas de enfermedades infecciosas de Norteamérica . 21 (1): 201–17, x. doi :10.1016/j.idc.2007.01.006. PMID 17502236.
- ^ Watkins DI (marzo de 2008). "La esperanza de una vacuna contra el VIH basada en la inducción de linfocitos T CD8+: una revisión". Memorias del Instituto Oswaldo Cruz . 103 (2): 119–29. doi :10.1590/S0074-02762008000200001. PMC 2997999 . PMID 18425263.
- ^ Létourneau S, Im EJ, Mashishi T, Brereton C, Bridgeman A, Yang H, Dorrell L, Dong T, Korber B, McMichael AJ, Hanke T (octubre de 2007). Nixon D (ed.). "Diseño y evaluación preclínica de una vacuna universal contra el VIH-1". MÁS UNO . 2 (10): e984. Código Bib : 2007PLoSO...2..984L. doi : 10.1371/journal.pone.0000984 . PMC 1991584 . PMID 17912361.
- ^ West AP, Jr; Diskin, R; Nussenzweig, MC; Bjorkman, PJ (24 de julio de 2012). "Base estructural para el uso de genes de la línea germinal de una potente clase de anticuerpos dirigidos al sitio de unión a CD4 de la gp120 del VIH-1". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 109 (30): E2083-90. Bibcode :2012PNAS..109E2083W. doi : 10.1073/pnas.1208984109 . PMC 3409792 . PMID 22745174.
- ^ ab Lee, Jeong Hyun; Toy, Laura; Kos, Justin T.; Safonova, Yana; Schief, William R.; Havenar-Daughton, Colin; Watson, Corey T.; Crotty, Shane (6 de septiembre de 2021). "Genética de vacunas de células B humanas vírgenes a precursores de anticuerpos ampliamente neutralizantes de clase IGHV1-2 VRC01". npj Vaccines . 6 (1): 113. doi : 10.1038/s41541-021-00376-7 . PMC 8421370 . PMID 34489473.
- ^ "Se revela la estructura clave de la proteína del VIH". Institutos Nacionales de Salud (NIH) . 2015-05-14 . Consultado el 2023-01-05 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Poignard P, Sabbe R, Picchio GR, Wang M, Gulizia RJ, Katinger H, et al. (abril de 1999). "Los anticuerpos neutralizantes tienen efectos limitados en el control de la infección por VIH-1 establecida in vivo". Inmunidad . 10 (4): 431–8. doi : 10.1016/S1074-7613(00)80043-6 . PMID 10229186.
- ^ Berman PW, Gregory TJ, Riddle L, Nakamura GR, Champe MA, Porter JP, et al. (junio de 1990). "Protección de los chimpancés contra la infección por VIH-1 después de la vacunación con la glicoproteína recombinante gp120 pero no con la gp160". Nature . 345 (6276): 622–5. Bibcode :1990Natur.345..622B. doi : 10.1038/345622a0 . PMID 2190095. S2CID 4258128.
- ^ Connor RI, Korber BT, Graham BS, Hahn BH, Ho DD, Walker BD, et al. (febrero de 1998). "Análisis inmunológicos y virológicos de personas infectadas por el virus de inmunodeficiencia humana tipo 1 mientras participaban en ensayos de vacunas recombinantes de subunidad gp120". Journal of Virology . 72 (2): 1552–76. doi :10.1128/JVI.72.2.1552-1576.1998. PMC 124637 . PMID 9445059.
- ^ Morgan C, Marthas M, Miller C, Duerr A, Cheng-Mayer C, Desrosiers R, et al. (agosto de 2008). "El uso de modelos de primates no humanos en el desarrollo de vacunas contra el VIH". PLOS Medicine . 5 (8): e173. doi : 10.1371/journal.pmed.0050173 . PMC 2504486 . PMID 18700814.
- ^ Marques R, Williams A, Eksmond U, Wullaert A, Killeen N, Pasparakis M, et al. (2009). "Activación inmunitaria generalizada como resultado directo de la eliminación de células T CD4+ activadas". Journal of Biology . 8 (10): 93. doi : 10.1186/jbiol194 . PMC 2790834 . PMID 19943952.
- ^ Vrisekoop N, Mandl JN, Germain RN (2009). "Vida y muerte como linfocito T: de la protección inmunitaria a la patogénesis del VIH". Journal of Biology . 8 (10): 91. doi : 10.1186/jbiol198 . PMC 2790836 . PMID 19951397.
- ^ Lin, año; Parques, KR; Weidle, C; Naidu, AS; Khechaduri, A; Riker, AO; Takushi, B; Chun, JH; Borst, AJ; Veesler, D; Estuardo, A; Agrawal, P; Gris, M; Pancera, M; Huang, PS; Stamatatos, L (13 de octubre de 2020). "Los inmunógenos dirigidos a la línea germinal del VIH-1 VRC01 seleccionan distintos receptores de células B específicos de epítopos". Inmunidad . 53 (4): 840–851.e6. doi : 10.1016/j.immuni.2020.09.007 . PMC 7735217 . PMID 33053332.
- ^ Ibeh, Bartholomew Okechukwu; Ashano, Efejiro (5 de noviembre de 2018). Modelos animales experimentales de VIH/SIDA para ensayos de vacunas. IntechOpen. ISBN 978-1-78923-165-6.[ enlace muerto permanente ]
- ^ Bekker LG, Moodie Z, Grunenberg N, Laher F, Tomaras GD, Cohen KW, et al. (junio de 2018). "Vacuna contra el VIH subtipo C ALVAC-HIV y vacuna bivalente contra el VIH-1 subtipo C gp120/MF59 en adultos sudafricanos de bajo riesgo y no infectados por el VIH: un ensayo de fase 1/2". The Lancet. VIH . 5 (7): e366–e378. doi :10.1016/S2352-3018(18)30071-7. PMC 6028742 . PMID 29898870.
- ^ Pavot V, Rochereau N, Lawrence P, Girard MP, Genin C, Verrier B, Paul S (julio de 2014). "Progresos recientes en vacunas contra el VIH que inducen respuestas inmunitarias en las mucosas". SIDA . 28 (12): 1701–18. doi : 10.1097/qad.0000000000000308 . PMID 25009956. S2CID 28618851.
- ^ "Nueva vacuna podría convertir el VIH en una infección menor". Fox News . 2011-09-29. Archivado desde el original el 2011-09-29 . Consultado el 29 de septiembre de 2011 .
- ^ Choi E, Michalski CJ, Choo SH, Kim GN, Banasikowska E, Lee S, et al. (noviembre de 2016). "Primer ensayo clínico en humanos de fase I de una vacuna con virus VIH-1 inactivado: demostración de su seguridad y mejora de las respuestas de anticuerpos anti-VIH". Retrovirology . 13 (1): 82. doi : 10.1186/s12977-016-0317-2 . PMC 5126836 . PMID 27894306.
- ^ "Nueva vacuna contra el VIH demuestra su eficacia en la fase 1 de los ensayos en humanos". Medical Daily . Nueva York. 4 de septiembre de 2013. Archivado desde el original el 7 de septiembre de 2013. Consultado el 4 de septiembre de 2013 .
- ^ Duan, H. et al., El enmascaramiento de glicanos enfoca las respuestas inmunitarias en el sitio de unión de CD4 del VIH-1 y mejora la obtención de anticuerpos precursores de la clase VRC01. Immunity 49, 301 (2018).
- ^ ab Iniciativa Internacional para la Vacuna contra el SIDA (2021-09-29). "Estudio de fase 1, aleatorizado, primero en humanos y de etiqueta abierta para evaluar la seguridad e inmunogenicidad de la vacuna de ARNm de 60 mer eOD-GT8 (ARNm-1644) y la vacuna de ARNm de 60 mer Core-g28v2 (ARNm-1644v2-Core) en adultos no infectados por VIH-1 con buena salud general". ModernaTX, Inc., Universidad de Texas en San Antonio, Universidad George Washington, Centro de Investigación del Cáncer Fred Hutchinson, Universidad Emory. Archivado desde el original el 2021-11-30 . Consultado el 2021-11-30 .
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ "La vacuna experimental de ARNm contra el VIH es segura y prometedora en animales - ScienceMag". 9 de diciembre de 2021. Archivado desde el original el 18 de enero de 2022. Consultado el 16 de enero de 2022 .
- ^ Zhang Peng; Elisabeth Narayanan; et al. (diciembre de 2021). "Una vacuna de ARNm VLP env-gag multiclado genera anticuerpos neutralizantes del VIH-1 de nivel 2 y reduce el riesgo de infección heteróloga por SHIV en macacos". Nature Medicine . 27 (12): 2234–2245. doi : 10.1038/s41591-021-01574-5 . ISSN 1546-170X. PMID 34887575. S2CID 245116317.
- ^ "IAVI y Moderna lanzan un ensayo de antígenos de vacunas contra el VIH con ARNm te". IAVI . Archivado desde el original el 2022-02-13 . Consultado el 2022-02-14 .
- ^ "Ubicaciones de estudio de STEP". Archivado desde el original el 24 de julio de 2008. Consultado el 4 de noviembre de 2008 .
- ^ Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA ( ONUSIDA ) (diciembre de 2005). «Actualización de la epidemia de SIDA» (PDF) . Organización Mundial de la Salud . Archivado (PDF) desde el original el 29 de junio de 2014. Consultado el 22 de abril de 2014 .
- ^ Resultados de eficacia del estudio STEP (protocolo Merck V520 023/HVTN 502): ensayo de fase II de prueba de concepto de la vacuna trivalente MRKAd5 VIH-1 Gag/Pol/Nef Archivado el 26 de julio de 2011 en Wayback Machine.
- ^ Sekaly RP (enero de 2008). "El estudio fallido de la vacuna contra el VIH de Merck: ¿un paso atrás o un punto de partida para el desarrollo de vacunas futuras?". The Journal of Experimental Medicine . 205 (1): 7–12. doi :10.1084/jem.20072681. PMC 2234358 . PMID 18195078.
- ^ Iaccino E, Schiavone M, Fiume G, Quinto I, Scala G (julio de 2008). "Las consecuencias del ensayo de la vacuna contra el VIH de Merck". Retrovirology . 5 : 56. doi : 10.1186/1742-4690-5-56 . PMC 2483718 . PMID 18597681.
- ^ Corey, Lawrence; Gilbert, Peter B.; Juraska, Michal; Montefiori, David C.; Morris, Lynn; Karuna, Shelly T.; Edupuganti, Srilatha; Mgodi, Nyaradzo M.; deCamp, Allan C.; Rudnicki, Erika; Huang, Yunda (18 de marzo de 2021). "Dos ensayos aleatorios de anticuerpos neutralizantes para prevenir la adquisición del VIH-1". The New England Journal of Medicine . 384 (11): 1003–1014. doi :10.1056/NEJMoa2031738. ISSN 1533-4406. PMC 8189692 . PMID 33730454.
- ^ "Candidato a nueva vacuna contra el sida avanza a la siguiente fase de ensayos previos a la aprobación". Tech2 . 2018-07-08. Archivado desde el original el 2018-07-11 . Consultado el 2018-07-11 .
- ^ "La vacuna candidata contra el VIH no protege suficientemente a las mujeres contra la infección por VIH". Institutos Nacionales de Salud (NIH) . 31 de agosto de 2021. Archivado desde el original el 31 de agosto de 2021. Consultado el 1 de septiembre de 2021 .
- ^ "Cura para el VIH/SIDA: Cuba logra un gran avance, el NIH y la Fundación Gate donarán para futuras investigaciones". 27 de diciembre de 2019. Archivado desde el original el 2021-12-11 . Consultado el 2021-12-11 .
- ^ "Exitosos ensayos clínicos de vacuna contra el VIH en Cuba". Archivado desde el original el 2021-12-11 . Consultado el 2021-12-11 .
- ^ Loret EP, Darque A, Jouve E, Loret EA, Nicolino-Brunet C, Morange S, et al. (abril de 2016). "La inyección intradérmica de una vacuna terapéutica contra el VIH basada en Tat Oyi reduce en 1,5 log copias/ml la mediana de rebote del ARN del VIH y no produce rebote del ADN del VIH tras la interrupción de la terapia antirretroviral en un ensayo clínico controlado aleatorizado de fase I/II". Retrovirology . 13 : 21. doi : 10.1186/s12977-016-0251-3 . PMC 4818470 . PMID 27036656.
- ^ Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S, Kaewkungwal J, Chiu J, Paris R, et al. (diciembre de 2009). "Vacunación con ALVAC y AIDSVAX para prevenir la infección por VIH-1 en Tailandia". The New England Journal of Medicine . 361 (23): 2209–20. doi : 10.1056/NEJMoa0908492 . PMID 19843557.
- ^ Callaway E (16 de septiembre de 2011). "Aparecen pistas que explican el primer ensayo exitoso de una vacuna contra el VIH". Nature . doi :10.1038/news.2011.541.
- ^ "Régimen de vacuna experimental contra el VIH ineficaz para prevenir el VIH". NIH. 3 de febrero de 2020. Archivado desde el original el 4 de febrero de 2020. Consultado el 4 de febrero de 2020 .
- ^ "NIH y socios lanzan ensayo de eficacia de vacuna contra el VIH en las Américas y Europa". Institutos Nacionales de Salud . 15 de julio de 2019. Archivado desde el original el 23 de julio de 2019 . Consultado el 23 de julio de 2019 .
- ^ "Un estudio revela que un régimen experimental de vacunas contra el VIH es seguro pero ineficaz". Institutos Nacionales de Salud (NIH) . 2023-01-18 . Consultado el 2023-01-26 .
- ^ "Invertir para poner fin a la epidemia del sida: una nueva era para la investigación y el desarrollo en materia de prevención del VIH" (PDF) . Archivado desde el original (PDF) el 2012-12-14 . Consultado el 2010-12-13 .
- ^ Berndt ER, Glennerster R, Kremer M, Lee J, Levine R, Weizsacker G, et al. (abril de 2005). "Compromisos de compra anticipada para una vacuna contra la malaria: estimación de costos y efectividad" (PDF) . Documento de trabajo del NBER . doi :10.2139/ssrn.696741. SSRN 696741. Archivado (PDF) desde el original el 2013-07-21 . Consultado el 2021-12-11 .
- ^ Collier L, Balows A, Sussman M (1998). Mahy B, Collier L (eds.). Virología . Topley y Wilson's Microbiology and Microbial Infections. Vol. 1 (novena edición). Hodder Education Publishers. págs. 75–91. ISBN 978-0-340-66316-5.
- ^ McGovern SL, Caselli E, Grigorieff N, Shoichet BK (abril de 2002). "Un mecanismo común subyacente a los inhibidores promiscuos del cribado virtual y de alto rendimiento". Journal of Medicinal Chemistry . 45 (8): 1712–22. doi :10.1021/jm010533y. PMID 11931626.
- ^ Comparado con la descripción general en: Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. (2007). Reseñas ilustradas de Lippincott: microbiología (Serie Reseñas ilustradas de Lippincott). Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 0-7817-8215-5 . Página 3
- ^ Foley B, Leitner T, Apetrei C, Hahn B, Mizrachi I, Mullins J, Rambaut A, Wolinsky S, Korber B (2017). Compendio de secuencias del VIH (informe). Grupo de Biología Teórica y Biofísica, Laboratorio Nacional de Los Álamos, NM, LA-UR 17-25240.
- ^ Malashkevich VN, Chan DC, Chutkowski CT, Kim PS (agosto de 1998). "Estructura cristalina del núcleo de gp41 del virus de inmunodeficiencia simia (VIS): interacciones helicoidales conservadas subyacen a la amplia actividad inhibidora de los péptidos gp41". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (16): 9134–9. Bibcode :1998PNAS...95.9134M. doi : 10.1073/pnas.95.16.9134 . PMC 21304 . PMID 9689046.
- ^ Bagasra O, Bagasra AU, Sheraz M, Pace DG (marzo de 2012). "Potencial utilidad del virus GB tipo C como vacuna preventiva para el VIH-1". Expert Review of Vaccines . 11 (3): 335–47. doi :10.1586/erv.11.191. PMID 22380825. S2CID 26476119.
- ^ Wang N, Li Y, Niu W, Sun M, Cerny R, Li Q, Guo J (mayo de 2014). "Construcción de una vacuna contra el VIH-1 viva atenuada mediante la expansión del código genético". Angewandte Chemie . 53 (19): 4867–71. doi :10.1002/anie.201402092. PMC 4984542 . PMID 24715496.
- ^ Perera Molligoda Arachchige, Arosh S (25 de marzo de 2022). "Terapias basadas en células NK para la infección por VIH: investigación de los avances actuales y las posibilidades futuras". Revista de biología de leucocitos . 111 (4): 921–931. doi :10.1002/JLB.5RU0821-412RR. ISSN 0741-5400. PMID 34668588.
- ^ Arachchige, Arosh S. Perera Molligoda (2021). "Un enfoque universal de células CAR-NK para la erradicación del VIH". AIMS Allergy and Immunology . 5 (3): 192–194. doi : 10.3934/Allergy.2021015 . ISSN 2575-615X.[ enlace muerto permanente ]
Enlaces externos
- Centro de Investigación de Vacunas (VRC): información sobre estudios de investigación de vacunas preventivas contra el VIH
- Sitio de vacunación contra el VIH del NIAID ( DAIDS )
- Alianza Mundial para Vacunas e Inmunización (GAVI)
- Iniciativa Internacional para una Vacuna contra el SIDA (IAVI)
- Coalición para la promoción de la vacuna contra el SIDA (AVAC)
- Programa de investigación sobre el VIH en el ejército de los Estados Unidos (MHRP)
- Investigación de la primera vacuna candidata
- HIV.gov - El recurso nacional federal de Estados Unidos sobre el VIH/SIDA
- HIVtest.org - Encuentre un sitio de pruebas de VIH cerca de usted
- Poco a poco, los científicos ganan terreno en la lucha contra el sida - The New York Times, 8 de marzo de 2019
- Grupo de Acción de Tratamiento

