Lluvia ácida


| Parte de una serie sobre |
| Contaminación |
|---|
 |
| Audio externo | |
|---|---|
 "¿Qué pasó con la lluvia ácida?", Instituto de Historia de la Ciencia "¿Qué pasó con la lluvia ácida?", Instituto de Historia de la Ciencia |
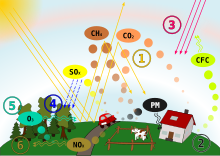
La lluvia ácida es la lluvia o cualquier otra forma de precipitación que es inusualmente ácida , lo que significa que tiene niveles elevados de iones de hidrógeno ( pH bajo ). La mayoría del agua, incluida el agua potable, tiene un pH neutro que existe entre 6,5 y 8,5, pero la lluvia ácida tiene un nivel de pH inferior a este y varía de 4 a 5 en promedio. [1] [2] Cuanto más ácida sea la lluvia ácida, más bajo será su pH. [2] La lluvia ácida puede tener efectos nocivos en las plantas, los animales acuáticos y la infraestructura. La lluvia ácida es causada por emisiones de dióxido de azufre y óxido de nitrógeno , que reaccionan con las moléculas de agua en la atmósfera para producir ácidos.
Se ha demostrado que la lluvia ácida tiene efectos adversos sobre los bosques, las aguas dulces , los suelos, los microbios, los insectos y las formas de vida acuáticas. [3] En los ecosistemas , la lluvia ácida persistente reduce la durabilidad de la corteza de los árboles, dejando a la flora más susceptible a los factores estresantes ambientales como la sequía, el calor/frío y la infestación de plagas. La lluvia ácida también es capaz de perjudicar la composición del suelo al despojarlo de nutrientes como el calcio y el magnesio que desempeñan un papel en el crecimiento de las plantas y el mantenimiento de un suelo saludable. En términos de infraestructura humana, la lluvia ácida también provoca el descascaramiento de la pintura, la corrosión de estructuras de acero como puentes y el desgaste de edificios de piedra y estatuas, además de tener impactos en la salud humana. [4] [5] [6] [7]
Algunos gobiernos, incluidos los de Europa y América del Norte , han realizado esfuerzos desde la década de 1970 para reducir la liberación de dióxido de azufre y óxido de nitrógeno a la atmósfera mediante regulaciones sobre la contaminación del aire. Estos esfuerzos han tenido resultados positivos debido a la amplia investigación sobre la lluvia ácida a partir de la década de 1960 y la información publicada sobre sus efectos nocivos. [8] [9] La principal fuente de compuestos de azufre y nitrógeno que dan lugar a la lluvia ácida son antropogénicos , pero los óxidos de nitrógeno también pueden producirse de forma natural por los rayos y el dióxido de azufre se produce por erupciones volcánicas . [10]
Definición
La "lluvia ácida" es aquella lluvia con un pH inferior a 5. [11] La lluvia "limpia" o no contaminada tiene un pH mayor a 5 pero aún menor a pH = 7 debido a la acidez causada por el ácido carbónico según las siguientes reacciones:
- H2O + CO2 ⇌ H2CO3
- H2O + H2CO3⇌HCO −3+ H3O +
Una variedad de fuentes naturales y artificiales contribuyen a la acidez. Por ejemplo, el ácido nítrico producido por descargas eléctricas en la atmósfera, como los rayos . [12] Las fuentes antropogénicas habituales son el dióxido de azufre y el óxido de nitrógeno . Reaccionan con el agua (al igual que el dióxido de carbono) para dar soluciones con un pH < 5. [2] Se han reportado lecturas ocasionales de pH en el agua de lluvia y niebla muy por debajo de 2,4 en áreas industrializadas. [13]
Historia
The examples and perspective in this section may not represent a worldwide view of the subject. (February 2020) |
La lluvia ácida se estudió sistemáticamente por primera vez en Europa, en la década de 1960, y en Estados Unidos y Canadá, en la década siguiente.
En Europa
El efecto corrosivo del aire contaminado y ácido de la ciudad sobre la piedra caliza y el mármol fue observado en el siglo XVII por John Evelyn , quien remarcó el mal estado de los mármoles de Arundel . [14] Desde la Revolución Industrial , las emisiones de dióxido de azufre y óxidos de nitrógeno a la atmósfera han aumentado. [13] [15] En 1852, Robert Angus Smith fue el primero en demostrar la relación entre la lluvia ácida y la contaminación atmosférica en Manchester , Inglaterra. [16] Smith acuñó el término "lluvia ácida" en 1872. [17]
A finales de los años 1960, los científicos comenzaron a observar y estudiar ampliamente el fenómeno. [18] Al principio, el foco principal de esta investigación recaía en los efectos locales de la lluvia ácida. Waldemar Christofer Brøgger fue el primero en reconocer el transporte de contaminantes a larga distancia cruzando fronteras desde el Reino Unido a Noruega, un problema estudiado sistemáticamente por Brynjulf Ottar en los años 1970. [19] El trabajo de Ottar estuvo fuertemente influenciado [20] por el científico sueco del suelo Svante Odén , quien había llamado la atención generalizada sobre el problema de la lluvia ácida en Europa en periódicos populares y escribió un artículo histórico sobre el tema en 1968. [21] [22] [23]
En los Estados Unidos
| Audio externo | |
|---|---|
 | |
 "¿Qué pasó con la lluvia ácida?", Podcast de Destilaciones , Instituto de Historia de la Ciencia "¿Qué pasó con la lluvia ácida?", Podcast de Destilaciones , Instituto de Historia de la Ciencia |
,_Harvard_University,_Cambridge,_MA_-_IMG_4607.JPG/440px-Bixi_stele_(wrapped),_Harvard_University,_Cambridge,_MA_-_IMG_4607.JPG)
El primer informe sobre la lluvia ácida en los Estados Unidos provino de evidencia química reunida en el valle de Hubbard Brook ; la conciencia pública sobre la lluvia ácida en los Estados Unidos aumentó en la década de 1970 después de que The New York Times informara sobre estos hallazgos. [25] [26]
En 1972, un grupo de científicos, entre ellos Gene Likens , descubrió que la lluvia que se depositaba en las Montañas Blancas de New Hampshire era ácida. El pH de la muestra se midió y fue de 4,03 en Hubbard Brook. [27] El Estudio del Ecosistema de Hubbard Brook siguió con una serie de estudios de investigación que analizaron los efectos ambientales de la lluvia ácida. La alúmina de los suelos neutralizó la lluvia ácida que se mezcló con el agua del arroyo en Hubbard Brook. [28] El resultado de esta investigación indicó que la reacción química entre la lluvia ácida y el aluminio conduce a una tasa creciente de erosión del suelo. La investigación experimental examinó los efectos del aumento de la acidez en los arroyos sobre las especies ecológicas. En 1980, los científicos modificaron la acidez de Norris Brook, New Hampshire, y observaron el cambio en el comportamiento de las especies. Hubo una disminución en la diversidad de especies, un aumento en los dominantes de la comunidad y una reducción en la complejidad de la red alimentaria . [29]
En 1980, el Congreso de los Estados Unidos aprobó una Ley de Deposición Ácida. [30] Esta ley estableció un programa de evaluación e investigación de 18 años bajo la dirección del Programa Nacional de Evaluación de Precipitaciones Ácidas (NAPAP). NAPAP amplió una red de sitios de monitoreo para determinar cuán ácida era la precipitación, buscando determinar tendencias a largo plazo, y estableció una red para la deposición seca. Utilizando un diseño de muestreo basado en estadísticas, NAPAP cuantificó los efectos de la lluvia ácida a nivel regional al enfocar la investigación y los estudios para identificar y cuantificar el impacto de la precipitación ácida en los ecosistemas terrestres y de agua dulce. NAPAP también evaluó los efectos de la lluvia ácida en edificios históricos, monumentos y materiales de construcción. También financió estudios extensos sobre procesos atmosféricos y posibles programas de control.
Desde el principio, los defensores de políticas de todos los bandos intentaron influir en las actividades del NAPAP para apoyar sus iniciativas de promoción de políticas específicas o para desacreditar las de sus oponentes. [30] Para la empresa científica del gobierno de los EE.UU., un impacto significativo del NAPAP fueron las lecciones aprendidas en el proceso de evaluación y en la gestión de la investigación ambiental para un grupo relativamente grande de científicos, administradores de programas y el público. [31]
En 1981, la Academia Nacional de Ciencias estaba investigando sobre las controvertidas cuestiones relacionadas con la lluvia ácida. [32] El presidente Ronald Reagan desestimó los problemas de la lluvia ácida [33] hasta su visita personal a Canadá y confirmó que la frontera canadiense sufría la contaminación derivada de las chimeneas originadas en el Medio Oeste de los EE . UU. Reagan honró el acuerdo con el Primer Ministro canadiense Pierre Trudeau para la aplicación de la regulación anticontaminación. [34] En 1982, Reagan encargó a William Nierenberg que formara parte del Consejo Nacional de Ciencias . [35] Nierenberg seleccionó a científicos, incluido Gene Likens, para formar parte de un panel para redactar un informe sobre la lluvia ácida. En 1983, el panel de científicos presentó un borrador del informe, que concluyó que la lluvia ácida es un problema real y que se deben buscar soluciones. [36] La Oficina de Política Científica y Tecnológica de la Casa Blanca revisó el borrador del informe y envió las sugerencias de Fred Singer al informe, que pusieron en duda la causa de la lluvia ácida. [37] Los panelistas manifestaron su rechazo a las posiciones de Singer y presentaron el informe a Nierenberg en abril. En mayo de 1983, la Cámara de Representantes votó en contra de la legislación que tenía como objetivo controlar las emisiones de azufre. Hubo un debate sobre si Nierenberg había demorado la publicación del informe. El propio Nierenberg negó las afirmaciones sobre su supresión del informe y afirmó que el informe fue retenido después de la votación de la Cámara porque no estaba listo para ser publicado. [38]
En 1991, el Programa Nacional de Evaluación de Precipitaciones Ácidas (NAPAP) de los Estados Unidos proporcionó su primera evaluación de la lluvia ácida en los Estados Unidos. [39] Informó que el 5% de los lagos de Nueva Inglaterra eran ácidos, siendo los sulfatos el problema más común. Observaron que el 2% de los lagos ya no podían soportar la trucha de arroyo y el 6% de los lagos no eran adecuados para la supervivencia de muchas especies de pececillos. Los informes posteriores al Congreso han documentado cambios químicos en los ecosistemas del suelo y de agua dulce, saturación de nitrógeno, disminuciones en las cantidades de nutrientes en el suelo, acidificación episódica, neblina regional y daños a los monumentos históricos.
Mientras tanto, en 1990, el Congreso de los Estados Unidos aprobó una serie de enmiendas a la Ley de Aire Limpio . [40] El Título IV de estas enmiendas estableció un sistema de límite y comercio diseñado para controlar las emisiones de dióxido de azufre y óxidos de nitrógeno. [41] Ambas emisiones demostraron causar un problema significativo en los ciudadanos estadounidenses y su acceso a un aire limpio y saludable. [42] El Título IV exigía una reducción total de alrededor de 10 millones de toneladas de emisiones de SO2 de las centrales eléctricas, cerca de una reducción del 50%. [41] Se implementó en dos fases. La Fase I comenzó en 1995 y limitó las emisiones de dióxido de azufre de 110 de las centrales eléctricas más grandes a un total combinado de 8,7 millones de toneladas de dióxido de azufre. Una central eléctrica en Nueva Inglaterra (Merrimack) estaba en la Fase I. Otras cuatro plantas (Newington, Mount Tom, Brayton Point y Salem Harbor) se agregaron bajo otras disposiciones del programa. La Fase II comenzó en 2000 y afecta a la mayoría de las centrales eléctricas del país.
Durante la década de 1990, la investigación continuó. El 10 de marzo de 2005, la EPA emitió la Norma Interestatal de Aire Limpio (CAIR, por sus siglas en inglés). Esta norma ofrece a los estados una solución al problema de la contaminación de las centrales eléctricas que se desplaza de un estado a otro. La CAIR limitará permanentemente las emisiones de SO2 y NOx en el este de los Estados Unidos. Cuando se implemente por completo [ ¿cuándo? ] , la CAIR reducirá las emisiones de SO2 en 28 estados del este y el Distrito de Columbia en más del 70% y las emisiones de NOx en más del 60% con respecto a los niveles de 2003. [43]
En general, el programa de topes y comercio de emisiones ha logrado sus objetivos. Desde los años 1990, las emisiones de SO2 han disminuido un 40% y, según el Instituto de Investigación del Pacífico , los niveles de lluvia ácida han disminuido un 65% desde 1976. [44] En la Unión Europea se utilizó una regulación convencional, que vio una disminución de más del 70% en las emisiones de SO2 durante el mismo período. [45]
En 2007, las emisiones totales de SO 2 fueron de 8,9 millones de toneladas, lo que permitió alcanzar el objetivo a largo plazo del programa antes de la fecha límite reglamentaria de 2010. [46]
En 2007, la EPA estimó que, para 2010, los costos generales de cumplir con el programa para las empresas y los consumidores serían de 1.000 a 2.000 millones de dólares al año, sólo una cuarta parte de lo que se había previsto originalmente. [44] Forbes afirma: "En 2010, cuando el sistema de límites máximos y comercio de emisiones había sido ampliado por la Norma Interestatal de Aire Limpio de la administración de George W. Bush, las emisiones de SO2 habían caído a 5,1 millones de toneladas". [47]
El término ciencia ciudadana se remonta a enero de 1989, cuando la Sociedad Audubon realizó una campaña para medir la lluvia ácida. El científico Muki Haklay cita en un informe de políticas para el Centro Wilson titulado 'Ciencia ciudadana y política: una perspectiva europea' un primer uso del término 'ciencia ciudadana' por parte de R. Kerson en la revista MIT Technology Review de enero de 1989. [48] [49] Citando el informe del Centro Wilson: "La nueva forma de participación en la ciencia recibió el nombre de 'ciencia ciudadana'. El primer ejemplo registrado del uso del término es de 1989, y describe cómo 225 voluntarios en todo Estados Unidos recogieron muestras de lluvia para ayudar a la Sociedad Audubon en una campaña de concienciación sobre la lluvia ácida. Los voluntarios recogieron muestras, comprobaron la acidez e informaron a la organización. La información se utilizó luego para demostrar la magnitud total del fenómeno". [48] [49]
En Canadá
El canadiense Harold Harvey fue uno de los primeros en investigar un lago "muerto". En 1971, él y RJ Beamish publicaron un informe, "Acidification of the La Cloche Mountain Lakes", en el que documentaban el deterioro gradual de las poblaciones de peces en 60 lagos del parque Killarney en Ontario, que habían estado estudiando sistemáticamente desde 1966. [50]
En los años 1970 y 1980, la lluvia ácida fue un tema importante de investigación en el Área Experimental de Lagos (ELA) en el Noroeste de Ontario, Canadá . [51] Los investigadores agregaron ácido sulfúrico a lagos enteros en experimentos de ecosistemas controlados para simular los efectos de la lluvia ácida. Debido a que sus condiciones remotas permitieron experimentos en todo el ecosistema, la investigación en el ELA mostró que el efecto de la lluvia ácida en las poblaciones de peces comenzó en concentraciones mucho más bajas que las observadas en experimentos de laboratorio. [52] En el contexto de una red alimentaria , las poblaciones de peces colapsaron antes que cuando la lluvia ácida tuvo efectos tóxicos directos para los peces porque la acidez provocó caídas en las poblaciones de presas (por ejemplo, los mísidos ). [52] A medida que se redujeron los aportes de ácido experimental, las poblaciones de peces y los ecosistemas lacustres se recuperaron al menos parcialmente, aunque las poblaciones de invertebrados aún no han regresado completamente a las condiciones de referencia. [53] Esta investigación demostró que la acidificación estaba vinculada a la disminución de las poblaciones de peces y que los efectos podrían revertirse si las emisiones de ácido sulfúrico disminuyeran, e influyó en las políticas de Canadá y los Estados Unidos. [51]
En 1985, siete provincias canadienses (todas excepto Columbia Británica , Alberta y Saskatchewan ) y el gobierno federal firmaron el Programa de Lluvia Ácida del Este de Canadá. [54] Las provincias acordaron limitar sus emisiones combinadas de dióxido de azufre a 2,3 millones de toneladas para 1994. El Acuerdo de Calidad del Aire Canadá-Estados Unidos se firmó en 1991. [54] En 1998, todos los Ministros federales, provinciales y territoriales de Energía y Medio Ambiente firmaron la Estrategia de Lluvia Ácida para todo Canadá después de 2000, que fue diseñada para proteger los lagos que son más sensibles que los protegidos por políticas anteriores. [54]
En la India
Un mayor riesgo podría ser el aumento esperado de las emisiones totales de azufre de 4.400 kilotoneladas (kt) en 1990 a 6.500 kt en 2000, 10.900 kt en 2010 y 18.500 en 2020. [55]
Emisiones de sustancias químicas que provocan acidificación
El gas más importante que provoca la acidificación es el dióxido de azufre. Las emisiones de óxidos de nitrógeno que se oxidan para formar ácido nítrico son cada vez más importantes debido a los controles más estrictos sobre las emisiones de compuestos de azufre. 70 Tg(S) por año en forma de SO2 provienen de la quema de combustibles fósiles y la industria, 2,8 Tg(S) de los incendios forestales y 7–8 Tg(S) por año de los volcanes . [56]
Fenómenos naturales
| Tipos de alimentos | Emisiones acidificantes (g SO 2 eq por 100g de proteína) |
|---|---|
| Carne de res | |
| Queso | |
| Cerdo | |
| Cordero y carnero | |
| Crustáceos de cultivo | |
| Aves de corral | |
| Peces de cultivo | |
| Huevos | |
| Cacahuetes | |
| Guisantes | |
| Tofu |
Los principales fenómenos naturales que aportan gases productores de ácido a la atmósfera son las emisiones de los volcanes. [58] Así, por ejemplo, las fumarolas del cráter de la Laguna Caliente del volcán Poás crean cantidades extremadamente altas de lluvia ácida y niebla, con una acidez tan alta como un pH de 2, limpiando un área de cualquier vegetación y causando con frecuencia irritación a los ojos y pulmones de los habitantes de los asentamientos cercanos. Los gases productores de ácido también son creados por procesos biológicos que ocurren en la tierra, en los humedales y en los océanos . La principal fuente biológica de compuestos de azufre es el sulfuro de dimetilo .
El ácido nítrico en el agua de lluvia es una fuente importante de nitrógeno fijado para la vida vegetal, y también es producido por la actividad eléctrica en la atmósfera, como los rayos . [59]
Se han detectado depósitos ácidos en hielo glacial de miles de años de antigüedad en zonas remotas del planeta. [60]
Actividad humana

La principal causa de la lluvia ácida son los compuestos de azufre y nitrógeno de origen humano, como la generación de electricidad , la ganadería , las fábricas y los vehículos de motor . [61] Entre ellas se incluyen las centrales eléctricas, que utilizan generadores de energía eléctrica que representan una cuarta parte de los óxidos de nitrógeno y dos tercios del dióxido de azufre de la atmósfera. [62] La lluvia ácida industrial es un problema importante en China y Rusia [63] [64] y en las zonas situadas a sotavento de ellas. Todas estas zonas queman carbón que contiene azufre para generar calor y electricidad. [65]
El problema de la lluvia ácida no sólo ha aumentado con el crecimiento demográfico e industrial, sino que se ha extendido. El uso de chimeneas altas para reducir la contaminación local ha contribuido a la propagación de la lluvia ácida al liberar gases en la circulación atmosférica regional; la dispersión de estas chimeneas más altas hace que los contaminantes sean transportados más lejos, causando un daño ecológico generalizado. [60] [66] A menudo, la deposición se produce a una distancia considerable a sotavento de las emisiones, y las regiones montañosas tienden a recibir la mayor deposición (debido a sus mayores precipitaciones). Un ejemplo de este efecto es el bajo pH de la lluvia que cae en Escandinavia . En cuanto a los bajos niveles de pH y los desequilibrios de pH en correlación con la lluvia ácida, los niveles bajos, o aquellos por debajo del valor de pH de 7, se consideran ácidos. La lluvia ácida cae a un valor de pH de aproximadamente 4, lo que la hace nociva para el consumo humano. Cuando estos niveles bajos de pH caen en regiones específicas, no sólo afectan al medio ambiente sino también a la salud humana. Los niveles de pH ácido en los seres humanos provocan pérdida de cabello, pH urinario bajo, desequilibrios minerales graves, estreñimiento y muchos casos de trastornos crónicos como fibromialgia y carcinoma basal. [67]
Proceso químico
La combustión de combustibles y la fundición de algunos minerales producen dióxido de azufre y óxidos nítricos, que se convierten en ácido sulfúrico y ácido nítrico. [68]
En la fase gaseosa, el dióxido de azufre se oxida a ácido sulfúrico :
- SO2 + 0,5 O2 + H2O → H2SO4
El dióxido de nitrógeno reacciona con radicales hidroxilo para formar ácido nítrico:
- NO2 +OH· → HNO3
Los mecanismos detallados dependen de la presencia de agua y trazas de hierro y manganeso . Además del O2 , existen otros oxidantes capaces de provocar estas reacciones, entre ellos el ozono , el peróxido de hidrógeno y el oxígeno . [16]
Deposición ácida
Deposición húmeda
La deposición húmeda de ácidos ocurre cuando cualquier forma de precipitación (lluvia, nieve, etc.) elimina ácidos de la atmósfera y los lleva a la superficie de la Tierra. Esto puede resultar de la deposición de ácidos producidos en las gotas de lluvia (ver química de la fase acuosa más arriba) o de la precipitación que elimina los ácidos ya sea en las nubes o debajo de ellas. La eliminación húmeda tanto de gases como de aerosoles es importante para la deposición húmeda. [2]
Las plantas CAM se encuentran predominantemente en ambientes áridos, donde la disponibilidad de agua es limitada.
Deposición seca
La deposición ácida también se produce por deposición seca en ausencia de precipitación. Esta puede ser responsable de hasta un 20 a 60% de la deposición ácida total. [69] Esto ocurre cuando partículas y gases se adhieren al suelo, plantas u otras superficies. [2]
Efectos adversos
Se ha demostrado que la lluvia ácida tiene efectos adversos sobre los bosques, las aguas dulces y los suelos, matando insectos y formas de vida acuáticas, además de causar daños a los edificios y tener efectos sobre la salud humana.
Aguas superficiales y animales acuáticos

El ácido sulfúrico y el ácido nítrico tienen múltiples impactos en los ecosistemas acuáticos, incluyendo la acidificación, el aumento del contenido de nitrógeno y aluminio y la alteración de los procesos biogeoquímicos . [70] Tanto el pH más bajo como las concentraciones más altas de aluminio en el agua superficial que se producen como resultado de la lluvia ácida pueden causar daños a los peces y otros animales acuáticos. A un pH inferior a 5, la mayoría de los huevos de peces no eclosionan y un pH más bajo puede matar a los peces adultos. A medida que los lagos y ríos se vuelven más ácidos, se reduce la biodiversidad . La lluvia ácida ha eliminado la vida de los insectos y algunas especies de peces, incluida la trucha de arroyo en algunos lagos, arroyos y riachuelos en áreas geográficamente sensibles, como las montañas Adirondack de los Estados Unidos. [71]
Sin embargo, el grado en que la lluvia ácida contribuye directa o indirectamente a través de la escorrentía de la cuenca a la acidez de lagos y ríos (es decir, dependiendo de las características de la cuenca hidrográfica circundante) es variable. El sitio web de la Agencia de Protección Ambiental de los Estados Unidos (EPA) afirma: "De los lagos y arroyos estudiados, la lluvia ácida causó acidez en el 75% de los lagos ácidos y aproximadamente el 50% de los arroyos ácidos". [71] Los lagos alojados en rocas de basamento de silicato son más ácidos que los lagos dentro de piedra caliza u otras rocas de basamento con una composición de carbonato (es decir, mármol) debido a los efectos amortiguadores de los minerales de carbonato, incluso con la misma cantidad de lluvia ácida. [72] [ cita requerida ]
Suelos
La biología y la química del suelo pueden verse seriamente dañadas por la lluvia ácida. Algunos microbios no pueden tolerar cambios en el pH y mueren. [73] Las enzimas de estos microbios se desnaturalizan (cambian de forma y dejan de funcionar) por el ácido. Los iones hidronio de la lluvia ácida también movilizan toxinas , como el aluminio, y eliminan nutrientes y minerales esenciales como el magnesio . [5]
- 2 H + (ac) + Mg 2+ (arcilla) ⇌ 2 H + (arcilla) + Mg 2+ (ac)
La química del suelo puede cambiar drásticamente cuando los cationes básicos, como el calcio y el magnesio, son lixiviados por la lluvia ácida, afectando así a especies sensibles, como el arce azucarero ( Acer saccharum ). [74]
Acidificación del suelo

Los efectos del agua ácida y la acidificación del suelo sobre las plantas pueden ser menores o, en la mayoría de los casos, mayores. La mayoría de los casos menores que no resultan en la muerte de la planta se pueden atribuir a que las plantas son menos susceptibles a las condiciones ácidas y/o a que la lluvia ácida es menos potente. Sin embargo, incluso en casos menores, la planta acabará muriendo debido a que el agua ácida reduce el pH natural de la planta. [75] El agua ácida entra en la planta y hace que los minerales importantes de la planta se disuelvan y se los lleven; lo que finalmente hace que la planta muera por falta de minerales para su nutrición. En los casos mayores, que son más extremos, se produce el mismo proceso de daño que en los casos menores, que es la eliminación de minerales esenciales, pero a un ritmo mucho más rápido. [6] Asimismo, la lluvia ácida que cae sobre el suelo y sobre las hojas de las plantas provoca el secado de la cutícula cerosa de las hojas, lo que en última instancia provoca una rápida pérdida de agua de la planta hacia la atmósfera exterior y, finalmente, resulta en la muerte de la planta. [76] La acidificación del suelo puede provocar una disminución de los microbios del suelo como resultado de un cambio en el pH, lo que tendría un efecto adverso en las plantas debido a su dependencia de los microbios del suelo para acceder a los nutrientes. [77] [78] [79] Para ver si una planta se está viendo afectada por la acidificación del suelo, se pueden observar de cerca las hojas de la planta. Si las hojas son verdes y se ven saludables, el pH del suelo es normal y aceptable para la vida de las plantas. Pero si las hojas de la planta tienen un color amarillento entre las venas de sus hojas, eso significa que la planta está sufriendo de acidificación y no está sana. [80] Además, una planta que sufre de acidificación del suelo no puede realizar la fotosíntesis; el proceso de secado de la planta inducido por el agua ácida puede destruir los orgánulos del cloroplasto. [81] Sin poder realizar la fotosíntesis, una planta no puede crear nutrientes para su propia supervivencia ni oxígeno para la supervivencia de los organismos aeróbicos, lo que afecta a la mayoría de las especies de la Tierra y, en última instancia, acaba con el propósito de la existencia de la planta. [82]
Bosques y otra vegetación

Los efectos adversos pueden estar indirectamente relacionados con la lluvia ácida, como los efectos del ácido sobre el suelo (véase más arriba) o la alta concentración de precursores gaseosos de la lluvia ácida. Los bosques de gran altitud son especialmente vulnerables, ya que suelen estar rodeados de nubes y niebla que son más ácidas que la lluvia. [83]
Las plantas son capaces de adaptarse a la lluvia ácida. En la montaña Jinyun, Chongqing , se observó que las especies de plantas se adaptaban a nuevas condiciones ambientales. Los efectos sobre las especies iban desde beneficiosos hasta perjudiciales. Con lluvias naturales o lluvias ácidas moderadas, las características bioquímicas y fisiológicas de las plántulas de las plantas se mejoraron. Una vez que el pH aumenta hasta el umbral de 3,5, la lluvia ácida ya no puede ser beneficiosa y comienza a tener efectos negativos. [84]
La lluvia ácida puede afectar negativamente la fotosíntesis en las hojas de las plantas, cuando las hojas están expuestas a un pH más bajo, la fotosíntesis se ve afectada debido a la disminución de la clorofila. [85] La lluvia ácida también tiene la capacidad de causar deformación de las hojas a nivel celular, los ejemplos incluyen; cicatrización de tejidos y cambios en las células estomáticas, epidermis y mesófilas. [86] Los impactos adicionales de la lluvia ácida incluyen una disminución en el grosor de la cutícula presente en la superficie de la hoja. [85] [86] Debido a que la lluvia ácida daña las hojas, esto afecta directamente la capacidad de las plantas de tener una fuerte cubierta de dosel, una disminución de la cubierta de dosel puede hacer que las plantas sean más vulnerables a las enfermedades. [77]
En las zonas afectadas por la lluvia ácida suelen aparecer árboles muertos o moribundos. La lluvia ácida hace que el aluminio se filtre del suelo, lo que supone un riesgo para la vida vegetal y animal. Además, priva al suelo de minerales y nutrientes esenciales para el crecimiento de los árboles.
En altitudes más altas, la niebla ácida y las nubes pueden agotar los nutrientes del follaje de los árboles, lo que provoca la decoloración o la muerte de las hojas y las acículas. Esta disminución compromete la capacidad de los árboles para absorber la luz solar, debilitándolos y disminuyendo su capacidad para soportar condiciones de frío. [87]
La lluvia ácida también puede dañar otras plantas, pero el efecto sobre los cultivos alimentarios se minimiza con la aplicación de cal y fertilizantes para reemplazar los nutrientes perdidos. En las zonas cultivadas, también se puede añadir caliza para aumentar la capacidad del suelo de mantener estable el pH, pero esta táctica es en gran medida inutilizable en el caso de las tierras silvestres. Cuando el calcio se lixivia de las agujas de la pícea roja, estos árboles se vuelven menos tolerantes al frío y sufren daños invernales e incluso la muerte. [88] [89] La lluvia ácida también puede afectar la productividad de los cultivos por necrosis o cambios en los nutrientes del suelo, que en última instancia impiden que las plantas alcancen la madurez. [90] [91]
Acidificación de los océanos
![[icon]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | This section needs expansion. You can help by adding to it. (July 2013) |
La lluvia ácida tiene un efecto mucho menos dañino en los océanos a escala global, pero crea un impacto amplificado en las aguas menos profundas de las aguas costeras. [92] La lluvia ácida puede hacer que el pH del océano caiga, conocido como acidificación del océano , lo que dificulta que las diferentes especies costeras creen sus exoesqueletos que necesitan para sobrevivir. Estas especies costeras se vinculan entre sí como parte de la cadena alimentaria del océano, y sin que sean una fuente para que otras formas de vida marina se alimenten, más vida marina morirá. [93] El esqueleto de piedra caliza del coral es particularmente sensible a las disminuciones de pH, porque el carbonato de calcio , un componente central del esqueleto de piedra caliza, se disuelve en soluciones ácidas (pH bajo).
Además de la acidificación, el exceso de nitrógeno procedente de la atmósfera promueve un mayor crecimiento del fitoplancton y otras plantas marinas, lo que, a su vez, puede provocar floraciones de algas nocivas más frecuentes y eutrofización (la creación de "zonas muertas" sin oxígeno) en algunas partes del océano. [92]
Efectos sobre la salud humana
La lluvia ácida puede afectar negativamente la salud humana, especialmente cuando las personas inhalan partículas liberadas por la lluvia ácida. [1] Los efectos de la lluvia ácida en la salud humana son complejos y pueden manifestarse de diversas maneras, como problemas respiratorios por exposición a largo plazo y exposición indirecta a través de fuentes de agua y alimentos contaminados.
Efectos del dióxido de nitrógeno
La exposición a contaminantes del aire asociados con la lluvia ácida, como el dióxido de nitrógeno (NO2), puede tener un impacto negativo en la salud respiratoria. [3] El dióxido de nitrógeno soluble en agua se acumula en las diminutas vías respiratorias, donde se transforma en ácidos nítrico y nitroso . [4] La neumonía causada por ácidos nítricos daña directamente las células epiteliales que recubren las vías respiratorias, lo que resulta en edema pulmonar . [8] La exposición al dióxido de nitrógeno también reduce la respuesta inmune al inhibir la generación de citocinas inflamatorias por los macrófagos alveolares en respuesta a la infección bacteriana. [10] En estudios con animales, el contaminante reduce aún más la inmunidad respiratoria al disminuir la depuración mucociliar en el tracto respiratorio inferior, lo que resulta en una capacidad reducida para eliminar infecciones respiratorias. [12]
Efectos del trióxido de azufre
Los efectos del trióxido de azufre y del ácido sulfúrico son similares porque ambos producen ácido sulfúrico cuando entran en contacto con las superficies húmedas de la piel o del sistema respiratorio . [94] La cantidad de SO3 que se respira por la boca es mayor que la cantidad de SO3 que se respira por la nariz. [94] Cuando los humanos respiran trióxido de azufre, se forman pequeñas gotas de ácido sulfúrico dentro del cuerpo que ingresan al tracto respiratorio hasta los pulmones según el tamaño de las partículas. [94] Los efectos del SO3 en el sistema respiratorio provocan dificultad para respirar en personas con síntomas de asma . El trióxido de azufre también causa mucha corrosión e irritación en la piel, los ojos y el tracto gastrointestinal cuando hay exposición directa a una concentración específica o exposición a largo plazo. [94] Se sabe que el consumo de ácido sulfúrico concentrado causa mortalidad, quema la boca y la garganta, erosiona un agujero en el estómago, quema la piel cuando entra en contacto con la piel y hace que los ojos lloren si entra en ellos. [94]
Recomendación del Gobierno Federal
Dióxidos de nitrógeno
La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido un límite máximo de 25 partes por millón (ppm) de óxido nítrico en el aire de trabajo para una jornada laboral de 8 horas y una semana laboral de 40 horas. [95] Además, la OSHA ha establecido un límite de exposición al dióxido de nitrógeno de 5 ppm durante 15 minutos en el lugar de trabajo. [95]
Trióxido de azufre
Los límites que no deben excederse en el aire, el agua, el suelo o los alimentos que recomiendan las reglamentaciones suelen basarse en niveles que afectan a los animales antes de modificarse para ayudar a proteger a las personas. Dependiendo de si emplean diferentes estudios con animales, tienen diferentes duraciones de exposición (por ejemplo, una jornada laboral de 8 horas frente a una jornada de 24 horas) o por otras razones, estos valores que no deben excederse pueden variar entre organismos federales. [94]
La EPA limita la cantidad de dióxido de azufre que se puede emitir a la atmósfera. Esto reduce la cantidad de dióxido de azufre en el aire que se convierte en trióxido de azufre y ácido sulfúrico. [14] La OSHA limita las concentraciones de ácido sulfúrico en el aire del lugar de trabajo a 1 mg/m 3 . Además, el NIOSH recomienda un límite promedio ponderado en el tiempo de 1 mg/m 3 . [94]
Cuando usted esté consciente de la exposición al NO2 y SO3, debe hablar con su médico y preguntar a las personas que están a su alrededor, especialmente a los niños.
Otros efectos adversos


La lluvia ácida puede dañar edificios, monumentos históricos y estatuas, especialmente los construidos con rocas, como la piedra caliza y el mármol , que contienen grandes cantidades de carbonato de calcio. Los ácidos de la lluvia reaccionan con los compuestos de calcio de las piedras y crean yeso, que luego se desprende.
- CaCO3 (s) + H2SO4 ( ac ) ⇌ CaSO4 ( s) + CO2 ( g ) + H2O ( l)
Los efectos de esto se ven comúnmente en las lápidas antiguas, donde la lluvia ácida puede hacer que las inscripciones se vuelvan completamente ilegibles. La lluvia ácida también aumenta la tasa de corrosión de los metales, en particular el hierro , el acero , el cobre y el bronce . [96] [97]
Zonas afectadas
Entre los lugares del mundo que se han visto significativamente afectados por la lluvia ácida se encuentran la mayor parte de Europa oriental, desde Polonia hacia el norte hasta Escandinavia, [98] el tercio oriental de los Estados Unidos, [99] y el sureste de Canadá . Otras áreas afectadas incluyen la costa sureste de China y Taiwán . [100]
Métodos de prevención
Soluciones técnicas
Muchas centrales eléctricas que queman carbón utilizan la desulfuración de gases de combustión (FGD) para eliminar los gases que contienen azufre de sus gases de chimenea. En una típica central eléctrica que quema carbón , la FGD eliminará el 95 % o más del SO2 de los gases de combustión. Un ejemplo de FGD es el depurador húmedo que se utiliza comúnmente. Un depurador húmedo es básicamente una torre de reacción equipada con un ventilador que extrae los gases de chimenea calientes de una planta de energía hacia la torre. También se inyecta cal o piedra caliza en forma de suspensión en la torre para mezclarla con los gases de chimenea y combinarla con el dióxido de azufre presente. El carbonato de calcio de la piedra caliza produce sulfato de calcio de pH neutro que se elimina físicamente del depurador. Es decir, el depurador convierte la contaminación por azufre en sulfatos industriales.
En algunas zonas, los sulfatos se venden a empresas químicas como yeso cuando la pureza del sulfato de calcio es alta. En otras, se depositan en vertederos . Los efectos de la lluvia ácida pueden durar generaciones, ya que los efectos del cambio del nivel de pH pueden estimular la lixiviación continua de sustancias químicas indeseables en fuentes de agua que de otro modo serían prístinas, matando especies vulnerables de insectos y peces y bloqueando los esfuerzos por restaurar la vida nativa.
La combustión en lecho fluidizado también reduce la cantidad de azufre emitida por la producción de energía.
El control de emisiones de vehículos reduce las emisiones de óxidos de nitrógeno de los vehículos motorizados.
Tratados internacionales
.jpg/440px-Acid_Rain_box_-_23_(49753937638).jpg)
Los países occidentales llevan ya algún tiempo acordando tratados internacionales sobre el transporte de contaminantes atmosféricos a larga distancia. A partir de 1979, los países europeos se reunieron para ratificar los principios generales discutidos durante la Convención de la CEPE. El objetivo era combatir la contaminación atmosférica transfronteriza a larga distancia. [101] El Protocolo de Helsinki de 1985 sobre la reducción de las emisiones de azufre en virtud de la Convención sobre la contaminación atmosférica transfronteriza a larga distancia promovió los resultados de la convención. Los resultados del tratado ya han dado frutos, como lo demuestra una reducción aproximada del 40 por ciento de las partículas en suspensión en América del Norte. [102] La eficacia de la Convención en la lucha contra la lluvia ácida ha inspirado otros actos de compromiso internacional para prevenir la proliferación de partículas en suspensión. Canadá y los Estados Unidos firmaron el Acuerdo sobre la calidad del aire en 1991. La mayoría de los países europeos y Canadá firmaron los tratados. La Convención sobre la contaminación atmosférica transfronteriza a gran distancia siguió sin actividad después de 1999, cuando 27 países se reunieron para reducir aún más los efectos de la lluvia ácida. [103] En 2000, se inició por primera vez la cooperación extranjera para prevenir la lluvia ácida en Asia. Diez diplomáticos de países de todo el continente se reunieron para debatir formas de prevenir la lluvia ácida. [104] Tras estos debates, en 2001 se creó la Red de Vigilancia de la Deposición Ácida en Asia Oriental (EANET, por sus siglas en inglés) como una iniciativa intergubernamental para proporcionar información basada en la ciencia a los encargados de la toma de decisiones y promover la cooperación internacional en materia de deposición ácida en Asia Oriental. [105] En 2023, los países miembros de la EANET incluyen a Camboya, China, Indonesia, Japón, República Democrática Popular Lao, Malasia, Mongolia, Myanmar, Filipinas, República de Corea, Rusia, Tailandia y Vietnam. [106]
Comercio de emisiones
En virtud de este esquema regulatorio, cada instalación contaminante recibe o puede comprar en un mercado abierto un derecho de emisión por cada unidad de un contaminante determinado que emita. Los operadores pueden entonces instalar equipos de control de la contaminación y vender las partes de sus derechos de emisión que ya no necesitan para sus propias operaciones, recuperando así parte del costo de capital de su inversión en dichos equipos. La intención es dar a los operadores incentivos económicos para instalar controles de la contaminación.
El primer mercado de comercio de emisiones se estableció en los Estados Unidos mediante la promulgación de las Enmiendas a la Ley de Aire Limpio de 1990. [ 107] El objetivo general del Programa de Lluvia Ácida establecido por la Ley [108] es lograr importantes beneficios ambientales y de salud pública mediante la reducción de las emisiones de dióxido de azufre (SO 2 ) y óxidos de nitrógeno (NO x ), las principales causas de la lluvia ácida. Para lograr este objetivo con el menor costo para la sociedad, el programa emplea enfoques tanto regulatorios como basados en el mercado para controlar la contaminación del aire.
Véase también
- Precipitación alcalina
- Ciencia ciudadana : uno de los dos «primeros usos» del término fue en una campaña contra la lluvia ácida en 1989.
- Lista de cuestiones medioambientales
- Listas de temas ambientales
- Acidificación de los océanos
- Polvo de lluvia (una lluvia alcalina )
- Regresión y degradación del suelo
Referencias
- ^ ab "Regulaciones y contaminantes del agua potable". EPA de EE. UU . 3 de septiembre de 2015. Consultado el 19 de octubre de 2021 .
- ^ abcde "¿Qué es la lluvia ácida?". US EPA . 9 de febrero de 2016. Archivado desde el original el 23 de mayo de 2020 . Consultado el 14 de abril de 2020 .
- ^ ab US EPA, OAR (16 de marzo de 2016). "Efectos de la lluvia ácida". epa.gov . Consultado el 29 de marzo de 2022 .
- ^ ab Magaino, S. (enero de 1997). "Tasa de corrosión de electrodos de disco rotatorios de cobre en lluvia ácida simulada". Electrochimica Acta . 42 (3): 377–382. doi :10.1016/S0013-4686(96)00225-3.
- ^ ab US EPA: Efectos de la lluvia ácida en los bosques Archivado el 26 de julio de 2008 en Wayback Machine.
- ^ ab Markewitz, Daniel; Richter, Daniel D.; Allen, H. Lee; Urrego, J. Byron (septiembre de 1998). "Tres décadas de acidificación del suelo observada en el bosque experimental de Calhoun: ¿ha marcado la lluvia ácida una diferencia?". Revista de la Sociedad Americana de Ciencias del Suelo . 62 (5): 1428–1439. Código Bibliográfico :1998SSASJ..62.1428M. doi :10.2136/sssaj1998.03615995006200050040x.
- ^ Efectos de la lluvia ácida en la salud humana Archivado el 18 de enero de 2008 en Wayback Machine . Epa.gov (2 de junio de 2006). Consultado el 9 de febrero de 2013.
- ^ ab P. Rafferty, John. "¿Qué pasó con la lluvia ácida?". Encyclopædia Britannica . Consultado el 21 de julio de 2022 .
- ^ Kjellstrom, Tord; Lodh, Madhumita; McMichael, Tony; Ranmuthugala, Geetha; Shrestha, Rupendra; Kingsland, Sally (2006), Jamison, Dean T.; Breman, Joel G.; Measham, Anthony R.; Alleyne, George (eds.), "Contaminación del aire y del agua: carga y estrategias para su control", Prioridades de control de enfermedades en los países en desarrollo (2.ª ed.), Banco Mundial, ISBN 978-0-8213-6179-5, PMID 21250344, archivado del original el 7 de agosto de 2020 , consultado el 22 de abril de 2020
- ^ ab Sisterson, DL; Liaw, YP (1990). "Una evaluación de la descarga de rayos y corona en el aire de tormentas eléctricas y la química de la precipitación". Journal of Atmospheric Chemistry . 10 (1): 83–96. Bibcode :1990JAtC...10...83S. doi :10.1007/BF01980039. S2CID 97714446.
- ^ "IUPAC GoldBook: Lluvia ácida". doi :10.1351/goldbook.A00083.
- ^ ab Likens, Gene E.; Keene, William C.; Miller, John M.; Galloway, James N. (20 de noviembre de 1987). "Química de la precipitación de un sitio remoto y terrestre en Australia". Revista de investigación geofísica: Atmósferas . 92 (D11): 13299–13314. Código Bibliográfico :1987JGR....9213299L. doi :10.1029/JD092iD11p13299.
- ^ ab Glosario, Estados Unidos: NASA Earth Observatory , lluvia ácida, archivado desde el original el 13 de diciembre de 2011 , consultado el 15 de febrero de 2013
- ^ ab ES de Beer, ed. El diario de John Evelyn , III, 1955 (19 de septiembre de 1667) pág. 495.
- ^ Weathers, KC y Likens, GE (2006). "Lluvia ácida", págs. 1549-1561 en: WN Rom y S. Markowitz (eds.). Medicina ambiental y ocupacional. Lippincott-Raven Publ., Filadelfia. Cuarta edición, ISBN 0-7817-6299-5 .
- ^ de Seinfeld, John H.; Pandis, Spyros N (1998). Química y física atmosférica: de la contaminación del aire al cambio climático. John Wiley and Sons, Inc. ISBN 978-0-471-17816-3
- ^ Lluvia ácida en Nueva Inglaterra: una breve historia Archivado el 25 de septiembre de 2010 en Wayback Machine . Epa.gov. Recuperado el 9 de febrero de 2013.
- ^ Likens, Gene E.; Bormann, F. Herbert; Johnson, Noye M. (marzo de 1972). "Lluvia ácida". Medio ambiente: ciencia y política para el desarrollo sostenible . 14 (2): 33–40. Código Bibliográfico :1972ESPSD..14b..33L. doi :10.1080/00139157.1972.9933001.
- ^ Brogger, Waldemar Christofer (1881). "Nota sobre una nevada contaminada bajo el título Mindre meddelelser (Comunicaciones breves)". Naturaleza . 5 : 47.
- ^ Ottar, Brynjulf (1976). Dochinger, Leon; Seliga, Thomas (eds.). "Organización del transporte a larga distancia de la vigilancia de la contaminación del aire en Europa". Contaminación del agua, el aire y el suelo . 6 (2–4). Upper Darby, PA: USDA Forest Service: 105. Bibcode :1976WASP....6..219O. doi :10.1007/BF00182866. S2CID 97680751.
Grandes cantidades de ácido sulfúrico pueden transportarse a distancias de hasta unos pocos miles de kilómetros.
- ^ Odén, Svante (1968). "La acidificación del aire y la precipitación y sus consecuencias para el medio ambiente natural". Comité de Ecología, Bul. 1. Consejo de Ciencias Naturales de Suecia . Consultado el 5 de diciembre de 2021 .
- ^ Satake, Kenichi, ed. (6 de diciembre de 2012). Acid Rain 2000, Actas de la 6.ª Conferencia internacional sobre deposición ácida: una mirada al pasado y una reflexión sobre el futuro, Tsukuba, Japón, 10-16 de diciembre de 2000. Países Bajos: Springer. pág. 20. ISBN 9789400708105. Recuperado el 5 de diciembre de 2021.
Se podría decir que la amplia atención científica a la deposición ácida comenzó en 1968, cuando Svante Odén publicó su artículo histórico sobre la acidificación (Oden, 1968).
- ^ Hannigan, John A. (1995). Sociología ambiental: una perspectiva constructivista social. Routledge. pág. 130. ISBN 9780415112543. Recuperado el 5 de diciembre de 2021 .
El trabajo de Svante Odén, un edafólogo sueco, tuvo un impacto más inmediato. Odén, considerado hoy en día como el "padre de los estudios sobre la lluvia ácida" (Park, 1987:6), no solo descubrió que los niveles de acidez de las precipitaciones estaban aumentando en Escandinavia, sino que también fue el primero en vincular definitivamente las áreas de origen y receptoras.
- ^ "Art Under Wraps Archivado el 17 de agosto de 2014 en Wayback Machine ", Harvard Magazine, marzo-abril de 2000
- ^ Likens, GE; Bormann, FH (1974). "Lluvia ácida: un serio problema ambiental regional". Science . 184 (4142): 1176–9. Bibcode :1974Sci...184.1176L. doi :10.1126/science.184.4142.1176. PMID 17756304. S2CID 24124373.
- ^ Keller, CK; White, TM; O'Brien, R.; Smith, JL (2006). "Dinámica y flujos de CO2 del suelo afectados por la cosecha de árboles en un ecosistema experimental de arena". Journal of Geophysical Research . 111 (G3): G03011. Bibcode :2006JGRG..111.3011K. doi : 10.1029/2005JG000157 .
- ^ Likens, Gene E.; Bormann, F. Herbert; Johnson, Noye M. (1972). "Lluvia ácida". Medio ambiente: ciencia y política para el desarrollo sostenible . 14 (2): 33–40. Código Bibliográfico :1972ESPSD..14b..33L. doi :10.1080/00139157.1972.9933001.
- ^ Johnson, Noye M.; Driscoll, Charles T.; Eaton, John S.; Likens, Gene E.; McDowell, William H. (1 de septiembre de 1981). "'Lluvia ácida', aluminio disuelto y meteorización química en el bosque experimental Hubbard Brook, New Hampshire". Geochimica et Cosmochimica Acta . 45 (9): 1421–1437. Bibcode :1981GeCoA..45.1421J. doi :10.1016/0016-7037(81)90276-3.
- ^ Hall, Ronald J.; Likens, Gene E.; Fiance, Sandy B.; Hendrey, George R. (agosto de 1980). "Acidificación experimental de un arroyo en el bosque experimental Hubbard Brook, New Hampshire". Ecología . 61 (4): 976–989. Bibcode :1980Ecol...61..976H. doi :10.2307/1936765. JSTOR 1936765.
- ^ ab Lackey, RT (1997). "Ciencia, política y lluvia ácida: lecciones aprendidas" (PDF) . Renewable Resources Journal . 15 (1): 9–13. Archivado (PDF) desde el original el 6 de mayo de 2013. Consultado el 15 de diciembre de 2011 .
- ^ Winstanley, Derek; Lackey, Robert T.; Warnick, Walter L.; Malanchuk, John (1998). "Lluvia ácida: ciencia y formulación de políticas". Environmental Science & Policy . 1 (1): 51. Bibcode :1998ESPol...1...51W. doi :10.1016/S1462-9011(98)00006-9.
- ^ Reinhold, Robert (8 de junio de 1982). «El problema de la lluvia ácida genera tensión entre la administración y la academia científica». The New York Times . Archivado desde el original el 16 de noviembre de 2016. Consultado el 16 de noviembre de 2016 .
- ^ "Ronald Reagan sobre el medio ambiente". ontheissues.org . Archivado desde el original el 25 de noviembre de 2016 . Consultado el 16 de noviembre de 2016 .
- ^ "HISTERIA SOBRE LA LLUVIA ÁCIDA Incluso Ronald Reagan la considera ahora la villana. Está pasando por alto muchas pruebas científicas. – 14 de abril de 1986". archive.fortune.com . Archivado desde el original el 16 de noviembre de 2016 . Consultado el 16 de noviembre de 2016 .
- ^ "Ronald Reagan: Nominación de William A. Nierenberg para ser miembro del Consejo Nacional de Ciencias". presidency.ucsb.edu . Archivado desde el original el 16 de noviembre de 2016 . Consultado el 16 de noviembre de 2016 .
- ^ "Informe del grupo de expertos en evaluación de la lluvia ácida". Visualización de documentos | NEPIS | US EPA . Julio de 1984. Archivado desde el original el 16 de noviembre de 2016 . Consultado el 16 de noviembre de 2016 .
- ^ Davidson, Osha Gray (17 de abril de 2010). «Desde el tabaco hasta el cambio climático, los 'mercaderes de la duda' socavaron la ciencia». Grist . Archivado desde el original el 16 de noviembre de 2016. Consultado el 16 de noviembre de 2016 .
- ^ Franklin, Ben A. (18 de agosto de 1984). "Legisladores en la Casa Blanca suprimieron informe sobre lluvia ácida". The New York Times . Archivado desde el original el 16 de noviembre de 2016. Consultado el 16 de noviembre de 2016 .
- ^ Programa Nacional de Evaluación de Precipitaciones Ácidas de los Estados Unidos: Informe de evaluación integrado de 1990. Washington, DC: Programa Nacional de Evaluación de Precipitaciones Ácidas, Oficina del Director, [1991]
- ^ "Ley de Aire Limpio Título IV – Subcapítulo A: Control de la Deposición Ácida | Descripción general de la Ley de Aire Limpio y la Contaminación del Aire | EPA de EE. UU.". Epa.gov. 3 de junio de 2015. Archivado desde el original el 26 de diciembre de 2017. Consultado el 20 de marzo de 2018 .
- ^ de John Bachmann, David Calkins, Margo Oge. "Limpiar el aire que respiramos: medio siglo de progreso". Archivado el 6 de julio de 2018 en Wayback Machine . Asociación de Antiguos Alumnos de la EPA. Septiembre de 2017. Páginas 26-27.
- ^ Schmalensee, Richard; Stavins, Robert N. (2019). "Evolución de las políticas en el marco de la Ley de Aire Limpio". Revista de Perspectivas Económicas . 33 (4): 27–50. doi : 10.1257/jep.33.4.27 . JSTOR 26796835. S2CID 211372557.
- ^ "US EPA: A Brief History of Acid Rain" (EPA de EE. UU.: Breve historia de la lluvia ácida). Agencia de Protección Ambiental de Estados Unidos. 2002. Archivado desde el original el 25 de septiembre de 2010. Consultado el 18 de noviembre de 2010 .
- ^ ab Modelo 'cap-and-trade' en la mira para reducir gases de efecto invernadero Archivado el 16 de marzo de 2012 en Wayback Machine , San Francisco Chronicle , 3 de diciembre de 2007.
- ^ Gilberston, T. y Reyes, O. 2009. Comercio de carbono: cómo funciona y por qué fracasa Archivado el 6 de enero de 2010 en Wayback Machine . Fundación Dag Hammarskjöld : 22
- ^ Informe de progreso del Programa de Lluvia Ácida 2007 Archivado el 1 de mayo de 2011 en Wayback Machine , Agencia de Protección Ambiental de los Estados Unidos , enero de 2009.
- ^ Gerdes, Justin. "El sistema de límites máximos y comercio de emisiones frenó la lluvia ácida: 7 razones por las que puede hacer lo mismo con el cambio climático". Forbes . Consultado el 27 de octubre de 2014 .
- ^ ab Muki Haklay (2015). «Ciencia ciudadana y política: una perspectiva europea» (PDF) . Woodrow Wilson International Center for Scholars. pág. 11. Archivado desde el original (PDF) el 18 de octubre de 2016. Consultado el 3 de junio de 2016 .
- ^ ab R. Kerson (1989). "Laboratorio para el medio ambiente". MIT Technology Review . Vol. 92, núm. 1. págs. 11-12.
- ^ Albin, Tom; Paulsen, Steve (1985). "5: Intereses ambientales y económicos en Canadá y Estados Unidos". En Schmandt, Jurgen; Roderick, Hilliard (eds.). Lluvia ácida y vecinos amistosos: la disputa política entre Canadá y Estados Unidos. Duke University Press. pág. 129. ISBN 9780822308706. Recuperado el 5 de diciembre de 2021 .
- ^ ab «Área de lagos experimentales del IISD: el laboratorio de agua dulce viviente del mundo». Revista BioLab Business . 12 de febrero de 2020. Archivado desde el original el 7 de julio de 2020. Consultado el 6 de julio de 2020 .
- ^ ab Luoma, Jon R. (13 de septiembre de 1988). «Un audaz experimento en los lagos rastrea el incesante costo de la lluvia ácida». The New York Times . Archivado desde el original el 7 de julio de 2020. Consultado el 6 de julio de 2020 .
- ^ "Un científico canadiense explica cómo la lluvia ácida sigue dejando su huella". Área de lagos experimentales del IISD . 16 de mayo de 2018. Archivado desde el original el 6 de julio de 2020. Consultado el 6 de julio de 2020 .
- ^ abc Canada, Environment and Climate Change (3 de junio de 2004). «Historia de la lluvia ácida». aem . Archivado desde el original el 7 de julio de 2020 . Consultado el 6 de julio de 2020 .
- ^ Staff, DTE (5 de enero de 2012). "La lluvia ácida llegará pronto a la India". Down To Earth . Consultado el 16 de agosto de 2024 .
- ^ Berresheim, H.; Wine, PH y Davies DD (1995). "Azufre en la atmósfera". En Composición, química y clima de la atmósfera , ed. HB Singh. Van Nostrand Rheingold ISBN 0-442-01264-0
- ^ Poore, J.; Nemecek, T. (junio de 2018). "Reducción de los impactos ambientales de los alimentos a través de productores y consumidores". Science . 360 (6392): 987–992. Bibcode :2018Sci...360..987P. doi : 10.1126/science.aaq0216 . PMID 29853680.
- ^ Floor, GH; Calabrese, S.; Román-Ross, G.; D´Alessandro, W.; Aiuppa, A. (octubre de 2011). "Movilización de selenio en suelos debido a la lluvia ácida de origen volcánico: un ejemplo del volcán Etna, Sicilia". Chemical Geology . 289 (3–4): 235–244. Bibcode :2011ChGeo.289..235F. doi :10.1016/j.chemgeo.2011.08.004. hdl : 10447/66526 . S2CID 140741081.
- ^ "Lluvia ácida: causas, efectos y soluciones". Live Science . 14 de julio de 2018. Archivado desde el original el 23 de agosto de 2019. Consultado el 23 de agosto de 2019 .
- ^ ab Likens, GE; Wright, RF; Galloway, JN; Butler, TJ (1979). "Lluvia ácida". Scientific American . 241 (4): 43–51. Código Bibliográfico :1979SciAm.241d..43L. doi :10.1038/scientificamerican1079-43.
- ^ US EPA, OAR (9 de febrero de 2016). "¿Qué es la lluvia ácida?". epa.gov . Consultado el 7 de abril de 2024 .
- ^ Vallie, Sarah (11 de noviembre de 2022). "Lo que hay que saber sobre los efectos de la lluvia ácida en la salud". WebMD . Consultado el 25 de octubre de 2023 .
- ^ Galloway, JN; Dianwu, Z; Jiling, X; Likens, GE (1987). "Lluvia ácida: China, Estados Unidos y una zona remota". Science . 236 (4808): 1559–62. Bibcode :1987Sci...236.1559G. doi :10.1126/science.236.4808.1559. PMID 17835740. S2CID 39308177.
- ^ Chandru (9 de septiembre de 2006). «CHINA: La industrialización contamina su zona rural con lluvia ácida». Southasiaanalysis.org. Archivado desde el original el 20 de junio de 2010. Consultado el 18 de noviembre de 2010 .
{{cite web}}: CS1 maint: unfit URL (link) - ^ Lefohn, AS; Husar, JD; Husar, RB (1999), Base de datos global de emisiones de azufre, Estados Unidos: ASL & Associates, archivado desde el original el 6 de junio de 2013 , consultado el 16 de febrero de 2013
- ^ Likens, GE (1984). "Lluvia ácida: la chimenea es la "pistola humeante"". Jardín . 8 (4): 12–18.
- ^ Rosborg, Ingegerd (agosto de 2020). "Estudio científico sobre la lluvia ácida y los consiguientes desequilibrios del pH en humanos, estudios de casos, tratamientos". Revista Europea de Nutrición Clínica . 74 (S1): 87–94. doi :10.1038/s41430-020-0690-8. PMID 32873963. S2CID 221381536. ProQuest 2439185222.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 599. ISBN 978-0-08-037941-8.
- ^ "Archivo Nacional de Calidad del Aire del Reino Unido: Glosario de contaminación del aire". Airquality.co.uk. 1 de abril de 2002. Archivado desde el original el 17 de abril de 2009. Consultado el 18 de noviembre de 2010 .
- ^ Lovett GM, Tear TH, Evers DC, Findlay SE, Cosby BJ, Dunscomb JK, et al. (abril de 2009). "Efectos de la contaminación del aire en los ecosistemas y la diversidad biológica en el este de los Estados Unidos". Anales de la Academia de Ciencias de Nueva York . 1162 (1): 99–135. Bibcode :2009NYASA1162...99L. doi :10.1111/j.1749-6632.2009.04153.x. PMID 19432647. S2CID 9368346.
- ^ ab "Efectos de la lluvia ácida: aguas superficiales y animales acuáticos". EPA de EE. UU . Archivado desde el original el 14 de mayo de 2009.
- ^ Kesler, Stephen (2015). Recursos minerales, economía y medio ambiente . Universidad de Cambridge. ISBN 9781107074910.
- ^ Rodhe, Henning; Dentener, Frank; Schulz, Michael (octubre de 2002). "La distribución global de la deposición húmeda acidificante". Environmental Science & Technology . 36 (20): 4382–4388. Bibcode :2002EnST...36.4382R. doi :10.1021/es020057g. PMID 12387412.
- ^ Likens, GE; Driscoll, CT; Buso, DC (12 de abril de 1996). "Efectos a largo plazo de la lluvia ácida: respuesta y recuperación de un ecosistema forestal". Science . 272 (5259): 244–246. Bibcode :1996Sci...272..244L. doi :10.1126/science.272.5259.244. S2CID 178546205.
- ^ Larssen, T.; Carmichael, GR (octubre de 2000). "Lluvia ácida y acidificación en China: la importancia de la deposición de cationes básicos". Contaminación ambiental . 110 (1): 89–102. doi :10.1016/S0269-7491(99)00279-1. PMID 15092859.
- ^ Evans, Lance S.; Gmur, Nicholas F.; Costa, Filomena Da (agosto de 1977). "Superficie foliar y perturbaciones histológicas de las hojas de Phaseolus vulgaris y Helianthus annuus después de la exposición a lluvia ácida simulada". American Journal of Botany . 64 (7): 903–913. doi :10.1002/j.1537-2197.1977.tb11934.x.
- ^ ab Prakash, Jigyasa; Agrawal, Shashi Bhushan; Agrawal, Madhoolika (marzo de 2023). "Tendencias globales de la acidez en las precipitaciones y su impacto en las plantas y el suelo". Revista de ciencia del suelo y nutrición vegetal . 23 (1): 398–419. Bibcode :2023JSSPN..23..398P. doi :10.1007/s42729-022-01051-z. ISSN 0718-9508. PMC 9672585 . PMID 36415481.
- ^ Jacoby, Richard; Peukert, Manuela; Succurro, Antonella; Koprivova, Anna; Kopriva, Stanislav (19 de septiembre de 2017). "El papel de los microorganismos del suelo en la nutrición mineral de las plantas: conocimiento actual y direcciones futuras". Frontiers in Plant Science . 8 : 1617. doi : 10.3389/fpls.2017.01617 . ISSN 1664-462X. PMC 5610682 . PMID 28974956.
- ^ Naz, Misbah; Dai, Zhicong; Hussain, Sajid; Tariq, Muhammad; Danish, Subhan; Khan, Irfan Ullah; Qi, Shanshan; Du, Daolin (noviembre de 2022). "El pH del suelo y los metales pesados revelaron su impacto en la comunidad microbiana del suelo". Journal of Environmental Management . 321 : 115770. Bibcode :2022JEnvM.32115770N. doi :10.1016/j.jenvman.2022.115770. PMID 36104873.
- ^ Du, Yan-Jun; Wei, Ming-Li; Reddy, Krishna R.; Liu, Zhao-Peng; Jin, Fei (abril de 2014). "Efecto del pH de la lluvia ácida en el comportamiento de lixiviación del suelo contaminado con plomo estabilizado con cemento". Journal of Hazardous Materials . 271 : 131–140. Bibcode :2014JHzM..271..131D. doi :10.1016/j.jhazmat.2014.02.002. PMID 24637445.
- ^ Sun, Jingwen; Hu, Huiqing; Li, Yueli; Wang, Lihong; Zhou, Qing; Huang, Xiaohua (septiembre de 2016). "Efectos y mecanismo de la lluvia ácida en la ATP sintasa del cloroplasto de las plantas". Environmental Science and Pollution Research . 23 (18): 18296–18306. Bibcode :2016ESPR...2318296S. doi : 10.1007/s11356-016-7016-3 . PMID 27278067. S2CID 22862843.
- ^ Stoyanova, D.; Velikova, V. (diciembre de 1997). "Efectos de la lluvia ácida simulada en la ultraestructura de los cloroplastos de las hojas primarias de Phaseolus vulgaris". Biologia Plantarum . 39 (4): 589–595. doi : 10.1023/A:1001761421851 . S2CID 20728684.
- ^ Johnson, Dale W.; Turner, John; Kelly, JM (junio de 1982). "Los efectos de la lluvia ácida en el estado de los nutrientes de los bosques". Water Resources Research . 18 (3): 449–461. Bibcode :1982WRR....18..449J. doi :10.1029/WR018i003p00449.
- ^ Zhang, Yuxuan; Yang, Feng; Wang, Yunqi; Zheng, Yonglin; Zhu, Junlin (22 de mayo de 2023). "Efectos del estrés por lluvia ácida en las características fisiológicas y bioquímicas de tres especies de plantas". Bosques . 14 (5): 1067. doi : 10.3390/f14051067 . ISSN 1999-4907.
- ^ ab Zhang, Yan; Li, Jiahong; Tan, Junyan; Li, Wenbin; Singh, Bhupinder Pal; Yang, Xunan; Bolan, Nanthi; Chen, Xin; Xu, Song; Bao, Yanping; Lv, Daofei; Peng, Anan; Zhou, Yanbo; Wang, Hailong (mayo de 2023). "Una descripción general de los efectos directos e indirectos de la lluvia ácida en las plantas: relaciones entre la lluvia ácida, el suelo, los microorganismos y las plantas". Science of the Total Environment . 873 : 162388. doi :10.1016/j.scitotenv.2023.162388. ISSN 0048-9697. PMID 36842576.
- ^ ab Rodríguez-Sánchez, Verónica M.; Rosas, Ulises; Calva-Vásquez, Germán; Sandoval-Zapotitla, Estela (8 de julio de 2020). "¿La lluvia ácida altera la anatomía de las hojas y los pigmentos fotosintéticos de los árboles urbanos?". Plantas . 9 (7): 862. doi : 10.3390/plantas9070862 . ISSN 2223-7747. PMC 7411892 . PMID 32650420.
- ^ US EPA, OAR (16 de marzo de 2016). "Efectos de la lluvia ácida". epa.gov . Consultado el 12 de abril de 2024 .
- ^ DeHayes, DH, Schaberg, PG y GR Strimbeck. (2001). Resistencia a las heladas y resistencia a las lesiones por congelación de la picea roja. En: F. Bigras, ed. Resistencia al frío de las coníferas. Kluwer Academic Publishers, Países Bajos ISBN 0-7923-6636-0 .
- ^ Lazarus, Brynne E; Schaberg, Paul G; Hawley, Gary J; DeHayes, Donald H (2006). "Patrones espaciales a escala del paisaje de los daños invernales al follaje de la picea roja en un año de graves daños en toda la región". Revista canadiense de investigación forestal . 36 (1): 142–152. doi :10.1139/x05-236.
- ^ Evans, LS (septiembre de 1984). "Efectos de la precipitación ácida en la vegetación terrestre". Revista anual de fitopatología . 22 (1): 397–420. doi :10.1146/annurev.py.22.090184.002145. ISSN 0066-4286.
- ^ Zhong, Jiawen; Liu, Yeqing; Chen, Xinheng; Ye, Zihao; Li, Yongtao; Li, Wenyan (enero de 2024). "El impacto de la lluvia ácida en la fitorremediación de cadmio en girasol (Helianthus annuus L.)". Contaminación ambiental . 340 (Pt 2): 122778. Bibcode :2024EPoll.34022778Z. doi :10.1016/j.envpol.2023.122778. ISSN 0269-7491. PMID 37863250.
- ^ ab "La lluvia ácida tiene un impacto desproporcionado en las aguas costeras". ScienceDaily (nota de prensa). Instituto Oceanográfico Woods Hole. 15 de septiembre de 2007. Archivado desde el original el 26 de junio de 2020.
- ^ "La lluvia ácida tiene un impacto desproporcionado en las aguas oceánicas cercanas a la costa – Ventanas al Universo". windows2universe.org . Archivado desde el original el 28 de febrero de 2017 . Consultado el 27 de febrero de 2017 .
- ^ abcdefg «Trióxido de azufre y ácido sulfúrico | Declaración de salud pública | ATSDR». wwwn.cdc.gov . Consultado el 2 de abril de 2024 .
- ^ ab "Óxidos de nitrógeno | ToxFAQs™ | ATSDR". wwwn.cdc.gov . Consultado el 2 de abril de 2024 .
- ^ Reisener, A.; Stäckle, B.; Snethlage, R. (1995). "ICP sobre efectos en materiales". Contaminación del agua, el aire y el suelo . 85 (4): 2701–2706. Bibcode :1995WASP...85.2701R. doi :10.1007/BF01186242. S2CID 94721996.
- ^ "Enfoques para modelar el impacto de la degradación de materiales inducida por la contaminación del aire" (PDF) . Archivado desde el original (PDF) el 16 de julio de 2011 . Consultado el 18 de noviembre de 2010 .
- ^ Ed. Hatier (1993). "Lluvia ácida en Europa". Programa de las Naciones Unidas para el Medio Ambiente GRID Arendal. Archivado desde el original el 22 de agosto de 2009. Consultado el 31 de enero de 2010 .
- ^ Agencia de Protección Ambiental de Estados Unidos (2008). "Clean Air Markets 2008 Highlights" (Aspectos destacados de los mercados de aire limpio en 2008) . Consultado el 31 de enero de 2010 .
- ^ "Lluvia ácida – Fundación para la Educación Verde | GEF | Educación para la sostenibilidad". greeneducationfoundation.org . Archivado desde el original el 21 de octubre de 2017 . Consultado el 2 de noviembre de 2017 .
- ^ "La Convención y sus logros | CEPE". unece.org . Consultado el 22 de octubre de 2021 .
- ^ Moses, Elizabeth; Cardenas, Beatriz; Seddon, Jessica (25 de febrero de 2020). "El tratado sobre contaminación del aire más exitoso del que nunca ha oído hablar".
- ^ "Acuerdos internacionales sobre lluvia ácida". enviropedia.org.uk . Archivado desde el original el 22 de octubre de 2021 . Consultado el 22 de octubre de 2021 .
- ^ "Comienzan las conversaciones para formar una red que monitoree la lluvia ácida en Asia". The Japan Times . 26 de octubre de 2000 . Consultado el 22 de octubre de 2021 .
- ^ Totsuka, Tsumugu; Sase, Hiroyuki; Shimizu, Hideyuki (2005). "Principales actividades de la red de monitoreo de la deposición ácida en Asia Oriental (EANET) y estudios relacionados". Respuestas de las plantas a la contaminación del aire y el cambio global : 251–259. doi :10.1007/4-431-31014-2_28. ISBN 978-4-431-31013-6.
- ^ "Puntos focales nacionales de EANET" https://www.eanet.asia/about/national-focal-points/ recuperado el 16 de febrero de 2023.
- ^ El ex administrador adjunto Hank Habicht habla sobre la gestión en la EPA. Entrevista con Hank Habicht Video, transcripción archivada el 12 de abril de 2019 en Wayback Machine (ver pág. 6). 21 de diciembre de 2012.
- ^ Enmiendas a la Ley de Aire Limpio de 1990, 42 US Code 7651 Archivado el 28 de marzo de 2021 en Wayback Machine .
Lectura adicional
- Ritchie, Hannah , "What We Learned from Acid Rain: By working together, the nation of the world can solve climate change ", Scientific American , vol. 330, no. 1 (enero de 2024), pp. 75–76. "Los países actuarán solo si saben que otros están dispuestos a hacer lo mismo. Con la lluvia ácida, actuaron colectivamente... Hicimos algo similar para restaurar la capa protectora de ozono de la Tierra ... [E]l costo de la tecnología realmente importa... En la última década, el precio de la energía solar ha caído más del 90 por ciento y el de la energía eólica más del 70 por ciento. Los costos de las baterías han caído un 98 por ciento desde 1990, arrastrando consigo el precio de los autos eléctricos ... [L]a postura de los funcionarios electos importa más que su afiliación partidaria ... El cambio puede ocurrir, pero no por sí solo. Necesitamos impulsarlo". (p. 76.)
Enlaces externos
- Informe del Programa Nacional de Evaluación de Precipitaciones Ácidas: informe de 98 páginas al Congreso (2005)
- Lluvia ácida para las escuelas
- Lluvia ácida para las escuelas – Hubbard Brook
- Agencia de Protección Ambiental de los Estados Unidos – Programa de Lluvia Ácida de Nueva Inglaterra (superficial)
- Lluvia ácida (más profundidad que la referencia anterior)
- Servicio Geológico de Estados Unidos: ¿Qué es la lluvia ácida?
- Lluvia ácida: una tragedia nacional continua: informe del Consejo de Adirondack sobre la lluvia ácida en la región de Adirondack (1998)
- ¿Qué pasa con la lluvia ácida?
- La lluvia ácida y cómo afecta a los peces y otros organismos acuáticos
- Cuarto informe para responsables de políticas (RPM4): Hacia un aire limpio para un futuro sostenible en Asia Oriental a través de actividades de colaboración: un informe para responsables de políticas, Red de monitoreo de la deposición ácida en Asia Oriental, EANET, (2019).



