Tropismo de células endoteliales
El tropismo de células endoteliales o endoteliotropismo es un tipo de tropismo tisular o tropismo del huésped que caracteriza la capacidad de un patógeno para reconocer e infectar una célula endotelial. Los patógenos, como los virus, pueden dirigirse a un tipo de tejido específico o a múltiples tipos de tejidos. Al igual que otras células, la célula endotelial posee varias características que respaldan una infección viral productiva en una célula, incluidos los receptores de superficie celular , las respuestas inmunitarias y otros factores de virulencia . [1] Las células endoteliales se encuentran en varios tipos de tejidos, como en los capilares , las venas y las arterias del cuerpo humano. Como las células endoteliales recubren estos vasos sanguíneos y redes críticas que extienden el acceso a varios sistemas de órganos humanos, la entrada del virus en estas células puede ser perjudicial para la propagación del virus en el sistema huésped y afectar el curso clínico de la enfermedad. Comprender los mecanismos de cómo los virus se adhieren, ingresan y controlan las funciones endoteliales y las respuestas del huésped informa la comprensión de las enfermedades infecciosas y las contramedidas médicas .
Características y mecanismos celulares
Hay una multitud de características de las células endoteliales que influyen en el tropismo celular y, en última instancia, contribuyen a la activación y disfunción de las células endoteliales, así como a la continuación del ciclo de vida del virus .
Receptores de superficie celular

Los patógenos virales aprovechan los receptores de la superficie celular, que son ubicuos y pueden reconocer muchos ligandos diversos para unirse y, en última instancia, ingresar a la célula. Estos ligandos no solo consisten en proteínas endógenas, sino también en productos bacterianos y virales. Una vez que el virus se ancla a la superficie celular, la captación del virus generalmente ocurre utilizando mecanismos del huésped, como la endocitosis . [2] [3] Un método de captación viral es a través de la endocitosis mediada por clatrina (CME). [4] Los receptores de la superficie celular proporcionan un bolsillo de unión para la unión y la entrada a la célula y, por lo tanto, afectan la susceptibilidad de una célula a la infección. Además, la densidad de receptores en la superficie de la célula endotelial también afecta la eficiencia con la que el virus ingresa a la célula huésped. Por ejemplo, una menor densidad de receptores de la superficie celular puede hacer que una célula endotelial sea menos susceptible a la infección por virus que una endotelial con una mayor densidad de receptores de la superficie celular. El endotelio contiene una gran cantidad de receptores de superficie celular asociados con funciones como la adherencia y el tráfico de células inmunes, la coagulación sanguínea , la vasodilatación y la permeabilidad de la barrera. [5] Dadas estas funciones vitales, las interacciones del virus con estos receptores ofrecen información sobre los síntomas que se presentan durante la patogénesis viral , como la inflamación , el aumento de la permeabilidad vascular y la trombosis .

Factores de transcripción y replicación viral
Después de entrar en la célula, estos parásitos intracelulares requieren factores en la célula huésped para apoyar la replicación viral y la liberación de viriones progenie. Específicamente, los factores del huésped incluyen proteínas , como factores de transcripción y polimerasas , que ayudan a replicar el genoma viral. [7] Por lo tanto, la sola entrada en un huésped vivo no necesariamente resulta en la propagación de la progenie viral ya que la célula puede no contener los factores de transcripción o polimerasas críticos para la replicación del virus. Además, dentro del genoma viral, no solo hay instrucciones para sintetizar proteínas virales sino también otros factores de virulencia como genes , estructuras celulares y otros procesos reguladores que permiten a un patógeno controlar las respuestas antivirales del huésped. [8] Estos factores de virulencia pueden contrarrestar los mecanismos de defensa del huésped que intentan eliminar la infección a través del sistema inmunológico del huésped .
Mecanismos de defensa del huésped
Las células endoteliales también poseen respuestas antivirales intrínsecas que aprovechan el sistema inmunológico del huésped para combatir la infección o restringir la replicación viral. [9] [10] En respuesta a la producción de virus en la célula, la célula huésped puede liberar una proteína como el interferón (IFN) similar a una citocina que indicará una respuesta inmunológica. El IFN "interfiere" con la replicación del virus al enviar señales a otras células de nuestro sistema inmunológico para detener la infección. Otros mecanismos celulares también se encuentran en los diferentes niveles subcelulares. Específicamente, existen receptores de reconocimiento de patrones celulares como TLR7 y TLR8 (que detectan ARN) y TLR9 (que detecta ADN). [11] Estos receptores tipo Toll pueden distinguir si hay ácidos nucleicos virales en la célula huésped y, de la misma manera, desencadenarán una respuesta inmunológica para marcar la célula e intentar eliminar el patógeno. La combinación de estos mecanismos que respaldan la entrada exitosa del virus, la replicación del virus y el bloqueo de la respuesta inmunológica del huésped contribuyen a una infección y replicación viral productivas.
Ejemplos y efectos sobre la patogénesis viral
Coronavirus

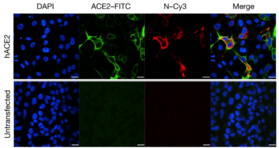
El SARS-CoV-2 es el virus que causa la enfermedad COVID-19 e infecta diferentes tipos de células, pero también ha mostrado afectación vascular multiorgánica. En casos graves, el SARS-CoV-2 puede causar disfunción o lesión endotelial . Estas respuestas endoteliales inducidas por el virus pueden provocar trombosis, congestión y microangiopatía . [12] Los receptores de la superficie celular asociados con la entrada viral incluyen ACE2 y el correceptor TMPRSS2 . TMPRSS2 es necesario para escindir la proteína de pico para la fusión viral a la membrana celular. Sin embargo, un estudio reciente ha demostrado que la baja expresión de ACE2 en células endoteliales se ha asociado con una capacidad deficiente para la propagación viral debido a la falta de puntos de entrada en la superficie celular. [13]
Flavivirus
El dengue es un ejemplo de flavivirus transmitido por mosquitos que causa la fiebre del dengue . Si bien las células endoteliales no son el tipo celular principal al que se dirige el dengue, el virus se une a varios receptores de la superficie celular en las células endoteliales, con una infección particularmente productiva a través de los receptores de la superficie celular que contienen sulfato de heparán . [14] Se ha indicado que la infección del endotelio a través de estos receptores altera las respuestas inmunitarias críticas y altera la permeabilidad capilar, lo que a su vez favorece el curso clínico de la enfermedad. [15]
Filovirus

El ébola es un virus de fiebre hemorrágica viral que causa la enfermedad del virus del ébola (EVE) . El análisis de muestras humanas de no sobrevivientes de la enfermedad ha demostrado que el endotelio cambia significativamente con respecto al estado saludable. [16] [17] Otras alteraciones de la homeostasis incluyen la expresión generalizada de antígenos virales en células endoteliales. [18] Se ha indicado que la glicoproteína del virus, que sirve como la "llave" del virus en la célula, daña gravemente el endotelio. [16] Por ejemplo, el hígado ha sido altamente implicado como un área de daño tras la infección. Las células endoteliales sinusoidales del hígado (LSEC) expresan una variedad de receptores depuradores , incluidos FcγRIIb2 y el receptor de manosa , que son fundamentales para eliminar moléculas de desecho en el hígado, pero también engullen ligandos a través de la vía CME. [19] Además de apoyar la entrada del virus, las interacciones con estos receptores también pueden obstaculizar la eliminación de los fármacos administrados para mitigar la infección.
Ortomixovirus
La influenza A H1N1 es un subtipo del virus de la gripe que ataca e infecta las células endoteliales del sistema respiratorio, como las del pulmón. El virus también puede atacar el epitelio de las membranas mucosas de estos sistemas orgánicos. [20] Las partículas del virus tienden a salir del lumen del endotelio, lo que lleva a los antígenos virales que se encuentran en la sangre y las células endoteliales linfáticas . Sin embargo, a medida que este virus se propaga, se dirigirá a las células endoteliales del pulmón, pero no a las del cerebro, por ejemplo.
Aplicaciones
Tecnologías de estudio

Dependiendo del nivel de bioseguridad (BSL), también conocido como nivel de protección o patógeno, existen diferentes niveles de biocontención y aprobaciones requeridas para estudiar el patógeno; este nivel de protección afecta cómo y dónde se estudia el patógeno. [21] Si bien estos resúmenes se centran en el tropismo de las células endoteliales, estas técnicas también se aplican ampliamente a varios métodos en virología . Estos resúmenes no proporcionan una lista completa, pero son representativos de plataformas comunes para estudiar enfermedades infecciosas emergentes.
Enfoques in vitro
Las células inmortalizadas ofrecen un recurso renovable para estudiar una variedad de patógenos. La caracterización del tropismo endotelial permite a los investigadores modificar la célula para mostrar el receptor con el que interactúa la glicoproteína del virus para unirse a la célula. Sin embargo, estos cultivos celulares 2D no están necesariamente destinados a imitar la propagación viral o las respuestas del huésped in vivo . Estos formatos de bioensayos permiten la investigación del virus y la posible identificación de los receptores de la superficie celular u otros factores involucrados en el tropismo celular. Comúnmente, los métodos de biología molecular como la inmunofluorescencia o la inmunohistoquímica permiten a los investigadores visualizar dónde está presente el receptor en la célula. Por el contrario, el uso de un virus sustituto o pseudotipado también es un método para comprender el tropismo celular. En resumen, estos enfoques generalmente toman un patógeno diferente y bien caracterizado, como el virus de la estomatitis vesicular (VSV), y lo modifican para que muestre la glicoproteína de otro virus de interés. [22] Como la glicoproteína actúa como la "llave" de entrada a la célula, este método permite estudiar la entrada a la célula independientemente de los demás procesos del ciclo de vida del virus. El crecimiento posterior o el paso en serie de este virus recombinante puede demostrar cómo evoluciona o muta el virus para favorecer la eficacia de la infección.
Modelos in vivo de infección

Los primates no humanos, como los macacos rhesus, sirven como el enfoque de "estándar de oro" para los modelos animales para muchos patógenos BSL4 cuando el fenómeno biológico no se puede estudiar en otras especies. [23] Como muchas enfermedades infecciosas son de naturaleza zoonótica , modelar estas enfermedades en estas especies de macacos que tienen algunas similitudes biológicas con los humanos proporciona una perspectiva para comprender la enfermedad en circunstancias en las que un virus es poco conocido y las opciones de tratamiento son limitadas o inexistentes. Las lecturas de estos modelos se pueden evaluar a través de muestras de tejido o muestras de sangre, por ejemplo. Sin embargo, estos modelos in vivo de infección, como los modelos de roedores y primates no humanos, han presentado preocupaciones éticas y deficiencias, ya que implican el confinamiento de un animal en un laboratorio y la introducción en él de una enfermedad. [24] La aparición de modelos in vivo avanzados que incluyen roedores humanizados o transgénicos proporciona una alternativa a la serie de macacos, pero también plantea preocupaciones si estos modelos recapitulan la fisiología humana o son predictivos de respuestas similares a las humanas a una enfermedad o terapia. Estos modelos implican la modificación genética y/o el trasplante de tejido humano en un modelo de roedor. [25] Junto con los ensayos basados en células in vitro , estos modelos in vivo son fundamentales para validar terapias durante el descubrimiento y desarrollo de fármacos.
Descubrimiento y desarrollo de fármacos
El tropismo de las células endoteliales informa las contramedidas médicas en respuesta a las enfermedades infecciosas emergentes. Estas contramedidas médicas incluyen cómo se desarrollan terapias como compuestos de moléculas pequeñas y vacunas .
Antivirales y otros fármacos de moléculas pequeñas
Los fármacos antivirales son terapias que ayudan al cuerpo humano a eliminar una infección, mitigar los síntomas de la infección y/o disminuir el curso clínico de la enfermedad. La comprensión del tropismo de las células endoteliales se utiliza en el descubrimiento de objetivos de fármacos antivirales. Muchos mecanismos de acción de estas terapias se dirigen primero al ciclo de vida del virus. [26] Estos fármacos vienen en forma de compuestos de moléculas pequeñas u otros bioterapéuticos (p. ej., terapias con anticuerpos monoclonales ). En la detección de fármacos de alto rendimiento basada en células , el tropismo celular es una consideración importante durante la selección del tipo de célula. El tipo de célula en estos ensayos debe mostrar el receptor objetivo para validar de forma representativa el mecanismo de acción propuesto del fármaco y determinar su potencia , seguridad y eficacia in vitro . [27] Además, otros aspectos del tropismo de las células endoteliales se prestan a enfoques terapéuticos. Estos aspectos incluyen los diversos mecanismos de cómo las células endoteliales detectan virus y responden a la infección. Por ejemplo, la barrera endotelial sirve como barrera protectora y mediadora de las respuestas inmunitarias contra cuerpos extraños. Sin embargo, la barrera endotelial está sujeta a daños como resultado de una infección viral. Las terapias que mejoran o recuperan la integridad de la barrera endotelial después de que ha sido dañada se han considerado como objetivos potenciales para enfermedades infecciosas emergentes como COVID-19, ébola, dengue y más. [1] [28] En conjunto, la investigación del tropismo de las células endoteliales puede proporcionar información sobre intervenciones terapéuticas apropiadas.
| Grupo | Droga(s) | Mecanismo de acción | Referencias |
|---|---|---|---|
| Inhibidores de la entrada viral | Maraviroc | Bloquea la participación del receptor, la endocitosis/macropinocitosis, la unión, la fusión o la captación del virus implicada en la señalización. | [26] [29] [30] |
| Inhibidores de la síntesis de proteínas virales | Lopinavir/ritonavir | Suprime o retarda la replicación del virus al interrumpir los procesos involucrados en la traducción o generación de proteínas. | [31] |
| Inhibidores de la polimerasa viral | Molnupiravir | Interfiere con la regulación de la transcripción de proteínas virales durante la replicación viral. | [32] |
| Inmunomoduladores | Nitazoxanida | Interfieren y contrarrestan las vías reguladas por el huésped durante la replicación viral (por ejemplo, las vías de IFN y el mecanismo de detección del ARN viral) | [26] [33] |
Vacunas
Las vacunas son terapias que son medidas preventivas para las enfermedades infecciosas. Estas terapias ofrecen al cuerpo inmunidad adaptativa a un patógeno específico. Fundamentalmente, las vacunas brindan protección a los pacientes al provocar una respuesta inmune para que desarrollen anticuerpos que ayudarán a protegerse contra el patógeno invasor. El desarrollo, la producción y la distribución global de estas vacunas son imperativos para prevenir, controlar y erradicar patógenos pandémicos potenciales. Específicamente, las tecnologías de vacunas basadas en cultivos celulares utilizan líneas celulares que tienen una amplia gama de tropismo viral para adaptar las cepas de virus utilizadas en el desarrollo de vacunas a nuevas células. [34] Esta aplicación del tropismo celular evalúa las diversas vías de entrada viral y los receptores del huésped para lograr este objetivo. Además, los aspectos de activación y disfunción de las células endoteliales se convierten en lecturas importantes durante el desarrollo de vacunas, ya que son parte de los sellos distintivos de muchos cursos clínicos de enfermedades infecciosas. Uno de los candidatos a vacuna más prometedores para el ébola es la vacuna recombinante VSV-EBOV de Merck , Ervebo . La vacuna fue fundamental durante el brote de ébola de finales de 2014/2015 en Guinea . Se demostró que Ervebo era eficaz en primates no humanos y más tarde en Guinea durante el ensayo de eficacia humana autorizado que mostró que Ervebo también era altamente protector en humanos. La vacuna emplea VSV como sustituto para mostrar la glicoproteína del ébola. [35] El VSV no causa enfermedad en humanos, lo que lo convierte en una columna vertebral útil para contener una proteína importante del virus del ébola de Zaire . Cuando se administra la vacuna, el VSV recombinante introduce una glicoproteína funcional del virus del ébola que interactúa con la barrera de células endoteliales y provoca una respuesta inmunitaria rápida sin causar enfermedad en los pacientes. Por lo tanto, el desarrollo y la ampliación de las vacunas implica consideraciones importantes para el tropismo de las células endoteliales.
Referencias
- ^ ab Fosse, Johanna Hol; Haraldsen, Guttorm; Falk, Knut; Edelmann, Reidunn (2021). "Células endoteliales en infecciones virales emergentes". Fronteras en Medicina Cardiovascular . 8 : 95. doi : 10.3389/fcvm.2021.619690 . ISSN 2297-055X. PMC 7943456 . PMID 33718448.
- ^ McMahon, Harvey T.; Boucrot, Emmanuel (agosto de 2011). "Mecanismo molecular y funciones fisiológicas de la endocitosis mediada por clatrina". Nature Reviews Molecular Cell Biology . 12 (8): 517–533. doi :10.1038/nrm3151. ISSN 1471-0080. PMID 21779028. S2CID 15235357.
- ^ Kaksonen, Marko; Roux, Aurélien (mayo de 2018). "Mecanismos de endocitosis mediada por clatrina". Nature Reviews Molecular Cell Biology . 19 (5): 313–326. doi :10.1038/nrm.2017.132. ISSN 1471-0080. PMID 29410531. S2CID 4380108.
- ^ Cossart, Pascale; Helenius, Ari (1 de agosto de 2014). "Endocitosis de virus y bacterias". Cold Spring Harbor Perspectives in Biology . 6 (8): a016972. doi :10.1101/cshperspect.a016972. ISSN 1943-0264. PMC 4107984 . PMID 25085912.
- ^ Yuan, Sarah Y.; Rigor, Robert R. (2010). Mecanismos de señalización en la regulación de la permeabilidad endotelial. Morgan & Claypool Life Sciences.
- ^ Bernard, Isabelle; Limonta, Daniel; Mahal, Lara; Hobman, Tom (26 de diciembre de 2020). "Infección y desregulación del endotelio por SARS-CoV-2: evidencia y advertencias en COVID-19". Viruses . 13 (1): 29. doi : 10.3390/v13010029 . PMC 7823949 . PMID 33375371.
- ^ Fenner, Frank; Bachmann, Peter A.; Gibbs, E. Paul J.; Murphy, Frederick A.; Studdert, Michael J.; White, David O. (1987), Fenner, Frank; Bachmann, Peter A.; Gibbs, E. Paul J.; Murphy, Frederick A. (eds.), "Capítulo 4 – Replicación viral", Virología veterinaria , Academic Press, págs. 55–88, ISBN 978-0122530555
- ^ Baggen, Jim; Vanstreels, Els; Jansen, Sander; Daelemans, Dirk (octubre de 2021). "Factores celulares del huésped para la infección por SARS-CoV-2". Nature Microbiology . 6 (10): 1219–1232. doi : 10.1038/s41564-021-00958-0 . ISSN 2058-5276. PMID 34471255. S2CID 237387636.
- ^ McFadden, Grant; Mohamed, Mohamed R.; Rahman, Masmudur M.; Bartee, Eric (septiembre de 2009). "Determinantes de citocinas del tropismo viral". Nature Reviews Immunology . 9 (9): 645–655. doi :10.1038/nri2623. ISSN 1474-1741. PMC 4373421 . PMID 19696766.
- ^ Majdoul, Saliha; Compton, Alex A. (13 de octubre de 2021). "Lecciones de autodefensa: inhibición de la entrada del virus por inmunidad intrínseca". Nature Reviews Immunology . 22 (6): 339–352. doi :10.1038/s41577-021-00626-8. ISSN 1474-1741. PMC 8511856 . PMID 34646033.
- ^ Pandey, Surya; Kawai, Taro; Akira, Shizuo (1 de enero de 2015). "Detección microbiana mediante receptores tipo Toll y sensores intracelulares de ácidos nucleicos". Cold Spring Harbor Perspectives in Biology . 7 (1): a016246. doi :10.1101/cshperspect.a016246. ISSN 1943-0264. PMC 4292165 . PMID 25301932.
- ^ Jin, Yuefei; Ji, Wangquan; Yang, Haiyan; Chen, Shuaiyin; Zhang, Weiguo; Duan, Guangcai (24 de diciembre de 2020). "Activación y disfunción endotelial en COVID-19: desde los mecanismos básicos hasta los posibles enfoques terapéuticos". Transducción de señales y terapia dirigida . 5 (1): 293. doi :10.1038/s41392-020-00454-7. ISSN 2059-3635. PMC 7758411 . PMID 33361764.
- ^ Schimmel, Lilian; Masticar, Keng Yih; Cepo, Claudia J.; Yordanov, Teodor E.; Essebier, Patricia; Kulasinghe, Arutha; Monkman, James; Miggiolaro, Anna Flavia Ribeiro dos Santos; Cooper, Carolina; Noronha, Lucía de; Schröder, Kate (2021). "Las células endoteliales no se infectan productivamente con el SARS-CoV-2". Inmunología clínica y traslacional . 10 (10): e1350. doi :10.1002/cti2.1350. ISSN 2050-0068. PMC 8542944 . PMID 34721846.
- ^ Neufeldt, Christopher J.; Cortese, Mirko; Acosta, Eliana G.; Bartenschlager, Ralf (marzo de 2018). "Reconexión de redes celulares por miembros de la familia Flaviviridae". Nature Reviews Microbiology . 16 (3): 125–142. doi :10.1038/nrmicro.2017.170. ISSN 1740-1534. PMC 7097628 . PMID 29430005.
- ^ Basu, Atanu; Chaturvedi, Umesh C. (agosto de 2008). "Endotelio vascular: el campo de batalla de los virus del dengue". FEMS Inmunología y Microbiología Médica . 53 (3): 287–299. doi :10.1111/j.1574-695x.2008.00420.x. ISSN 0928-8244. PMC 7110366 . PMID 18522648.
- ^ ab Falasca, L.; Agrati, C.; Petrosillo, N.; Di Caro, A.; Capobianchi, señor; Hipólito, G.; Piacentini, M. (agosto de 2015). "Mecanismos moleculares de la patogénesis del virus del Ébola: centrarse en la muerte celular". Muerte y diferenciación celular . 22 (8): 1250-1259. doi :10.1038/cdd.2015.67. ISSN 1476-5403. PMC 4495366 . PMID 26024394.
- ^ Wahl-Jensen, Victoria M.; Afanasieva, Tatiana A.; Seebach, Jochen; Ströher, Ute; Feldmann, Heinz; Schnittler, Hans-Joachim (agosto de 2005). "Efectos de las glicoproteínas del virus del Ébola sobre la activación de las células endoteliales y la función de barrera". Revista de Virología . 79 (16): 10442–10450. doi :10.1128/JVI.79.16.10442-10450.2005. ISSN 0022-538X. PMC 1182673 . PMID 16051836.
- ^ Jain, Sahil; Khaiboullina, Svetlana F.; Baranwal, Manoj (17 de octubre de 2020). "Perspectiva inmunológica de la infección por el virus del Ébola y diversas medidas de tratamiento adoptadas para combatir la enfermedad". Pathogens (Basilea, Suiza) . 9 (10): E850. doi : 10.3390/pathogens9100850 . ISSN 2076-0817. PMC 7603231. PMID 33080902 .
- ^ Bhandari, Sabin; Larsen, Anett Kristin; McCourt, Peter; Smedsrød, Bård; Sørensen, Karen Kristine (2021). "La función depuradora de las células endoteliales sinusoidales del hígado en la salud y la enfermedad". Frontiers in Physiology . 12 : 1711. doi : 10.3389/fphys.2021.757469 . ISSN 1664-042X. PMC 8542980 . PMID 34707514.
- ^ Breve, Kirsty R.; Veldhuis Kroeze, Edwin JB; Reperante, Leslie A.; Ricardo, Mathilde; Kuiken, Thijs (2014). "Virus de la influenza y células endoteliales: una relación específica de especie". Fronteras en Microbiología . 5 : 653. doi : 10.3389/fmicb.2014.00653 . ISSN 1664-302X. PMC 4251441 . PMID 25520707.
- ^ Bayot, Marlon L.; King, Kevin C. (2021), "Niveles de riesgo biológico", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 30570972 , consultado el 1 de noviembre de 2021
- ^ Joglekar, Alok V.; Sandoval, Salemiz (diciembre de 2017). "Vectores lentivirales pseudotipados: un vector, muchas apariencias". Métodos de terapia génica humana . 28 (6): 291–301. doi :10.1089/hgtb.2017.084. ISSN 1946-6536. PMID 28870117.
- ^ Bennett, Richard S.; Logue, James; Liu, David X.; Reeder, Rebecca J.; Janosko, Krisztina B.; Perry, Donna L.; Cooper, Timothy K.; Byrum, Russell; Ragland, Danny; St. Claire, Marisa; Adams, Ricky (14 de julio de 2020). "Progresión de la enfermedad del virus del Ébola de Kikwit en el modelo animal del mono Rhesus". Viruses . 12 (7): 753. doi : 10.3390/v12070753 . ISSN 1999-4915. PMC 7411891 . PMID 32674252.
- ^ Carvalho, Constança; Gaspar, Augusta; Knight, Andrew; Vicente, Luís (2018-12-29). "Errores éticos y científicos relacionados con la investigación de laboratorio con primates no humanos y posibles soluciones". Animales . 9 (1): 12. doi : 10.3390/ani9010012 . ISSN 2076-2615. PMC 6356609 . PMID 30597951.
- ^ Masemann, Dörthe; Ludwig, Stephan; Boergeling, Yvonne (enero de 2020). "Avances en modelos de ratones transgénicos para estudiar infecciones por virus patógenos humanos". Revista internacional de ciencias moleculares . 21 (23): 9289. doi : 10.3390/ijms21239289 . PMC 7730764 . PMID 33291453.
- ^ abc Kausar, Shamaila; Dijo Khan, Fahad; Ishaq Mujeeb Ur Rehman, Mahoma; Akram, Mahoma; Riaz, Mahoma; Rasool, Ghulam; Hamid Khan, Abdul; Saleem, Iqra; Shamim, Saba; Malik, Arif (1 de enero de 2021). "Una revisión: mecanismo de acción de los fármacos antivirales". Revista Internacional de Inmunopatología y Farmacología . 35 : 20587384211002621. doi : 10.1177/20587384211002621. ISSN 2058-7384. PMC 7975490 . PMID 33726557.
- ^ Szymański, Paweł; Markowicz, Magdalena; Mikiciuk-Olasik, Elżbieta (29 de diciembre de 2011). "Adaptación de la detección de alto rendimiento en el descubrimiento de fármacos: pruebas de detección toxicológica". Revista Internacional de Ciencias Moleculares . 13 (1): 427–452. doi : 10.3390/ijms13010427 . ISSN 1422-0067. PMC 3269696 . PMID 22312262.
- ^ Mackow, Erich R.; Gorbunova, Elena E.; Gavrilovskaya, Irina N. (2015). "Disfunción de células endoteliales en hemorragia y edema viral". Frontiers in Microbiology . 5 : 733. doi : 10.3389/fmicb.2014.00733 . ISSN 1664-302X. PMC 4283606 . PMID 25601858.
- ^ Zhou, Yanchen; Simmons, Graham (octubre de 2012). "Desarrollo de nuevos inhibidores de entrada dirigidos a virus emergentes". Revisión experta de terapia antiinfecciosa . 10 (10): 1129–1138. doi :10.1586/eri.12.104. ISSN 1478-7210. PMC 3587779 . PMID 23199399.
- ^ Markham, Anthony (1 de enero de 2021). "REGN-EB3: primera aprobación". Drugs . 81 (1): 175–178. doi :10.1007/s40265-020-01452-3. ISSN 1179-1950. PMC 7799152 . PMID 33432551.
- ^ Lee, Bohae Rachel; Paing, May Hnin; Sharma-Walia, Neelam (2021). "Prostaglandinas de ciclopentenona: mediadores lipídicos biológicamente activos que se dirigen a la inflamación". Frontiers in Physiology . 12 : 801. doi : 10.3389/fphys.2021.640374 . ISSN 1664-042X. PMC 8320392 . PMID 34335286.
- ^ Singh, Awadhesh Kumar; Singh, Akriti; Singh, Ritu; Misra, Anoop (1 de noviembre de 2021). "Molnupiravir en COVID-19: una revisión sistemática de la literatura". Diabetes y síndrome metabólico: investigación clínica y revisiones . 15 (6): 102329. doi :10.1016/j.dsx.2021.102329. ISSN 1871-4021. PMC 8556684. PMID 34742052 .
- ^ Anunciada, Giuseppe; Sanduzzi Zamparelli, Marco; Santoro, Ciro; Ciampaglia, Roberto; Stornauolo, Mariano; Tenore, Gian Carlo; Sanduzzi, Alessandro; Novellino, Ettore (2020). "¿Pueden los polifenoles tener un papel contra la infección por coronavirus? Una descripción general de la evidencia in vitro". Fronteras en Medicina . 7 : 240. doi : 10.3389/fmed.2020.00240 . ISSN 2296-858X. PMC 7243156 . PMID 32574331.
- ^ Dai, Xiaofeng; Zhang, Xuanhao; Ostrikov, Kostya; Abrahamyan, Levon (3 de marzo de 2020). "Receptores del huésped: la clave para establecer células con un amplio tropismo viral para la producción de vacunas". Critical Reviews in Microbiology . 46 (2): 147–168. doi :10.1080/1040841X.2020.1735992. ISSN 1040-841X. PMC 7113910 . PMID 32202955.
- ^ Chappell, Keith J.; Watterson, Daniel (12 de enero de 2017). "La lucha contra el ébola: ¿una ventana para la reevaluación de las vacunas?". PLOS Pathogens . 13 (1): e1006037. doi : 10.1371/journal.ppat.1006037 . ISSN 1553-7374. PMC 5230751 . PMID 28081225.