Transferencia de electrones
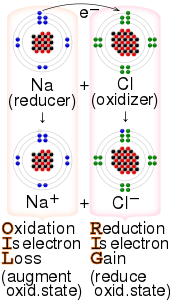
La transferencia de electrones ( ET ) ocurre cuando un electrón se reubica desde un átomo , ion o molécula a otra entidad química similar. La ET describe el mecanismo por el cual los electrones se transfieren en reacciones redox . [2]
Los procesos electroquímicos son reacciones de ET. Las reacciones de ET son relevantes para la fotosíntesis y la respiración y comúnmente involucran complejos de metales de transición . [3] [4] En química orgánica, la ET es un paso en algunas reacciones de polimerización industriales. Es fundamental para la catálisis fotorredox .
Clases de transferencia de electrones
Transferencia de electrones en la esfera interna
En la ET de esfera interna, dos centros redox están unidos covalentemente durante la ET. Este puente puede ser permanente, en cuyo caso el evento de transferencia de electrones se denomina transferencia electrónica intramolecular. Sin embargo, más comúnmente, el enlace covalente es transitorio, formándose justo antes de la ET y luego desconectándose después del evento de ET. En tales casos, la transferencia de electrones se denomina transferencia electrónica intermolecular. Un ejemplo famoso de un proceso de ET de esfera interna que se lleva a cabo a través de un intermedio con puente transitorio es la reducción de [CoCl(NH 3 ) 5 ] 2+ por [Cr(H 2 O) 6 ] 2+ . [5] [6] En este caso, el ligando de cloruro es el ligando puente que conecta covalentemente a los socios redox. [7]
Transferencia de electrones a la esfera exterior
En las reacciones de ET de la esfera exterior, los centros redox participantes no están unidos a través de ningún puente durante el evento de ET. En cambio, el electrón "salta" a través del espacio desde el centro reductor hasta el aceptor. La transferencia de electrones de la esfera exterior puede ocurrir entre especies químicas diferentes o entre especies químicas idénticas que difieren solo en su estado de oxidación. Este último proceso se denomina autointercambio. Como ejemplo, el autointercambio describe la reacción degenerada entre el permanganato y su pariente reducido de un electrón, el manganato :
- [MnO 4 ] − + [Mn*O 4 ] 2− → [MnO 4 ] 2− + [Mn*O 4 ] −
En general, si la transferencia de electrones es más rápida que la sustitución del ligando, la reacción seguirá la ruta de transferencia de electrones de la esfera exterior.
Las reacciones ET de esfera exterior a menudo ocurren cuando uno o ambos reactivos son inertes o si no hay un ligando puente adecuado.
Un concepto clave de la teoría de Marcus [8] es que las velocidades de dichas reacciones de autointercambio están matemáticamente relacionadas con las velocidades de las "reacciones cruzadas". Las reacciones cruzadas implican componentes que difieren en algo más que sus estados de oxidación. Un ejemplo (entre muchos miles) es la reducción del permanganato por yoduro para formar yodo y manganato.
Cinco pasos de una reacción de esfera exterior
- Los reactivos se difunden juntos, formando un "complejo de encuentro", fuera de sus capas de solvente => complejo precursor (requiere trabajo = w r )
- Cambiar la longitud de los enlaces, reorganizar el disolvente => complejo activado
- Transferencia de electrones
- Relajación de longitudes de enlace, moléculas de disolvente => complejo sucesor
- Difusión de productos (requiere trabajo = w p )
Transferencia heterogénea de electrones
En la transferencia heterogénea de electrones, un electrón se mueve entre una especie química presente en solución y la superficie de un sólido, como un material semiconductor o un electrodo . Las teorías que abordan la transferencia heterogénea de electrones tienen aplicaciones en la electroquímica y el diseño de células solares .
Transferencia de electrones vectorial
Especialmente en las proteínas, la transferencia de electrones a menudo implica el salto de un electrón de un centro redox activo a otro. La vía de salto, que puede considerarse como un vector , guía y facilita la ET dentro de una matriz aislante . Los centros redox típicos son los grupos de hierro-azufre , por ejemplo, las ferredoxinas 4Fe-4S . Estos sitios suelen estar separados por 7-10 Å, una distancia compatible con la ET rápida de esfera exterior.
Teoría
La primera teoría generalmente aceptada de la ET fue desarrollada por Rudolph A. Marcus (Premio Nobel de Química en 1992) [8] para abordar la transferencia de electrones en la esfera exterior y se basó en un enfoque de teoría del estado de transición . La teoría de Marcus de transferencia de electrones luego se amplió para incluir la transferencia de electrones en la esfera interior por Noel Hush y Marcus. La teoría resultante, llamada teoría Marcus-Hush , ha guiado la mayoría de las discusiones sobre la transferencia de electrones desde entonces. Sin embargo, ambas teorías son de naturaleza semiclásica, aunque Joshua Jortner , Alexander M. Kuznetsov y otros las han extendido a tratamientos completamente mecánicos cuánticos a partir de la regla de oro de Fermi y siguiendo trabajos anteriores en transiciones no radiativas. Además, se han propuesto teorías para tener en cuenta los efectos del acoplamiento vibrónico en la transferencia de electrones; en particular, la teoría PKS de transferencia de electrones. [9] En las proteínas, las tasas de ET están gobernadas por las estructuras de enlace: los electrones, en efecto, hacen un túnel a través de los enlaces que comprenden la estructura de la cadena de las proteínas. [10]
Véase también
Referencias
- ^ "Metales". Bitesize . BBC. Archivado desde el original el 3 de noviembre de 2022.
- ^ Piechota, Eric J.; Meyer, Gerald J. (2019). "Introducción a la transferencia de electrones: fundamentos teóricos y ejemplos pedagógicos". Revista de educación química . 96 (11): 2450–2466. Código Bibliográfico :2019JChEd..96.2450P. doi :10.1021/acs.jchemed.9b00489. S2CID 208754569.
- ^ Greenwood, NN; Earnshaw, A. (1997). Química de los elementos (2.ª ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4 .
- ^ Holleman, AF; Wiberg, E. (2001). Química inorgánica . San Diego: Academic Press. ISBN 0-12-352651-5 .
- ^ Taube, Henry; Myers, Howard (1954). "Evidencia de un complejo activado con puente para reacciones de transferencia de electrones". Revista de la Sociedad Química Americana . 76 (8): 2103–2111. doi :10.1021/ja01637a020. ISSN 0002-7863.
- ^ "Comunicado de prensa: Premio Nobel de Química 1983". NobelPrize.org El sitio web oficial del Premio Nobel . Consultado el 2 de septiembre de 2024 .
- ^ Taube, Henry (30 de noviembre de 1984). "Transferencia de electrones entre complejos metálicos: retrospectiva". Science . 226 (4678): 1028–1036. Bibcode :1984Sci...226.1028T. doi :10.1126/science.6494920. ISSN 0036-8075. PMID 6494920.
- ^ ab "El Premio Nobel de Química 1992". NobelPrize.org . 1992 . Consultado el 2 de septiembre de 2024 .
- ^ Susan B. Piepho, Elmars R. Krausz, PN Schatz; J. Am. Chem. Soc., 1978, 100 (10), págs. 2996-3005; Modelo de acoplamiento vibrónico para el cálculo de perfiles de absorción de valencia mixta; doi :10.1021/ja00478a011; Fecha de publicación: mayo de 1978
- ^ Beratan DN, Betts JN, Onuchic JN, Science 31 de mayo de 1991: vol. 252, núm. 5010, págs. 1285-1288; Tasas de transferencia de electrones de proteínas determinadas por la estructura secundaria y terciaria que une las estructuras; doi : 10.1126/science.1656523