Transcriptasa inversa
| Transcriptasa inversa (ADN polimerasa dependiente de ARN) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
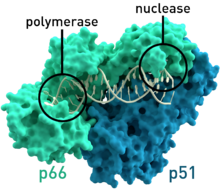 Estructura cristalográfica de la transcriptasa inversa del VIH -1 donde las dos subunidades p51 y p66 están coloreadas y los sitios activos de la polimerasa y la nucleasa están resaltados. [1] | |||||||||
| Identificadores | |||||||||
| Símbolo | RVT_1 | ||||||||
| Pfam | PF00078 | ||||||||
| Clan Pfam | CL0027 | ||||||||
| Interprofesional | IPR000477 | ||||||||
| PROSITIO | PS50878 | ||||||||
| SCOP2 | 1hmv / ALCANCE / SUPFAM | ||||||||
| Diligenciamiento de conflictos | cd00304 | ||||||||
| |||||||||
| ADN polimerasa dirigida por ARN | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| N.º CE | 2.7.7.49 | ||||||||
| N.º CAS | 9068-38-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
Una transcriptasa inversa ( RT ) es una enzima que se utiliza para convertir el genoma de ARN en ADN , un proceso denominado transcripción inversa . Las transcriptasas inversas son utilizadas por virus como el VIH y la hepatitis B para replicar sus genomas, por elementos genéticos móviles de retrotransposón para proliferar dentro del genoma del huésped y por células eucariotas para extender los telómeros en los extremos de sus cromosomas lineales . Contrariamente a una creencia generalizada, el proceso no viola los flujos de información genética descritos por el dogma central clásico , ya que las transferencias de información del ARN al ADN se consideran explícitamente posibles. [2] [3] [4]
La RT retroviral tiene tres actividades bioquímicas secuenciales: actividad de la ADN polimerasa dependiente del ARN, ribonucleasa H (ARNasa H) y actividad de la ADN polimerasa dependiente del ADN. En conjunto, estas actividades permiten que la enzima convierta el ARN monocatenario en ADNc bicatenario. En los retrovirus y retrotransposones, este ADNc puede luego integrarse en el genoma del huésped, a partir del cual se pueden hacer nuevas copias de ARN mediante la transcripción de la célula huésped . La misma secuencia de reacciones se utiliza ampliamente en el laboratorio para convertir el ARN en ADN para su uso en la clonación molecular , la secuenciación del ARN , la reacción en cadena de la polimerasa (PCR) o el análisis del genoma .
Historia
Las transcriptasas inversas fueron descubiertas por Howard Temin en la Universidad de Wisconsin-Madison en viriones del sarcoma de Rous [5] y aisladas independientemente por David Baltimore en 1970 en el MIT a partir de dos virus tumorales de ARN: el virus de la leucemia murina y nuevamente el virus del sarcoma de Rous . [6] Por sus logros, compartieron el Premio Nobel de Fisiología o Medicina de 1975 (con Renato Dulbecco ).
Las transcriptasas inversas bien estudiadas incluyen:
- La transcriptasa inversa del VIH-1 del virus de inmunodeficiencia humana tipo 1 ( PDB : 1HMV ) tiene dos subunidades, que tienen pesos moleculares respectivos de 66 y 51 kDas . [7]
- La transcriptasa inversa M-MLV del virus de la leucemia murina de Moloney es un único monómero de 75 kDa. [8]
- La transcriptasa inversa AMV del virus de la mieloblastosis aviar también tiene dos subunidades, una subunidad de 63 kDa y una subunidad de 95 kDa. [8]
- La transcriptasa inversa de la telomerasa mantiene los telómeros de los cromosomas eucariotas . [9]
Función en los virus

Las enzimas son codificadas y utilizadas por virus que utilizan la transcripción inversa como un paso en el proceso de replicación. Los virus de ARN de transcripción inversa , como los retrovirus , utilizan la enzima para transcribir de forma inversa sus genomas de ARN en ADN, que luego se integra en el genoma del huésped y se replica junto con él. Los virus de ADN de transcripción inversa , como los hepadnavirus , pueden permitir que el ARN sirva como plantilla para ensamblar y fabricar cadenas de ADN. El VIH infecta a los humanos con el uso de esta enzima. Sin la transcriptasa inversa, el genoma viral no podría incorporarse a la célula huésped, lo que provocaría un fallo en la replicación. [ cita requerida ]
Proceso de transcripción inversa o retrotranscripción
La transcriptasa inversa crea ADN de doble cadena a partir de una plantilla de ARN.
En especies de virus con transcriptasa inversa que carecen de actividad de ADN polimerasa dependiente de ADN, la creación de ADN bicatenario posiblemente pueda ser realizada por la ADN polimerasa δ codificada por el huésped , confundiendo el ADN-ARN viral con un cebador y sintetizando un ADN bicatenario mediante un mecanismo similar al de la eliminación del cebador , donde el ADN recién sintetizado desplaza la plantilla de ARN original. [ cita requerida ]
El proceso de transcripción inversa, también llamado retrotranscripción o retrotras, es extremadamente propenso a errores y es durante este paso que pueden ocurrir mutaciones. Dichas mutaciones pueden causar resistencia a los medicamentos .
Transcripción inversa retroviral

Los retrovirus , también denominados virus ssRNA-RT de clase VI , son virus de transcripción inversa de ARN con un intermediario de ADN. Sus genomas constan de dos moléculas de ARN monocatenario de sentido positivo con una tapa de 5' y una cola poliadenilada de 3' . Entre los ejemplos de retrovirus se incluyen el virus de la inmunodeficiencia humana ( VIH ) y el virus linfotrópico de células T humanas ( HTLV ). La creación de ADN bicatenario se produce en el citosol [10] como una serie de estos pasos:
- El ARNt de lisil actúa como cebador y se hibrida con una parte complementaria del genoma del ARN del virus denominada sitio de unión del cebador o PBS.
- Luego, la transcriptasa inversa agrega nucleótidos de ADN al extremo 3' del cebador, sintetizando ADN complementario a la región U5 (región no codificante) y R (una repetición directa que se encuentra en ambos extremos de la molécula de ARN) del ARN viral.
- Un dominio de la enzima transcriptasa inversa llamado ARNasa H degrada las regiones U5 y R en el extremo 5' del ARN.
- Luego, el cebador de ARNt "salta" al extremo 3' del genoma viral, y las cadenas de ADN recién sintetizadas se hibridan con la región R complementaria del ARN.
- El ADN complementario (ADNc) añadido en (2) se extiende aún más.
- La mayor parte del ARN viral es degradado por la ARNasa H, dejando sólo la secuencia PP.
- Comienza la síntesis de la segunda cadena de ADN, utilizando el fragmento PP restante del ARN viral como cebador.
- El cebador de ARNt se va y se produce un "salto". El PBS de la segunda cadena se hibrida con el PBS complementario de la primera cadena.
- Ambas hebras se extienden para formar una copia completa de ADN bicatenario del genoma de ARN viral original, que luego puede incorporarse al genoma del huésped mediante la enzima integrasa .
La creación de ADN bicatenario también implica la transferencia de cadena , en la que hay una translocación de un producto de ADN corto desde la síntesis de ADN dependiente de ARN inicial a regiones de plantilla aceptoras en el otro extremo del genoma, que luego son alcanzadas y procesadas por la transcriptasa inversa para su actividad de ADN dependiente de ADN. [11]
El ARN retroviral se organiza en el extremo 5' al extremo 3'. El sitio donde el cebador se une al ARN viral se llama sitio de unión del cebador (PBS). El extremo 5' del ARN al sitio PBS se llama U5, y el extremo 3' del ARN al PBS se llama líder. El cebador de ARNt se desenrolla entre 14 y 22 nucleótidos y forma un dúplex de pares de bases con el ARN viral en PBS. El hecho de que el PBS esté ubicado cerca del extremo 5' del ARN viral es inusual porque la transcriptasa inversa sintetiza ADN desde el extremo 3' del cebador en la dirección 5' a 3' (con respecto a la cadena de ADN recién sintetizada). Por lo tanto, el cebador y la transcriptasa inversa deben reubicarse en el extremo 3' del ARN viral. Para lograr esta reposición, se necesitan múltiples pasos y varias enzimas, incluida la ADN polimerasa , la ribonucleasa H (RNasa H) y el desenrollado de polinucleótidos. [12] [13]
La transcriptasa inversa del VIH también tiene actividad ribonucleasa que degrada el ARN viral durante la síntesis de ADNc, así como actividad de ADN polimerasa dependiente de ADN que copia la cadena de ADNc sentido en un ADN antisentido para formar un intermediario de ADN viral bicatenario (vADN). [14] Los elementos estructurales del ARN viral del VIH regulan la progresión de la transcripción inversa. [15]
En la vida celular
Los tramos autorreplicantes de genomas eucariotas , conocidos como retrotransposones, utilizan la transcriptasa inversa para pasar de una posición a otra en el genoma a través de un ARN intermediario. Se encuentran en abundancia en los genomas de plantas y animales. La telomerasa es otra transcriptasa inversa que se encuentra en muchos eucariotas, incluidos los humanos, y que lleva su propia plantilla de ARN ; este ARN se utiliza como plantilla para la replicación del ADN . [16]
Los primeros informes sobre la transcriptasa inversa en procariotas se remontan a 1971 en Francia ( Beljanski et al., 1971a, 1972) y unos años más tarde en la URSS (Romashchenko 1977 [17] ). Desde entonces, se han descrito ampliamente como parte de los retrones bacterianos , secuencias distintas que codifican la transcriptasa inversa y se utilizan en la síntesis de msADN . Para iniciar la síntesis de ADN, se necesita un cebador. En las bacterias, el cebador se sintetiza durante la replicación. [18]
Valerian Dolja, de la Universidad Estatal de Oregón, sostiene que los virus, debido a su diversidad, han desempeñado un papel evolutivo en el desarrollo de la vida celular, y que la transcriptasa inversa desempeña un papel central. [19]
Estructura
La transcriptasa inversa emplea una estructura de "mano derecha" similar a la que se encuentra en otras polimerasas de ácidos nucleicos virales . [20] [21] Además de la función de transcripción, las transcriptasas inversas retrovirales tienen un dominio que pertenece a la familia de la ARNasa H , que es vital para su replicación. Al degradar la plantilla de ARN, permite que se sintetice la otra hebra de ADN. [22] Algunos fragmentos de la digestión también sirven como cebador para la ADN polimerasa (ya sea la misma enzima o una proteína huésped), responsable de producir la otra hebra (más). [20]
Fidelidad de replicación
Existen tres sistemas de replicación diferentes durante el ciclo de vida de un retrovirus. El primer proceso es la síntesis del ADN viral a partir del ARN viral por la transcriptasa inversa, que luego forma nuevas cadenas de ADN complementarias. El segundo proceso de replicación ocurre cuando la ADN polimerasa celular del huésped replica el ADN viral integrado. Por último, la ARN polimerasa II transcribe el ADN proviral en ARN, que se empaquetará en viriones. La mutación puede ocurrir durante uno o todos estos pasos de replicación. [23]
La transcriptasa inversa tiene una alta tasa de error al transcribir ARN en ADN ya que, a diferencia de la mayoría de las demás polimerasas de ADN , no tiene capacidad de corrección de errores . Esta alta tasa de error permite que las mutaciones se acumulen a un ritmo acelerado en relación con las formas de replicación corregidas. Los manuales de las transcriptasas inversas disponibles comercialmente producidas por Promega indican que tienen tasas de error en el rango de 1 en 17.000 bases para AMV y 1 en 30.000 bases para M-MLV. [24]
Además de crear polimorfismos de un solo nucleótido , también se ha demostrado que las transcriptasas inversas están involucradas en procesos como fusiones de transcripciones, reordenamiento de exones y creación de transcripciones antisentido artificiales . [25] [26] Se ha especulado que esta actividad de cambio de plantilla de la transcriptasa inversa, que se puede demostrar completamente in vivo , puede haber sido una de las causas para encontrar varios miles de transcripciones no anotadas en los genomas de organismos modelo. [27]
Cambio de plantilla
Dos genomas de ARN se empaquetan en cada partícula de retrovirus, pero, después de una infección, cada virus genera solo un provirus . [28] Después de la infección, la transcripción inversa se acompaña de un cambio de plantilla entre las dos copias del genoma (recombinación por elección de copia). [28] Hay dos modelos que sugieren por qué la ARN transcriptasa cambia las plantillas. El primero, el modelo de elección de copia forzada, propone que la transcriptasa inversa cambia la plantilla de ARN cuando encuentra una mella, lo que implica que la recombinación es obligatoria para mantener la integridad del genoma del virus. El segundo, el modelo de elección dinámica, sugiere que la transcriptasa inversa cambia las plantillas cuando la función de la ARNasa y la función de la polimerasa no están sincronizadas en cuanto a velocidad, lo que implica que la recombinación ocurre al azar y no en respuesta a un daño genómico. Un estudio de Rawson et al. respaldó ambos modelos de recombinación. [28] De 5 a 14 eventos de recombinación por genoma ocurren en cada ciclo de replicación. [29] El cambio de plantilla (recombinación) parece ser necesario para mantener la integridad del genoma y como mecanismo de reparación para salvar genomas dañados. [30] [28]
Aplicaciones

Medicamentos antivirales
Como el VIH utiliza la transcriptasa inversa para copiar su material genético y generar nuevos virus (parte de un círculo de proliferación de retrovirus), se han diseñado medicamentos específicos para interrumpir el proceso y, de ese modo, suprimir su crecimiento. En conjunto, estos medicamentos se conocen como inhibidores de la transcriptasa inversa e incluyen los análogos de nucleósidos y nucleótidos zidovudina (nombre comercial Retrovir), lamivudina (Epivir) y tenofovir (Viread), así como inhibidores no nucleósidos, como la nevirapina (Viramune). [ cita requerida ]
Biología molecular
La transcriptasa inversa se utiliza habitualmente en la investigación para aplicar la técnica de reacción en cadena de la polimerasa al ARN en una técnica llamada reacción en cadena de la polimerasa con transcripción inversa (RT-PCR). La técnica clásica de PCR se puede aplicar solo a cadenas de ADN , pero, con la ayuda de la transcriptasa inversa, el ARN se puede transcribir en ADN, lo que hace posible el análisis por PCR de las moléculas de ARN. La transcriptasa inversa también se utiliza para crear bibliotecas de ADNc a partir de ARNm . La disponibilidad comercial de la transcriptasa inversa mejoró enormemente el conocimiento en el área de la biología molecular, ya que, junto con otras enzimas , permitió a los científicos clonar, secuenciar y caracterizar el ARN.
Véase también
- Biblioteca de ADNc
- ADN polimerasa
- ADNms
- Virus de transcripción inversa
- ARN polimerasa
- Telomerasa
- Marcador de retrotransposón
Referencias
- ^ PDB : 3KLF ; Tu X, Das K, Han Q, Bauman JD, Clark AD, Hou X, Frenkel YV, Gaffney BL, Jones RA, Boyer PL, Hughes SH, Sarafianos SG, Arnold E (octubre de 2010). "Base estructural de la resistencia del VIH-1 a AZT por escisión". Nature Structural & Molecular Biology . 17 (10): 1202–9. doi :10.1038/nsmb.1908. PMC 2987654 . PMID 20852643.
- ^ Crick F (agosto de 1970). "Dogma central de la biología molecular". Nature . 227 (5258): 561–3. Bibcode :1970Natur.227..561C. doi :10.1038/227561a0. PMID 4913914. S2CID 4164029.
- ^ Sarkar S (1996). La filosofía y la historia de la biología molecular: nuevas perspectivas . Dordrecht: Kluwer Academic Publishers. págs. 187–232.
- ^ Danchin É, Pocheville A, Rey O, Pujol B, Blanchet S (2019). "Asimilación mutacional facilitada epigenéticamente: la epigenética como eje dentro de la síntesis evolutiva inclusiva". Biological Reviews . 94 (1): 259–282. doi : 10.1111/brv.12453 . PMC 6378602 . S2CID 67861162.
- ^ Temin HM, Mizutani S (junio de 1970). "ADN polimerasa dependiente de ARN en viriones del virus del sarcoma de Rous". Nature . 226 (5252): 1211–3. doi :10.1038/2261211a0. PMID 4316301. S2CID 4187764.
- ^ Baltimore D (junio de 1970). "ADN polimerasa dependiente de ARN en viriones de virus tumorales de ARN". Nature . 226 (5252): 1209–11. doi :10.1038/2261209a0. PMID 4316300. S2CID 4222378.
- ^ Ferris AL, Hizi A, Showalter SD, Pichuantes S, Babe L, Craik CS, Hughes SH (abril de 1990). "Análisis inmunológico y proteolítico de la estructura de la transcriptasa inversa del VIH-1" (PDF) . Virology . 175 (2): 456–64. doi :10.1016/0042-6822(90)90430-y. PMID 1691562.
- ^ ab Konishi A, Yasukawa K, Inouye K (julio de 2012). "Mejora de la estabilidad térmica de la subunidad α de la transcriptasa inversa del virus de la mieloblastosis aviar mediante mutagénesis dirigida" (PDF) . Biotechnology Letters . 34 (7): 1209–15. doi :10.1007/s10529-012-0904-9. hdl : 2433/157247 . PMID: 22426840. S2CID : 207096569.
- ^ Autexier C, Lue NF (junio de 2006). "La estructura y función de la transcriptasa inversa de la telomerasa". Revisión anual de bioquímica . 75 (1): 493–517. doi :10.1146/annurev.biochem.75.103004.142412. PMID 16756500.
- ^ Bio-Medicine.org - Retrovirus Recuperado el 17 de febrero de 2009
- ^ Telesnitsky A, Goff SP (1993). "Transferencia de cadena de parada fuerte durante la transcripción inversa". En Skalka MA, Goff SP (eds.). Transcriptasa inversa (1.ª ed.). Nueva York: Cold Spring Harbor. pág. 49. ISBN 978-0-87969-382-4.
- ^ Bernstein A, Weiss R, Tooze J (1985). "Virus tumorales de ARN". Biología molecular de los virus tumorales (2.ª ed.). Cold Spring Harbor, Nueva York: Laboratorio de Cold Spring Harbor.
- ^ Moelling K, Broecker F (abril de 2015). "La transcriptasa inversa-RNasa H: de los virus a la defensa antiviral". Anales de la Academia de Ciencias de Nueva York . 1341 (1): 126–35. Bibcode :2015NYASA1341..126M. doi :10.1111/nyas.12668. PMID 25703292. S2CID 42378727.
- ^ Kaiser GE (enero de 2008). "El ciclo de vida del VIH". Página de inicio de microbiología de Doc Kaiser . Community College of Baltimore Count. Archivado desde el original el 26 de julio de 2010.
- ^ Krupkin M, Jackson LN, Ha B, Puglisi EV (diciembre de 2020). "Avances en la comprensión del inicio de la transcripción inversa del VIH-1". Curr Opin Struct Biol . 65 : 175–183. doi :10.1016/j.sbi.2020.07.005. PMC 9973426. PMID 32916568. S2CID 221636459 .
- ^ Krieger M, Scott MP, Matsudaira PT, Lodish HF, Darnell JE, Zipursky L, Kaiser C, Berk A (2004). Biología celular molecular . Nueva York: WH Freeman and CO. ISBN 978-0-7167-4366-8.
- ^ Romashchenko AG, et al. (1977). "Otdelenie ot preparatov DNK-polimeraz I RNK-zavisimoy DNK-polimeraz; oshistka i svoystva fermenta". Actas de la Academia de Ciencias de la URSS . 233 : 734–737.
- ^ Hurwitz J, Leis JP (enero de 1972). "Actividad de la ADN polimerasa dependiente de ARN de los virus tumorales de ARN. I. Influencia directriz del ADN en la reacción". Journal of Virology . 9 (1): 116–29. doi :10.1128/JVI.9.1.116-129.1972. PMC 356270 . PMID 4333538.
- ^ Arnold C (17 de julio de 2014). «¿Podrían los virus gigantes ser el origen de la vida en la Tierra?». National Geographic . Archivado desde el original el 18 de julio de 2014. Consultado el 29 de mayo de 2016 .
- ^ ab Sarafianos SG, Marchand B, Das K, Himmel DM, Parniak MA, Hughes SH, Arnold E (enero de 2009). "Estructura y función de la transcriptasa inversa del VIH-1: mecanismos moleculares de polimerización e inhibición". Journal of Molecular Biology . 385 (3): 693–713. doi :10.1016/j.jmb.2008.10.071. PMC 2881421 . PMID 19022262.
- ^ Hansen JL, Long AM, Schultz SC (agosto de 1997). "Estructura de la ARN polimerasa dependiente de ARN del virus de la poliomielitis". Structure . 5 (8): 1109–22. doi : 10.1016/S0969-2126(97)00261-X . PMID 9309225.
- ^ Schultz SJ, Champoux JJ (junio de 2008). "Actividad de la ARNasa H: estructura, especificidad y función en la transcripción inversa". Virus Research . 134 (1–2): 86–103. doi :10.1016/j.virusres.2007.12.007. PMC 2464458 . PMID 18261820.
- ^ Bbenek K, Kunkel AT (1993). "La fidelidad de las transcriptasas inversas retrovirales". En Skalka MA, Goff PS (eds.). Transcriptasa inversa . Nueva York: Cold Spring Harbor Laboratory Press. pág. 85. ISBN 978-0-87969-382-4.
- ^ "Manual de instrucciones del kit Promega" (PDF) . 1999. Archivado desde el original (PDF) el 2006-11-21.
- ^ Houseley J, Tollervey D (agosto de 2010). "La transcriptasa inversa genera un empalme trans aparentemente no canónico in vitro". PLOS ONE . 5 (8): e12271. Bibcode :2010PLoSO...512271H. doi : 10.1371/journal.pone.0012271 . PMC 2923612 . PMID 20805885.
- ^ Zeng XC, Wang SX (junio de 2002). "Evidencia de que el ADNc de BmTXK beta-BmKCT del escorpión chino Buthus martensii Karsch es un artefacto generado en el proceso de transcripción inversa". FEBS Letters . 520 (1–3): 183–4, respuesta del autor 185. doi : 10.1016/S0014-5793(02)02812-0 . PMID 12044895. S2CID 24619868.
- ^ van Bakel H, Nislow C, Blencowe BJ, Hughes TR (2011). "Respuesta a "La realidad de la transcripción generalizada"". PLOS Biology . 9 (7): e1001102. doi : 10.1371/journal.pbio.1001102 . PMC 3134445 .
- ^ abcd Rawson JM, Nikolaitchik OA, Keele BF, Pathak VK, Hu WS (noviembre de 2018). "La recombinación es necesaria para la replicación eficiente del VIH-1 y el mantenimiento de la integridad del genoma viral". Nucleic Acids Research . 46 (20): 10535–10545. doi :10.1093/nar/gky910. PMC 6237782 . PMID 30307534.
- ^ Cromer D, Grimm AJ, Schlub TE, Mak J, Davenport MP (enero de 2016). "Estimación de la tasa de recombinación y cambio de plantilla del VIH in vivo". SIDA . 30 (2): 185–92. doi : 10.1097/QAD.0000000000000936 . PMID 26691546. S2CID 20086739.
- ^ Hu WS, Temin HM (noviembre de 1990). "Recombinación retroviral y transcripción inversa". Science . 250 (4985). Nueva York, NY: 1227–33. Bibcode :1990Sci...250.1227H. doi :10.1126/science.1700865. PMID 1700865.
Enlaces externos
- ARN+transcriptasa en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Animación de la acción de la transcriptasa inversa y tres inhibidores de la transcriptasa inversa
- Molécula del mes (septiembre de 2002) en el PDB del RCSB
- Animación médica en 3D sobre la replicación del VIH (noviembre de 2008). Vídeo de Boehringer Ingelheim.
- Goodsell DS. "Molécula del mes: transcriptasa inversa (septiembre de 2002)". Banco de datos de proteínas (PDB) del Laboratorio de investigación en bioinformática estructural (RCSB) . Consultado el 13 de enero de 2013 .
- Resumen de toda la información estructural disponible en el PDB para UniProt : P03366 (Transcriptasa inversa del virus de inmunodeficiencia humana) en el PDBe-KB .
- TWiV 904: 50 años de transcriptasa inversa Vincent Racaniello viaja al Laboratorio Cold Spring Harbor para hablar con David Baltimore , John Coffin (científico) y Harold Varmus sobre el descubrimiento en 1970 de la transcriptasa inversa retroviral y su impacto en la investigación en ciencias de la vida.

