Toluidina
Hay tres isómeros de toluidina , que son compuestos orgánicos descubiertos y nombrados por James Sheridan Muspratt y August Wilhelm von Hofmann en 1845. [1] Estos isómeros son o -toluidina , m -toluidina y p -toluidina , con la letra prefijada que abrevia, respectivamente, orto ; meta ; y para . Los tres son aminas arílicas cuyas estructuras químicas son similares a la anilina excepto que un grupo metilo está sustituido en el anillo de benceno. La diferencia entre estos tres isómeros es la posición donde el grupo metilo (–CH 3 ) está unido al anillo en relación con el grupo funcional amino (–NH 2 ); vea la ilustración de las estructuras químicas a continuación. [2]
| Isómeros de toluidina | |||
|---|---|---|---|
| Posición de metilo | orto | meta | paraca |
| Nombre común | o -toluidina | m -toluidina | p -toluidina |
| Otros nombres | o -metilanilina | m -metilanilina | p -metilanilina |
| Nombre químico | 2-metilanilina | 3-metilanilina | 4-metilanilina |
| Fórmula química | C7H9N | ||
| Masa molecular | 107,17 g/mol | ||
| Temperatura de transición vítrea | 189 K [3] | 187 K [4] | Vidrio no formado [3] |
| Punto de fusión | -23 °C | -30 °C | 43 °C |
| Punto de ebullición | 199–200 °C | 203–204 °C | 200 °C |
| Densidad | 1,00 g/ cm3 | 0,98 g/ cm3 | 1,05 g/ cm3 |
| Susceptibilidad magnética | 76,0 × 10 −6 cm3 / mol | 74,6 × 10 −6 cm3 / mol | 72,1 × 10 −6 cm3 / mol |
| Número CAS | [95-53-4] | [108-44-1] | [106-49-0] |
| SONRISAS | Cc1ccccc1N | Cc1cccc(N)c1 | Cc1ccc(N)cc1 |
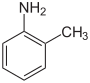 |  |  | |
| Aviso legal y referencias | |||
Las propiedades químicas de las toluidinas son bastante similares a las de la anilina , y las toluidinas tienen propiedades en común con otras aminas aromáticas . Debido al grupo amino unido al anillo aromático, las toluidinas son débilmente básicas . Las toluidinas son poco solubles en agua pura , pero se disuelven bien en agua ácida debido a la formación de sales de amonio , como es habitual en las aminas orgánicas. Las orto- y meta -toluidinas son líquidos viscosos , pero la para -toluidina es un sólido escamoso . Esta diferencia está relacionada con el hecho de que las moléculas de p -toluidina son más simétricas. La p -toluidina se puede obtener a partir de la reducción de p -nitrotolueno . La p -toluidina reacciona con formaldehído para formar la base de Tröger .
Usos y ocurrencia
El isómero orto es el que se produce en mayor escala. Su principal aplicación es como precursor de los pesticidas metolaclor y acetoclor . [2] Los demás isómeros de toluidina se utilizan en la producción de colorantes . Son un componente de los aceleradores de los pegamentos de cianoacrilato .
En algunos pacientes, la o -toluidina es un metabolito de la prilocaína , que puede causar metahemoglobinemia . En este caso, se trata con azul de metileno .
Referencias
- ^ Muspratt, James Sheridan; Hofmann, Augustus William (septiembre de 1845). "Sobre la toluidina, una nueva base orgánica". Revista filosófica y revista científica de Londres, Edimburgo y Dublín . 27 (179): 178-194. doi :10.1080/14786444508645253. ISSN 1941-5966.
- ^ ab Bowers, Joseph S. "Toluidinas". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a27_159. ISBN 978-3527306732.
- ^ ab Pratesi, G.; Bartolini, P.; Senador, D.; Ricci, M.; Righini, R.; Barocchi, F.; Torre, R. (2003). "Estudios experimentales de la transición vítrea orto -toluidina". Revisión física E. 67 (2): 021505. Código bibliográfico : 2003PhRvE..67b1505P. doi : 10.1103/PhysRevE.67.021505. PMID 12636682.
- ^ Alba-Simionesco, C.; Fan, J.; Angell, CA (1999). "Aspectos termodinámicos del fenómeno de transición vítrea. II. Líquidos moleculares con interacciones variables". The Journal of Chemical Physics . 110 (11): 5262. Bibcode :1999JChPh.110.5262A. doi :10.1063/1.478800.
Enlaces externos
- Hoja de datos de seguridad del material (MSDS)
- o-Toluidina, m-Toluidina, p-Toluidina CDC – NIOSH Pocket to Chemical Hazards