Tioamida

Una tioamida (raramente, tionamida , pero también conocida como tiourilenos ) es un grupo funcional con la estructura general R 1 −C(=S)−NR 2 R 3 , donde R 1 , R 2 y R 3 son grupos cualesquiera (típicamente grupos organilo o hidrógeno ). De manera análoga a las amidas , las tioamidas exhiben un mayor carácter de enlace múltiple a lo largo del enlace CN, lo que resulta en una barrera rotacional más grande. [1]
Ejemplos
Una tioamida muy conocida es la tioacetamida , que se utiliza como fuente del ion sulfuro y es un componente básico de la química heterocíclica . El ácido tiocianúrico es una tristioamida.
Las tioamidas o fármacos antitiroideos también son una clase de medicamentos que se utilizan para controlar la tirotoxicosis .
Preparación y estructura
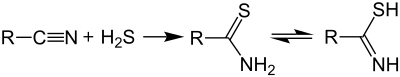
Las tioamidas se preparan típicamente tratando amidas con sulfuros de fósforo como el pentasulfuro de fósforo , una reacción descrita por primera vez en la década de 1870. [2] [3] [4] Las rutas alternativas incluyen el uso del reactivo de Lawesson [5] o la reacción de nitrilos con sulfuro de hidrógeno :
La reacción de Willgerodt-Kindler también produce benciltioamidas. [6]
El núcleo C(R)(N)(S) de las tioamidas es plano. Si se toma la tioacetamida como ejemplo, las distancias CS, CN y CC son 1,68, 1,31 y 1,50 Å, respectivamente. Las distancias cortas CS y CN indican enlaces múltiples. [7]
Tioamidas en bioquímica y medicina
Las tioamidas también son una clase de medicamentos que se utilizan para controlar la tirotoxicosis .
Las tioamidas se han incorporado a los péptidos como isósteros para el enlace amida. [8] Las modificaciones de péptidos son análogos del péptido nativo, que pueden revelar la relación estructura-actividad ( SAR ). Los análogos de péptidos también se pueden utilizar como fármacos con una biodisponibilidad oral mejorada . Las tioamidas inhiben la enzima peroxidasa tiroidea en la tiroides , reduciendo la síntesis de triyodotironina (T 3 ) y tiroxina (T 4 ), bloqueando así la captación de yodotirosinas del coloide . También bloquean la liberación de yodo de la hormona periférica. Los efectos máximos ocurren solo después de un mes, ya que el agotamiento de la hormona es causado por la síntesis reducida, que es un proceso lento.
Referencias
- ^ Wiberg, Kenneth B.; Rablen, Paul R. (1995). "¿Por qué la tioformamida tiene una barrera rotacional más grande que la formamida?". J. Am. Chem. Soc. 117 (8): 2201–2209. doi :10.1021/ja00113a009.
- ^ "Preparación de tiamidas". Revista de la Sociedad Química, Resúmenes . 34 : 396. 1878. doi : 10.1039/CA8783400392 .
- ^ Gompper, R.; Elser, W. (1973). "2-Metilmercapto-N-Metil-Δ2-pirrolina". Síntesis orgánicas; Volúmenes recopilados , vol. 5, pág. 780.
- ^ Schwarz, George (1955). "2,4-Dimetiltiazol". Síntesis orgánicas; Volúmenes recopilados , vol. 3, pág. 332.
- ^ Shabana, R.; Scheibye, S.; Clausen, K.; Olesen, SO; Lawesson, S.-O. (1980). "Estudios sobre compuestos organofosforados XXXI. Síntesis de tiolactamas y tioimidas". Nouveau Journal de Chimie . 1980 (4): 47.
- ^ Rolfs, Andrés; Liebscher, Jürgen (1998). "Morfolida del ácido 3-morfolino-2-feniltioacrílico y 5-(4-bromobenzoil-2-(4-morfolino)-3-feniltiofeno". Síntesis orgánicas; Volúmenes recopilados , vol. 9, pág. 99.
- ^ Trevor W. Hambley; David E. Hibbs; Peter Turner; Siân. T. Howard; Michael B. Hursthouse (2002). "Información sobre la vinculación y la direccionalidad de los enlaces de hidrógeno en tioacetamida a partir de la distribución de carga experimental". J. Chem. Soc., Perkin Trans. (2): 235–239. doi :10.1039/B109353C.
- ^ Artis, Dean R.; Lipton, Mark A. (1998). "Conformaciones de dipéptidos que contienen tioamida: un estudio computacional". J. Am. Chem. Soc . 120 (47): 12200–12206. doi :10.1021/ja982398t.