Superantígeno



Los superantígenos ( SAgs ) son una clase de antígenos que resultan en una activación excesiva del sistema inmunológico . Específicamente, causan una activación no específica de las células T que resulta en la activación de células T policlonales y la liberación masiva de citocinas . Los superantígenos actúan uniéndose a las proteínas MHC en las células presentadoras de antígenos (APC) y a los TCR en sus células T auxiliares adyacentes, uniendo las moléculas de señalización y, por lo tanto, conduciendo a la activación de las células T, independientemente del péptido que se muestre en la molécula MHC. [1] Los SAgs son producidos por algunos virus y bacterias patógenos probablemente como un mecanismo de defensa contra el sistema inmunológico. [2] En comparación con una respuesta normal de células T inducida por antígeno donde se activan el 0,0001-0,001% de las células T del cuerpo, estos SAgs son capaces de activar hasta el 20% de las células T del cuerpo. [3] Además, los anticuerpos anti- CD3 y anti- CD28 ( CD28-SuperMAB ) también han demostrado ser superantígenos muy potentes (y pueden activar hasta el 100% de las células T).
La gran cantidad de células T activadas genera una respuesta inmunitaria masiva que no es específica de ningún epítopo particular en el SAg, socavando así una de las fortalezas fundamentales del sistema inmunitario adaptativo , es decir, su capacidad para dirigirse a antígenos con alta especificidad. Más importante aún, la gran cantidad de células T activadas secretan grandes cantidades de citocinas , la más importante de las cuales es el interferón gamma . Esta cantidad excesiva de IFN-gamma a su vez activa los macrófagos . Los macrófagos activados, a su vez, sobreproducen citocinas proinflamatorias como IL-1 , IL-6 y TNF-alfa . El TNF-alfa es particularmente importante como parte de la respuesta inflamatoria del cuerpo. En circunstancias normales, se libera localmente en niveles bajos y ayuda al sistema inmunitario a derrotar a los patógenos. Sin embargo, cuando se libera sistémicamente en la sangre y en niveles altos (debido a la activación masiva de células T resultante de la unión de SAg), puede causar síntomas graves y potencialmente mortales, incluido el choque séptico y la insuficiencia orgánica múltiple .
Estructura
Los SAgs son producidos intracelularmente por bacterias y se liberan tras la infección como toxinas maduras extracelulares. [4]
Las secuencias de estas toxinas bacterianas están relativamente conservadas entre los diferentes subgrupos. Más importante que la homología de secuencias, la estructura 3D es muy similar entre los diferentes SAgs, lo que da como resultado efectos funcionales similares entre los diferentes grupos. [5] [6] Hay al menos 5 grupos de superantígenos con diferentes preferencias de unión. [7]
Las estructuras cristalinas de las enterotoxinas revelan que son proteínas compactas y elipsoidales que comparten un patrón característico de plegamiento de dos dominios que comprende un dominio globular de barril β NH2-terminal conocido como pliegue de oligosacárido / oligonucleótido , una hélice α larga que se extiende diagonalmente por el centro de la molécula y un dominio globular terminal COOH. [5]
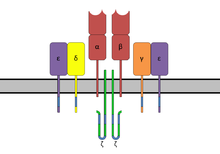
Los dominios tienen regiones de unión para el complejo mayor de histocompatibilidad clase II ( MHC clase II ) y el receptor de células T (TCR), respectivamente. Al unirlos, el SAg provoca una activación no específica. [8]
Vinculante
Los superantígenos se unen primero al MHC de clase II y luego se coordinan con la cadena variable alfa o beta de los receptores de células T (TCR) [6] [9] [10]
MHC Clase II
Los SAg muestran preferencia por la forma HLA-DQ de la molécula. [10] La unión a la cadena α coloca al SAg en la posición adecuada para coordinarse con el TCR.
Con menor frecuencia, los SAg se unen a la cadena β polimórfica del MHC de clase II en una interacción mediada por un complejo de coordinación de iones de zinc entre tres residuos de SAg y una región altamente conservada de la cadena β del HLA-DR . [6] El uso de un ion de zinc en la unión conduce a una interacción de mayor afinidad. [5] Varios SAg estafilocócicos son capaces de reticular las moléculas del MHC uniéndose a las cadenas α y β. [5] [6] Este mecanismo estimula la expresión y liberación de citocinas en las células presentadoras de antígenos, además de inducir la producción de moléculas coestimuladoras que permiten que la célula se una a las células T y las active de manera más efectiva. [6]
Receptor de células T
La región de unión de células T del SAg interactúa con la región variable en la cadena Beta (región Vβ) del receptor de células T. Un SAg determinado puede activar una gran proporción de la población de células T porque el repertorio de células T humanas comprende solo alrededor de 50 tipos de elementos Vβ y algunos SAgs son capaces de unirse a múltiples tipos de regiones Vβ. Esta interacción varía ligeramente entre los diferentes grupos de SAgs. [8] La variabilidad entre diferentes personas en los tipos de regiones de células T que prevalecen explica por qué algunas personas responden con más fuerza a ciertos SAgs. Los SAgs del grupo I entran en contacto con Vβ en la región CDR2 y de estructura de la molécula. [11] [12] Los SAgs del grupo II interactúan con la región Vβ utilizando mecanismos que dependen de la conformación . Estas interacciones son en su mayor parte independientes de las cadenas laterales de aminoácidos Vβ específicos. Se ha demostrado que los SAgs del grupo IV se acoplan a los tres bucles CDR de ciertas formas Vβ. [11] [12] La interacción se produce en una hendidura entre los dominios pequeño y grande del SAg y permite que el SAg actúe como una cuña entre el TCR y el MHC. Esto desplaza el péptido antigénico lejos del TCR y evita el mecanismo normal de activación de las células T. [6] [13]
La fuerza biológica del SAg (su capacidad de estimular) está determinada por su afinidad por el TCR. Los SAg con la mayor afinidad por el TCR provocan la respuesta más fuerte. [14] SPMEZ-2 es el SAg más potente descubierto hasta la fecha. [14]
Señalización de células T
El SAg se une al MHC y al TCR, lo que induce una vía de señalización que da lugar a la proliferación de la célula y la producción de citocinas. Esto ocurre porque un antígeno cognado activa una célula T no por su estructura per se , sino porque su afinidad le permite unirse al TCR durante un período de tiempo suficientemente prolongado, y el SAg imita esta unión temporal. Se han encontrado niveles bajos de Zap-70 en células T activadas por SAgs, lo que indica que la vía de señalización normal de activación de células T está alterada. [15]
Se plantea la hipótesis de que Fyn , en lugar de Lck , es activada por una tirosina quinasa , lo que conduce a la inducción adaptativa de anergia. [16]
Se activan tanto la vía de la proteína quinasa C como la de la proteína tirosina quinasa, lo que da como resultado una regulación positiva de la producción de citocinas proinflamatorias. [17]
Esta vía de señalización alternativa altera levemente las vías calcio/calcineurina y Ras/MAPquinasa, [16] pero permite una respuesta inflamatoria focalizada.
Efectos
Efectos directos
La estimulación de las células presentadoras de antígenos y de las células T por SAg provoca una respuesta que es principalmente inflamatoria, centrada en la acción de las células T auxiliares Th1 . Algunos de los principales productos son IL-1 , IL-2 , IL -6 , TNF-α , interferón gamma (IFN-γ), proteína inflamatoria de macrófagos 1α (MIP-1α), MIP-1β y proteína quimioatrayente de monocitos 1 ( MCP-1 ). [17]
Esta liberación excesiva y descoordinada de citocinas (especialmente TNF-α) sobrecarga el cuerpo y produce erupciones cutáneas, fiebre y puede conducir a insuficiencia multiorgánica, coma y muerte. [10] [12]
La infección produce una deleción o anergia de las células T activadas, como resultado de la producción de IL-4 e IL-10 a partir de la exposición prolongada a la toxina. La IL-4 y la IL-10 regulan negativamente la producción de IFN-gamma, MHC de clase II y moléculas coestimulantes en la superficie de las células madre adenomatosas. Estos efectos producen células de memoria que no responden a la estimulación antigénica. [18] [19]
Un mecanismo por el cual esto es posible involucra la supresión de células T mediada por citocinas. La reticulación de MHC también activa una vía de señalización que suprime la hematopoyesis y regula positivamente la apoptosis mediada por Fas . [20]
El IFN-α es otro producto de la exposición prolongada a SAg. Esta citocina está estrechamente relacionada con la inducción de la autoinmunidad [21] y se sabe que la enfermedad autoinmune llamada enfermedad de Kawasaki es causada por la infección con SAg [14] .
La activación de SAg en las células T conduce a la producción del ligando CD40 que activa el cambio de isotipo en las células B a IgG , IgM e IgE . [22]
En resumen, las células T se estimulan y producen cantidades excesivas de citocinas, lo que da lugar a una supresión de las células T mediada por citocinas y a la eliminación de las células activadas a medida que el cuerpo vuelve a la homeostasis. Los efectos tóxicos del microbio y del SAg también dañan los tejidos y los sistemas orgánicos, una afección conocida como síndrome de shock tóxico . [22]
Si se sobrevive a la inflamación inicial, las células huésped se vuelven anérgicas o se eliminan, lo que da como resultado un sistema inmunológico gravemente comprometido.
Efectos (indirectos) independientes de la superantigenicidad
Además de su actividad mitogénica, los SAgs pueden causar síntomas característicos de la infección. [2]
Uno de estos efectos es el vómito . Este efecto se siente en casos de intoxicación alimentaria , cuando las bacterias productoras de SAg liberan la toxina, que es muy resistente al calor. Hay una región específica de la molécula que es activa en la inducción de toxicidad gastrointestinal . [2] Esta actividad también es muy potente , y cantidades tan pequeñas como 20-35 μg de SAg son capaces de inducir el vómito. [10]
Los SAgs pueden estimular el reclutamiento de neutrófilos al sitio de la infección de una manera que es independiente de la estimulación de las células T. Este efecto se debe a la capacidad de los SAgs para activar las células monocíticas , estimulando la liberación de la citocina TNF-α, lo que conduce a una mayor expresión de moléculas de adhesión que reclutan leucocitos a las regiones infectadas. Esto causa inflamación en los pulmones, el tejido intestinal y cualquier lugar que las bacterias hayan colonizado . [23] Si bien pequeñas cantidades de inflamación son naturales y útiles, la inflamación excesiva puede provocar la destrucción del tejido.
Uno de los efectos indirectos más peligrosos de la infección por SAg se refiere a la capacidad de estos últimos de aumentar los efectos de las endotoxinas en el organismo, lo que se consigue reduciendo el umbral de endotoxicidad. Schlievert demostró que, cuando se administran conjuntamente, los efectos de los SAg y las endotoxinas se magnifican hasta 50.000 veces. [9] Esto podría deberse a la menor eficiencia del sistema inmunitario inducida por la infección por SAg. Aparte de la relación sinérgica entre la endotoxina y el SAg, el efecto de “doble impacto” de la actividad de la endotoxina y el SAg produce efectos más nocivos que los observados en una infección bacteriana típica. Esto también implica a los SAg en la progresión de la sepsis en pacientes con infecciones bacterianas. [22]
Enfermedades asociadas con la producción de superantígenos
- Diabetes mellitus
- Eczema
- Psoriasis guttata
- Enfermedad de Kawasaki
- Pólipos nasales [24]
- Fiebre reumática
- Artritis reumatoide
- Escarlatina [10]
- Síndrome de shock tóxico
- Endocarditis infecciosa [25]
Tratamiento
Los objetivos principales del tratamiento médico son estabilizar hemodinámicamente al paciente y, si está presente, eliminar el microbio que produce los SAgs. Esto se logra mediante el uso de vasopresores , reanimación con líquidos y antibióticos . [2]
El cuerpo produce naturalmente anticuerpos contra algunos SAgs, y este efecto se puede aumentar estimulando la producción de estos anticuerpos por parte de las células B. [26]
Los grupos de inmunoglobulinas pueden neutralizar anticuerpos específicos y evitar la activación de las células T. Se han creado anticuerpos y péptidos sintéticos para imitar las regiones de unión de SAg en el MHC de clase II, bloqueando la interacción y evitando la activación de las células T. [2]
También se emplean inmunosupresores para prevenir la activación de las células T y la liberación de citocinas. Los corticosteroides se utilizan para reducir los efectos inflamatorios. [22]
Evolución de la producción de superantígenos
La producción de SAg corrompe eficazmente la respuesta inmunitaria, permitiendo que el microbio que secreta SAg sea transportado y transmitido sin control. Un mecanismo por el cual esto se hace es a través de la inducción de anergia de las células T a antígenos y SAg. [15] [18] Lussow y MacDonald demostraron esto al exponer sistemáticamente animales a un antígeno estreptocócico. Encontraron que la exposición a otros antígenos después de la infección con SAg no provocó una respuesta inmunitaria. [18] En otro experimento, Watson y Lee descubrieron que las células T de memoria creadas por estimulación antigénica normal eran anérgicas a la estimulación con SAg y que las células T de memoria creadas después de una infección con SAg eran anérgicas a toda estimulación antigénica. El mecanismo por el cual esto ocurrió fue indeterminado. [15] Los genes que regulan la expresión de SAg también regulan mecanismos de evasión inmunitaria como la proteína M y la expresión de la cápsula bacteriana , lo que apoya la hipótesis de que la producción de SAg evolucionó principalmente como un mecanismo de evasión inmunitaria. [27]
Cuando se comparó la estructura de los dominios SAg individuales con otras proteínas estreptocócicas que se unen a inmunoglobulinas (como las toxinas producidas por E. coli ), se descubrió que los dominios se parecían por separado a los miembros de estas familias. Esta homología sugiere que los SAg evolucionaron a través de la recombinación de dos motivos de cadena β más pequeños. [28]
Las toxinas "similares a superantígenos estafilocócicos" (SSL) son un grupo de proteínas secretadas estructuralmente similares a los SAgs. En lugar de unirse al MHC y al TCR, se dirigen a diversos componentes de la inmunidad innata, como el complemento , los receptores Fc y las células mieloides . Una forma en que la SSL se dirige a las células mieloides es uniéndose al glicano de sialilactosamina en las glicoproteínas de superficie. [29] En 2017, se descubrió que un superantígeno también tenía la capacidad de unirse al glicano. [30]
SAgs endógenos y virales
Las exotoxinas estimulantes de linfocitos menores (Mls; P03319 ) se descubrieron originalmente en las células del estroma tímico de ratones. Estas toxinas están codificadas por genes SAg que se incorporaron al genoma del ratón a partir del virus del tumor mamario del ratón (MMTV). La presencia de estos genes en el genoma del ratón permite que el ratón exprese el antígeno en el timo como un medio de selección negativa de linfocitos con una región Beta variable que es susceptible a la estimulación por el SAg viral. El resultado es que estos ratones son inmunes a la infección por el virus más adelante en la vida. [2]
Todavía no se ha identificado una selección dependiente de SAg endógena similar en el genoma humano, pero se han descubierto SAgs endógenos y se sospecha que desempeñan un papel integral en la infección viral. Se sabe que la infección por el virus de Epstein-Barr , por ejemplo, causa la producción de un SAg en las células infectadas, pero no se ha encontrado ningún gen para la toxina en el genoma del virus. El virus manipula la célula infectada para que exprese sus propios genes SAg, y esto la ayuda a evadir el sistema inmunológico del huésped. Se han encontrado resultados similares con la rabia , el citomegalovirus y el VIH . [2] En 2001, se descubrió que el VEB en realidad transactiva un superantígeno codificado por el gen env ( O42043 ) de HERV-K18. En 2006, se descubrió que el VEB lo hace al acoplarse a CD2 . [31]
Los dos superantígenos virales no tienen homología con los superantígenos bacterianos mencionados anteriormente, ni son homólogos entre sí.
Referencias
- ^ Levinson, Warren (2020). Revista de microbiología médica e inmunología (16.ª ed.). EE. UU.: McGraw-Hill Education. pág. 530. ISBN 9781260116717.
- ^ abcdefg Llewelyn M, Cohen J (marzo de 2002). "Superantígenos: agentes microbianos que corrompen la inmunidad". Lancet Infect Dis . 2 (3): 156–62. doi :10.1016/S1473-3099(02)00222-0. PMID 11944185.
- ^ Li H., Llera A., Malchiodi EL, Mariuzza RA La base estructural de la activación de las células T por superantígenos. Año. Rev. Immunol. 1999;17:435–466. doi: 10.1146/annurev.immunol.17.1.435.
- ^ Sriskandan S, Faulkner L, Hopkins P (2007). "Streptococcus pyogenes: información sobre la función de los superantígenos estreptocócicos". Int. J. Biochem. Cell Biol . 39 (1): 12–9. doi :10.1016/j.biocel.2006.08.009. PMID 17029999.
- ^ abcd Petersson K, Forsberg G, Walse B (abril de 2004). "Interacción entre superantígenos e inmunorreceptores". Scand. J. Immunol . 59 (4): 345–55. doi : 10.1111/j.0300-9475.2004.01404.x . PMID 15049778.
- ^ abcdef Mehindate K, Thibodeau J, Dohlsten M, Kalland T, Sékaly RP, Mourad W (noviembre de 1995). "La reticulación de las moléculas del complejo mayor de histocompatibilidad de clase II por el superantígeno de la enterotoxina A estafilocócica es un requisito para la expresión del gen de la citocina inflamatoria". J. Exp. Med . 182 (5): 1573–7. doi :10.1084/jem.182.5.1573. PMC 2192187. PMID 7595227 .
- ^ Sundberg, Eric J.; Deng, Lu; Mariuzza, Roy A. (agosto de 2007). "Reconocimiento de complejos de péptidos/MHC de clase II y superantígenos por TCR". Seminarios en Inmunología . 19 (4): 262–271. doi :10.1016/j.smim.2007.04.006. PMC 2949352 . PMID 17560120.
- ^ ab Papageorgiou AC, Tranter HS, Acharya KR (marzo de 1998). "Estructura cristalina del superantígeno microbiano enterotoxina B estafilocócica a una resolución de 1,5 A: implicaciones para el reconocimiento del superantígeno por moléculas MHC de clase II y receptores de células T". J. Mol. Biol . 277 (1): 61–79. doi :10.1006/jmbi.1997.1577. PMID 9514739.
- ^ ab Schlievert PM (abril de 1982). "Aumento de la susceptibilidad del huésped al shock letal por endotoxina mediante la exotoxina pirogénica estafilocócica de tipo C". Infect. Inmun . 36 (1): 123–8. doi :10.1128/IAI.36.1.123-128.1982. PMC 351193. PMID 7042568.
- ^ abcde Alouf JE, Müller-Alouf H (febrero de 2003). "Superantígenos estafilocócicos y estreptocócicos: aspectos moleculares, biológicos y clínicos". Int. J. Med. Microbiol . 292 (7–8): 429–40. doi :10.1078/1438-4221-00232. PMID 12635926.
- ^ ab Brouillard JN, Günther S, Varma AK, et al. (abril de 2007). "Estructura cristalina del superantígeno estreptocócico SpeI y función de un nuevo dominio de bucle en la activación de células T por superantígenos del grupo V". J. Mol. Biol . 367 (4): 925–34. doi :10.1016/j.jmb.2007.01.024. PMID 17303163.
- ^ abc Buonpane RA, Moza B, Sundberg EJ, Kranz DM (octubre de 2005). "Caracterización de receptores de células T diseñados para una alta afinidad contra la toxina-1 del síndrome de choque tóxico". J. Mol. Biol . 353 (2): 308–21. doi :10.1016/j.jmb.2005.08.041. PMID 16171815.
- ^ Li H, Llera A, Tsuchiya D, et al. (diciembre de 1998). "Estructura tridimensional del complejo entre una cadena beta del receptor de células T y el superantígeno enterotoxina B estafilocócica". Inmunidad . 9 (6): 807–16. doi : 10.1016/S1074-7613(00)80646-9 . PMID 9881971.
- ^ abc Arcus VL, Proft T, Sigrell JA, Baker HM, Fraser JD, Baker EN (mayo de 2000). "Conservación y variación en la estructura y actividad de superantígenos resaltadas por las estructuras tridimensionales de dos nuevos superantígenos de Streptococcus pyogenes". J. Mol. Biol . 299 (1): 157–68. doi :10.1006/jmbi.2000.3725. PMID 10860729.
- ^ abc Watson AR, Lee WT (agosto de 2006). "Transducción de señales mediada por receptores de células T defectuosos en linfocitos T CD4 de memoria expuestos a superantígenos o anticuerpos anti-receptor de células T". Cell. Immunol . 242 (2): 80–90. doi :10.1016/j.cellimm.2006.09.008. PMC 1829409. PMID 17083922 .
- ^ ab Choi S, Schwartz RH (junio de 2007). "Mecanismos moleculares para la tolerancia adaptativa y otros modelos de anergia de células T". Semin. Immunol . 19 (3): 140–52. doi :10.1016/j.smim.2007.02.005. PMC 2045643. PMID 17400472 .
- ^ ab Stiles BG, Krakauer (2005). "Enterotoxinas estafilocócicas: una experiencia depurativa en revisión, parte I". Boletín de microbiología clínica . 27 (23): 23. doi :10.1016/j.clinmicnews.2005.11.001.
- ^ abc Lussow AR, MacDonald HR (febrero de 1994). "Efectos diferenciales de la "anergia" inducida por superantígenos en las etapas de preparación y efecto de una respuesta de anticuerpos dependiente de células T". Eur. J. Immunol . 24 (2): 445–9. doi :10.1002/eji.1830240227. PMID 8299694. S2CID 6208425.
- ^ Miller C, Ragheb JA, Schwartz RH (julio de 1999). "Anergia y supresión mediada por citocinas como mecanismos distintos de tolerancia inducida por superantígenos in vivo". J. Exp. Med . 190 (1): 53–64. doi :10.1084/jem.190.1.53. PMC 2195559. PMID 10429670 .
- ^ Yamaguchi M, Nadler S, Lee JW, Deeg HJ (septiembre de 1999). "Inducción de reguladores negativos de la hematopoyesis en células de médula ósea humana mediante entrecruzamiento HLA-DR". Transpl. Immunol . 7 (3): 159–68. doi :10.1016/S0966-3274(99)80035-5. PMID 10608299.
- ^ Stauffer Y, Marguerat S, Meylan F, et al. (octubre de 2001). "Superantígeno endógeno inducido por interferón alfa. Un modelo que vincula el medio ambiente y la autoinmunidad". Inmunidad . 15 (4): 591–601. doi : 10.1016/S1074-7613(01)00212-6 . PMID 11672541.
- ^ abcd Jabara HH, Geha RS (octubre de 1996). "El superantígeno toxina-1 del síndrome de choque tóxico induce la expresión del ligando CD40 y modula el cambio de isotipo de IgE". Int. Immunol . 8 (10): 1503–10. doi : 10.1093/intimm/8.10.1503 . PMID 8921429.
- ^ Diener K, Tessier P, Fraser J, Köntgen F, McColl SR (junio de 1998). "Inducción de inflamación aguda in vivo por superantígenos estafilocócicos I: el reclutamiento de leucocitos ocurre independientemente de los linfocitos T y las moléculas del complejo mayor de histocompatibilidad de clase II". Lab. Invest . 78 (6): 647–56. PMID 9645755.
- ^ Van Cauwenberge P, Gevaert P, Van Hoecke H, Van Zele T, Bachert C (2005). "Nuevos conocimientos sobre la patología de la poliposis nasal: el papel de los superantígenos y la IgE". Verh K Acad Geneeskd Belg . 67 (5–28): 5–28, discusión 29–32. PMID 15828304.
- ^ Salgado-Pabón W, et al. (2013) Los superantígenos son fundamentales para la endocarditis infecciosa, la sepsis y la lesión renal aguda por Staphylococcus aureus. MBio 4:e00494-00413.
- ^ Erlandsson E, Andersson K, Cavallin A, Nilsson A, et al. (2003). "Identificación de los epítopos antigénicos en las enterotoxinas estafilocócicas A y E y diseño de un superantígeno para la terapia del cáncer humano". J. Mol. Biol . 333 (5): 893–905. doi :10.1016/j.jmb.2003.09.009. PMID 14583188.
- ^ Cleary PP, McLandsborough L, Ikeda L, Cue D, Krawczak J, Lam H (abril de 1998). "La infección intracelular de alta frecuencia y la expresión de la toxina A eritrogénica experimentan una variación de fase en los estreptococos del grupo A M1". Mol. Microbiol . 28 (1): 157–67. doi : 10.1046/j.1365-2958.1998.00786.x . PMID 9593304.
- ^ Bachert C, Gevaert P, van Cauwenberge P (junio de 2002). "Enterotoxinas de Staphylococcus aureus: ¿una clave en la enfermedad de las vías respiratorias?". Alergia . 57 (6): 480–7. doi : 10.1034/j.1398-9995.2002.02156.x . PMID 12028112.
- ^ Hermans, SJ; Baker, HM; Sequeira, RP; Langley, RJ; Baker, EN; Fraser, JD (noviembre de 2012). "Propiedades estructurales y funcionales de la proteína similar a un superantígeno estafilocócico 4". Infección e inmunidad . 80 (11): 4004–13. doi : 10.1128/IAI.00764-12 . PMC 3486064 . PMID 22949551.
- ^ Langley, RJ; Ting, YT; Clow, F; Young, PG; Radcliff, FJ; Choi, JM; Sequeira, RP; Holtfreter, S; Baker, H; Fraser, JD (septiembre de 2017). "La enterotoxina estafilocócica similar a X (SE1X) es un superantígeno único con características funcionales de dos familias principales de factores de virulencia estafilocócica". PLOS Pathogens . 13 (9): e1006549. doi : 10.1371/journal.ppat.1006549 . PMC 5589262 . PMID 28880913.
- ^ Hsiao, Francis C.; Lin, Miao; Tai, Albert; Chen, Gang; Huber, Brigitte T. (15 de agosto de 2006). "Vanguardia: el virus de Epstein-Barr transactiva el superantígeno HERV-K18 mediante acoplamiento al receptor de complemento humano 2 (CD21) en células B primarias". The Journal of Immunology . 177 (4): 2056–2060. doi : 10.4049/jimmunol.177.4.2056 . PMID 16887963.
Rasooly, R., Do, P. y Hernlem, B. (2011) Autopresentación de la enterotoxina estafilocócica A por células T CD4+ de ratón. Open Journal of Immunology, 1, 8-14.
Lectura adicional
- Base de datos web de superantígenos en Birkbeck, Universidad de Londres
- Introducción a los SAgs en la base de datos web Superantigen
- Lista de proteínas superantígenas de UniProt
- Superantígenos en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
