- dióxido de tiourea , un agente reductor utilizado en textiles
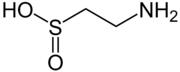
- hipotaurina , un intermediario biosintético
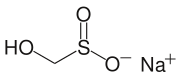
- Rongalita , fuente de "SO 2 2− "
Ácido sulfínico
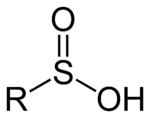
Los ácidos sulfínicos son oxoácidos de azufre con la estructura RSO(OH). En estos compuestos organosulfurados , el azufre es piramidal . [1]
Estructura y propiedades
Los ácidos sulfínicos RSO 2 H son aproximadamente 1000 veces más ácidos que el ácido carboxílico correspondiente RCO 2 H. [ cita requerida ] El azufre es piramidal, en consecuencia los ácidos sulfínicos son quirales. Los ácidos libres son típicamente inestables, desproporcionándose con el ácido sulfónico RSO 3 H y el tiosulfonato RSSO 3 R. [2] : 679 El anhídrido formal de un ácido sulfínico no tiene un átomo de oxígeno que lo una , sino que es una sulfinil sulfona (R–S + (–O − )–S 2+ (–O − ) 2 –R ′ ), [3] y se cree que la desproporción ocurre a través de la fisión de radicales libres de este intermediario. [4]
La alquilación de ácidos sulfínicos puede dar sulfonas o ésteres de sulfinato , dependiendo del disolvente y del reactivo. Los reactivos fuertemente polarizados (por ejemplo, tetrafluoroborato de trimetiloxonio ) dan ésteres, mientras que los reactivos relativamente no polarizados (por ejemplo, un haluro de alquilo o enona ) dan sulfonas. [2] : 682 Los sulfinatos reaccionan con reactivos de Grignard para dar sulfóxidos y experimentan una variante de la condensación de Claisen hacia el mismo fin. [2] : 686
Las sales de cobalto (III) pueden oxidar los ácidos sulfínicos a disulfonas, aunque los rendimientos son solo del 30 al 50 %. [5]
Preparación
Los ácidos sulfínicos se preparan a menudo in situ mediante la acidificación de las sales de sulfinato correspondientes , que suelen ser más robustas que el ácido. Estas sales se generan mediante la reducción de cloruros de sulfonilo con metales, [6] aunque los tiolatos también reducen los tioésteres de sulfonato a un sulfinato y un disulfuro . [2] : 681
Una vía alternativa es la reacción de reactivos de Grignard con dióxido de azufre . Los sulfinatos de metales de transición también se generan mediante la inserción de dióxido de azufre en alquilos metálicos, una reacción que puede realizarse a través de un complejo de dióxido de azufre y metal .
Las sulfonas pueden eliminarse en base, particularmente si está presente un nucleófilo fuerte ; así, por ejemplo, el cianuro de sodio hace que la bis(2-butanona-4-il) sulfona se divida en levulinonitrilo y ácido 3-oxobutano 1-sulfínico: [2] : 681
- SO 2 ((CH 2 ) 2 Ac) 2 + NaCN → NaSO 2 (CH 2 ) 2 Ac + NC(CH 2 ) 2 Ac
Se supone que el nitrilo se forma mediante la adición conjugada de cianuro a la enona correspondiente .
La adición de cloruro de tionilo a un alqueno mediante la técnica de Friedel-Crafts da lugar a un cloruro de α-clorosulfinilo, que normalmente forma un complejo con un ácido de Lewis. Asimismo, un carbanión puede atacar al cloruro de tionilo para dar lugar a un cloruro de sulfinilo. Una hidrólisis cuidadosa da lugar a un ácido sulfínico. [2] : 682, 684 Los cloruros de sulfinilo atacan a los sulfinatos para dar lugar a sulfonas de sulfinilo (anhídridos sulfínicos). [3]
El ácido sulfínico no sustituido, cuando R es el átomo de hidrógeno, es un isómero de mayor energía del ácido sulfoxílico , ambos inestables.
Ejemplos
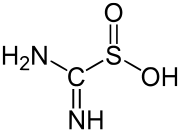
Un ejemplo de un ácido sulfínico simple y bien estudiado es el ácido fenilsulfínico . Un ácido sulfínico comercialmente importante es el dióxido de tiourea , que se prepara mediante la oxidación de tiourea con peróxido de hidrógeno . [2]
- (NH2 ) 2CS + 2H2O2 → ( NH ) ( NH2 ) CSO2H + 2H2O
Otro ácido sulfínico de importancia comercial es el ácido hidroximetilsulfínico, que se emplea habitualmente en forma de sal sódica (HOCH 2 SO 2 Na). Este anión, llamado Rongalita , también es comercialmente útil como agente reductor.
Sulfinatos
La base conjugada de un ácido sulfínico es un anión sulfinato . La enzima cisteína dioxigenasa convierte la cisteína en el sulfinato correspondiente. Un producto de esta reacción catabólica es la hipotaurina del ácido sulfínico . El término sulfinito también describe los ésteres del ácido sulfínico. Los ésteres de sulfinito cíclicos se denominan sultinas .
Referencias
- ^ Saul Patai, ed. (1981). Ácidos sulfínicos, ésteres y derivados . Química de grupos funcionales de PATAI. John Wiley & Sons. doi :10.1002/9780470772270. ISBN 9780470772270.
- ^ abcdefg D. Schubart "Ácidos sulfínicos y derivados" en Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. doi :10.1002/14356007.a25_461
- ^ ab Bredereck, Hellmut; Wagner, Adolfo; Beck, Heinz; Klein, Rainer-Joachim (1960) [2 de julio de 1960]. "Die Struktur der Sulfinsäureanhyride" [La estructura de los anhídridos de ácido sulfínico]. Chemische Berichte (en alemán). 93 (11): 2736–2742. doi :10.1002/cber.19600931145.
- ^ Kice, John L.; Guaraldi, Giancarlo; Venier, Clifford G. (noviembre de 1966). "El mecanismo de la desproporción de los ácidos sulfínicos. Constantes de velocidad y equilibrio para el equilibrio ácido sulfínico-sulfinil sulfona (anhídrido sulfínico)". The Journal of Organic Chemistry . 31 (11): 3561–3567. doi :10.1021/jo01349a021. ISSN 0022-3263.
- ^ Denzer, George C., Jr.; Allen, Paul, Jr.; Conway, Patrick; van der Veen, James M. (octubre de 1966) [17 de marzo de 1966]. "La preparación de α-disulfonas mediante oxidación de cobalto (III)". J. Org. Chem . 31 (10): 3418–3419. doi :10.1021/jo01348a514.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Whitmore, FC; Hamilton, FH (1922). "Ácido p-toluenosulfínico de sodio". 2 : 89. doi :10.15227/orgsyn.002.0089.
{{cite journal}}: Requiere citar revista|journal=( ayuda )
Enlaces externos
- Ácidos sulfínicos+ en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Diagrama en ucalgary.ca
- Diagrama en acdlabs.com