Bomba de solubilidad
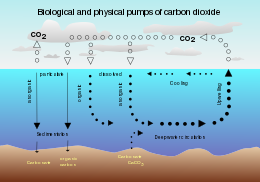
En biogeoquímica oceánica , la bomba de solubilidad es un proceso físico-químico que transporta carbono como carbono inorgánico disuelto (CID) desde la superficie del océano hasta su interior.
Descripción general
| Parte de una serie sobre el |
| Ciclo del carbono |
|---|
 |
La bomba de solubilidad es impulsada por la coincidencia de dos procesos en el océano:
- La solubilidad del dióxido de carbono es una fuerte función inversa de la temperatura del agua de mar (es decir, la solubilidad es mayor en agua más fría).
- La circulación termohalina es impulsada por la formación de aguas profundas en latitudes altas donde el agua de mar suele ser más fría y densa.
Dado que el agua profunda (es decir, el agua de mar en el interior del océano) se forma en las mismas condiciones superficiales que favorecen la solubilidad del dióxido de carbono, contiene una concentración de carbono inorgánico disuelto mayor que la que cabría esperar a partir de las concentraciones superficiales medias. En consecuencia, estos dos procesos actúan juntos para bombear carbono desde la atmósfera hacia el interior del océano.
Una consecuencia de esto es que cuando las aguas profundas afloran en latitudes ecuatoriales más cálidas, liberan una gran cantidad de dióxido de carbono a la atmósfera debido a la menor solubilidad del gas.
La bomba de solubilidad tiene una contraparte biológica conocida como bomba biológica . Para una descripción general de ambas bombas, consulte Raven y Falkowski (1999). [1]
Solubilidad del dióxido de carbono

El dióxido de carbono , al igual que otros gases, es soluble en agua. Sin embargo, a diferencia de muchos otros gases ( por ejemplo, el oxígeno ), reacciona con el agua y forma un equilibrio de varias especies iónicas y no iónicas (conocidas colectivamente como carbono inorgánico disuelto o CID). Estas son dióxido de carbono libre disuelto (CO2 ( aq) ), ácido carbónico (H2CO3 ) , bicarbonato (HCO3− ) y carbonato ( CO32− ) , que interactúan con el agua de la siguiente manera:
El equilibrio de estas especies de carbonato (que en última instancia afecta la solubilidad del dióxido de carbono), depende de factores como el pH , como se muestra en un diagrama de Bjerrum . En el agua de mar, esto está regulado por el equilibrio de carga de una serie de iones positivos (p. ej., Na + , K + , Mg 2+ , Ca 2+ ) y negativos (p. ej., el propio CO 3 2− , Cl − , SO 4 2− , Br − ). Normalmente, el equilibrio de estas especies deja una carga neta positiva. Con respecto al sistema de carbonato, este exceso de carga positiva desplaza el equilibrio de las especies de carbonato hacia iones negativos para compensar. El resultado de lo cual es una concentración reducida de las especies de dióxido de carbono libre y ácido carbónico, lo que a su vez conduce a una absorción oceánica de dióxido de carbono de la atmósfera para restablecer el equilibrio. Por lo tanto, cuanto mayor sea el desequilibrio de carga positiva, mayor será la solubilidad del dióxido de carbono. En términos de química de carbonatos, este desequilibrio se conoce como alcalinidad .
En términos de medición, cuatro parámetros básicos son de importancia clave: carbono inorgánico total (TIC, T CO 2 o C T ), alcalinidad total (T ALK o A T ), pH y pCO 2 . La medición de dos de estos parámetros permite la determinación de una amplia gama de especies dependientes del pH (incluidas las especies mencionadas anteriormente). Este equilibrio puede verse alterado por varios procesos. Por ejemplo, el flujo aire-mar de CO 2 , la disolución / precipitación de CaCO 3 o la actividad biológica como la fotosíntesis / respiración . Cada uno de estos tiene diferentes efectos en cada uno de los cuatro parámetros básicos, y juntos ejercen fuertes influencias en los ciclos globales. La carga neta y local de los océanos permanece neutra durante cualquier proceso químico.
Cambios antropogénicos

La combustión de combustibles fósiles , los cambios en el uso de la tierra y la producción de cemento han provocado un flujo de CO2 hacia la atmósfera. En la actualidad, se cree que alrededor de un tercio (aproximadamente 2 gigatoneladas de carbono por año) [2] [3] de las emisiones antropogénicas de CO2 ingresan al océano. La bomba de solubilidad es el principal mecanismo que impulsa este flujo, con la consecuencia de que el CO2 antropogénico está llegando al interior del océano a través de sitios de formación de aguas profundas en latitudes altas (en particular el Atlántico Norte). En última instancia, la mayor parte del CO2 emitido por las actividades humanas se disolverá en el océano, [4] sin embargo, la velocidad a la que el océano lo absorberá en el futuro es menos segura.
En un estudio del ciclo del carbono hasta finales del siglo XXI, Cox et al. (2000) [5] predijeron que la tasa de absorción de CO 2 comenzará a saturarse a una tasa máxima de 5 gigatoneladas de carbono por año para 2100. Esto se debió en parte a las no linealidades en el sistema de carbonato del agua de mar, pero también al cambio climático . El calentamiento del océano disminuye la solubilidad del CO 2 en el agua de mar, lo que ralentiza la respuesta del océano a las emisiones. El calentamiento también actúa para aumentar la estratificación del océano , aislando el océano superficial de las aguas más profundas. Además, los cambios en la circulación termohalina del océano (específicamente la ralentización) [6] pueden actuar para disminuir el transporte de CO 2 disuelto en el océano profundo. Sin embargo, la magnitud de estos procesos aún es incierta, lo que impide buenas estimaciones a largo plazo del destino de la bomba de solubilidad.
Si bien la absorción oceánica del CO2 antropogénico de la atmósfera actúa para disminuir el cambio climático, causa la acidificación de los océanos , lo que se cree que tendrá consecuencias negativas para los ecosistemas marinos. [7]
Véase también
- Alcalinidad
- Bomba biológica
- Bomba de plataforma continental
- Acidificación de los océanos
- Circulación termohalina
- Carbono inorgánico total
Referencias
- ^ Raven, JA y PG Falkowski (1999). Sumideros oceánicos de CO2 atmosférico. Plant Cell Environ. 22 , 741-755.
- ^ Takahashi, Taro; Sutherland, Stewart C.; Sweeney, Colm; Poisson, Alain; Metzl, Nicolas; Tilbrook, Bronte; Bates, Nicolas; Wanninkhof, Rik; Feely, Richard A.; Sabine, Christopher; Olafsson, Jon; Nojiri, Yukihiro (2002). "Flujo global de CO2 mar-aire basado en la pCO2 climatológica superficial del océano y efectos biológicos y de temperatura estacionales". Investigación en aguas profundas, parte II: estudios temáticos en oceanografía . 49 (9–10): 1601–1622. Código Bibliográfico :2002DSRII..49.1601T. doi :10.1016/S0967-0645(02)00003-6.
- ^ Orr, JC, E. Maier-Reimer, U. Mikolajewicz, P. Monfray, JL Sarmiento, JR Toggweiler, NK Taylor, J. Palmer, N. Gruber, CL Sabine, C. Le Quéré, RM Key y J. Boutin (2001). Estimaciones de la absorción antropogénica de carbono a partir de cuatro modelos oceánicos globales tridimensionales. Global Biogeochem. Cycles 15 , 43-60.
- ^ Archer, D. (2005). Destino del CO2 de los combustibles fósiles en el tiempo geológico. J. Geophys. Res. , 110 , doi :10.1029/2004JC002625.
- ^ Cox, PM, Betts, RA, Jones, CD, Spall, SA y Totterdell, IJ (2000). Aceleración del calentamiento global debido a la retroalimentación del ciclo del carbono en un modelo climático acoplado. Nature , 408 , 184-187.
- ^ Bryden, HL, Longworth, HR y Cunningham, SA (2005). Desaceleración de la circulación meridional atlántica a 25° N. Nature , 438 , 655-657.
- ^ Orr, JC et al. (2005). Acidificación oceánica antropogénica durante el siglo XXI y su impacto en los organismos calcificadores. Nature 437 , 681-686.

