Metilación del ADN

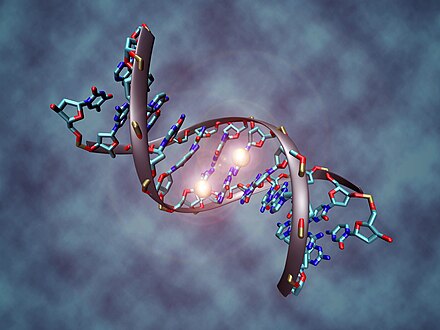
La metilación del ADN es un proceso biológico por el cual se añaden grupos metilo a la molécula de ADN . La metilación puede cambiar la actividad de un segmento de ADN sin cambiar la secuencia. Cuando se encuentra en un promotor de genes , la metilación del ADN normalmente actúa para reprimir la transcripción de genes . En los mamíferos, la metilación del ADN es esencial para el desarrollo normal y está asociada con una serie de procesos clave, entre ellos la impronta genómica , la inactivación del cromosoma X , la represión de elementos transponibles , el envejecimiento y la carcinogénesis .
A partir de 2016 se han encontrado dos nucleobases en las que se produce la metilación enzimática natural del ADN: la adenina y la citosina . Las bases modificadas son la N 6 -metiladenina, [1] la 5-metilcitosina [2] y la N 4 -metilcitosina. [3]
| Base sin modificar |  | 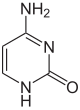 | ||||||
| Adenina, A | Citosina, C | |||||||
| Formularios modificados |  | 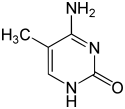 | 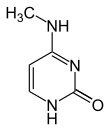 | |||||
| N6 - Metiladenina, 6 mA | 5-Metilcitosina, 5mC | N 4 -Metilcitosina, 4mC | ||||||
La metilación de citosina está muy extendida tanto en eucariotas como en procariotas , aunque la tasa de metilación del ADN de la citosina puede diferir en gran medida entre especies: el 14% de las citosinas están metiladas en Arabidopsis thaliana , del 4% al 8% en Physarum , [4] el 7,6% en Mus musculus , el 2,3% en Escherichia coli , el 0,03% en Drosophila ; la metilación es esencialmente indetectable en Dictyostelium ; [5] [6] y prácticamente ausente (del 0,0002 al 0,0003%) en Caenorhabditis [7] o en hongos como Saccharomyces cerevisiae y S. pombe (pero no en N. crassa ). [8] [9] : 3699 La metilación de adenina se ha observado en ADN bacteriano, vegetal y recientemente en ADN de mamíferos, [10] [11] pero ha recibido considerablemente menos atención.
La metilación de la citosina para formar 5-metilcitosina ocurre en la misma posición 5 en el anillo de pirimidina donde se encuentra el grupo metilo de la base de ADN timina ; la misma posición distingue a la timina de la base de ARN análoga uracilo , que no tiene grupo metilo. La desaminación espontánea de la 5-metilcitosina la convierte en timina. Esto da como resultado un desajuste T:G. Los mecanismos de reparación luego lo corrigen de nuevo al par C:G original; alternativamente, pueden sustituir A por G, convirtiendo el par C:G original en un par T:A, cambiando efectivamente una base e introduciendo una mutación. Esta base mal incorporada no se corregirá durante la replicación del ADN ya que la timina es una base de ADN. Si el desajuste no se repara y la célula entra en el ciclo celular, la hebra que lleva la T se complementará con una A en una de las células hijas, de modo que la mutación se vuelve permanente. El uso casi universal de timina exclusivamente en el ADN y de uracilo exclusivamente en el ARN puede haber evolucionado como un mecanismo de control de errores, para facilitar la eliminación de uracilos generados por la desaminación espontánea de la citosina. [12] Se ha pensado que la metilación del ADN, así como muchas de sus metiltransferasas de ADN contemporáneas, evolucionaron a partir de la actividad de metilación del ARN primitivo del mundo temprano y está respaldada por varias líneas de evidencia. [13]
En plantas y otros organismos, la metilación del ADN se encuentra en tres contextos de secuencia diferentes: CG (o CpG ), CHG o CHH (donde H corresponde a A, T o C). Sin embargo, en los mamíferos, la metilación del ADN se encuentra casi exclusivamente en dinucleótidos CpG, y las citosinas de ambas cadenas suelen estar metiladas. Sin embargo, la metilación no CpG se puede observar en células madre embrionarias , [14] [15] [16] y también se ha indicado en el desarrollo neuronal . [17] Además, la metilación no CpG también se ha observado en células progenitoras hematopoyéticas , y se produjo principalmente en un contexto de secuencia CpApC. [18]
Función conservada de la metilación del ADN

El panorama de metilación del ADN de los vertebrados es muy particular en comparación con otros organismos. En los mamíferos, alrededor del 75% de los dinucleótidos CpG están metilados en las células somáticas [19] y la metilación del ADN aparece como un estado predeterminado que debe excluirse específicamente de ubicaciones definidas [16] [20] Por el contrario, el genoma de la mayoría de las plantas, invertebrados, hongos o protistos muestra patrones de metilación en "mosaico", donde solo se seleccionan elementos genómicos específicos, y se caracterizan por la alternancia de dominios metilados y no metilados [21] [22]

La alta metilación de CpG en los genomas de mamíferos tiene un costo evolutivo porque aumenta la frecuencia de mutaciones espontáneas. La pérdida de grupos amino ocurre con una alta frecuencia en las citosinas, con diferentes consecuencias según su metilación. Los residuos C metilados se desaminan espontáneamente para formar residuos T con el tiempo; por lo tanto, los dinucleótidos CpG se desaminan constantemente para formar dinucleótidos TpG, lo que se evidencia por la subrepresentación de dinucleótidos CpG en el genoma humano (ocurren solo en el 21% de la frecuencia esperada) [23] . (Por otro lado, la desaminación espontánea de residuos C no metilados da lugar a residuos U, un cambio que es rápidamente reconocido y reparado por la célula).
Islas CpG
En los mamíferos, la única excepción para esta disminución global de CpG reside en una categoría específica de secuencias ricas en GC y CpG denominadas islas CpG que generalmente no están metiladas y, por lo tanto, conservan el contenido esperado de CpG. [24] Las islas CpG generalmente se definen como regiones con: 1) una longitud mayor a 200 pb, 2) un contenido de G+C mayor al 50%, 3) una relación de CpG observado a esperado mayor a 0,6, aunque a veces se utilizan otras definiciones. [25] Excluyendo secuencias repetidas, hay alrededor de 25.000 islas CpG en el genoma humano, el 75% de las cuales tienen menos de 850 pb de longitud. [23] Son unidades reguladoras importantes y alrededor del 50% de las islas CpG se encuentran en regiones promotoras de genes, mientras que otro 25% se encuentra en cuerpos de genes, que a menudo sirven como promotores alternativos. Recíprocamente, alrededor del 60-70% de los genes humanos tienen una isla CpG en su región promotora. [26] [27] La mayoría de las islas CpG no están metiladas de manera constitutiva y están enriquecidas para la modificación permisiva de la cromatina , como la metilación de H3K4 . En los tejidos somáticos, solo el 10% de las islas CpG están metiladas, y la mayoría de ellas se encuentran en regiones intergénicas e intragénicas. [ cita requerida ]
Represión de promotores densos en CpG
La metilación del ADN probablemente estuvo presente en algún grado en los ancestros eucariotas más tempranos. En prácticamente todos los organismos analizados, la metilación en las regiones promotoras se correlaciona negativamente con la expresión génica. [21] [28] Los promotores densos en CpG de genes transcritos activamente nunca están metilados, pero, recíprocamente, los genes transcripcionalmente silenciosos no necesariamente llevan un promotor metilado. En ratones y humanos, alrededor del 60-70% de los genes tienen una isla CpG en su región promotora y la mayoría de estas islas CpG permanecen sin metilar independientemente de la actividad transcripcional del gen, tanto en tipos de células diferenciadas como indiferenciadas. [29] [30] Cabe destacar que, mientras que la metilación del ADN de las islas CpG está inequívocamente vinculada con la represión transcripcional, la función de la metilación del ADN en promotores pobres en CG sigue sin estar clara; aunque hay poca evidencia de que podría ser funcionalmente relevante. [31]
La metilación del ADN puede afectar la transcripción de genes de dos maneras. En primer lugar, la metilación del ADN en sí puede impedir físicamente la unión de las proteínas transcripcionales al gen [32] y, en segundo lugar, y probablemente más importante, el ADN metilado puede estar unido por proteínas conocidas como proteínas del dominio de unión a metil-CpG (MBD). Las proteínas MBD luego reclutan proteínas adicionales al locus, como histonas desacetilasas y otras proteínas de remodelación de la cromatina que pueden modificar las histonas , formando así una cromatina compacta e inactiva, denominada heterocromatina . Este vínculo entre la metilación del ADN y la estructura de la cromatina es muy importante. En particular, la pérdida de la proteína 2 de unión a metil-CpG (MeCP2) se ha implicado en el síndrome de Rett ; y la proteína 2 del dominio de unión a metil-CpG (MBD2) media el silenciamiento transcripcional de genes hipermetilados en el "cáncer". [ cita requerida ]
Represión de elementos transponibles
La metilación del ADN es un potente represor transcripcional, al menos en contextos densos de CpG. La represión transcripcional de genes codificadores de proteínas parece limitada esencialmente a clases muy específicas de genes que necesitan ser silenciados permanentemente y en casi todos los tejidos. Si bien la metilación del ADN no tiene la flexibilidad requerida para el ajuste fino de la regulación génica, su estabilidad es perfecta para asegurar el silenciamiento permanente de los elementos transponibles . [33] El control de transposones es una de las funciones más antiguas de la metilación del ADN que comparten animales, plantas y múltiples protistos. [34] Incluso se sugiere que la metilación del ADN evolucionó precisamente para este propósito. [35]
Expansión del genoma
Se sabe que la metilación de elementos transponibles en el ADN está relacionada con la expansión del genoma. Sin embargo, el factor evolutivo que impulsa la expansión del genoma sigue siendo desconocido. Existe una clara correlación entre el tamaño del genoma y el CpG, lo que sugiere que la metilación de elementos transponibles en el ADN condujo a un aumento notable de la masa del ADN. [36]
Metilación del cuerpo génico de genes altamente transcritos
Una función que parece incluso más conservada que el silenciamiento de transposones se correlaciona positivamente con la expresión génica. En casi todas las especies donde hay metilación del ADN, la metilación del ADN está especialmente enriquecida en el cuerpo de genes altamente transcritos. [21] [28] La función de la metilación del cuerpo del gen no se entiende bien. Un conjunto de evidencias sugiere que podría regular el empalme [37] y suprimir la actividad de las unidades transcripcionales intragénicas (promotores crípticos o elementos transponibles). [38] La metilación del cuerpo del gen parece estar estrechamente vinculada a la metilación de H3K36. En levaduras y mamíferos, la metilación de H3K36 está altamente enriquecida en el cuerpo de genes altamente transcritos. Al menos en levaduras, H3K36me3 recluta enzimas como las histonas desacetilasas para condensar la cromatina y prevenir la activación de los sitios de inicio crípticos. [39] En los mamíferos, el dominio PWWP de DNMT3a y DNMT3b se une a H3K36me3 y las dos enzimas se reclutan al cuerpo de genes transcritos activamente. [ cita requerida ]
En los mamíferos

Durante el desarrollo embrionario
Los patrones de metilación del ADN se borran en gran medida y luego se restablecen entre generaciones en los mamíferos. Casi todas las metilaciones de los padres se borran, primero durante la gametogénesis y nuevamente en la embriogénesis temprana , con desmetilación y remetilación ocurriendo cada vez. La desmetilación en la embriogénesis temprana ocurre en el período de preimplantación en dos etapas: inicialmente en el cigoto , luego durante los primeros ciclos de replicación embrionaria de mórula y blástula . Luego tiene lugar una ola de metilación durante la etapa de implantación del embrión, con islas CpG protegidas de la metilación. Esto da como resultado una represión global y permite que los genes de mantenimiento se expresen en todas las células. En la etapa posterior a la implantación, los patrones de metilación son específicos de la etapa y el tejido, con cambios que definirían cada tipo de célula individual que duran de manera estable durante un largo período. [40] Los estudios sobre yemas de las extremidades de ratas durante la embriogénesis han ilustrado aún más la naturaleza dinámica de la metilación del ADN en el desarrollo. En este contexto, se observaron variaciones en la metilación global del ADN en diferentes etapas de desarrollo y condiciones de cultivo, lo que destaca la intrincada regulación de la metilación durante la organogénesis y sus posibles implicaciones para las estrategias de medicina regenerativa. [41]
Si bien la metilación del ADN no es necesaria per se para el silenciamiento transcripcional, se cree que representa un estado "bloqueado" que definitivamente inactiva la transcripción. En particular, la metilación del ADN parece crítica para el mantenimiento del silenciamiento monoalélico en el contexto de la impronta genómica y la inactivación del cromosoma X. [42] [43] En estos casos, los alelos expresados y silenciosos difieren por su estado de metilación, y la pérdida de la metilación del ADN da como resultado la pérdida de la impronta y la reexpresión de Xist en las células somáticas. Durante el desarrollo embrionario, pocos genes cambian su estado de metilación, con la importante excepción de muchos genes expresados específicamente en la línea germinal. [44] La metilación del ADN parece absolutamente necesaria en las células diferenciadas , ya que la inactivación de cualquiera de las tres metiltransferasas de ADN competentes da como resultado letalidad embrionaria o posparto. En cambio, la metilación del ADN es prescindible en tipos celulares indiferenciados, como la masa celular interna del blastocisto, las células germinales primordiales o las células madre embrionarias. Dado que la metilación del ADN parece regular directamente sólo un número limitado de genes, sigue siendo una incógnita cómo la ausencia de metilación del ADN causa con precisión la muerte de células diferenciadas.
Debido al fenómeno de la impronta genómica , los genomas maternos y paternos están marcados de forma diferencial y deben reprogramarse adecuadamente cada vez que pasan por la línea germinal. Por lo tanto, durante la gametogénesis , las células germinales primordiales deben tener sus patrones de metilación de ADN biparental originales borrados y restablecidos en función del sexo del progenitor transmisor. Después de la fertilización, los genomas paterno y materno se desmetilan y remetilan una vez más (excepto las regiones metiladas de forma diferencial asociadas con los genes impresos). Esta reprogramación es probablemente necesaria para la totipotencia del embrión recién formado y el borrado de los cambios epigenéticos adquiridos. [45]
En el cáncer
En muchos procesos patológicos, como el cáncer , las islas CpG promotoras de genes adquieren una hipermetilación anormal, lo que da como resultado un silenciamiento transcripcional que puede ser heredado por las células hijas después de la división celular. [46] Las alteraciones de la metilación del ADN se han reconocido como un componente importante del desarrollo del cáncer. La hipometilación, en general, surge antes y está vinculada a la inestabilidad cromosómica y la pérdida de la impronta, mientras que la hipermetilación está asociada con los promotores y puede surgir de forma secundaria al silenciamiento de genes (supresores de oncogenes), pero podría ser un objetivo para la terapia epigenética . [47] En contextos de desarrollo, los cambios dinámicos en los patrones de metilación del ADN también tienen implicaciones significativas. Por ejemplo, en los brotes de las extremidades de ratas, los cambios en el estado de metilación se asociaron con diferentes etapas de la condrogénesis, lo que sugiere un vínculo potencial entre la metilación del ADN y la progresión de ciertos procesos de desarrollo. [41]
La hipometilación global también se ha visto implicada en el desarrollo y progresión del cáncer a través de diferentes mecanismos. [48] Normalmente, hay hipermetilación de genes supresores de tumores e hipometilación de oncogenes . [49]
En general, durante la progresión hacia el cáncer, cientos de genes se silencian o se activan . Aunque el silenciamiento de algunos genes en los cánceres ocurre por mutación, una gran proporción del silenciamiento de genes cancerígenos es resultado de una metilación alterada del ADN (ver Metilación del ADN en el cáncer ). La metilación del ADN que causa el silenciamiento en el cáncer ocurre típicamente en múltiples sitios CpG en las islas CpG que están presentes en los promotores de los genes codificadores de proteínas. [ cita requerida ]
Las expresiones alteradas de microARN también silencian o activan muchos genes en la progresión hacia el cáncer (ver microARN en el cáncer ). La expresión alterada de microARN ocurre a través de la hiper/hipometilación de sitios CpG en islas CpG en promotores que controlan la transcripción de los microARN .
El silenciamiento de los genes de reparación del ADN a través de la metilación de las islas CpG en sus promotores parece ser especialmente importante en la progresión hacia el cáncer (véase metilación de los genes de reparación del ADN en el cáncer ). [ cita requerida ]
En la aterosclerosis
Las modificaciones epigenéticas, como la metilación del ADN, se han relacionado con enfermedades cardiovasculares, incluida la aterosclerosis . En modelos animales de aterosclerosis, el tejido vascular, así como las células sanguíneas, como las células sanguíneas mononucleares, presentan una hipometilación global con áreas de hipermetilación específicas de genes. Los polimorfismos de metilación del ADN pueden utilizarse como un biomarcador temprano de la aterosclerosis, ya que están presentes antes de que se observen las lesiones, lo que puede proporcionar una herramienta temprana para la detección y la prevención de riesgos. [50]
Dos de los tipos de células objetivo de los polimorfismos de metilación del ADN son los monocitos y los linfocitos, que experimentan una hipometilación general. Un mecanismo propuesto detrás de esta hipometilación global son los niveles elevados de homocisteína que causan hiperhomocisteinemia , un factor de riesgo conocido para la enfermedad cardiovascular. Los niveles plasmáticos altos de homocisteína inhiben las metiltransferasas del ADN, lo que causa hipometilación. La hipometilación del ADN afecta a los genes que alteran la proliferación de células musculares lisas, causan disfunción de las células endoteliales y aumentan los mediadores inflamatorios, todos los cuales son críticos en la formación de lesiones ateroscleróticas. [51] Los niveles altos de homocisteína también resultan en la hipermetilación de las islas CpG en la región promotora del gen del receptor de estrógeno alfa (ERα), causando su regulación negativa. [52] ERα protege contra la aterosclerosis debido a su acción como supresor del crecimiento, haciendo que las células musculares lisas permanezcan en un estado inactivo. [53] La hipermetilación del promotor ERα permite que las células musculares lisas íntimas proliferen excesivamente y contribuyan al desarrollo de la lesión aterosclerótica. [54]
Otro gen que experimenta un cambio en el estado de metilación en la aterosclerosis es el transportador de monocarboxilato (MCT3), que produce una proteína responsable del transporte de lactato y otros cuerpos cetónicos fuera de muchos tipos de células, incluidas las células musculares lisas vasculares. En pacientes con aterosclerosis, hay un aumento en la metilación de las islas CpG en el exón 2, lo que disminuye la expresión de la proteína MCT3. La regulación negativa de MCT3 altera el transporte de lactato y aumenta significativamente la proliferación de células musculares lisas, lo que contribuye aún más a la lesión aterosclerótica. Se demostró que un experimento ex vivo utilizando el agente desmetilante Decitabina (5-aza-2-desoxicitidina) inducía la expresión de MCT3 de una manera dependiente de la dosis, ya que todos los sitios hipermetilados en la isla CpG del exón 2 se desmetilaron después del tratamiento. Esto puede servir como un nuevo agente terapéutico para tratar la aterosclerosis, aunque hasta ahora no se han realizado estudios en humanos. [55]
En caso de insuficiencia cardíaca
Además de la aterosclerosis descrita anteriormente, se han identificado cambios epigenéticos específicos en el corazón humano con insuficiencia cardíaca. Esto puede variar según la etiología de la enfermedad. Por ejemplo, en la insuficiencia cardíaca isquémica, los cambios en la metilación del ADN se han relacionado con cambios en la expresión génica que pueden dirigir la expresión génica asociada con los cambios en el metabolismo cardíaco que se sabe que ocurren. [56] Se deben explorar otras formas de insuficiencia cardíaca (por ejemplo, miocardiopatía diabética) y comorbilidades (por ejemplo, obesidad) para ver cuán comunes son estos mecanismos. Lo más sorprendente es que en el corazón humano con insuficiencia cardíaca estos cambios en la metilación del ADN están asociados con el estado racial y socioeconómico, que afectan aún más la forma en que se altera la expresión génica, [57] y pueden influir en cómo se debe tratar la insuficiencia cardíaca del individuo.
En el envejecimiento
En los seres humanos y otros mamíferos, los niveles de metilación del ADN se pueden utilizar para estimar con precisión la edad de los tejidos y los tipos de células, formando un reloj epigenético preciso . [58]
Un estudio longitudinal de niños gemelos mostró que, entre los 5 y los 10 años, hubo divergencia de los patrones de metilación debido a influencias ambientales más que genéticas. [59] Hay una pérdida global de metilación del ADN durante el envejecimiento. [49]
En un estudio que analizó los metilomas completos del ADN de las células T CD4 + en un recién nacido, un individuo de 26 años y un individuo de 103 años se observó que la pérdida de metilación es proporcional a la edad. [60] Los CpG hipometilados observados en los ADN de los centenarios en comparación con los neonatos cubrieron todos los compartimentos genómicos (promotores, regiones intergénicas , intrónicas y exónicas ). [60] Sin embargo, algunos genes se hipermetilan con la edad, incluidos los genes para el receptor de estrógeno , p16 , factor de crecimiento similar a la insulina 2 , [49] ELOVL2 [61] y FHL2 [62]
En ejercicio
Se ha demostrado que el ejercicio de alta intensidad produce una reducción de la metilación del ADN en el músculo esquelético. [63] La metilación del promotor PGC-1α y PDK4 se redujo inmediatamente después del ejercicio de alta intensidad, mientras que la metilación de PPAR-γ no se redujo hasta tres horas después del ejercicio. [63] Al mismo tiempo, seis meses de ejercicio en hombres de mediana edad previamente sedentarios dieron como resultado un aumento de la metilación en el tejido adiposo . [64] Un estudio mostró un posible aumento de la metilación del ADN genómico global de los glóbulos blancos con más actividad física en no hispanos. [65]
En la diferenciación de células B
Un estudio que investigó el metiloma de las células B a lo largo de su ciclo de diferenciación, utilizando la secuenciación de bisulfito de todo el genoma (WGBS), mostró que existe una hipometilación desde las etapas más tempranas hasta las etapas más diferenciadas. La mayor diferencia de metilación se da entre las etapas de las células B del centro germinal y las células B de memoria. Además, este estudio mostró que existe una similitud entre los tumores de células B y las células B de larga vida en sus firmas de metilación del ADN. [18]
En el cerebro
Dos revisiones resumen la evidencia de que las alteraciones de la metilación del ADN en las neuronas cerebrales son importantes en el aprendizaje y la memoria. [66] [67] El condicionamiento del miedo contextual (una forma de aprendizaje asociativo) en animales, como ratones y ratas, es rápido y es extremadamente robusto en la creación de recuerdos. [68] En ratones [69] y en ratas [70] el condicionamiento del miedo contextual, dentro de 1-24 horas, se asocia con metilaciones alteradas de varios miles de citosinas del ADN en genes de neuronas del hipocampo . Veinticuatro horas después del condicionamiento del miedo contextual, el 9,2% de los genes en las neuronas del hipocampo de la rata están metilados diferencialmente. [70] En ratones [69] , cuando se examinó a las cuatro semanas después del condicionamiento, las metilaciones y desmetilaciones del hipocampo se habían restablecido a las condiciones ingenuas originales. El hipocampo es necesario para formar recuerdos, pero los recuerdos no se almacenan allí. En el caso de estos ratones, cuatro semanas después del condicionamiento contextual del miedo, se produjeron metilaciones y desmetilaciones de CpG diferenciales sustanciales en las neuronas corticales durante el mantenimiento de la memoria, y había 1223 genes metilados diferencialmente en su corteza cingulada anterior. [69] En 2022 se resumieron los mecanismos que guían las nuevas metilaciones y desmetilaciones de ADN en el hipocampo durante el establecimiento de la memoria. [71] Esa revisión también indicó los mecanismos por los cuales los nuevos patrones de metilación dieron lugar a nuevos patrones de expresión de ARN mensajero . Estos nuevos ARN mensajeros fueron luego transportados por partículas RNP (gránulos neuronales) a las sinapsis de las neuronas, donde podrían traducirse en proteínas. [71] Los cambios activos en la metilación y desmetilación del ADN neuronal parecen actuar como controladores del escalamiento sináptico y el tráfico de receptores de glutamato en el aprendizaje y la formación de la memoria . [66]
Metiltransferasas de ADN (en mamíferos)

En las células de mamíferos, la metilación del ADN ocurre principalmente en la posición C5 de los dinucleótidos CpG y se lleva a cabo mediante dos clases generales de actividades enzimáticas: metilación de mantenimiento y metilación de novo . [72]
La actividad de metilación de mantenimiento es necesaria para preservar la metilación del ADN después de cada ciclo de replicación del ADN celular. Sin la metiltransferasa del ADN (DNMT), la maquinaria de replicación en sí misma produciría cadenas hijas que no están metiladas y, con el tiempo, conducirían a una desmetilación pasiva. La DNMT1 es la metiltransferasa de mantenimiento propuesta que es responsable de copiar los patrones de metilación del ADN en las cadenas hijas durante la replicación del ADN. Los modelos de ratón con ambas copias de DNMT1 eliminadas son letales embrionariamente aproximadamente en el día 9, debido al requisito de la actividad de DNMT1 para el desarrollo en células de mamíferos. [ cita requerida ]
Se cree que DNMT3a y DNMT3b son las metiltransferasas de novo que establecen los patrones de metilación del ADN en las primeras etapas del desarrollo. DNMT3L es una proteína homóloga a las otras DNMT3 pero que no tiene actividad catalítica. En cambio, DNMT3L ayuda a las metiltransferasas de novo aumentando su capacidad de unirse al ADN y estimulando su actividad. Los ratones y las ratas tienen una tercera enzima metiltransferasa de novo funcional llamada DNMT3C, que evolucionó como un parálogo de Dnmt3b por duplicación en tándem en el ancestro común de los roedores Muroidea. DNMT3C cataliza la metilación de los promotores de elementos transponibles durante la espermatogénesis temprana, una actividad que se ha demostrado que es esencial para su represión epigenética y la fertilidad masculina. [73] [74] Aún no está claro si en otros mamíferos que no tienen DNMT3C (como los humanos) dependen de DNMT3B o DNMT3A para la metilación de novo de elementos transponibles en la línea germinal. Finalmente, DNMT2 (TRDMT1) ha sido identificada como un homólogo de la metiltransferasa de ADN, que contiene los 10 motivos de secuencia comunes a todas las metiltransferasas de ADN; sin embargo, DNMT2 (TRDMT1) no metila el ADN sino que metila la citosina-38 en el bucle anticodón del ARN de transferencia de ácido aspártico. [75]
Dado que muchos genes supresores de tumores son silenciados por la metilación del ADN durante la carcinogénesis , ha habido intentos de reexpresar estos genes inhibiendo los DNMT. La 5-aza-2'-desoxicitidina ( decitabina ) es un análogo de nucleósido que inhibe los DNMT atrapándolos en un complejo covalente en el ADN al evitar el paso de eliminación β de la catálisis, lo que resulta en la degradación de las enzimas. Sin embargo, para que la decitabina sea activa, debe incorporarse al genoma de la célula, lo que puede causar mutaciones en las células hijas si la célula no muere. Además, la decitabina es tóxica para la médula ósea, lo que limita el tamaño de su ventana terapéutica. Estos escollos han llevado al desarrollo de terapias de ARN antisentido que se dirigen a los DNMT degradando sus ARNm y evitando su traducción . Sin embargo, actualmente no está claro si la diana DNMT1 por sí sola es suficiente para reactivar los genes supresores de tumores silenciados por la metilación del ADN. [ cita requerida ]
En las plantas
Se han logrado avances significativos en la comprensión de la metilación del ADN en la planta modelo Arabidopsis thaliana . La metilación del ADN en plantas difiere de la de los mamíferos: mientras que la metilación del ADN en mamíferos ocurre principalmente en el nucleótido citosina en un sitio CpG , en plantas la citosina puede metilarse en sitios CpG, CpHpG y CpHpH, donde H representa cualquier nucleótido pero no guanina. [76] En general, el ADN de Arabidopsis está altamente metilado, el análisis de espectrometría de masas estimó que el 14% de las citosinas están modificadas. [9] : resumen Más tarde, los datos de secuenciación de bisulfito estimaron que alrededor del 25% de los sitios CG de Arabidopsis están metilados, pero estos niveles varían según la ubicación geográfica de las accesiones de Arabidopsis (las plantas en el norte están más metiladas que las accesiones del sur). [77]
Las principales enzimas metiltransferasas de ADN de Arabidopsis , que transfieren y unen covalentemente grupos metilo al ADN, son DRM2, MET1 y CMT3. Tanto las proteínas DRM2 como MET1 comparten una homología significativa con las metiltransferasas de mamíferos DNMT3 y DNMT1, respectivamente, mientras que la proteína CMT3 es exclusiva del reino vegetal. Actualmente existen dos clases de metiltransferasas de ADN: 1) la clase de novo o enzimas que crean nuevas marcas de metilación en el ADN; 2) una clase de mantenimiento que reconoce las marcas de metilación en la cadena parental de ADN y transfiere nueva metilación a las cadenas hijas después de la replicación del ADN. DRM2 es la única enzima que se ha implicado como una metiltransferasa de ADN de novo . También se ha demostrado que DRM2, junto con MET1 y CMT3, está involucrada en el mantenimiento de las marcas de metilación a través de la replicación del ADN. [78] Otras metiltransferasas de ADN se expresan en plantas pero no tienen una función conocida (véase la base de datos de cromatina).
Los niveles de metilación del ADN en todo el genoma varían ampliamente entre especies de plantas, y las citosinas de Arabidopsis tienden a estar menos densamente metiladas que las de otras plantas. Por ejemplo, aproximadamente el 92,5 % de las citosinas CpG están metiladas en Beta vulgaris . [79] Los patrones de metilación también difieren entre contextos de secuencias de citosinas; universalmente, la metilación de CpG es mayor que la de CHG y CHH, y la metilación de CpG se puede encontrar tanto en genes activos como en elementos transponibles, mientras que CHG y CHH suelen relegarse a elementos transponibles silenciados. [80] [76]
No está claro cómo la célula determina las ubicaciones de la metilación de ADN de novo , pero la evidencia sugiere que para muchas (aunque no todas) ubicaciones, está involucrada la metilación de ADN dirigida por ARN (RdDM). En RdDM, se producen transcripciones de ARN específicas a partir de una plantilla de ADN genómico, y este ARN forma estructuras secundarias llamadas moléculas de ARN bicatenario. [81] Los ARN bicatenarios, a través de las vías de ARN interferente pequeño ( siRNA ) o microARN ( miRNA ), dirigen la metilación de ADN de novo de la ubicación genómica original que produjo el ARN. [81] Se cree que este tipo de mecanismo es importante en la defensa celular contra virus de ARN y/o transposones , los cuales a menudo forman un ARN bicatenario que puede ser mutagénico para el genoma del huésped. Al metilar sus ubicaciones genómicas, a través de un mecanismo aún poco comprendido, se desactivan y ya no están activos en la célula, protegiendo al genoma de su efecto mutagénico. Recientemente, se ha descrito que la metilación del ADN es el principal determinante de la formación de cultivos embriogénicos a partir de explantos en plantas leñosas y se considera el principal mecanismo que explica la pobre respuesta de los explantos maduros a la embriogénesis somática en las plantas (Isah 2016). [ cita requerida ]
En los insectos
Diversos órdenes de insectos muestran patrones variados de metilación del ADN, desde niveles casi indetectables en moscas hasta niveles bajos en mariposas y más altos en chinches verdaderas y algunas cucarachas (hasta el 14% de todos los sitios CG en Blattella asahinai ). [82]
Se ha descubierto la metilación funcional del ADN en las abejas melíferas. [83] [84] Las marcas de metilación del ADN se encuentran principalmente en el cuerpo del gen, y las opiniones actuales sobre la función de la metilación del ADN son la regulación genética a través del empalme alternativo [85].
Los niveles de metilación del ADN en Drosophila melanogaster son casi indetectables. [86] Los métodos sensibles aplicados al ADN de Drosophila sugieren niveles en el rango de 0,1-0,3% de la citosina total. [87] Un estudio de 2014 encontró que el bajo nivel de metilación en moscas de la fruta apareció "en motivos cortos específicos y es independiente de la actividad de DNMT2". [88] Además, los enfoques de espectrometría de masas altamente sensibles, [89] ahora han demostrado la presencia de niveles bajos (0,07%) pero significativos de metilación de adenina durante las primeras etapas de la embriogénesis de Drosophila.
En hongos
Muchos hongos tienen niveles bajos (0,1 a 0,5%) de metilación de citosina, mientras que otros hongos tienen hasta un 5% del genoma metilado. [90] Este valor parece variar tanto entre especies como entre aislados de la misma especie. [91] También hay evidencia de que la metilación del ADN puede estar involucrada en el control específico del estado de la expresión génica en hongos. [ cita requerida ] Sin embargo, en un límite de detección de 250 attomoles mediante espectrometría de masas de ultra alta sensibilidad , la metilación del ADN no se confirmó en especies de levaduras unicelulares como Saccharomyces cerevisiae o Schizosaccharomyces pombe , lo que indica que las levaduras no poseen esta modificación del ADN. [9] : resumen
Aunque la levadura cervecera ( Saccharomyces ), la levadura de fisión ( Schizosaccharomyces ) y el Aspergillus flavus [92] no tienen metilación de ADN detectable, el hongo filamentoso modelo Neurospora crassa tiene un sistema de metilación bien caracterizado. [93] Varios genes controlan la metilación en Neurospora y la mutación de la metiltransferasa de ADN, dim-2 , elimina toda la metilación de ADN pero no afecta el crecimiento ni la reproducción sexual. Si bien el genoma de Neurospora tiene muy poco ADN repetido, la mitad de la metilación ocurre en el ADN repetido, incluidas las reliquias de transposones y el ADN centromérico. La capacidad de evaluar otros fenómenos importantes en un contexto genético deficiente en metilasa de ADN hace de Neurospora un sistema importante en el que estudiar la metilación de ADN. [ cita requerida ]
En otros eucariotas
La metilación del ADN está prácticamente ausente en Dictyostelium discoidium [94], donde parece ocurrir en aproximadamente el 0,006 % de las citosinas. [6] Por el contrario, la metilación del ADN está ampliamente distribuida en Physarum polycephalum [95] , donde la 5-metilcitosina representa hasta el 8 % de la citosina total [4].
En bacterias

La metilación de la adenina o la citosina está mediada por sistemas de modificación de restricción de muchas bacterias , en los que secuencias específicas de ADN se metilan periódicamente a lo largo del genoma. [97] Una metilasa es la enzima que reconoce una secuencia específica y metila una de las bases en o cerca de esa secuencia. Los ADN extraños (que no se metilan de esta manera) que se introducen en la célula son degradados por enzimas de restricción específicas de la secuencia y escindidos. El ADN genómico bacteriano no es reconocido por estas enzimas de restricción. La metilación del ADN nativo actúa como una especie de sistema inmunológico primitivo, permitiendo a las bacterias protegerse de la infección por bacteriófagos . [ cita requerida ]
La adenina metiltransferasa de ADN de E. coli (Dam) es una enzima de ~32 kDa que no pertenece a un sistema de restricción/modificación. La secuencia de reconocimiento diana para Dam de E. coli es GATC, ya que la metilación ocurre en la posición N6 de la adenina en esta secuencia (G meATC). Los tres pares de bases que flanquean cada lado de este sitio también influyen en la unión entre el ADN y Dam. Dam desempeña varias funciones clave en los procesos bacterianos, incluida la reparación de errores de apareamiento, el momento de la replicación del ADN y la expresión génica. Como resultado de la replicación del ADN, el estado de los sitios GATC en el genoma de E. coli cambia de completamente metilado a hemimetilado. Esto se debe a que la adenina introducida en la nueva cadena de ADN no está metilada. La remetilación ocurre en un plazo de dos a cuatro segundos, tiempo durante el cual se reparan los errores de replicación en la nueva cadena. La metilación, o su ausencia, es el marcador que permite al aparato de reparación de la célula diferenciar entre la plantilla y las cadenas nacientes. Se ha demostrado que la alteración de la actividad de Dam en las bacterias da como resultado un aumento de la tasa de mutación espontánea. La viabilidad bacteriana se ve comprometida en mutantes de Dam que también carecen de otras enzimas reparadoras del ADN, lo que proporciona más evidencia del papel de Dam en la reparación del ADN.
Una región del ADN que mantiene su estado hemimetilado durante más tiempo es el origen de replicación , que tiene una gran cantidad de sitios GATC. Esto es fundamental para el mecanismo bacteriano de cronometrar la replicación del ADN. SeqA se une al origen de replicación, secuestrándolo y evitando así la metilación. Debido a que los orígenes de replicación hemimetilados son inactivos, este mecanismo limita la replicación del ADN a una vez por ciclo celular.
La expresión de ciertos genes, por ejemplo, los que codifican la expresión de pilus en E. coli , está regulada por la metilación de los sitios GATC en la región promotora del operón del gen. Las condiciones ambientales de las células justo después de la replicación del ADN determinan si se bloquea la metilación de Dam en una región proximal o distal a la región promotora. Una vez que se ha creado el patrón de metilación, la transcripción del gen pilus se bloquea en la posición activada o desactivada hasta que el ADN se vuelve a replicar. En E. coli , estos operones pili tienen papeles importantes en la virulencia en las infecciones del tracto urinario. Se ha propuesto [¿ por quién? ] que los inhibidores de Dam pueden funcionar como antibióticos.
Por otra parte, la metilasa de citosina de ADN se dirige a los sitios CCAGG y CCTGG para metilar la citosina en la posición C5 (C meC(A/T) GG). La otra enzima metilasa, EcoKI, provoca la metilación de adeninas en las secuencias AAC(N 6 )GTGC y GCAC(N 6 )GTT.
En Clostridioides difficile , se ha demostrado que la metilación del ADN en el motivo objetivo CAAAAA afecta la esporulación , un paso clave en la transmisión de la enfermedad, así como la longitud celular, la formación de biopelículas y la colonización del huésped. [98]
Clonación molecular
La mayoría de las cepas utilizadas por los biólogos moleculares son derivadas de E. coli K-12 y poseen tanto Dam como Dcm, pero existen cepas disponibles comercialmente que son dam-/dcm- (falta de actividad de cualquiera de las dos metilasas). De hecho, es posible desmetilar el ADN extraído de cepas dam+/dcm+ transformándolo en cepas dam-/dcm-. Esto ayudaría a digerir secuencias que no están siendo reconocidas por enzimas de restricción sensibles a la metilación. [99] [100]
La enzima de restricción DpnI puede reconocer los sitios 5'-GmeATC-3' y digerir el ADN metilado. Al ser un motivo tan corto, aparece con frecuencia en secuencias por casualidad y, como tal, su uso principal para los investigadores es degradar el ADN molde después de las PCR (los productos de PCR carecen de metilación, ya que no hay metilasas presentes en la reacción). De manera similar, algunas enzimas de restricción disponibles comercialmente son sensibles a la metilación en sus sitios de restricción afines y, como se mencionó anteriormente, deben usarse en el ADN que pasa a través de una cepa dam-/dcm- para permitir el corte. [ cita requerida ]
Detección
La metilación del ADN se puede detectar mediante los siguientes ensayos que se utilizan actualmente en la investigación científica: [101]
- La espectrometría de masas es un método analítico muy sensible y fiable para detectar la metilación del ADN. Sin embargo, en general, la espectrometría de masas no proporciona información sobre el contexto de la secuencia de la metilación, por lo que resulta limitada para estudiar la función de esta modificación del ADN.
- PCR específica de metilación (MSP) , que se basa en una reacción química de bisulfito de sodio con ADN que convierte las citosinas no metiladas de los dinucleótidos CpG en uracilo o UpG, seguida de una PCR tradicional . [102] Sin embargo, las citosinas metiladas no se convertirán en este proceso, y los cebadores están diseñados para superponerse al sitio CpG de interés, lo que permite determinar el estado de metilación como metilado o no metilado.
- La secuenciación de todo el genoma con bisulfito , también conocida como BS-Seq, es un análisis de alto rendimiento de la metilación del ADN en todo el genoma. Se basa en la conversión del ADN genómico con bisulfito de sodio antes mencionada, que luego se secuencia en una plataforma de secuenciación de próxima generación . Las secuencias obtenidas se vuelven a alinear con el genoma de referencia para determinar el estado de metilación de los dinucleótidos CpG en función de los desajustes resultantes de la conversión de citosinas no metiladas en uracilo.
- La secuenciación enzimática de metilo (EM-seq) funciona de manera similar a la secuenciación con bisulfito, pero utiliza las enzimas APOBEC y TET2 para desaminar la citosina no metilada en uracilo antes de la secuenciación. Las bibliotecas EM-seq son menos propensas a sufrir daños en el ADN que las bibliotecas tratadas con bisulfito. [103]
- La secuenciación con bisulfito de representación reducida , también conocida como RRBS, conoce varios protocolos de trabajo. El primer protocolo RRBS se llamó RRBS y apunta a alrededor del 10 % del metiloma; se necesita un genoma de referencia. Más tarde, llegaron más protocolos que podían secuenciar una porción más pequeña del genoma y una mayor multiplexación de muestras. EpiGBS fue el primer protocolo en el que se podían multiplexar 96 muestras en una línea de secuenciación de Illumina y donde ya no se necesitaba un genoma de referencia. Una construcción de referencia de novo a partir de las lecturas de Watson y Crick hizo que la detección poblacional de SNP y SMP simultáneamente fuera una realidad.
- El ensayo HELP , que se basa en la capacidad diferencial de las enzimas de restricción para reconocer y escindir sitios de ADN CpG metilados y no metilados.
- Ensayo GLAD-PCR , que se basa en un nuevo tipo de enzimas: endonucleasas de ADN dirigidas a metilo y específicas del sitio, que hidrolizan únicamente el ADN metilado.
- Ensayos ChIP-on-chip , que se basan en la capacidad de los anticuerpos preparados comercialmente para unirse a proteínas asociadas a la metilación del ADN como MeCP2.
- Exploración genómica de puntos de referencia de restricción , un ensayo complicado y ahora poco utilizado que se basa en el reconocimiento diferencial de sitios CpG metilados y no metilados por parte de las enzimas de restricción; el ensayo es similar en concepto al ensayo HELP.
- Inmunoprecipitación de ADN metilado (MeDIP), análoga a la inmunoprecipitación de cromatina , la inmunoprecipitación se utiliza para aislar fragmentos de ADN metilado para su introducción en métodos de detección de ADN, como microarreglos de ADN (MeDIP-chip) o secuenciación de ADN (MeDIP-seq).
- Pirosecuenciación de ADN tratado con bisulfito. Se trata de la secuenciación de un amplicón creado con un cebador directo normal y un cebador inverso biotinilado para realizar la PCR del gen de elección. A continuación, el pirosecuenciador analiza la muestra desnaturalizando el ADN y añadiendo un nucleótido a la vez a la mezcla según una secuencia proporcionada por el usuario. Si hay una discordancia, se registra y se anota el porcentaje de ADN en el que está presente la discordancia. Esto proporciona al usuario un porcentaje de metilación por isla CpG.
- Ensayo de luz de ruptura molecular para la actividad de la adenina metiltransferasa del ADN: un ensayo que se basa en la especificidad de la enzima de restricción DpnI para los sitios GATC completamente metilados (metilación de la adenina) en un oligonucleótido marcado con un fluoróforo y un inhibidor. La adenina metiltransferasa metila el oligonucleótido convirtiéndolo en un sustrato para DpnI. El corte del oligonucleótido por DpnI da lugar a un aumento de la fluorescencia. [104] [105]
- El Southern Blotting sensible a metilo es similar al ensayo HELP, aunque utiliza técnicas de Southern Blotting para investigar diferencias específicas de genes en la metilación mediante digestos de restricción. Esta técnica se utiliza para evaluar la metilación local cerca del sitio de unión de la sonda.
- Las proteínas de unión a metilCpG (MBP) y las proteínas de fusión que contienen solo el dominio de unión a metil (MBD) se utilizan para separar el ADN nativo en fracciones metiladas y no metiladas. El porcentaje de metilación de las islas CpG individuales se puede determinar cuantificando la cantidad del objetivo en cada fracción. [ cita requerida ] Se puede lograr una detección extremadamente sensible en tejidos FFPE con detección basada en abscripción.
- El análisis de fusión de alta resolución (HRM o HRMA) es una técnica analítica posterior a la PCR . El ADN diana se trata con bisulfito de sodio, que convierte químicamente las citosinas no metiladas en uracilos, mientras que las citosinas metiladas se conservan. A continuación, se lleva a cabo la amplificación por PCR con cebadores diseñados para amplificar tanto las plantillas metiladas como las no metiladas. Después de esta amplificación, las secuencias de ADN altamente metiladas contienen una mayor cantidad de sitios CpG en comparación con las plantillas no metiladas, lo que da como resultado una temperatura de fusión diferente que se puede utilizar en la detección cuantitativa de la metilación. [106] [107]
- Reconstrucción de la metilación del ADN antiguo, un método para reconstruir la metilación del ADN de alta resolución a partir de muestras de ADN antiguo. El método se basa en los procesos de degradación natural que ocurren en el ADN antiguo: con el tiempo, las citosinas metiladas se degradan en timinas, mientras que las citosinas no metiladas se degradan en uracilos. Esta asimetría en las señales de degradación se utilizó para reconstruir los mapas de metilación completos del neandertal y el denisovano . [108] En septiembre de 2019, los investigadores publicaron un nuevo método para inferir rasgos morfológicos a partir de datos de metilación del ADN. Los autores pudieron demostrar que vincular los genes regulados a la baja con los fenotipos de enfermedades monogénicas, donde una o dos copias de un gen están alteradas, permite una precisión de aproximadamente el 85 % en la reconstrucción de rasgos anatómicos directamente a partir de mapas de metilación del ADN. [109]
- Ensayo de extensión de cebador de nucleótido único sensible a la metilación (msSNuPE), que utiliza cebadores internos que se unen directamente al extremo 5' del nucleótido que se va a detectar. [110]
- El ensayo de metilación de Illumina mide la metilación del ADN específica de un locus mediante hibridación de matriz. El ADN tratado con bisulfito se hibrida con sondas en "BeadChips". La extensión de base única con sondas marcadas se utiliza para determinar el estado de metilación de los sitios objetivo. [111] En 2016, se lanzó el Infinium MethylationEPIC BeadChip, que interroga a más de 850.000 sitios de metilación en todo el genoma humano. [112]
Regiones metiladas diferencialmente (DMR)
Las regiones metiladas diferencialmente , que son regiones genómicas con diferentes estados de metilación entre múltiples muestras (tejidos, células, individuos u otros), se consideran posibles regiones funcionales involucradas en la regulación transcripcional de genes. La identificación de DMR entre múltiples tejidos (T-DMR) proporciona un estudio integral de las diferencias epigenéticas entre los tejidos humanos. [113] Por ejemplo, estas regiones metiladas que son exclusivas de un tejido en particular permiten a los individuos diferenciar entre el tipo de tejido, como el semen y el fluido vaginal. La investigación actual realizada por Lee et al., mostró que DACT1 y USP49 identificaron positivamente el semen al examinar las T-DMR. [114] El uso de T-DMR ha demostrado ser útil en la identificación de varios fluidos corporales encontrados en escenas del crimen. Los investigadores en el campo forense actualmente están buscando nuevos T-DMR en genes para usar como marcadores en el análisis de ADN forense. Las DMR entre muestras de cáncer y normales (C-DMR) demuestran la metilación aberrante en los cánceres. [115] Es bien sabido que la metilación del ADN está asociada con la diferenciación y proliferación celular. [116] Se han encontrado muchos DMR en las etapas de desarrollo (D-DMR) [117] y en el progreso reprogramado (R-DMR). [118] Además, existen DMR intraindividuales (Intra-DMR) con cambios longitudinales en la metilación global del ADN junto con el aumento de la edad en un individuo determinado. [119] También existen DMR interindividuales (Inter-DMR) con diferentes patrones de metilación entre múltiples individuos. [120]
La QDMR (Quantitative Differentially Methylated Regions) es un enfoque cuantitativo para cuantificar la diferencia de metilación e identificar DMR a partir de perfiles de metilación de todo el genoma mediante la adaptación de la entropía de Shannon. [121] La naturaleza libre de plataforma y de especie de la QDMR la hace potencialmente aplicable a varios datos de metilación. Este enfoque proporciona una herramienta eficaz para la identificación de alto rendimiento de las regiones funcionales involucradas en la regulación epigenética. La QDMR se puede utilizar como una herramienta eficaz para la cuantificación de la diferencia de metilación y la identificación de DMR en múltiples muestras. [122]
Se ha demostrado que el análisis de conjuntos de genes (también conocido como análisis de vías; herramientas que se utilizan habitualmente como DAVID, GoSeq o GSEA) está gravemente sesgado cuando se aplica a datos de metilación de alto rendimiento (por ejemplo, MeDIP-seq, MeDIP-ChIP, HELP-seq, etc.), y una amplia gama de estudios han informado erróneamente sobre la hipermetilación de genes relacionados con el desarrollo y la diferenciación; se ha sugerido que esto se puede corregir utilizando permutaciones de etiquetas de muestra o utilizando un modelo estadístico para controlar las diferencias en el número de sondas CpG/sitios CpG que se dirigen a cada gen. [123]
Marcas de metilación del ADN
Las marcas de metilación del ADN (regiones genómicas con patrones de metilación específicos en un estado biológico específico, como un tejido, un tipo de célula o un individuo) se consideran posibles regiones funcionales implicadas en la regulación de la transcripción génica. Aunque varios tipos de células humanas pueden tener el mismo genoma, estas células tienen diferentes metilomas. La identificación y caracterización sistemática de las marcas de metilación en los distintos tipos de células es crucial para comprender la compleja red reguladora de la determinación del destino celular. Hongbo Liu et al. propusieron un marco basado en la entropía denominado SMART para integrar los metilomas de secuenciación de bisulfito del genoma completo en 42 tejidos/células humanas e identificaron 757.887 segmentos del genoma. [124] Casi el 75 % de los segmentos mostraron una metilación uniforme en todos los tipos de células. Del 25 % restante de los segmentos, identificaron marcas de hipo/hipermetilación específicas del tipo de célula que estaban específicamente hipo/hipermetiladas en una minoría de tipos de células utilizando un enfoque estadístico y presentaron un atlas de las marcas de metilación humanas. Un análisis posterior reveló que las marcas de hipometilación específicas del tipo celular se enriquecieron a través de H3K27ac y los sitios de unión de factores de transcripción de una manera específica del tipo celular. En particular, observaron que las marcas de hipometilación específicas del tipo celular están asociadas con los superpotenciadores específicos del tipo celular que impulsan la expresión de genes de identidad celular. Este marco proporciona una anotación funcional complementaria del genoma humano y ayuda a dilucidar las características y funciones críticas de la hipometilación específica del tipo celular. [ cita requerida ]
La herramienta de análisis y generación de informes de metilación específica basada en la entropía, denominada "SMART", se centra en la integración de una gran cantidad de metilomas de ADN para la identificación de novo de marcas de metilación específicas del tipo celular. La última versión de SMART se centra en tres funciones principales, que incluyen la identificación de novo de regiones metiladas diferencialmente (DMR) mediante la segmentación del genoma, la identificación de DMR a partir de regiones de interés predefinidas y la identificación de sitios CpG metilados diferencialmente. [125]
En la identificación y detección de fluidos corporales
La metilación del ADN permite analizar varios tejidos en un solo ensayo, así como identificar pequeñas cantidades de fluido corporal con el uso de ADN extraído. Por lo general, los dos enfoques de la metilación del ADN son las enzimas de restricción sensibles a la metilación o el tratamiento con bisulfito de sodio. [126] Las enzimas de restricción sensibles a la metilación funcionan escindiendo CpG específicos, citosina y guanina separados por un solo grupo fosfato, sitios de reconocimiento cuando el CpG está metilado. Por el contrario, las citosinas no metiladas se transforman en uracilo y, en el proceso, las citosinas metiladas permanecen metiladas. En particular, los perfiles de metilación pueden proporcionar información sobre cuándo o cómo se dejaron fluidos corporales en las escenas del crimen, identificar el tipo de fluido corporal y aproximar la edad, el sexo y las características fenotípicas de los perpetradores. [127] Las investigaciones indican varios marcadores que se pueden utilizar para la metilación del ADN. Decidir qué marcador utilizar para un ensayo es uno de los primeros pasos de la identificación de fluidos corporales. En general, los marcadores se seleccionan examinando investigaciones previas realizadas. Los marcadores de identificación que se eligen deben dar un resultado positivo para un tipo de célula. Una porción del cromosoma que es un área de enfoque cuando se lleva a cabo la metilación del ADN son las regiones diferencialmente metiladas específicas del tejido, T-DMR. El grado de metilación de las T-DMR varía según el fluido corporal. [127] Un equipo de investigación desarrolló un sistema de marcadores que es doble. El primer marcador está metilado solo en el fluido objetivo, mientras que el segundo está metilado en el resto de los fluidos. [110] Por ejemplo, si el marcador de sangre venosa A no está metilado y el marcador de sangre venosa B está metilado en un fluido, indica la presencia de solo sangre venosa. Por el contrario, si el marcador de sangre venosa A está metilado y el marcador de sangre venosa B no está metilado en algún fluido, entonces eso indica que la sangre venosa está en una mezcla de fluidos. Algunos ejemplos de marcadores de metilación del ADN son Mens1 (sangre menstrual), Spei1 (saliva) y Sperm2 (líquido seminal).
La metilación del ADN proporciona un método relativamente bueno de sensibilidad para identificar y detectar fluidos corporales. En un estudio, sólo se necesitaron diez nanogramos de una muestra para determinar resultados satisfactorios. [128] La metilación del ADN proporciona un buen discernimiento de muestras mixtas, ya que implica marcadores que dan señales de "activación o desactivación". La metilación del ADN no es inmune a las condiciones externas. Incluso en condiciones degradadas utilizando las técnicas de metilación del ADN, los marcadores son lo suficientemente estables como para que todavía haya diferencias notables entre las muestras degradadas y las muestras de control. Específicamente, en un estudio, se encontró que no hubo cambios notables en los patrones de metilación durante un período extenso de tiempo. [127]
La detección de la metilación del ADN en el ADN libre de células y otros fluidos corporales se ha convertido recientemente en uno de los principales enfoques de la biopsia líquida . [129] En particular, la identificación de patrones específicos de tejido y de enfermedad permite la detección y el seguimiento no invasivos de enfermedades como el cáncer. [130] Si se compara con los enfoques estrictamente genómicos de la biopsia líquida, el perfil de metilación del ADN ofrece un mayor número de sitios CpG metilados diferencialmente y regiones metiladas diferencialmente (DMRS), lo que mejora potencialmente su sensibilidad. Los algoritmos de deconvolución de señales basados en la metilación del ADN se han aplicado con éxito al ADN libre de células y pueden nominar el tejido de origen de los cánceres de origen primario desconocido, el rechazo del aloinjerto y la resistencia a la terapia hormonal. [131]
Predicción computacional
La metilación del ADN también se puede detectar mediante modelos computacionales a través de algoritmos y métodos sofisticados. Los modelos computacionales pueden facilitar el perfil global de la metilación del ADN en los cromosomas y, a menudo, estos modelos son más rápidos y más económicos de realizar que los ensayos biológicos. Estos modelos computacionales actualizados incluyen Bhasin, et al. , [132] Bock, et al ., [133] y Zheng, et al . [134] [135] Junto con el ensayo biológico, estos métodos facilitan enormemente el análisis de la metilación del ADN.
Véase también
- 5-Hidroximetilcitosina
- 5-Metilcitosina
- 7-Metilguanosina
- Disminución de la metilación del ADN I (DDM1) , un gen de metilación de plantas
- Agente desmetilante
- Regiones metiladas diferencialmente
- Desmetilación del ADN
- Reprogramación de la metilación del ADN
- Epigenética , de la cual la metilación del ADN es un contribuyente significativo
- Reloj epigenético , un método para calcular la edad basándose en la metilación del ADN
- Epigenoma
- Genoma
- Impronta genómica , una represión hereditaria de un alelo, que depende de la metilación del ADN.
- Base de datos de metilación del ADN MethBase alojada en el navegador del genoma de la UCSC
- Base de datos de metilación del ADN MethDB
- N 6 -Metiladenosina
- Metilación de proteínas
Referencias
- ^ DB Dunn, JD Smith: "La presencia de 6-metilaminopurina en ácidos desoxirribonucleicos". En: Biochem J. 68(4), abril de 1958, págs. 627–636. PMID 13522672. PMC 1200409.
- ^ BF Vanyushin, SG Tkacheva, AN Belozersky: "Bases raras en el ADN animal". En: Naturaleza . 225, 1970, págs. 948–949. PMID 4391887.
- ^ Melanie Ehrlich, Miguel A. Gama-Sosa, Laura H. Carreira, Lars G. Ljungdahl, Kenneth C. Kuo, Charles W. Gehrke: "Metilación del ADN en bacterias termófilas: N6-metilcitosina, 5-metilcitosina y N6-metiladenina". En: Nucleic Acids Research . 13, 1985, pág. 1399. PMID 4000939. PMC 341080.
- ^ ab Evans HH, Evans TE (diciembre de 1970). "Metilación del ácido desoxirribonucleico de Physarum polycephalum en varios períodos durante el ciclo mitótico". The Journal of Biological Chemistry . 245 (23): 6436–6441. doi : 10.1016/S0021-9258(18)62627-4 . PMID 5530731.

- ^ Smith SS, Rather DI (julio de 1991). "Falta de 5-metilcitosina en el ADN de Dictyostelium discoideum". The Biochemical Journal . 277 (1): 273–275. doi :10.1042/bj2770273. PMC 1151219 . PMID 1713034.
- ^ ab Drewell RA, Cormier TC, Steenwyk JL, St Denis J, Tabima JF, Dresch JM, Larochelle DA (abril de 2023). "El genoma de Dictyostelium discoideum carece de metilación significativa del ADN y descubre secuencias palindrómicas como fuente de falsos positivos en la secuenciación con bisulfito". NAR Genomics Bioinformatics . 5 (2): lqad035. doi :10.1093/nargab/lqad035. PMC 10111430 . PMID 37081864.
- ^ Hu CW, Chen JL, Hsu YW, Yen CC, Chao MR (enero de 2015). "Análisis de trazas de citosinas metiladas e hidroximetiladas en ADN mediante LC-MS/MS de dilución isotópica: primera evidencia de metilación del ADN en Caenorhabditis elegans". The Biochemical Journal . 465 (1): 39–47. doi :10.1042/bj20140844. PMID 25299492.
- ^ Bird A (diciembre de 2001). "Biología molecular. La conversación sobre la metilación entre las histonas y el ADN". Science's Compass. Science . 294 (5549): 2113–2115. doi :10.1126/science.1066726. hdl : 1842/464 . PMID 11739943. S2CID 82947750.
Como resultado de este proceso, conocido como mutación puntual inducida por repetición (RIP), el genoma
de Neurospora
de tipo salvaje contiene una pequeña fracción de ADN metilado, y la mayoría del ADN permanece sin metilar.

- ^ abc Capuano F, Mülleder M, Kok R, Blom HJ, Ralser M (abril de 2014). "La metilación del ADN de la citosina se encuentra en Drosophila melanogaster pero está ausente en Saccharomyces cerevisiae, Schizosaccharomyces pombe y otras especies de levadura". Química analítica . 86 (8): 3697–3702. doi :10.1021/ac500447w. PMC 4006885 . PMID 24640988.
- ^ Ratel D, Ravanat JL, Berger F, Wion D (marzo de 2006). "N6-metiladenina: la otra base metilada del ADN". BioEssays . 28 (3): 309–315. doi :10.1002/bies.20342. PMC 2754416 . PMID 16479578.
- ^ Wu TP, Wang T, Seetin MG, Lai Y, Zhu S, Lin K, et al. (abril de 2016). "Metilación del ADN en N(6)-adenina en células madre embrionarias de mamíferos". Nature . 532 (7599): 329–333. Bibcode :2016Natur.532..329W. doi :10.1038/nature17640. PMC 4977844 . PMID 27027282.
- ^ Angéla Békési y Beáta G Vértessy "Uracilo en el ADN: ¿error o señal?"
- ^ Rana AK, Ankri S (2016). "Reviviendo el mundo del ARN: una mirada a la aparición de las metiltransferasas de ARN". Frontiers in Genetics . 7 : 99. doi : 10.3389/fgene.2016.00099 . PMC 4893491 . PMID 27375676.
- ^ Dodge JE, Ramsahoye BH, Wo ZG, Okano M, Li E (mayo de 2002). "Metilación de novo del provirus MMLV en células madre embrionarias: metilación con CpG frente a metilación sin CpG". Gene . 289 (1–2): 41–48. doi :10.1016/S0378-1119(02)00469-9. PMID 12036582.
- ^ Haines TR, Rodenhiser DI, Ainsworth PJ (diciembre de 2001). "Metilación no CpG específica de alelo del gen Nf1 durante el desarrollo temprano del ratón". Biología del desarrollo . 240 (2): 585–598. doi : 10.1006/dbio.2001.0504 . PMID 11784085.
- ^ ab Lister R, Pelizzola M, Dowen RH, Hawkins RD, Hon G, Tonti-Filippini J, et al. (noviembre de 2009). "Los metilomas del ADN humano con resolución de base muestran diferencias epigenómicas generalizadas". Nature . 462 (7271): 315–322. Bibcode :2009Natur.462..315L. doi :10.1038/nature08514. PMC 2857523 . PMID 19829295.
- ^ Lister R, Mukamel EA, Nery JR, Urich M, Puddifoot CA, Johnson ND, et al. (agosto de 2013). "Reconfiguración epigenómica global durante el desarrollo del cerebro de los mamíferos". Science . 341 (6146): 1237905. doi :10.1126/science.1237905. PMC 3785061 . PMID 23828890.
- ^ ab Kulis M, Merkel A, Heath S, Queirós AC, Schuyler RP, Castellano G, et al. (julio de 2015). "Huella dactilar del genoma completo del metiloma del ADN durante la diferenciación de células B humanas". Nature Genetics . 47 (7): 746–756. doi :10.1038/ng.3291. PMC 5444519 . PMID 26053498.
- ^ Tost J (enero de 2010). "Metilación del ADN: una introducción a la biología y los cambios asociados a la enfermedad de un biomarcador prometedor". Biotecnología molecular . 44 (1): 71–81. doi :10.1007/s12033-009-9216-2. PMID 19842073. S2CID 20307488.
- ^ Stadler MB, Murr R, Burger L, Ivanek R, Lienert F, Schöler A, et al. (diciembre de 2011). "Los factores de unión al ADN dan forma al metiloma del ratón en las regiones reguladoras distales". Nature . 480 (7378): 490–495. doi : 10.1038/nature11086 . PMID 22170606.
- ^ abc Zemach A, McDaniel IE, Silva P, Zilberman D (mayo de 2010). "Análisis evolutivo de la metilación del ADN eucariota en todo el genoma". Science (Informe ScienceExpress). 328 (5980): 916–919. Bibcode :2010Sci...328..916Z. doi : 10.1126/science.1186366 . PMID 20395474. S2CID 206525166.
Aquí cuantificamos la metilación del ADN en diecisiete genomas eucariotas....
 Parece que las cifras complementarias sólo son accesibles a través del muro de pago de science.sciencemag.org.
Parece que las cifras complementarias sólo son accesibles a través del muro de pago de science.sciencemag.org. - ^ Suzuki MM, Kerr AR, De Sousa D, Bird A (mayo de 2007). "La metilación de CpG está dirigida a las unidades de transcripción en un genoma de invertebrados". Genome Research . 17 (5): 625–631. doi :10.1101/gr.6163007. PMC 1855171 . PMID 17420183.
- ^ ab Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, et al. (febrero de 2001). "Secuenciación inicial y análisis del genoma humano". Nature . 409 (6822): 860–921. Bibcode :2001Natur.409..860L. doi : 10.1038/35057062 . hdl : 2027.42/62798 . PMID 11237011.
- ^ Bird AP (15 de mayo de 1986). "Islas ricas en CpG y la función de la metilación del ADN". Nature . 321 (6067): 209–213. Bibcode :1986Natur.321..209B. doi :10.1038/321209a0. PMID 2423876. S2CID 4236677.
- ^ Gardiner-Garden M, Frommer M (julio de 1987). "Islas CpG en genomas de vertebrados". Journal of Molecular Biology . 196 (2): 261–282. doi :10.1016/0022-2836(87)90689-9. PMID 3656447.
- ^ Illingworth RS, Gruenewald-Schneider U, Webb S, Kerr AR, James KD, Turner DJ, et al. (septiembre de 2010). "Las islas CpG huérfanas identifican numerosos promotores conservados en el genoma de los mamíferos". PLOS Genetics . 6 (9): e1001134. doi : 10.1371/journal.pgen.1001134 . PMC 2944787 . PMID 20885785.
- ^ Saxonov S, Berg P, Brutlag DL (enero de 2006). "Un análisis de todo el genoma de los dinucleótidos CpG en el genoma humano distingue dos clases distintas de promotores". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (5): 1412–1417. Bibcode :2006PNAS..103.1412S. doi : 10.1073/pnas.0510310103 . PMC 1345710 . PMID 16432200.
- ^ ab Feng S, Cokus SJ, Zhang X, Chen PY, Bostick M, Goll MG, et al. (mayo de 2010). "Conservación y divergencia de los patrones de metilación en plantas y animales". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (19): 8689–8694. doi : 10.1073/pnas.1002720107 . PMC 2889301 . PMID 20395551.
- ^ Mohn F, Weber M, Rebhan M, Roloff TC, Richter J, Stadler MB, et al. (junio de 2008). "Los objetivos polycomb específicos de linaje y la metilación de ADN de novo definen la restricción y el potencial de los progenitores neuronales". Molecular Cell . 30 (6): 755–766. doi : 10.1016/j.molcel.2008.05.007 . PMID 18514006.
- ^ Weber M, Hellmann I, Stadler MB, Ramos L, Pääbo S, Rebhan M, Schübeler D (abril de 2007). "Distribución, potencial de silenciamiento e impacto evolutivo de la metilación del ADN del promotor en el genoma humano". Nature Genetics . 39 (4): 457–466. doi :10.1038/ng1990. PMID 17334365. S2CID 22446734.
- ^ Schübeler D (enero de 2015). "Función y contenido de información de la metilación del ADN". Nature . 517 (7534): 321–326. Bibcode :2015Natur.517..321S. doi :10.1038/nature14192. PMID 25592537. S2CID 4403755.
- ^ Choy MK, Movassagh M, Goh HG, Bennett MR, Down TA, Foo RS (septiembre de 2010). "Los motivos de unión de factores de transcripción de consenso conservados en todo el genoma están hipermetilados". BMC Genomics . 11 (1): 519. doi : 10.1186/1471-2164-11-519 . PMC 2997012 . PMID 20875111.
- ^ Dahlet T, Argüeso Lleida A, Al Adhami H, Dumas M, Bender A, Ngondo RP, et al. (junio de 2020). "El análisis de todo el genoma en el embrión de ratón revela la importancia de la metilación del ADN para la integridad de la transcripción". Nature Communications . 11 (1): 3153. Bibcode :2020NatCo..11.3153D. doi :10.1038/s41467-020-16919-w. PMC 7305168 . PMID 32561758.
- ^ Huff JT, Zilberman D (marzo de 2014). "La metilación de CG independiente de Dnmt1 contribuye al posicionamiento de nucleosomas en diversos eucariotas". Cell . 156 (6): 1286–1297. doi :10.1016/j.cell.2014.01.029. PMC 3969382 . PMID 24630728.
- ^ Yoder JA, Walsh CP, Bestor TH (agosto de 1997). "Metilación de citosina y ecología de parásitos intragenómicos". Tendencias en genética . 13 (8): 335–340. doi : 10.1016/s0168-9525(97)01181-5 . PMID 9260521.
- ^ Zhou W, Liang G, Molloy PL, Jones PA (agosto de 2020). "La metilación del ADN permite la expansión del genoma impulsada por elementos transponibles". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 117 (32): 19359–19366. Bibcode :2020PNAS..11719359Z. doi : 10.1073/pnas.1921719117 . PMC 7431005 . PMID 32719115.
- ^ Lev Maor G, Yearim A, Ast G (mayo de 2015). "El papel alternativo de la metilación del ADN en la regulación del splicing". Tendencias en genética . 31 (5): 274–280. doi :10.1016/j.tig.2015.03.002. PMID 25837375. S2CID 34258335.
- ^ Maunakea AK, Nagarajan RP, Bilenky M, Ballinger TJ, D'Souza C, Fouse SD, et al. (julio de 2010). "Papel conservado de la metilación intragénica del ADN en la regulación de promotores alternativos". Nature . 466 (7303): 253–257. Bibcode :2010Natur.466..253M. doi :10.1038/nature09165. PMC 3998662 . PMID 20613842.
- ^ Carrozza MJ, Li B, Florens L, Suganuma T, Swanson SK, Lee KK, et al. (noviembre de 2005). "La metilación de la histona H3 por Set2 dirige la desacetilación de las regiones codificantes por Rpd3S para suprimir la transcripción intragénica espuria". Cell . 123 (4): 581–592. doi : 10.1016/j.cell.2005.10.023 . PMID 16286007. S2CID 9328002.
- ^ Cedar H, Bergman Y (julio de 2012). "Programación de patrones de metilación del ADN". Revista Anual de Bioquímica . 81 : 97–117. doi :10.1146/annurev-biochem-052610-091920. PMID 22404632. – a través de Reseñas anuales (requiere suscripción)
- ^ ab Mužić Radović V, Bunoza P, Marić T, Himelreich-Perić M, Bulić-Jakuš F, Takahashi M, et al. (julio de 2022). "Metilación global del ADN y condrogénesis de yemas de extremidades de ratas en un sistema de cultivo de órganos tridimensional". Revista bosnia de ciencias médicas básicas . 22 (4): 560–568. doi :10.17305/bjbms.2021.6584. PMC 9392980 . PMID 35188093. S2CID 247010798.
- ^ Beard C, Li E, Jaenisch R (octubre de 1995). "La pérdida de metilación activa Xist en células somáticas pero no en células embrionarias". Genes & Development . 9 (19): 2325–2334. doi : 10.1101/gad.9.19.2325 . PMID 7557385.
- ^ Li E, Beard C, Jaenisch R (noviembre de 1993). "El papel de la metilación del ADN en la impronta genómica". Nature . 366 (6453): 362–365. Bibcode :1993Natur.366..362L. doi :10.1038/366362a0. PMID 8247133. S2CID 4311091.
- ^ Borgel J, Guibert S, Li Y, Chiba H, Schübeler D, Sasaki H, et al. (Diciembre de 2010). "Objetivos y dinámica de la metilación del ADN promotor durante el desarrollo temprano del ratón". Genética de la Naturaleza . 42 (12): 1093-1100. doi :10.1038/ng.708. PMID 21057502. S2CID 205357042.
- ^ Seisenberger S, Peat JR, Hore TA, Santos F, Dean W, Reik W (enero de 2013). "Reprogramación de la metilación del ADN en el ciclo de vida de los mamíferos: construcción y ruptura de barreras epigenéticas". Philosophical Transactions of the Royal Society of London. Serie B, Biological Sciences . 368 (1609): 20110330. doi :10.1098/rstb.2011.0330. PMC 3539359 . PMID 23166394.
- ^ Wang YP, Lei QY (mayo de 2018). "Recodificación metabólica de la epigenética en el cáncer". Cancer Communications . 38 (1): 25. doi : 10.1186/s40880-018-0302-3 . PMC 5993135 . PMID 29784032.
- ^ Daura-Oller E, Cabre M, Montero MA, Paternain JL, Romeu A (abril de 2009). "Hipometilación de genes específicos y cáncer: nuevos conocimientos sobre las tendencias de las características de las regiones codificantes". Bioinformation . 3 (8): 340–343. doi :10.6026/97320630003340. PMC 2720671 . PMID 19707296.
- ^ Craig JM, Wong NC, eds. (2011). Epigenética: un manual de referencia . Caister Academic Press . ISBN 978-1-904455-88-2.
- ^ abc Gonzalo S (agosto de 2010). "Alteraciones epigenéticas en el envejecimiento". Revista de Fisiología Aplicada . 109 (2): 586–597. doi :10.1152/japplphysiol.00238.2010. PMC 2928596 . PMID 20448029.
- ^ Lund G, Andersson L, Lauria M, Lindholm M, Fraga MF, Villar-Garea A, et al. (julio de 2004). "Los polimorfismos de metilación del ADN preceden a cualquier signo histológico de aterosclerosis en ratones que carecen de apolipoproteína E". The Journal of Biological Chemistry . 279 (28): 29147–29154. doi : 10.1074/jbc.m403618200 . hdl : 2445/176763 . PMID 15131116.
- ^ Castro R, Rivera I, Struys EA, Jansen EE, Ravasco P, Camilo ME, et al. (agosto de 2003). "Aumento de las concentraciones de homocisteína y S-adenosilhomocisteína e hipometilación del ADN en la enfermedad vascular". Química clínica . 49 (8): 1292–1296. doi : 10.1373/49.8.1292 . PMID 12881445.
- ^ Huang YS, Zhi YF, Wang SR (octubre de 2009). "Hipermetilación del gen del receptor de estrógeno alfa en pacientes con ateromatosis y su correlación con la homocisteína". Fisiopatología . 16 (4): 259–265. doi :10.1016/j.pathophys.2009.02.010. PMID 19285843.
- ^ Dong C, Yoon W, Goldschmidt-Clermont PJ (agosto de 2002). "Metilación del ADN y aterosclerosis". The Journal of Nutrition . 132 (8 Suppl): 2406S–2409S. doi : 10.1093/jn/132.8.2406S . PMID 12163701.
- ^ Ying AK, Hassanain HH, Roos CM, Smiraglia DJ, Issa JJ, Michler RE, et al. (abril de 2000). "La metilación del promotor del gen del receptor de estrógeno alfa aumenta de forma selectiva en las células musculares lisas aórticas humanas en proliferación". Investigación cardiovascular . 46 (1): 172–179. doi : 10.1016/s0008-6363(00)00004-3 . PMID 10727665.
- ^ Zhu S, Goldschmidt-Clermont PJ, Dong C (agosto de 2005). "Inactivación del transportador de monocarboxilato MCT3 por metilación del ADN en la aterosclerosis". Circulation . 112 (9): 1353–1361. doi : 10.1161/circulationaha.104.519025 . PMID 16116050.
- ^ Pepin ME, Ha CM, Crossman DK, Litovsky SH, Varambally S, Barchue JP, et al. (marzo de 2019). "La metilación del ADN en todo el genoma codifica la reprogramación transcripcional cardíaca en la insuficiencia cardíaca isquémica humana". Investigación de laboratorio; una revista de métodos técnicos y patología . 99 (3): 371–386. doi : 10.1038/s41374-018-0104-x . PMC 6515060 . PMID 30089854.
- ^ Pepin ME, Ha CM, Potter LA, Bakshi S, Barchue JP, Haj Asaad A, et al. (mayo de 2021). "La disparidad racial y socioeconómica se asocia con diferencias en la metilación del ADN cardíaco entre hombres con insuficiencia cardíaca terminal". Revista estadounidense de fisiología. Fisiología cardíaca y circulatoria . 320 (5): H2066–H2079. doi : 10.1152 /ajpheart.00036.2021 . PMC 8163657. PMID 33769919.
- ^ Field, Adam E.; Robertson, Neil A.; Wang, Tina; Havas, Aaron; Ideker, Trey; Adams, Peter D. (septiembre de 2018). "Relojes de metilación del ADN en el envejecimiento: categorías, causas y consecuencias". Molecular Cell . 71 (6): 882–895. doi :10.1016/j.molcel.2018.08.008. PMC 6520108 .
- ^ Wong CC, Caspi A, Williams B, Craig IW, Houts R, Ambler A, et al. (agosto de 2010). "Un estudio longitudinal de la variación epigenética en gemelos". Epigenética . 5 (6): 516–526. doi :10.4161/epi.5.6.12226. PMC 3322496 . PMID 20505345.
- ^ ab Heyn H, Li N, Ferreira HJ, Moran S, Pisano DG, Gomez A, et al. (junio de 2012). "Distinct DNA methylomes of newlyns and centenarians" (Metilomas de ADN distintos de recién nacidos y centenarios). Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 109 (26): 10522–10527. Bibcode :2012PNAS..10910522H. doi : 10.1073/pnas.1120658109 . PMC 3387108 . PMID 22689993.
- ^ Chen, Daniel; Chao, Daniel L.; Rocha, Lorena; Kolar, Matthew; Nguyen Huu, Viet Anh; Krawczyk, Michal; Dasyani, Manish; Wang, Tina; Jafari, Maryam; Jabari, Mary; Ross, Kevin D.; Saghatelian, Alan; Hamilton, Bruce A.; Zhang, Kang; Skowronska‐Krawczyk, Dorota (febrero de 2020). "La enzima de elongación lipídica ELOVL2 es un regulador molecular del envejecimiento en la retina". Aging Cell . 19 (2). doi :10.1111/acel.13100. ISSN 1474-9718. PMC 6996962 . PMID 31943697.
- ^ Ronn, T.; Volkov, P.; Gillberg, L.; Kokosar, M.; Perfilyev, A.; Jacobsen, AL; Jorgensen, SW; Brons, C.; Jansson, P.-A.; Eriksson, K.-F.; Pedersen, O.; Hansen, T.; Groop, L.; Stener-Victorin, E.; Vaag, A. (10 de abril de 2015). "Impacto de la edad, el IMC y los niveles de HbA1c en los patrones de metilación del ADN y expresión del ARNm en todo el genoma en el tejido adiposo humano e identificación de biomarcadores epigenéticos en sangre". Genética molecular humana . doi :10.1093/hmg/ddv124. ISSN 0964-6906.
- ^ ab Barrès R, Yan J, Egan B, Treebak JT, Rasmussen M, Fritz T, et al. (marzo de 2012). "El ejercicio agudo remodela la metilación del promotor en el músculo esquelético humano". Metabolismo celular . 15 (3): 405–411. doi : 10.1016/j.cmet.2012.01.001 . PMID 22405075.
- ^ Rönn T, Volkov P, Davegårdh C, Dayeh T, Hall E, Olsson AH, et al. (junio de 2013). "Una intervención de ejercicio de seis meses influye en el patrón de metilación del ADN de todo el genoma en el tejido adiposo humano". PLOS Genetics . 9 (6): e1003572. doi : 10.1371/journal.pgen.1003572 . PMC 3694844 . PMID 23825961.
- ^ Zhang FF, Cardarelli R, Carroll J, Zhang S, Fulda KG, Gonzalez K, et al. (marzo de 2011). "Actividad física y metilación global del ADN genómico en una población libre de cáncer". Epigenética . 6 (3): 293–299. doi :10.4161/epi.6.3.14378. PMC 3092677 . PMID 21178401.
- ^ ab Sweatt JD (mayo de 2016). "La metilación dinámica del ADN controla el tráfico del receptor de glutamato y la escala sináptica". Journal of Neurochemistry . 137 (3): 312–330. doi :10.1111/jnc.13564. PMC 4836967 . PMID 26849493.
- ^ Kim S, Kaang BK (enero de 2017). "Regulación epigenética y remodelación de la cromatina en el aprendizaje y la memoria". Medicina experimental y molecular . 49 (1): e281. doi :10.1038/emm.2016.140. PMC 5291841. PMID 28082740 .
- ^ Schafe GE, Nadel NV, Sullivan GM, Harris A, LeDoux JE (1999). "La consolidación de la memoria para el condicionamiento del miedo contextual y auditivo depende de la síntesis de proteínas, PKA y MAP quinasa". Aprendizaje y memoria . 6 (2): 97–110. doi :10.1101/lm.6.2.97. PMC 311283 . PMID 10327235.
- ^ abc Halder R, Hennion M, Vidal RO, Shomroni O, Rahman RU, Rajput A, et al. (enero de 2016). "Los cambios en la metilación del ADN en los genes de plasticidad acompañan la formación y el mantenimiento de la memoria". Nature Neuroscience . 19 (1): 102–110. doi :10.1038/nn.4194. PMC 4700510 . PMID 26656643.
- ^ ab Duke CG, Kennedy AJ, Gavin CF, Day JJ, Sweatt JD (julio de 2017). "Reorganización epigenómica dependiente de la experiencia en el hipocampo". Aprendizaje y memoria . 24 (7): 278–288. doi :10.1101/lm.045112.117. PMC 5473107 . PMID 28620075.
- ^ ab Bernstein C (2022). "Metilación del ADN y establecimiento de la memoria". Epigenetics Insights . 15 : 25168657211072499. doi :10.1177/25168657211072499. PMC 8793415 . PMID 35098021.
- ^ Gratchev A. "Revisión sobre la metilación del ADN". METHODS.info .
- ^ Barau J, Teissandier A, Zamudio N, Roy S, Nalesso V, Hérault Y, et al. (noviembre de 2016). "La ADN metiltransferasa DNMT3C protege las células germinales masculinas de la actividad de los transposones". Ciencia . 354 (6314): 909–912. Código Bib : 2016 Ciencia... 354..909B. doi : 10.1126/ciencia.aah5143. PMID 27856912. S2CID 30907442.
- ^ Jain D, Meydan C, Lange J, Claeys Bouuaert C, Lailler N, Mason CE, et al. (agosto de 2017). "rahu es un alelo mutante de Dnmt3c, que codifica un homólogo de la ADN metiltransferasa necesario para la meiosis y la represión de transposones en la línea germinal masculina del ratón". PLOS Genetics . 13 (8): e1006964. doi : 10.1371/journal.pgen.1006964 . PMC 5607212 . PMID 28854222.
- ^ Goll MG, Kirpekar F, Maggert KA, Yoder JA, Hsieh CL, Zhang X, et al. (enero de 2006). "Metilación de ARNtAsp por el homólogo de la metiltransferasa de ADN Dnmt2". Science . 311 (5759): 395–398. Bibcode :2006Sci...311..395G. doi :10.1126/science.1120976. PMID 16424344. S2CID 39089541.
- ^ ab Zhang H, Lang Z, Zhu JK (agosto de 2018). "Dinámica y función de la metilación del ADN en plantas". Nature Reviews. Biología celular molecular . 19 (8): 489–506. doi :10.1038/s41580-018-0016-z. PMID 29784956. S2CID 256745172.
- ^ Dubin MJ, Zhang P, Meng D, Remigereau MS, Osborne EJ, Paolo Casale F, et al. (mayo de 2015). Dermitzakis ET (ed.). "La metilación del ADN en Arabidopsis tiene una base genética y muestra evidencia de adaptación local". eLife . 4 : e05255. doi : 10.7554/eLife.05255 . PMC 4413256 . PMID 25939354.
- ^ Cao X, Jacobsen SE (diciembre de 2002). "Control específico de locus de la metilación asimétrica y de CpNpG por los genes de la metiltransferasa DRM y CMT3". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (Suppl 4): 16491–16498. Bibcode :2002PNAS...9916491C. doi : 10.1073/pnas.162371599 . PMC 139913 . PMID 12151602.
- ^ Niederhuth CE, Bewick AJ, Ji L, Alabady MS, Kim KD, Li Q, et al. (septiembre de 2016). "Variación natural generalizada de la metilación del ADN en las angiospermas". Genome Biology . 17 (1): 194. doi : 10.1186/s13059-016-1059-0 . PMC 5037628 . PMID 27671052.
- ^ Zemach A, McDaniel IE, Silva P, Zilberman D (mayo de 2010). "Análisis evolutivo de la metilación del ADN eucariota en todo el genoma". Science . 328 (5980): 916–919. Bibcode :2010Sci...328..916Z. doi : 10.1126/science.1186366 . PMID 20395474. S2CID 206525166.
- ^ ab Aufsatz W, Mette MF, van der Winden J, Matzke AJ, Matzke M (diciembre de 2002). "Metilación del ADN dirigida por ARN en Arabidopsis". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (Supl 4): 16499–16506. Bibcode :2002PNAS...9916499A. doi : 10.1073/pnas.162371499 . PMC 139914 . PMID 12169664.
- ^ Bewick AJ, Vogel KJ, Moore AJ, Schmitz RJ (marzo de 2017). "Evolución de la metilación del ADN en insectos". Biología molecular y evolución . 34 (3): 654–665. doi :10.1093/molbev/msw264. PMC 5400375 . PMID 28025279.
- ^ Wang Y, Jorda M, Jones PL, Maleszka R, Ling X, Robertson HM, et al. (octubre de 2006). "Sistema de metilación de CpG funcional en un insecto social". Science . 314 (5799): 645–647. Bibcode :2006Sci...314..645W. doi :10.1126/science.1135213. PMID 17068262. S2CID 31709665.
- ^ Ying y Li-Byarlay (2015). Mecanismos fisiológicos y moleculares de la nutrición en las abejas melíferas . Avances en fisiología de los insectos. Vol. 49. págs. 25-58. doi :10.1016/bs.aiip.2015.06.002. ISBN 9780128025864.
- ^ Li-Byarlay H, Li Y, Stroud H, Feng S, Newman TC, Kaneda M, et al. (julio de 2013). "La inhibición de la metiltransferasa 3 del ADN por interferencia de ARN afecta el empalme alternativo de genes en la abeja melífera". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 110 (31): 12750–12755. Bibcode :2013PNAS..11012750L. doi : 10.1073/pnas.1310735110 . PMC 3732956 . PMID 23852726.
- ^ Smith SS, Thomas CA (mayo de 1981). "Análisis de restricción bidimensional de ADN de Drosophila: machos y hembras". Gene . 13 (4): 395–408. doi :10.1016/0378-1119(81)90019-6. PMID 6266924.
- ^ Lyko F, Ramsahoye BH, Jaenisch R (noviembre de 2000). "Metilación del ADN en Drosophila melanogaster". Nature . 408 (6812): 538–540. doi :10.1038/35046205. PMID 11117732. S2CID 4427540.
- ^ Takayama S, Dhahbi J, Roberts A, Mao G, Heo SJ, Pachter L , et al. (mayo de 2014). "La metilación del genoma en D. melanogaster se encuentra en motivos cortos específicos y es independiente de la actividad de DNMT2". Genome Research . 24 (5): 821–830. doi :10.1101/gr.162412.113. PMC 4009611 . PMID 24558263.
- ^ Zhang G, Huang H, Liu D, Cheng Y, Liu X, Zhang W, et al. (mayo de 2015). "Modificación del ADN con N6-metiladenina en Drosophila". Cell . 161 (4): 893–906. doi : 10.1016/j.cell.2015.04.018 . PMID 25936838.
- ^ Antequera F, Tamame M, Villanueva JR, Santos T (julio de 1984). "Metilación del ADN en los hongos". The Journal of Biological Chemistry . 259 (13): 8033–8036. doi : 10.1016/S0021-9258(17)39681-3 . PMID 6330093.
- ^ Binz T, D'Mello N, Horgen PA (1998). "Una comparación de los niveles de metilación del ADN en aislados seleccionados de hongos superiores". Mycologia . 90 (5): 785–790. doi :10.2307/3761319. JSTOR 3761319.
- ^ Liu SY, Lin JQ, Wu HL, Wang CC, Huang SJ, Luo YF, et al. (2012). "La secuenciación con bisulfito revela que Aspergillus flavus tiene un hueco en la metilación del ADN". PLOS ONE . 7 (1): e30349. Bibcode :2012PLoSO...730349L. doi : 10.1371/journal.pone.0030349 . PMC 3262820 . PMID 22276181.
- ^ Selker EU, Tountas NA, Cross SH, Margolin BS, Murphy JG, Bird AP, Freitag M (abril de 2003). "El componente metilado del genoma de Neurospora crassa". Nature . 422 (6934): 893–897. Bibcode :2003Natur.422..893S. doi :10.1038/nature01564. hdl : 1842/694 . PMID 12712205. S2CID 4380222.
- ^ Smith SS, Ratner DI (julio de 1991). "Falta de 5-metilcitosina en el ADN de Dictyostelium discoideum". The Biochemical Journal . 277 (Parte 1) (Parte 1): 273–275. doi :10.1042/bj2770273. PMC 1151219 . PMID 1713034.
- ^ Reilly JG, Braun R, Thomas CA (julio de 1980). "Metilación en ADN de Physarum". FEBS Letters . 116 (2): 181–184. doi :10.1016/0014-5793(80)80638-7. PMID 6250882. S2CID 83941623.
- ^ Matthew J. Blow, Tyson A. Clark, Chris G. Daum, Adam M. Deutschbauer, Alexey Fomenkov, Roxanne Fries, Jeff Froula, Dongwan D. Kang, Rex R. Malmstrom, Richard D. Morgan, Janos Posfai, Kanwar Singh, Axel Visel, Kelly Wetmore, Zhiying Zhao, Edward M. Rubin, Jonas Korlach, Len A. Pennacchio, Richard J. Roberts: El paisaje epigenómico de los procariotas. En: PLoS Genet. 12(2), febrero de 2016, S. e1005854. doi:10.1371/journal.pgen.1005854. PMID 26870957. PMC 4752239
- ^ Oliveira PH (agosto de 2021). "Epigenómica bacteriana: la mayoría de edad". mSystems . 6 (4): e0074721. doi : 10.1128/mSystems.00747-21 . PMC 8407109 . PMID 34402642.
- ^ Oliveira PH, Ribis JW, Garrett EM, Trzilova D, Kim A, Sekulovic O, et al. (enero de 2020). "La caracterización epigenómica de Clostridioides difficile encuentra una metiltransferasa de ADN conservada que media la esporulación y la patogénesis". Nature Microbiology . 5 (1): 166–180. doi :10.1038/s41564-019-0613-4. PMC 6925328 . PMID 31768029.
- ^ Palmer BR, Marinus MG (mayo de 1994). "Las cepas dam y dcm de Escherichia coli: una revisión". Gene . 143 (1): 1–12. doi :10.1016/0378-1119(94)90597-5. PMID 8200522.
- ^ "Fabricación de ADN no metilado (dam-/dcm-)". Archivado desde el original el 6 de enero de 2011.
- ^ Rana AK (enero de 2018). "Investigación criminal a través del análisis de metilación del ADN: métodos y aplicaciones en la ciencia forense". Revista egipcia de ciencias forenses . 8 (7). doi : 10.1186/s41935-018-0042-1 .
- ^ Hernández HG, Tse MY, Pang SC, Arboleda H, Forero DA (octubre de 2013). "Optimización de metodologías para el análisis de metilación de ADN basado en PCR". BioTechniques . 55 (4): 181–197. doi : 10.2144/000114087 . PMID 24107250.
- ^ Feng, Suhua; Zhong, Zhenhui; Wang, Ming; Jacobsen, Steven E. (7 de octubre de 2020). "Determinación eficiente y precisa de patrones de metilación del ADN en todo el genoma en Arabidopsis thaliana con secuenciación enzimática de metilación". Epigenética y cromatina . 13 (1): 42. doi : 10.1186/s13072-020-00361-9 . ISSN 1756-8935. PMC 7542392 . PMID 33028374.
- ^ Wood RJ, Maynard-Smith MD, Robinson VL, Oyston PC, Titball RW, Roach PL (agosto de 2007). Fugmann S (ed.). "Análisis cinético de la actividad de la ADN adenina metiltransferasa de Yersinia pestis utilizando un oligonucleótido de luz de ruptura molecular hemimetilado". PLOS ONE . 2 (8): e801. Bibcode :2007PLoSO...2..801W. doi : 10.1371/journal.pone.0000801 . PMC 1949145 . PMID 17726531.
- ^ Li J, Yan H, Wang K, Tan W, Zhou X (febrero de 2007). "Sonda de ADN de fluorescencia en horquilla para el seguimiento en tiempo real de la metilación del ADN". Química analítica . 79 (3): 1050–1056. doi :10.1021/ac061694i. PMID 17263334.
- ^ Wojdacz TK, Dobrovic A (2007). "Fusión de alta resolución sensible a la metilación (MS-HRM): un nuevo enfoque para la evaluación sensible y de alto rendimiento de la metilación". Nucleic Acids Research . 35 (6): e41. doi :10.1093/nar/gkm013. PMC 1874596 . PMID 17289753.
- ^ Malentacchi F, Forni G, Vinci S, Orlando C (julio de 2009). "Evaluación cuantitativa de la metilación del ADN mediante la optimización de un protocolo de análisis de fusión de alta resolución diferencial". Nucleic Acids Research . 37 (12): e86. doi :10.1093/nar/gkp383. PMC 2709587 . PMID 19454604.
- ^ Gokhman D, Lavi E, Prüfer K, Fraga MF, Riancho JA, Kelso J, et al. (mayo de 2014). "Reconstrucción de los mapas de metilación del ADN del neandertal y del denisovano". Ciencia . 344 (6183): 523–527. Código Bib : 2014 Ciencia... 344.. 523G. doi : 10.1126/ciencia.1250368 . PMID 24786081. S2CID 28665590.
- ^ Gokhman D, Mishol N, de Manuel M, de Juan D, Shuqrun J, Meshorer E, et al. (septiembre de 2019). "Reconstrucción de la anatomía de los denisovanos mediante mapas de metilación del ADN". Cell . 179 (1): 180–192.e10. doi : 10.1016/j.cell.2019.08.035 . PMID 31539495. S2CID 202676502.
- ^ ab Forat S, Huettel B, Reinhardt R, Fimmers R, Haidl G, Denschlag D, Olek K (1 de febrero de 2016). "Marcadores de metilación para la identificación de fluidos y tejidos corporales a partir de evidencia forense". PLOS ONE . 11 (2): e0147973. Bibcode :2016PLoSO..1147973F. doi : 10.1371/journal.pone.0147973 . PMC 4734623 . PMID 26829227.
- ^ "Ensayo de metilación de Infinium | Interrogar sitios CpG individuales". www.illumina.com . Consultado el 10 de enero de 2020 .
- ^ "Infinium MethylationEPIC Kit | Matriz de perfilado de metilación para EWAS". www.illumina.com . Consultado el 10 de enero de 2020 .
- ^ Rakyan VK, Down TA, Thorne NP, Flicek P, Kulesha E, Gräf S, et al. (septiembre de 2008). "Un recurso integrado para la identificación y el análisis de todo el genoma de regiones metiladas diferencialmente específicas de tejidos humanos (tDMR)". Genome Research . 18 (9): 1518–1529. doi :10.1101/gr.077479.108. PMC 2527707 . PMID 18577705.
- ^ Lee HY, Park MJ, Choi A, An JH, Yang WI, Shin KJ (enero de 2012). "Potencial aplicación forense del perfil de metilación del ADN para la identificación de fluidos corporales". Revista Internacional de Medicina Legal . 126 (1): 55–62. doi :10.1007/s00414-011-0569-2. PMID 21626087. S2CID 22243051.
- ^ Irizarry RA, Ladd-Acosta C, Wen B, Wu Z, Montano C, Onyango P, et al. (febrero de 2009). "El metiloma del cáncer de colon humano muestra una hipo- e hipermetilación similar en las costas de islas CpG específicas de tejido conservadas". Nature Genetics . 41 (2): 178–186. doi :10.1038/ng.298. PMC 2729128 . PMID 19151715.
- ^ Reik W, Dean W, Walter J (agosto de 2001). "Reprogramación epigenética en el desarrollo de los mamíferos". Science . 293 (5532): 1089–1093. doi :10.1126/science.1063443. PMID 11498579. S2CID 17089710.
- ^ Meissner A, Mikkelsen TS, Gu H, Wernig M, Hanna J, Sivachenko A, et al. (agosto de 2008). "Mapas de metilación del ADN a escala genómica de células pluripotentes y diferenciadas". Nature . 454 (7205): 766–770. Bibcode :2008Natur.454..766M. doi :10.1038/nature07107. PMC 2896277 . PMID 18600261.
- ^ Doi A, Park IH, Wen B, Murakami P, Aryee MJ, Irizarry R, et al. (diciembre de 2009). "La metilación diferencial de las costas de las islas CpG específicas de tejidos y cáncer distingue a las células madre pluripotentes inducidas humanas, las células madre embrionarias y los fibroblastos". Nature Genetics . 41 (12): 1350–1353. doi :10.1038/ng.471. PMC 2958040 . PMID 19881528.
- ^ Bjornsson HT, Sigurdsson MI, Fallin MD, Irizarry RA, Aspelund T, Cui H, et al. (junio de 2008). "Cambio intraindividual a lo largo del tiempo en la metilación del ADN con agrupamiento familiar". JAMA . 299 (24): 2877–2883. doi :10.1001/jama.299.24.2877. PMC 2581898 . PMID 18577732.
- ^ Bock C, Walter J, Paulsen M, Lengauer T (junio de 2008). "Variación interindividual de la metilación del ADN y sus implicaciones para el mapeo epigenómico a gran escala". Nucleic Acids Research . 36 (10): e55. doi :10.1093/nar/gkn122. PMC 2425484 . PMID 18413340.
- ^ "QDMR: un método cuantitativo para la identificación de regiones metiladas diferencialmente por entropía". bioinfo.hrbmu.edu.cn . Archivado desde el original el 23 de octubre de 2015 . Consultado el 9 de marzo de 2013 .
- ^ Zhang Y, Liu H, Lv J, Xiao X, Zhu J, Liu X, et al. (mayo de 2011). "QDMR: un método cuantitativo para la identificación de regiones metiladas diferencialmente por entropía". Nucleic Acids Research . 39 (9): e58. doi :10.1093/nar/gkr053. PMC 3089487 . PMID 21306990.
- ^ Geeleher P, Hartnett L, Egan LJ, Golden A, Raja Ali RA, Seoighe C (agosto de 2013). "El análisis de conjuntos de genes está severamente sesgado cuando se aplica a datos de metilación de todo el genoma". Bioinformática . 29 (15): 1851–1857. doi : 10.1093/bioinformatics/btt311 . PMID 23732277.
- ^ Liu H, Liu X, Zhang S, Lv J, Li S, Shang S, et al. (enero de 2016). "La identificación y anotación sistemática de las marcas de metilación humana basadas en metilomas de secuenciación con bisulfito revela funciones distintas de la hipometilación específica del tipo celular en la regulación de los genes de identidad celular". Nucleic Acids Research . 44 (1): 75–94. doi :10.1093/nar/gkv1332. PMC 4705665 . PMID 26635396.
- ^ Hongbo L (2016). "SMART 2: una herramienta de análisis integral para datos de secuenciación de bisulfito". fame.edbc.org .
- ^ Sijen T (septiembre de 2015). "Enfoques moleculares para la identificación de tipos celulares forenses: sobre ARNm, miARN, metilación del ADN y marcadores microbianos". Forensic Science International. Genética . 18 : 21–32. doi :10.1016/j.fsigen.2014.11.015. PMID 25488609.
- ^ abc Kader F, Ghai M (abril de 2015). "Metilación del ADN y aplicación en las ciencias forenses". Forensic Science International . 249 : 255–265. doi :10.1016/j.forsciint.2015.01.037. PMID 25732744.
- ^ Silva DS, Antunes J, Balamurugan K, Duncan G, Alho CS, McCord B (julio de 2016). "Estudios de validación del desarrollo de marcadores epigenéticos de metilación del ADN para la detección de muestras de sangre, semen y saliva". Forensic Science International. Genética . 23 : 55–63. doi :10.1016/j.fsigen.2016.01.017. hdl : 10923/23633 . PMID: 27010659. S2CID : 7438775.
- ^ Dor Y, Cedar H (septiembre de 2018). "Principios de la metilación del ADN y sus implicaciones para la biología y la medicina". Lancet . 392 (10149): 777–786. doi :10.1016/S0140-6736(18)31268-6. PMID 30100054. S2CID 51965986.
- ^ Liu MC, Oxnard GR, Klein EA, Swanton C, Seiden MV (junio de 2020). "Detección y localización sensible y específica de múltiples cánceres mediante firmas de metilación en ADN libre de células". Anales de Oncología . 31 (6): 745–759. doi :10.1016/j.annonc.2020.02.011. PMC 8274402 . PMID 33506766.
- ^ Moss J, Magenheim J, Neiman D, Zemmour H, Loyfer N, Korach A, et al. (noviembre de 2018). "Atlas integral de metilación de tipos celulares humanos revela los orígenes del ADN circulante libre de células en la salud y la enfermedad". Nature Communications . 9 (1): 5068. Bibcode :2018NatCo...9.5068M. doi :10.1038/s41467-018-07466-6. PMC 6265251 . PMID 30498206.
- ^ Bhasin M, Zhang H, Reinherz EL, Reche PA (agosto de 2005). "Predicción de CpG metilados en secuencias de ADN utilizando una máquina de vectores de soporte" (PDF) . FEBS Letters . 579 (20): 4302–4308. doi :10.1016/j.febslet.2005.07.002. PMID 16051225. S2CID 14487630.
- ^ Bock C, Paulsen M, Tierling S, Mikeska T, Lengauer T, Walter J (marzo de 2006). "La metilación de las islas CpG en los linfocitos humanos está altamente correlacionada con la secuencia de ADN, las repeticiones y la estructura prevista del ADN". PLOS Genetics . 2 (3): e26. doi : 10.1371/journal.pgen.0020026 . PMC 1386721 . PMID 16520826.
- ^ Zheng H, Jiang SW, Wu H (2011). "Mejora del poder predictivo del modelo de predicción de la metilación del ADN genómico humano". Conferencia internacional sobre bioinformática y biología computacional (BIOCOMP'11) .
- ^ Zheng H, Wu H, Li J, Jiang SW (2013). "CpGIMethPred: modelo computacional para predecir el estado de metilación de las islas CpG en el genoma humano". BMC Medical Genomics . 6 (Supl 1): S13. doi : 10.1186/1755-8794-6-S1-S13 . PMC 3552668 . PMID 23369266.
Lectura adicional
- Law JA, Jacobsen SE (marzo de 2010). "Establecimiento, mantenimiento y modificación de patrones de metilación del ADN en plantas y animales". Nature Reviews. Genetics . 11 (3): 204–220. doi :10.1038/nrg2719. PMC 3034103 . PMID 20142834.
- Straussman R, Nejman D, Roberts D, Steinfeld I, Blum B, Benvenisty N, et al. (mayo de 2009). "Programación del desarrollo de los perfiles de metilación de las islas CpG en el genoma humano". Nature Structural & Molecular Biology . 16 (5): 564–571. doi :10.1038/nsmb.1594. PMID 19377480. S2CID 8804930.
- Patra SK (abril de 2008). "Regulación de la metilación del ADN y el cáncer por Ras". Experimental Cell Research . 314 (6): 1193–1201. doi :10.1016/j.yexcr.2008.01.012. PMID 18282569.
- Patra SK, Patra A, Rizzi F, Ghosh TC, Bettuzzi S (junio de 2008). "Desmetilación del ADN (citosina-5-C-metil) y regulación de la transcripción en las vías epigenéticas del desarrollo del cáncer". Cancer and Metastasis Reviews . 27 (2): 315–334. doi :10.1007/s10555-008-9118-y. hdl : 11381/1797001 . PMID 18246412. S2CID 22435914.
- Nagpal G, Sharma M, Kumar S, Chaudhary K, Gupta S, Gautam A, Raghava GP (febrero de 2014). "PCMdb: base de datos de metilación del cáncer de páncreas". Scientific Reports . 4 : 4197. Bibcode :2014NatSR...4E4197N. doi :10.1038/srep04197. PMC 3935225 . PMID 24569397.
Enlaces externos
- Metilación del ADN en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Explorador de hilos ENCODE Caracterización de ARN no codificante. Nature (revista)
- Base de datos de metilación del cáncer de páncreas PCMdb.
- Herramienta de análisis y generación de informes de metilación específica SMART
- Atlas de la marca de metilación humana
- Base de datos de metilación de enfermedades humanas Archivado el 27 de enero de 2020 en Wayback Machine
- Atlas EWAS Una base de conocimiento de estudios de asociación de todo el epigenoma

