Sal ácida
Las sales ácidas son una clase de sales que producen una solución ácida después de disolverse en un disolvente . Su formación como sustancia tiene una conductividad eléctrica mayor que la del disolvente puro. [1] Una solución ácida formada por sal ácida se realiza durante la neutralización parcial de ácidos dipróticos o polipróticos . Una semineutralización ocurre debido al resto de átomos de hidrógeno reemplazables de la disociación parcial de ácidos débiles que no han reaccionado con iones hidróxido ( OH − ) para crear moléculas de agua.
Formación
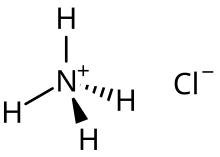
La propiedad ácido-base de la solución resultante de una reacción de neutralización depende de los productos de sal restantes. Una sal que contiene cationes reactivos sufre hidrólisis por la cual reaccionan con las moléculas de agua, lo que provoca la desprotonación de los ácidos conjugados .
Por ejemplo, la sal ácida cloruro de amonio es la principal especie formada tras la semineutralización del amoníaco en una solución acuosa de cloruro de hidrógeno : [2]
- NH 3 ( acuoso ) + HCl(acuoso) → [NH 4 ] + Cl − (acuoso)
Ejemplos de sales ácidas
| Nombre | Bisulfato de sodio | Fosfato monosódico | Fosfato disódico |
|---|---|---|---|
| Fórmula estructural |  |  |  |
| Fórmula química | NaHSO4 | NaH2PO4 | Na2HPO4 |
| Nombre IUPAC | Sulfato de hidrógeno y sodio | Fosfato dihidrógeno de sodio | Fosfato disódico de hidrógeno |
| Otro nombre |
|
|
|
| Peso molecular | 120,054 g/mol | 119,976 g/mol | 141,957 g/mol |
| Acusación formal | cero | cero | cero |
| Olor | Inodoro | Inodoro | Sin olor [3] |
| Apariencia | Cristales o gránulos blancos | Polvo cristalino blanco [4] | Polvo blanco higroscópico [5] |
| Estructura |
| Cristales monoclínicos [6] | Cristales monoclínicos (anhidros) [7] |
| Solubilidad |
|
|
|
| Densidad |
| 0,5–1,2 g/ cm3 | 1,7 g/ cm3 |
| Descomposición (a través del calentamiento) | Emite humos tóxicos de fosfóxidos y óxido de sodio [8] | Emite humos tóxicos de óxidos de fósforo y sodio [8] | |
| Usos |
|
|
|
Uso en alimentos
Las sales ácidas se utilizan a menudo en los alimentos como parte de los agentes leudantes. En este contexto, las sales ácidas se denominan "ácidos leudantes". [9] Los ácidos leudantes más comunes incluyen el crémor tártaro y el fosfato monocálcico .
Una sal ácida se puede mezclar con cierta sal base (como bicarbonato de sodio o bicarbonato de sodio) para crear polvos de hornear que liberan dióxido de carbono . [10] Los agentes leudantes pueden ser de acción lenta (por ejemplo, fosfato de aluminio y sodio ) que reaccionan cuando se calientan, o de acción rápida (por ejemplo, cremor tártaro) que reaccionan inmediatamente a bajas temperaturas. Los polvos de hornear de doble acción contienen agentes leudantes de acción lenta y rápida y reaccionan a temperaturas bajas y altas para proporcionar leudado durante todo el proceso de horneado. [11]
El fosfato disódico , Na2HPO4 , se utiliza en alimentos y el fosfato monosódico, NaH2PO4 , se utiliza en alimentos para animales, pasta de dientes y leche evaporada.
Intensidad del ácido
Un ácido con un valor de K a más alto domina la reacción química. Sirve como un mejor contribuyente de protones ( H + ). Una comparación entre K a y K b indica la propiedad ácido-base de la solución resultante por la cual:
- La solución es ácida si K a > K b . Contiene una mayor concentración de iones H + que de iones OH − debido a una hidrólisis de cationes más extensa en comparación con la hidrólisis de aniones.
- La solución es alcalina si K a < K b . Los aniones se hidrolizan más que los cationes, lo que provoca una concentración excesiva de iones OH − .
- Se espera que la solución sea neutral solo cuando K a = K b . [12]
Otros factores posibles que podrían variar el nivel de pH de una solución son las constantes de equilibrio relevantes y las cantidades adicionales de cualquier base o ácido.
Por ejemplo, en solución de cloruro de amonio , NH+4es la principal influencia para la solución ácida. Tiene un valor de K a mayor en comparación con el de las moléculas de agua; K a de NH+4es5,6 × 10 −10 , y K w de H 2 O es1,0 × 10 −14 . Esto asegura su desprotonación al reaccionar con agua, y es responsable del pH por debajo de 7 a temperatura ambiente. El Cl − no tendrá afinidad por H + ni tendencia a hidrolizarse, ya que su valor de K b es muy bajo ( la K b del Cl − es7,7 × 10 −21 ). [13]
La hidrólisis del amonio a temperatura ambiente produce:
Véase también
- Sal base
- Sal (química)
- Oxoácido
- Bicarbonato de sodio
- Bisulfato de sodio : un ejemplo de sal ácida
- Fosfato disódico : un ejemplo de sal ácida
- Fosfato monosódico : un ejemplo de sal ácida
Referencias
- ^ Cady, HP; Elsey, HM (1928). "Una definición general de ácidos, bases y sales". Revista de Educación Química . 5 (11): 1425. Bibcode :1928JChEd...5.1425C. doi :10.1021/ed005p1425.
- ^ Dekock, Roger L.; Gray, Harry B. (1989). Enlace químico y estructura (segunda edición). Sausalito, California: University Science Book. págs. 97-98. ISBN 978-0-935702-61-3. Recuperado el 8 de febrero de 2018 .
- ^ Guardia Costera de Estados Unidos, Departamento de Transporte. CHRIS - Datos sobre sustancias químicas peligrosas. Volumen II. Washington, DC: Oficina de Imprenta del Gobierno de Estados Unidos, 1984-5.
- ^ Lewis, RJ Sr.; Diccionario químico condensado de Hawley, 15.ª edición. John Wiley & Sons, Inc. Nueva York, NY 2007, pág. 1153
- ^ Lide, DR Manual de química y física del CRC, 88.ª edición, 2007-2008. CRC Press, Taylor & Francis, Boca Raton, Florida, 2007, pág. 4-90
- ^ Haynes, WM (ed.). Manual de química y física del CRC. 95.ª edición. CRC Press LLC, Boca Raton: FL 2014-2015, pág. 4-89
- ^ Somov, NV; Chausov, FF; Russ, J. (2017). "Polimorfo de alta simetría de fosfato de hidrógeno disódico anhidro". Revista rusa de química inorgánica . 62 (2): 172–174. doi :10.1134/S0036023617020176. S2CID 102468247.
- ^ ab Wiley, John; Hoboken, NJ (2004). Propiedades peligrosas de los materiales industriales de Sax (11.ª edición, por Richard J. Lewis, ed.). Wiley-Interscience. pág. 3274. doi :10.1021/ja041002c. ISBN 978-0-471-47662-7.
- ^ Wallace, David (10 de junio de 2015). «Ácidos leudantes: ingredientes para hornear». BAKERpedia . Consultado el 17 de octubre de 2019 .
- ^ "Los múltiples usos del crémor tártaro". Oficina para la Ciencia y la Sociedad . Consultado el 17 de octubre de 2019 .
- ^ Gabriala, Pop (2007). "INVESTIGACIONES SOBRE EL PAPEL DE LOS AGENTES QUÍMICOS LEUDANTES EN LA CALIDAD DE LOS PRODUCTOS DE PANADERIA". Revista de Procesos y Tecnologías Agroalimentarias . XIII, N.º 1: 105–112. S2CID 54052197.
- ^ Raymond, Chang (2010). Química (décima edición). Américas, Nueva York: McGraw-Hill. pp. 725–727. ISBN 978-0077274313. Recuperado el 9 de febrero de 2018 .
- ^ Lower, SK, (1999). Introducción a la química ácido-base. Texto de química general Chem1. Recuperado de http://www.chem1.com/acad/pdf/c1xacid1.pdf

![{\displaystyle K_{\mathrm {a} }={\frac {\mathrm {[NH_{3}][H_{3}O^{+}]} }{\mathrm {[NH_{4}^{+ }]} }}={\frac {K_{\mathrm {w} }}{K_{\mathrm {b} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5eac34ff25fa376268b6f116d33bf3d00ca7dfab)
![{\displaystyle K_{\mathrm {a}}={\frac {[1,0\times 10^{-14}]}{[1,8\times 10^{-5}]}}={5,6}\times 10^{-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43f0025153c13e4b649bc0ef2c4ea94caefc4c28)