Recombinación genética

La recombinación genética (también conocida como reorganización genética ) es el intercambio de material genético entre diferentes organismos que conduce a la producción de descendencia con combinaciones de rasgos que difieren de los encontrados en cualquiera de los progenitores. En eucariotas , la recombinación genética durante la meiosis puede conducir a un nuevo conjunto de información genética que puede transmitirse de padres a hijos. La mayor parte de la recombinación ocurre de forma natural y se puede clasificar en dos tipos: (1) recombinación intercromosómica , que ocurre a través de la distribución independiente de alelos cuyos loci están en cromosomas diferentes pero homólogos (orientación aleatoria de pares de cromosomas homólogos en la meiosis I); y (2) recombinación intracromosómica , que ocurre a través del entrecruzamiento. [1]
Durante la meiosis en eucariotas , la recombinación genética implica el apareamiento de cromosomas homólogos . Esto puede ir seguido de una transferencia de información entre los cromosomas. La transferencia de información puede ocurrir sin intercambio físico (una sección de material genético se copia de un cromosoma a otro, sin que se modifique el cromosoma donante) (véase la vía SDSA – Synthesis Dependent Strand Annealing en la Figura); o mediante la ruptura y la reunificación de las hebras de ADN , lo que forma nuevas moléculas de ADN (véase la vía DHJ en la Figura).
La recombinación también puede ocurrir durante la mitosis en eucariotas, donde normalmente involucra a los dos cromosomas hermanos formados después de la replicación cromosómica. En este caso, no se producen nuevas combinaciones de alelos ya que los cromosomas hermanos suelen ser idénticos. En la meiosis y la mitosis, la recombinación ocurre entre moléculas similares de ADN ( secuencias homólogas ). En la meiosis, los cromosomas homólogos no hermanos se aparean entre sí de modo que la recombinación ocurre característicamente entre homólogos no hermanos. Tanto en las células meióticas como en las mitóticas, la recombinación entre cromosomas homólogos es un mecanismo común utilizado en la reparación del ADN .
La conversión genética , el proceso mediante el cual las secuencias homólogas se vuelven idénticas, también se incluye dentro de la recombinación genética.
La recombinación genética y la reparación recombinatoria del ADN también ocurren en bacterias y arqueas , que utilizan la reproducción asexual .
La recombinación se puede inducir artificialmente en entornos de laboratorio ( in vitro ), produciendo ADN recombinante para fines que incluyen el desarrollo de vacunas .
La recombinación V(D)J en organismos con un sistema inmune adaptativo es un tipo de recombinación genética específica del sitio que ayuda a las células inmunes a diversificarse rápidamente para reconocer y adaptarse a nuevos patógenos .
Sinapsis
Durante la meiosis, la sinapsis (el apareamiento de cromosomas homólogos) normalmente precede a la recombinación genética.
Mecanismo
La recombinación genética está catalizada por muchas enzimas diferentes . Las recombinasas son enzimas clave que catalizan el paso de transferencia de cadena durante la recombinación. RecA , la principal recombinasa que se encuentra en Escherichia coli , es responsable de la reparación de las roturas de doble cadena del ADN (DSB). En la levadura y otros organismos eucariotas hay dos recombinasas necesarias para reparar las DSB. La proteína RAD51 es necesaria para la recombinación mitótica y meiótica , mientras que la proteína de reparación del ADN, DMC1 , es específica de la recombinación meiótica. En las arqueas, el ortólogo de la proteína bacteriana RecA es RadA.
- Recombinación bacteriana
En las bacterias se produce una recombinación genética regular, así como una transferencia ineficaz de material genético , expresada como transferencia fallida o transferencia abortiva, que es cualquier transferencia de ADN bacteriano de la célula donante a los receptores que han fijado el ADN entrante como parte del material genético del receptor. [ cita requerida ] [ aclaración necesaria ] La transferencia abortiva se registró en la siguiente transducción y conjugación. [ aclaración necesaria ] En todos los casos, el fragmento transmitido se diluye por el crecimiento del cultivo. [2] [3] [4]
Cruce cromosómico

En los eucariotas , la recombinación durante la meiosis se ve facilitada por el entrecruzamiento cromosómico . El proceso de entrecruzamiento hace que los descendientes tengan combinaciones de genes diferentes a las de sus progenitores, y ocasionalmente puede producir nuevos alelos quiméricos . [ cita requerida ] La mezcla de genes provocada por la recombinación genética produce una mayor variación genética . También permite que los organismos que se reproducen sexualmente eviten el trinquete de Müller , en el que los genomas de una población asexual tienden a acumular más mutaciones perjudiciales con el tiempo que mutaciones beneficiosas o reversibles. [ cita requerida ]
El entrecruzamiento cromosómico implica la recombinación entre los cromosomas emparejados heredados de cada uno de los padres, que generalmente ocurre durante la meiosis . [ cita requerida ] Durante la profase I (etapa de paquiteno), las cuatro cromátidas disponibles están en formación apretada entre sí. [ cita requerida ] Mientras están en esta formación, los sitios homólogos en dos cromátidas pueden emparejarse estrechamente entre sí y pueden intercambiar información genética. [ 5 ]
Debido a que existe una pequeña probabilidad de recombinación en cualquier ubicación a lo largo de un cromosoma, la frecuencia de recombinación entre dos ubicaciones depende de la distancia que las separa. [ cita requerida ] Por lo tanto, para genes suficientemente distantes en el mismo cromosoma, la cantidad de cruce es lo suficientemente alta como para destruir la correlación entre alelos. [ cita requerida ]
El seguimiento del movimiento de los genes resultantes de los cruces ha resultado muy útil para los genetistas. Debido a que dos genes que están cerca uno del otro tienen menos probabilidades de separarse que los genes que están más alejados, los genetistas pueden deducir aproximadamente cuán separados están dos genes en un cromosoma si conocen la frecuencia de los cruces. [ cita requerida ] Los genetistas también pueden utilizar este método para inferir la presencia de ciertos genes. Los genes que normalmente permanecen juntos durante la recombinación se dice que están ligados . Un gen en un par ligado a veces se puede utilizar como marcador para deducir la presencia del otro gen. Esto se utiliza normalmente para detectar la presencia de un gen causante de enfermedades. [ 6 ]
La frecuencia de recombinación observada entre dos loci es el valor de entrecruzamiento . Es la frecuencia de entrecruzamiento entre dos loci genéticos vinculados ( marcadores ), y depende de la distancia entre los loci genéticos observados. Para cualquier conjunto fijo de condiciones genéticas y ambientales, la recombinación en una región particular de una estructura de ligamiento ( cromosoma ) tiende a ser constante, y lo mismo es cierto para el valor de entrecruzamiento que se utiliza en la producción de mapas genéticos . [2] [7]
Conversión genética
En la conversión genética, una sección de material genético se copia de un cromosoma a otro, sin que se modifique el cromosoma donante. La conversión genética ocurre con alta frecuencia en el sitio real del evento de recombinación durante la meiosis . Es un proceso por el cual una secuencia de ADN se copia de una hélice de ADN (que permanece inalterada) a otra hélice de ADN, cuya secuencia se altera. La conversión genética a menudo se ha estudiado en cruces de hongos [8] donde se pueden observar convenientemente los 4 productos de meiosis individuales. Los eventos de conversión genética se pueden distinguir como desviaciones en una meiosis individual del patrón normal de segregación 2:2 (por ejemplo, un patrón 3:1).
Recombinación no homóloga
La recombinación puede ocurrir entre secuencias de ADN que no contienen homología de secuencia . Esto puede causar translocaciones cromosómicas , que a veces conducen al cáncer.
En las células B
Las células B del sistema inmunitario realizan una recombinación genética, llamada cambio de clase de inmunoglobulina . Se trata de un mecanismo biológico que cambia un anticuerpo de una clase a otra, por ejemplo, de un isotipo llamado IgM a un isotipo llamado IgG .
Ingeniería genética
En ingeniería genética , la recombinación también puede referirse a la recombinación artificial y deliberada de fragmentos dispares de ADN, a menudo de diferentes organismos, creando lo que se llama ADN recombinante . Un excelente ejemplo de este uso de la recombinación genética es la selección de genes , que se puede utilizar para agregar, eliminar o cambiar de otro modo los genes de un organismo. Esta técnica es importante para los investigadores biomédicos , ya que les permite estudiar los efectos de genes específicos. Las técnicas basadas en la recombinación genética también se aplican en la ingeniería de proteínas para desarrollar nuevas proteínas de interés biológico.
Los ejemplos incluyen la integración mediada por enzimas de restricción , el ensamblaje de Gibson y la clonación Golden Gate .
Reparación recombinacional
Los daños en el ADN causados por una variedad de agentes exógenos (por ejemplo, luz ultravioleta , rayos X , agentes de reticulación química ) pueden repararse mediante reparación recombinatoria homóloga (HRR). [9] [10] Estos hallazgos sugieren que los daños en el ADN que surgen de procesos naturales , como la exposición a especies reactivas de oxígeno que son subproductos del metabolismo normal, también son reparados por HRR. En los seres humanos, las deficiencias en los productos genéticos necesarios para HRR durante la meiosis probablemente causan infertilidad [11] En los seres humanos, las deficiencias en los productos genéticos necesarios para HRR, como BRCA1 y BRCA2 , aumentan el riesgo de cáncer (ver trastorno por deficiencia de reparación del ADN ).
En las bacterias, la transformación es un proceso de transferencia de genes que ocurre normalmente entre células individuales de la misma especie bacteriana. La transformación implica la integración del ADN del donante en el cromosoma receptor mediante recombinación. Este proceso parece ser una adaptación para reparar los daños del ADN en el cromosoma receptor mediante la HRR. [12] La transformación puede proporcionar un beneficio a las bacterias patógenas al permitir la reparación del daño del ADN, en particular los daños que ocurren en el entorno inflamatorio y oxidante asociado con la infección de un huésped.
Cuando dos o más virus, cada uno con daños genómicos letales, infectan la misma célula huésped, los genomas del virus a menudo pueden emparejarse entre sí y experimentar HRR para producir progenie viable. Este proceso, conocido como reactivación por multiplicidad, se ha estudiado en bacteriófagos lambda y T4 , [13] así como en varios virus patógenos. En el caso de los virus patógenos, la reactivación por multiplicidad puede ser un beneficio adaptativo para el virus ya que permite la reparación de los daños del ADN causados por la exposición al entorno oxidante producido durante la infección del huésped. [12] Véase también reordenamiento .
Recombinación meiótica
En la primera figura de este artículo se describe un modelo molecular del mecanismo de recombinación meiótica presentado por Anderson y Sekelsky [14] . Dos de las cuatro cromátidas presentes al principio de la meiosis (profase I) están emparejadas entre sí y pueden interactuar. La recombinación, en este modelo, se inicia mediante una rotura (o espacio) de doble cadena que se muestra en la molécula de ADN (cromátida) en la parte superior de la figura. Otros tipos de daño del ADN también pueden iniciar la recombinación. Por ejemplo, un enlace cruzado entre cadenas (causado por la exposición a un agente de enlace cruzado como la mitomicina C) puede ser reparado por la HRR.
Se producen dos tipos de productos recombinantes. En el lado derecho se indica un tipo "cruzado" (CO), en el que se intercambian las regiones flanqueantes de los cromosomas, y en el lado izquierdo, un tipo "no cruzado" (NCO), en el que no se intercambian las regiones flanqueantes. El tipo de recombinación CO implica la formación intermedia de dos "uniones de Holliday" indicadas en la parte inferior derecha de la figura por dos estructuras en forma de X en cada una de las cuales hay un intercambio de cadenas simples entre las dos cromátidas participantes. Esta vía se denomina en la figura vía DHJ (doble unión de Holliday).
Los recombinantes NCO (ilustrados a la izquierda de la figura) se producen mediante un proceso denominado "recocido de hebras dependiente de la síntesis" (SDSA). Los eventos de recombinación del tipo NCO/SDSA parecen ser más comunes que los del tipo CO/DHJ. [15] La vía NCO/SDSA contribuye poco a la variación genética, ya que los brazos de los cromosomas que flanquean el evento de recombinación permanecen en la configuración parental. Por lo tanto, las explicaciones de la función adaptativa de la meiosis que se centran exclusivamente en el entrecruzamiento son inadecuadas para explicar la mayoría de los eventos de recombinación.
Aciasmia y heteroquiasmia
La aquiasmia es el fenómeno en el que la recombinación autosómica está completamente ausente en uno de los sexos de una especie. La segregación cromosómica aquiasmática está bien documentada en los machos de Drosophila melanogaster . La "regla de Haldane-Huxley" establece que la aquiasmia suele ocurrir en el sexo heterogamético . [16]
La heteroquiasmia se produce cuando las tasas de recombinación difieren entre los sexos de una especie. [16] En los seres humanos, cada ovocito tiene en promedio 41,6 ± 11,3 recombinaciones, 1,63 veces más que los espermatozoides. Este patrón de dimorfismo sexual en la tasa de recombinación se ha observado en muchas especies. En los mamíferos, las hembras suelen tener tasas de recombinación más altas. [17]
Recombinación del virus ARN
Numerosos virus de ARN son capaces de recombinación genética cuando al menos dos genomas virales están presentes en la misma célula huésped. [18] [19] La recombinación es en gran medida responsable de la diversidad de virus de ARN y la evasión inmune. [20] La recombinación de ARN parece ser una fuerza impulsora importante en la determinación de la arquitectura del genoma y el curso de la evolución viral entre los picornaviridae ( (+)ssRNA ) (por ejemplo, el virus de la poliomielitis ). [21] En los retroviridae ((+)ssRNA)(por ejemplo, el VIH ), el daño en el genoma de ARN parece evitarse durante la transcripción inversa mediante el cambio de cadena, una forma de recombinación. [22] [23]
La recombinación también ocurre en reoviridae (dsRNA) (por ejemplo, reovirus), orthomyxoviridae ((-)ssRNA) (por ejemplo, virus de la influenza ) [23] y coronaviridae ((+)ssRNA) (por ejemplo, SARS ). [24] [25]
La recombinación en los virus de ARN parece ser una adaptación para hacer frente al daño del genoma. [18] El cambio entre cadenas de plantilla durante la replicación del genoma, conocido como recombinación por elección de copia, se propuso originalmente para explicar la correlación positiva de los eventos de recombinación en distancias cortas en organismos con un genoma de ADN (ver la primera figura, vía SDSA ). [26]
La recombinación puede ocurrir con poca frecuencia entre virus animales de la misma especie pero de linajes divergentes. Los virus recombinantes resultantes pueden causar a veces un brote de infección en humanos. [24]
Especialmente en los coronavirus, la recombinación también puede ocurrir incluso entre grupos evolutivos distantemente relacionados (subgéneros), debido a su mecanismo de transcripción característico, que involucra ARNm subgenómicos que se forman por cambio de plantilla. [27] [25]
Al replicar su genoma de (+)ssRNA , la ARN polimerasa dependiente de ARN (RdRp) del poliovirus es capaz de llevar a cabo la recombinación. La recombinación parece ocurrir por un mecanismo de elección de copia en el que la RdRp cambia las plantillas de (+)ssRNA durante la síntesis de la cadena negativa. [28] La recombinación por cambio de cadena de RdRp también ocurre en los carmovirus vegetales (+)ssRNA y tombusvirus . [29]
La recombinación parece ser una fuerza impulsora importante para determinar la variabilidad genética dentro de los coronavirus, así como la capacidad de las especies de coronavirus de saltar de un huésped a otro y, con poca frecuencia, para el surgimiento de nuevas especies, aunque el mecanismo de recombinación no está claro. [24]
A principios de 2020, muchas secuencias genómicas de aislamientos australianos de SARS-CoV-2 tienen deleciones o mutaciones (29742G>A o 29742G>U; "G19A" o "G19U") en el s2m, lo que sugiere que la recombinación de ARN puede haber ocurrido en este elemento de ARN. 29742G("G19"), 29744G("G21") y 29751G("G28") se predijeron como puntos críticos de recombinación. [30] Durante los primeros meses de la pandemia de COVID-19, se sugirió que un evento de recombinación de este tipo había sido un paso crítico en la evolución de la capacidad del SARS-CoV-2 para infectar a los humanos. [31] El análisis de desequilibrio de ligamiento confirmó que la recombinación de ARN con la mutación 11083G > T también contribuyó al aumento de mutaciones entre la progenie viral. Los hallazgos indican que la mutación 11083G > T del SARS-CoV-2 se propagó durante la cuarentena a bordo del Diamond Princess y surgió a través de una recombinación de ARN de novo bajo presión de selección positiva. En tres pacientes del crucero Diamond Princess , dos mutaciones, 29736G > T y 29751G > T (G13 y G28) se localizaron en el motivo similar al tallo-bucle II (s2m) del coronavirus 3' del SARS-CoV-2. Aunque s2m se considera un motivo de ARN altamente conservado en la región no traducida 3' entre muchas especies de coronavirus, este resultado también sugiere que s2m del SARS-CoV-2 es un punto crítico de recombinación/mutación del ARN. [32]
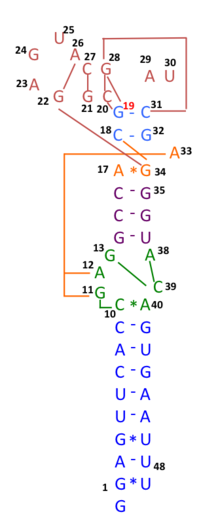
Según observaciones preliminares, todo el motivo de unión al receptor del SARS-CoV-2 parecía haber sido introducido a través de la recombinación de coronavirus de pangolines . [33] Sin embargo, análisis más exhaustivos posteriores refutaron esta sugerencia y demostraron que el SARS-CoV-2 probablemente evolucionó únicamente dentro de los murciélagos y con poca o ninguna recombinación. [34] [35]
El papel de la recombinación en el origen de la vida
Nowak y Ohtsuki [36] observaron que el origen de la vida ( abiogénesis ) es también el origen de la evolución biológica . Señalaron que toda la vida conocida en la Tierra se basa en biopolímeros y propusieron que cualquier teoría sobre el origen de la vida debe involucrar polímeros biológicos que actúen como portadores de información y catalizadores. Lehman [37] argumentó que la recombinación fue un desarrollo evolutivo tan antiguo como los orígenes de la vida. Smail et al. [38] propusieron que en la Tierra primordial, la recombinación jugó un papel clave en la expansión de los polímeros informativos inicialmente cortos (se presume que son ARN ) que fueron los precursores de la vida.
Véase también
- Genoma híbrido eucariota
- Prueba de los cuatro gametos
- Recombinación homóloga
- Surtido independiente
- Frecuencia de recombinación
- Punto caliente de recombinación
- Tecnología de recombinasa específica del sitio
- Recombinación específica del sitio
- Reordenamiento
- Recombinación V(D)J
Referencias
- ^ Daly, MJ; Minton, KW (octubre de 1995). "Recombinación intercromosómica en la bacteria extremadamente radioresistente Deinococcus radiodurans". Journal of Bacteriology . 177 (19): 5495–5505. doi :10.1128/jb.177.19.5495-5505.1995. ISSN 0021-9193. PMC 177357 . PMID 7559335.
- ^ ab Rieger R, Michaelis A, Green MM (1976). Glosario de genética y citogenética: clásica y molecular . Heidelberg – Nueva York: Springer-Verlag. ISBN 978-3-540-07668-1.
- ^ King RC, Stransfield WD (1998). Diccionario de genética . Nueva York, Oxford: Oxford University Press. ISBN 978-0-19-50944-1-1.
- ^ Bajrović K, Jevrić-Čaušević A, Hadžiselimović R, eds. (2005). Uvod u genetičko inženjerstvo i biotehnologiju . Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 978-9958-9344-1-4.
- ^ Alberts B (2002). Biología molecular de la célula, cuarta edición . Nueva York: Garland Science. ISBN 978-0-8153-3218-3.
- ^ "Access Excellence". Crossing-over: Genetic Recombination . Centro de recursos del Museo Nacional de la Salud . Consultado el 23 de febrero de 2011 .
- ^ King RC, Stransfield WD (1998). Diccionario de genética . Nueva York, Oxford: Oxford University Press. ISBN 0-19-509442-5.
- ^ Stacey KA (1994). "Recombinación". En Kendrew J, Lawrence E (eds.). La enciclopedia de biología molecular . Oxford: Blackwell Science. págs. 945–950.
- ^ Baker BS, Boyd JB, Carpenter AT, Green MM, Nguyen TD, Ripoll P, Smith PD (noviembre de 1976). "Controles genéticos de la recombinación meiótica y el metabolismo del ADN somático en Drosophila melanogaster". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 73 (11): 4140–4. Bibcode :1976PNAS...73.4140B. doi : 10.1073/pnas.73.11.4140 . PMC 431359 . PMID 825857.
- ^ Boyd JB (1978). "Reparación del ADN en Drosophila ". En Hanawalt PC, Friedberg EC, Fox CF (eds.). Mecanismos de reparación del ADN . Nueva York: Academic Press. págs. 449–452.
- ^ Galetzka D, Weis E, Kohlschmidt N, Bitz O, Stein R, Haaf T (abril de 2007). "Expresión de genes de reparación del ADN somático en testículos humanos". Journal of Cellular Biochemistry . 100 (5): 1232–9. doi :10.1002/jcb.21113. PMID 17177185. S2CID 23743474.
- ^ ab Michod RE, Bernstein H, Nedelcu AM (mayo de 2008). "Valor adaptativo del sexo en patógenos microbianos" (PDF) . Infección, genética y evolución . 8 (3): 267–85. Bibcode :2008InfGE...8..267M. doi :10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ Bernstein C (marzo de 1981). "Reparación del ácido desoxirribonucleico en bacteriófagos". Microbiological Reviews . 45 (1): 72–98. doi :10.1128/MMBR.45.1.72-98.1981. PMC 281499 . PMID 6261109.
- ^ Andersen SL, Sekelsky J (diciembre de 2010). "Recombinación meiótica versus mitótica: dos rutas diferentes para la reparación de roturas de doble cadena: las diferentes funciones de la reparación de roturas de doble cadena meiótica versus mitótica se reflejan en diferentes usos de la vía y diferentes resultados". BioEssays . 32 (12): 1058–66. doi :10.1002/bies.201000087. PMC 3090628 . PMID 20967781.
- ^ Mehrotra, S.; McKim, KS (2006). "Análisis temporal de la formación y reparación de roturas de doble cadena del ADN meiótico en hembras de Drosophila". PLOS Genetics . 2 (11): e200. doi : 10.1371/journal.pgen.0020200 . PMC 1657055 . PMID 17166055.
- ^ ab Lenormand T (febrero de 2003). "La evolución del dimorfismo sexual en la recombinación". Genética . 163 (2): 811–22. doi :10.1093/genetics/163.2.811. PMC 1462442 . PMID 12618416.
- ^ Ottolini, Christian S.; Newnham, Louise J.; Capalbo, Antonio; Natesan, Senthilkumar A.; Joshi, Hrishikesh A.; Cimadomo, Danilo; Griffin, Darren K.; Sage, Karen; Summers, Michael C.; Thornhill, Alan R.; Housworth, Elizabeth; Herbert, Alex D.; Rienzi, Laura; Ubaldi, Filippo M.; Handyside, Alan H. (julio de 2015). "Los mapas de recombinación y segregación cromosómica de todo el genoma en ovocitos y embriones humanos muestran selección para las tasas de recombinación materna". Nature Genetics . 47 (7): 727–735. doi :10.1038/ng.3306. ISSN 1546-1718. PMC 4770575 . PMID 25985139.
- ^ ab Barr JN, Fearns R (junio de 2010). "Cómo los virus de ARN mantienen la integridad de su genoma". The Journal of General Virology . 91 (Pt 6): 1373–87. doi : 10.1099/vir.0.020818-0 . PMID 20335491.
- ^ Simon-Loriere, Etienne; Holmes, Edward C. (agosto de 2011). "¿Por qué los virus ARN se recombinan?". Nature Reviews Microbiology . 9 (8): 617–626. doi :10.1038/nrmicro2614. ISSN 1740-1526. PMC 3324781 . PMID 21725337.
- ^ Rawson JM, Nikolaitchik OA, Keele BF, Pathak VK, Hu WS (noviembre de 2018). "La recombinación es necesaria para la replicación eficiente del VIH-1 y el mantenimiento de la integridad del genoma viral". Nucleic Acids Research . 46 (20): 10535–10545. doi :10.1093/nar/gky910. PMC 6237782 . PMID 30307534.
- ^ Muslin C, Mac Kain A, Bessaud M, Blondel B, Delpeyroux F (septiembre de 2019). "Recombinación en enterovirus, un proceso evolutivo modular de múltiples pasos". Viruses . 11 (9): 859. doi : 10.3390/v11090859 . PMC 6784155 . PMID 31540135.
- ^ Hu WS, Temin HM (noviembre de 1990). "Recombinación retroviral y transcripción inversa". Science . 250 (4985): 1227–33. Bibcode :1990Sci...250.1227H. doi :10.1126/science.1700865. PMID 1700865.
- ^ ab Bernstein H, Bernstein C, Michod RE (enero de 2018). "Sexo en patógenos microbianos". Infección, genética y evolución . 57 : 8–25. doi : 10.1016/j.meegid.2017.10.024 . PMID 29111273.
- ^ abc Su S, Wong G, Shi W, Liu J, Lai AC, Zhou J, Liu W, Bi Y, Gao GF (junio de 2016). "Epidemiología, recombinación genética y patogénesis de los coronavirus". Tendencias en microbiología . 24 (6): 490–502. doi :10.1016/j.tim.2016.03.003. PMC 7125511 . PMID 27012512.
- ^ ab Nikolaidis, Marios; Markoulatos, Panayotis; Van de Peer, Yves; Oliver, Stephen G; Amoutzias, Grigorios D (12 de octubre de 2021). Hepp, Crystal (ed.). "El vecindario del gen Spike es un punto de acceso para la recombinación homóloga y no homóloga intertípica modular en los genomas de Coronavirus". Biología molecular y evolución . 39 : msab292. doi :10.1093/molbev/msab292. ISSN 0737-4038. PMC 8549283 . PMID 34638137.
- ^ Bernstein H (1962). "Sobre el mecanismo de recombinación intragénica. I. La región rII del bacteriófago T4". Journal of Theoretical Biology . 3 (3): 335–353. Bibcode :1962JThBi...3..335B. doi :10.1016/S0022-5193(62)80030-7.
- ^ Graham, Rachel L.; Deming, Damon J.; Deming, Meagan E.; Yount, Boyd L.; Baric, Ralph S. (diciembre de 2018). "Evaluación de un coronavirus resistente a la recombinación como una plataforma de vacuna de amplia aplicación y rápida implementación". Communications Biology . 1 (1): 179. doi :10.1038/s42003-018-0175-7. ISSN 2399-3642. PMC 6206136 . PMID 30393776.
- ^ Kirkegaard K, Baltimore D (noviembre de 1986). "El mecanismo de recombinación del ARN en el virus de la poliomielitis". Cell . 47 (3): 433–43. doi :10.1016/0092-8674(86)90600-8. PMC 7133339 . PMID 3021340.
- ^ Cheng CP, Nagy PD (noviembre de 2003). "Mecanismo de recombinación de ARN en los virus carmo y tombus: evidencia de cambio de plantilla por la ARN polimerasa dependiente de ARN in vitro". Journal of Virology . 77 (22): 12033–47. doi :10.1128/jvi.77.22.12033-12047.2003. PMC 254248 . PMID 14581540.
- ^ Yeh TY, Contreras GP (julio de 2020). "Los mutantes virales emergentes en Australia sugieren un evento de recombinación de ARN en el genoma del SARS-CoV-2". The Medical Journal of Australia . 213 (1): 44–44.e1. doi :10.5694/mja2.50657. PMC 7300921 . PMID 32506536.
- ^ Wang H, Pipes L, Nielsen R (12 de octubre de 2020). "Mutaciones sinónimas y evolución molecular de los orígenes del SARS-Cov-2". bioRxiv 10.1101/2020.04.20.052019 .
- ^ Yeh TY, Contreras GP (1 de julio de 2021). "Transmisión viral y dinámica evolutiva del SARS-CoV-2 en cuarentena a bordo". Bull. Órgano Mundial de la Salud . 99 (7): 486–495. doi :10.2471/BLT.20.255752. PMC 8243027 . PMID 34248221.
- ^ Li X, Giorgi EE, Marichannegowda MH, Foley B, Xiao C, Kong XP, Chen Y, Gnanakaran S, Korber B, Gao F (julio de 2020). "Aparición del SARS-CoV-2 mediante recombinación y fuerte selección purificadora". Avances científicos . 6 (27): eabb9153. Código Bib : 2020SciA....6.9153L. doi : 10.1126/sciadv.abb9153. PMC 7458444 . PMID 32937441.
- ^ Boni MF, Lemey P, Jiang X, Lam TT, Perry BW, Castoe TA, et al. (noviembre de 2020). "Orígenes evolutivos del linaje del sarbecovirus SARS-CoV-2 responsable de la pandemia de COVID-19". Nature Microbiology . 5 (11): 1408–1417. doi : 10.1038/s41564-020-0771-4 . hdl : 20.500.11820/222bb9b9-2481-4086-bd22-f0b200930bef . PMID 32724171.
- ^ Neches RY, McGee MD, Kyrpides NC (noviembre de 2020). "La recombinación no debería ser una idea de último momento". Nature Reviews. Microbiología . 18 (11): 606. doi :10.1038/s41579-020-00451-1. PMC 7503439. PMID 32958891 .
- ^ Nowak, Martin A.; Ohtsuki, Hisashi (30 de septiembre de 2008). "Dinámica prevolucionaria y el origen de la evolución". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (39): 14924–14927. Bibcode :2008PNAS..10514924N. doi : 10.1073/pnas.0806714105 . ISSN 0027-8424. PMC 2567469 . PMID 18791073.
- ^ Lehman, Niles (2003). "Un caso de la extrema antigüedad de la recombinación". Journal of Molecular Evolution . 56 (6): 770–777. Bibcode :2003JMolE..56..770L. doi :10.1007/s00239-003-2454-1. PMID 12911039. S2CID 33130898.
- ^ Smail, Benedict A.; Clifton, Bryce E.; Mizuuchi, Ryo; Lehman, Niles (2019). "Aparición espontánea de diversidad genética en poblaciones de ARN a través de múltiples mecanismos de recombinación". ARN . 25 (4): 453–464. doi :10.1261/rna.068908.118. PMC 642629 . PMID 30670484.
Enlaces externos
- Animaciones – recombinación homóloga: Animaciones que muestran varios modelos de recombinación homóloga
- El modelo Holliday de recombinación genética
- Genética+recombinación en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Guía animada sobre la recombinación homóloga.
![]() Este artículo incorpora material de dominio público de Science Primer. NCBI . Archivado desde el original el 8 de diciembre de 2009.
Este artículo incorpora material de dominio público de Science Primer. NCBI . Archivado desde el original el 8 de diciembre de 2009.
