Prueba de Griess
La prueba de Griess es una prueba de química analítica que detecta la presencia de iones nitrito en solución . Uno de sus usos más importantes es la determinación de nitrito en agua potable . La reacción de diazotación de Griess , en la que se basa el reactivo de Griess, fue descrita por primera vez en 1858 por Peter Griess . [1] [2] La prueba también se ha utilizado ampliamente para la detección de nitratos ( estado de oxidación de N = 5+), que son un componente común de los explosivos , ya que pueden reducirse a nitritos ( estado de oxidación de N = 3+) y detectarse con la prueba de Griess. [3]
Método
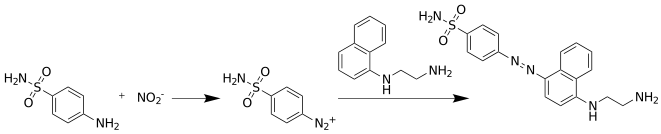
El nitrito se detecta y analiza por la formación de un color rojo rosado tras el tratamiento de una muestra que contiene nitrito con el reactivo de Griess, que consta de dos componentes en una solución ácida: un derivado de anilina y un agente de acoplamiento. Las disposiciones más comunes utilizan sulfanilamida y N-(1-naftil)etilendiamina : [3] un reactivo de Griess comercial típico contiene 0,2% de dihidrocloruro de N-(1-naftil)etilendiamina y 2% de sulfanilamida en ácido fosfórico al 5% . [4] Esta diamina se utiliza en lugar de la 1-naftilamina, más sencilla y barata , porque esta última es un potente carcinógeno y, además, la diamina forma un colorante más polar y, por tanto, mucho más soluble en un medio acuoso ácido. [5] Otros derivados de anilina que se han utilizado incluyen ácido sulfanílico , nitroanilina y p -aminoacetofenona. [3]
La prueba de Griess implica dos reacciones posteriores. Cuando se añade sulfanilamida, el ion nitrito reacciona con ella en la reacción de diazotación de Griess para formar una sal de diazonio , que luego reacciona con N-(1-naftil)etilendiamina en una reacción de acoplamiento azoico , formando un colorante azoico de color rosa rojizo .
Con un espectrofotómetro es posible determinar cuantitativamente la concentración de nitrito. El límite de detección de la prueba de Griess generalmente oscila entre 0,02 y 2 μM, dependiendo de los detalles exactos de los componentes específicos utilizados en el reactivo de Griess. [3]
Ciencias forenses
La prueba se utilizó en la ciencia forense durante muchos años para detectar rastros de nitroglicerina . La soda cáustica se utiliza para descomponer la muestra que contiene nitroglicerina y producir iones de nitrito.
La prueba consiste en tomar una muestra con éter y dividirla en dos recipientes. En el primer recipiente se añade sosa cáustica y luego el reactivo de Griess; si la solución se vuelve rosada en diez segundos, esto indica la presencia de nitritos. La prueba en sí es positiva si, después de agregar solo el reactivo de Griess al segundo recipiente, la solución permanece transparente.
Las condenas de Judith Ward y los Seis de Birmingham fueron ayudadas por la interpretación errónea que Frank Skuse hizo de los resultados de la prueba de Griess. [6]
Véase también
Referencias
- ^ Peter Griess (1858) "Vorläufige Notiz über die Einwirkung von salpetriger Säure auf Amidinitro- und Aminitrofenilsäure" (Aviso preliminar de la reacción del ácido nitroso con ácido picrámico y aminonitrofenol), Annalen der Chemie und Pharmacie , 106 : 123-125.
- ^ Wang, Zerong (2010). "Diazotización de Griess". Reacciones y reactivos de nombres orgánicos completos . John Wiley & Sons. doi :10.1002/9780470638859.conrr280. ISBN 9780470638859.
- ^ abcd Moorcroft, M.; Davis, J.; Compton, RG (2001). "Detección y determinación de nitrato y nitrito: una revisión". Talanta . 54 (5): 785–803. doi :10.1016/S0039-9140(01)00323-X. PMID 18968301.
- ^ Komsta, Lukasz; Waksmundzka-Hajnos, Monika; Sherma, José, eds. (20 de octubre de 2013). Cromatografía en capa fina en el análisis de fármacos. Prensa CRC. pag. 302.ISBN 9781466507166. Recuperado el 11 de junio de 2020 .
- ^ Marshall, Maurice; Oxle, Jimmie C., eds. (28 de junio de 2010). Aspectos de la detección de explosivos. Elsevier. pág. 47. ISBN 9780080923147. Recuperado el 11 de junio de 2020 .
- ^ Connor, Steve (29 de enero de 1987). «La ciencia que cambió la opinión de un ministro». New Scientist . N.º 1545. pág. 24. Consultado el 11 de junio de 2020 .