Receptor activado por el proliferador de peroxisomas
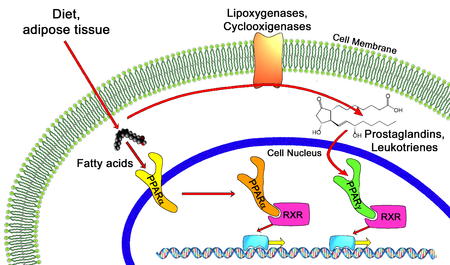
En el campo de la biología molecular , los receptores activados por el proliferador de peroxisomas ( PPAR ) son un grupo de proteínas receptoras nucleares que funcionan como factores de transcripción que regulan la expresión de genes . [1] Los PPAR desempeñan papeles esenciales en la regulación de la diferenciación celular , el desarrollo y el metabolismo ( carbohidratos , lípidos , proteínas ), [2] y la tumorigénesis [3] de organismos superiores. [4] [5]
Nomenclatura y distribución de tejidos
| Receptor alfa activado por el proliferador de peroxisomas | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | Para | ||||||
| Símbolos alternativos | PPAR | ||||||
| Gen NCBI | 5465 | ||||||
| HGNC | 9232 | ||||||
| OMI | 170998 | ||||||
| Secuencia de referencia | NM_001001928 | ||||||
| Protección unificada | Q07869 | ||||||
| Otros datos | |||||||
| Lugar | Crónica 22 q12-q13.1 | ||||||
| |||||||
| Receptor gamma activado por el proliferador de peroxisomas | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Identificadores | |||||||
| Símbolo | PPARG | ||||||
| Gen NCBI | 5468 | ||||||
| HGNC | 9236 | ||||||
| OMI | 601487 | ||||||
| Secuencia de referencia | Número nuevo_005037 | ||||||
| Protección unificada | P37231 | ||||||
| Otros datos | |||||||
| Lugar | Cap. 3 pág. 25 | ||||||
| |||||||
| Receptor delta activado por el proliferador de peroxisomas | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | PPARD | ||||||
| Gen NCBI | 5467 | ||||||
| HGNC | 9235 | ||||||
| OMI | 600409 | ||||||
| Secuencia de referencia | Número nuevo_006238 | ||||||
| Protección unificada | Q03181 | ||||||
| Otros datos | |||||||
| Lugar | Cap. 6 pág. 21.2 | ||||||
| |||||||
Se han identificado tres tipos de PPAR: alfa, gamma y delta (beta): [4]
- α (alfa) - expresada en hígado , riñones , corazón , músculos , tejido adiposo y otros [6]
- β/δ (beta/delta) : se expresa en muchos tejidos, especialmente en el cerebro , el tejido adiposo y la piel.
- γ (gamma) - aunque transcrito por el mismo gen, este PPAR, mediante empalme alternativo , se expresa en tres formas:
- γ1 - se expresa en prácticamente todos los tejidos, incluidos el corazón , los músculos , el colon , los riñones , el páncreas y el bazo.
- γ2 - se expresa principalmente en el tejido adiposo ; tiene 30 aminoácidos más que γ1
- γ3 - expresado en macrófagos , intestino grueso y tejido adiposo blanco
Historia
Estos agentes, farmacológicamente relacionados con los fibratos, fueron descubiertos a principios de la década de 1980.
Los PPAR se identificaron originalmente en las ranas Xenopus como receptores que inducen la proliferación de peroxisomas en las células en 1992. [7] El primer PPAR (PPARα) se descubrió en 1990 durante la búsqueda de un objetivo molecular de un grupo de agentes entonces denominados proliferadores de peroxisomas , ya que aumentaban el número de peroxisomas en el tejido hepático de roedores, además de mejorar la sensibilidad a la insulina . [8]
Cuando se demostró que los PPAR desempeñaban un papel mucho más versátil en biología, los agentes se denominaron a su vez ligandos de PPAR . Los ligandos de PPAR más conocidos son las tiazolidinedionas .
Después de que PPARδ (delta) fuera identificado en humanos en 1992, [9] resultó estar estrechamente relacionado con PPARβ (beta), descrito previamente durante el mismo año en un anfibio, Xenopus . El término "PPARδ" se utiliza generalmente en los EE. UU., mientras que el uso de "PPARβ" se ha mantenido en Europa, donde este receptor fue descubierto inicialmente en Xenopus .
Los PPAR recibieron ese nombre porque se descubrió que inducen la proliferación de peroxisomas en roedores, pero no se cree que esta inducción de la proliferación de peroxisomas ocurra en humanos. [10] [11]
Función fisiológica
Todos los PPAR heterodimerizan con el receptor X de retinoides (RXR) y se unen a regiones específicas del ADN de los genes diana. Estas secuencias de ADN se denominan PPRE ( elementos de respuesta a la hormona proliferadora de peroxisomas ). La secuencia de consenso del ADN es AGGTCANAGGTCA, donde N es cualquier nucleótido . En general, esta secuencia se encuentra en la región promotora de un gen y, cuando el PPAR se une a su ligando, la transcripción de los genes diana aumenta o disminuye, según el gen. El RXR también forma un heterodímero con varios otros receptores (p. ej., vitamina D y hormona tiroidea ).
La función de los PPAR se modifica por la forma precisa de su dominio de unión al ligando (ver más abajo) inducida por la unión del ligando y por una serie de proteínas coactivadoras y correpresoras , cuya presencia puede estimular o inhibir la función del receptor, respectivamente. [12]
Los ligandos endógenos para los PPAR incluyen ácidos grasos libres , eicosanoides y vitamina B3 . PPARγ es activado por PGJ 2 (una prostaglandina ) y ciertos miembros de la familia 5-HETE de metabolitos de ácido araquidónico, incluyendo 5-oxo-15(S)-HETE y 5-oxo-ETE. [13] Por el contrario, PPARα es activado por leucotrieno B 4 . Ciertos miembros de la familia de metabolitos de ácido araquidónico de ácido 15-hidroxieicosatetraenoico , incluyendo 15(S)-HETE, 15(R)-HETE y 15-HpETE activan en diversos grados PPAR alfa, beta/delta y gamma. Además, se informó que PPARγ está involucrado en la patogénesis y el crecimiento del cáncer. [14] [15] La activación de PPARγ por el agonista RS5444 puede inhibir el crecimiento del cáncer de tiroides anaplásico. [16] Véase [17] para una revisión y crítica de los roles del PPAR gamma en el cáncer.
Genética
Las tres formas principales de PPAR se transcriben a partir de genes diferentes :
- PPARα - cromosoma 22q 12-13.1 (OMIM 170998)
- PPARβ/δ - cromosoma 6p 21.2-21.1 (OMIM 600409)
- PPARγ – cromosoma 3p 25 (OMIM 601487).
Se han descrito trastornos hereditarios de estos 3 PPAR, que generalmente conducen a una pérdida de función y lipodistrofia concomitante , resistencia a la insulina y/o acantosis nigricans . [18] De PPARγ , se ha descrito y estudiado una mutación de ganancia de función : Pro 12 Ala , que disminuye el riesgo de resistencia a la insulina . Es bastante prevalente, con una frecuencia alélica de 0,03 - 0,12 en algunas poblaciones. [19] Por el contrario, pro 115 gln está asociado con la obesidad . Ciertos otros polimorfismos en PPAR muestran una alta incidencia en poblaciones con índices de masa corporal elevados .
Estructura
Al igual que otros receptores nucleares, los PPAR tienen una estructura modular y contienen los siguientes dominios funcionales :
- (A/B) - Región N-terminal
- (C) DBD - Dominio de unión al ADN
- (D) - región de bisagra flexible
- (E) LBD - dominio de unión del ligando
- (F) Región C-terminal
El DBD contiene dos motivos de dedos de zinc , que se unen a secuencias específicas de ADN conocidas como elementos de respuesta hormonal cuando se activa el receptor.
El LBD tiene una estructura secundaria extensa que consta de 13 hélices alfa y una lámina beta . [20] Tanto los ligandos naturales como los sintéticos pueden unirse al LBD, activando o reprimiendo la actividad del receptor.
Farmacología y moduladores del PPAR
PPARα y PPARγ son los objetivos moleculares de varios fármacos comercializados .
Por ejemplo, los fibratos hipolipidémicos activan PPARα. [ cita requerida ]
Las tiazolidinedionas antidiabéticas activan el PPARγ. [ cita requerida ]
El ácido perfluorooctanoico, químico sintético, activa el PPARα, mientras que el ácido perfluorononanoico activa tanto el PPARα como el PPARγ. [ cita requerida ]
La berberina inactiva el PPARγ. Huang C, Zhang Y, Gong Z, Sheng X, Li Z, Zhang W, Qin Y (2006). "La berberina inhibe la diferenciación de adipocitos 3T3-L1 a través de la vía PPARgamma". Comunicaciones de investigación bioquímica y biofísica . 348 (2): 571–578. doi :10.1016/j.bbrc.2006.07.095. PMID 16890192.</ref>
Otros compuestos naturales de diferentes clases químicas activan o inactivan PPARγ. [21] [22] [23]
Véase también
Referencias
- ^ Michalik L, Auwerx J, Berger JP, Chatterjee VK, Glass CK, Gonzalez FJ, Grimaldi PA, Kadowaki T, Lazar MA, O'Rahilly S, Palmer CN, Plutzky J, Reddy JK, Spiegelman BM, Staels B, Wahli W (2006). "Unión Internacional de Farmacología. LXI. Receptores activados por el proliferador de peroxisomas". Pharmacol. Rev. 58 ( 4): 726–41. doi :10.1124/pr.58.4.5. PMID 17132851. S2CID 2240461.
- ^ Dunning, Kylie R.; Anastasi, Marie R.; Zhang, Voueleng J.; Russell, Darryl L.; Robker, Rebecca L. (5 de febrero de 2014). "Regulación de la oxidación de ácidos grasos en complejos cúmulo-ocito de ratón durante la maduración y modulación por agonistas de PPAR". PLOS ONE . 9 (2): e87327. Bibcode :2014PLoSO...987327D. doi : 10.1371/journal.pone.0087327 . ISSN 1932-6203. PMC 3914821 . PMID 24505284.
- ^ Belfiore A, Genua M, Malaguarnera R (2009). "Agonistas de PPAR-gamma y sus efectos en la señalización del receptor de IGF-I: implicaciones para el cáncer". PPAR Res . 2009 : 830501. doi : 10.1155/2009/830501 . PMC 2709717 . PMID 19609453.
- ^ ab Berger J, Moller DE (2002). "Los mecanismos de acción de los PPAR". Año. Rev. Med . 53 : 409–35. doi :10.1146/annurev.med.53.082901.104018. PMID 11818483.
- ^ Feige JN, Gelman L, Michalik L, Desvergne B, Wahli W (2006). "De la acción molecular a los resultados fisiológicos: los receptores activados por el proliferador de peroxisomas son receptores nucleares en la encrucijada de funciones celulares clave". Prog. Lipid Res . 45 (2): 120–59. doi :10.1016/j.plipres.2005.12.002. PMID 16476485.
- ^ Tyagi S, Gupta P, Saini AS, Kaushal C, Sharma S (octubre de 2011). "El receptor activado por el proliferador de peroxisomas: una familia de receptores nucleares que desempeñan un papel en diversas enfermedades". J Adv Pharm Technol Res . 2 (4): 236–40. doi : 10.4103/2231-4040.90879 . PMC 3255347 . PMID 22247890.
- ^ Dreyer C, Krey G, Keller H, Givel F, Helftenbein G, Wahli W (1992). "Control de la vía de beta-oxidación peroxisomal por una nueva familia de receptores nucleares de hormonas". Cell . 68 (5): 879–87. doi :10.1016/0092-8674(92)90031-7. PMID 1312391. S2CID 3148132.
- ^ Issemann I, Green S (1990). "Activación de un miembro de la superfamilia de receptores de hormonas esteroides por proliferadores de peroxisomas". Nature . 347 (6294): 645–50. Bibcode :1990Natur.347..645I. doi :10.1038/347645a0. PMID 2129546. S2CID 4306126.
- ^ Schmidt A, Endo N, Rutledge SJ, Vogel R, Shinar D, Rodan GA (1992). "Identificación de un nuevo miembro de la superfamilia de receptores de hormonas esteroides que es activado por un proliferador de peroxisomas y ácidos grasos". Mol. Endocrinol . 6 (10): 1634–41. doi : 10.1210/mend.6.10.1333051 . PMID 1333051. S2CID 23506853.
- ^ Corton JC, Peters JM, Klaunig JE (2018). "La respuesta tumoral hepática de roedores dependiente de PPARα no es relevante para los humanos: abordando conceptos erróneos". Journal of Molecular Endocrinology . 92 (1): 83–119. Bibcode :2018ArTox..92...83C. doi :10.1007/s00204-017-2094-7. PMC 6092738 . PMID 29197930.
- ^ Sugden MC, Caton PW, Holness MJ, Miller JJ (2021). "Receptores activados por proliferadores de peroxisomas". Módulo de referencia en ciencias de la vida . Vol. 17. Elsevier. págs. 574–583. doi :10.1016/B978-0-12-819460-7.00200-0. ISBN 9780128096338.S2CID241510571 .
- ^ Yu S, Reddy JK (2007). "Coactivadores de la transcripción para receptores activados por el proliferador de peroxisomas". Biochim. Biophys. Acta . 1771 (8): 936–51. doi :10.1016/j.bbalip.2007.01.008. PMID 17306620.
- ^ Bioquímica. Biophys. Acta 1736:228–236, 2005
- ^ Ezzeddini R, Taghikhani M, Salek Farrokhi A, Somi MH, Samadi N, Esfahani A, Rasaee, MJ (mayo de 2021). "Regulación negativa de la oxidación de ácidos grasos por la participación de HIF-1α y PPARγ en el adenocarcinoma gástrico humano y su importancia clínica relacionada". Revista de fisiología y bioquímica . 77 (2): 249–260. doi :10.1007/s13105-021-00791-3. PMID 33730333. S2CID 232300877.
- ^ Mol. Farmacocinética 77-171-184, 2010
- ^ Marlow LA, Reynolds LA, Cleland AS, Cooper SJ, Gumz ML, Kurakata S, Fujiwara K, Zhang Y, Sebo T, Grant C, McIver B, Wadsworth JT, Radisky DC, Smallridge RC, Copland JA (febrero de 2009). "La reactivación de RhoB suprimido es un paso crítico para la inhibición del crecimiento del cáncer de tiroides anaplásico". Cancer Res . 69 (4): 1536–44. doi :10.1158/0008-5472.CAN-08-3718. PMC 2644344 . PMID 19208833.
- ^ Curr. Mol. Med. 7:532–540, 2007
- ^ Meirhaeghe A, Amouyel P (2004). "Impacto de la variación genética de PPARgamma en humanos". Mol. Genet. Metab . 83 (1–2): 93–102. doi :10.1016/j.ymgme.2004.08.014. PMID 15464424.
- ^ Buzzetti R, Petrone A, Ribaudo MC, Alemanno I, Zavarella S, Mein CA, Maiani F, Tiberti C, Baroni MG, Vecci E, Arca M, Leonetti F, Di Mario U (2004). "La variante común PPAR-gamma2 Pro12Ala se asocia con una mayor sensibilidad a la insulina". Revista europea de genética humana . 12 (12): 1050–4. doi : 10.1038/sj.ejhg.5201283 . PMID 15367918.
- ^ Zoete V, Grosdidier A, Michielin O (2007). "Estructuras de receptores activados por proliferadores de peroxisomas: especificidad de ligando, interruptor molecular e interacciones con reguladores". Biochim. Biophys. Acta . 1771 (8): 915–25. doi :10.1016/j.bbalip.2007.01.007. PMID 17317294.
- ^ Atanasov AG, Wang JN, Gu SP, Bu J, Kramer MP, Baumgartner L, Fakhrudin N, Ladurner A, Malainer C, Vuorinen A, Noha SM, Schwaiger S, Rollinger JM, Schuster D, Stuppner H, Dirsch VM, Heiss EH (2013). "Honokiol: un agonista de PPARγ no adipogénico procedente de la naturaleza". Biochim. Biofísica. Acta . 1830 (10): 4813–9. doi :10.1016/j.bbagen.2013.06.021. PMC 3790966 . PMID 23811337.
- ^ Atanasov AG, Blunder M, Fakhrudin N, Liu X, Noha SM, Malainer C, Kramer MP, Cocic A, Kunert O, Schinkovitz A, Heiss EH, Schuster D, Dirsch VM, Bauer R (2013). "Poliacetilenos de Notopterygium incisum: nuevos agonistas parciales selectivos del receptor gamma activado por el proliferador de peroxisomas". MÁS UNO . 8 (4): e61755. Código Bib : 2013PLoSO...861755A. doi : 10.1371/journal.pone.0061755 . PMC 3632601 . PMID 23630612.
- ^ Ammazzalorso, Alessandra; Amoroso, Rosa (28 de febrero de 2019). "Inhibición de PPARγ por compuestos naturales como estrategia prometedora en obesidad y diabetes". The Open Medicinal Chemistry Journal . 13 (1): 7–15. doi : 10.2174/1874104501913010007 .
Enlaces externos
- [1] (Página de recursos de PPAR, Universidad Estatal de Pensilvania).
- [2] (Recursos sobre receptores nucleares).
- Esquema de referencia de PPAR Archivado el 14 de febrero de 2020 en Wayback Machine . (Universidad Rutgers).
- Receptores activados por proliferadores de peroxisomas en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Receptores activados por proliferadores de peroxisomas de Proteopedia : la estructura del receptor activado por proliferadores de peroxisomas en 3D interactivo