Poliquistosis renal
| Poliquistosis renal | |
|---|---|
| Otros nombres | Riñón poliquístico [1] |
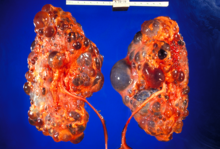 | |
| Riñones poliquísticos gravemente afectados extirpados en el momento del trasplante | |
| Especialidad | Nefrología |
| Síntomas | Dolor abdominal [1] |
| Tipos | ADPKD [2] y ARPKD [3] |
| Método de diagnóstico | Resonancia magnética, tomografía computarizada, ecografía [1] |
| Tratamiento | Antihipertensivos, Gestión del estilo de vida [4] |
La enfermedad renal poliquística ( PKD o PCKD , también conocida como síndrome renal poliquístico ) es un trastorno genético [5] [6] en el que los túbulos renales se vuelven estructuralmente anormales, lo que resulta en el desarrollo y crecimiento de múltiples quistes dentro del riñón. [7] Estos quistes pueden comenzar a desarrollarse en el útero, en la infancia, en la niñez o en la edad adulta. [8] Los quistes son túbulos no funcionales llenos de líquido bombeado hacia ellos, que varían en tamaño desde microscópicos a enormes, aplastando los túbulos normales adyacentes y eventualmente volviéndolos no funcionales también.
La PKD es causada por genes anormales que producen una proteína anormal específica; esta proteína tiene un efecto adverso en el desarrollo de los túbulos. PKD es un término general para dos tipos, cada uno con su propia patología y causa genética: enfermedad renal poliquística autosómica dominante (ADPKD) y enfermedad renal poliquística autosómica recesiva (ARPKD). El gen anormal existe en todas las células del cuerpo; como resultado, pueden aparecer quistes en el hígado , las vesículas seminales y el páncreas . Este defecto genético también puede causar aneurismas de la raíz aórtica y aneurismas en las arterias cerebrales del polígono de Willis , que si se rompen, pueden causar una hemorragia subaracnoidea .
El diagnóstico puede sospecharse a partir de uno, algunos o todos los siguientes factores: aparición de dolor en el flanco o coloración roja de la orina; antecedentes familiares positivos; palpación de riñones agrandados en el examen físico; un hallazgo incidental en una ecografía abdominal ; o un hallazgo incidental de función renal anormal en análisis de laboratorio de rutina ( BUN , creatinina sérica o eGFR ). El diagnóstico definitivo se realiza mediante un examen de TC abdominal .
Las complicaciones incluyen hipertensión debido a la activación del sistema renina-angiotensina-aldosterona (SRAA), infecciones frecuentes de quistes, sangrado urinario y deterioro de la función renal. La hipertensión se trata con inhibidores de la enzima convertidora de angiotensina ( IECA ) o bloqueadores de los receptores de angiotensina (ARA). Las infecciones se tratan con antibióticos. El deterioro de la función renal se trata con terapia de reemplazo renal (TRR): diálisis y/o trasplante . El manejo desde el momento del diagnóstico sospechado o definitivo lo realiza un médico debidamente capacitado.
Signos y síntomas
Los signos y síntomas incluyen presión arterial alta, dolores de cabeza, dolor abdominal, sangre en la orina y micción excesiva . [1] Otros síntomas incluyen dolor en la espalda y formación de quistes (renales y otros órganos). [9]
Causa
La poliquistosis renal es causada por genes anormales que producen una proteína anormal específica que tiene un efecto adverso en el desarrollo de los túbulos. La poliquistosis renal es un término general para dos tipos, cada uno con su propia patología y causa genética: la poliquistosis renal autosómica dominante (PQRAD) y la poliquistosis renal autosómica recesiva (PQRAD). [10] [11]
Autosómico dominante


La enfermedad renal poliquística autosómica dominante (ERPAD) es la más común de todas las enfermedades renales quísticas hereditarias [12] [13] [14] con una incidencia de 1:500 nacidos vivos. [12] [14] Los estudios muestran que el 10% de los pacientes con enfermedad renal terminal (ERT) que reciben tratamiento con diálisis en Europa y los EE. UU. fueron diagnosticados y tratados inicialmente por ERPAD. [12] [11]
Las mutaciones genéticas en cualquiera de los tres genes PKD1 , PKD2 y PKD3 tienen presentaciones fenotípicas similares. [15]
- El gen PKD1 está localizado en el cromosoma 16 y codifica una proteína involucrada en la regulación del ciclo celular y el transporte intracelular de calcio en las células epiteliales y es responsable del 85% de los casos de PQRAD. [16]
- El gen PKD2 se identifica, mediante un estudio de ligamiento genético, [17] [18] en el cromosoma 4. [19] Un grupo de canales de cationes ligados al voltaje , con selectividad interna para K>Na>>Ca y selectividad externa para Ca2+ ≈ Ba2+ > Na+ ≈ K+, están codificados por PKD2 en el cromosoma 4. [ 20]
- Recientemente, se ha publicado en artículos de investigación que se ha postulado que el PKD3 es un tercer gen. [12] [13] Menos del 10 % de los casos de PQRAD aparecen en familias sin PQRAD. La formación de quistes comienza en el útero desde cualquier punto a lo largo de la nefrona , aunque se cree que menos del 5 % de las nefronas están implicadas. A medida que los quistes acumulan líquido, se agrandan, se separan de la nefrona, comprimen el parénquima renal vecino y comprometen progresivamente la función renal . [11]
Autosómica recesiva
La enfermedad renal poliquística autosómica recesiva (ERPA) (OMIM #263200) es la menos común de los dos tipos de ERP, con una incidencia de 1:20.000 nacidos vivos y se identifica típicamente en las primeras semanas después del nacimiento. Desafortunadamente, los riñones suelen estar subdesarrollados , lo que resulta en una tasa de mortalidad del 30% en recién nacidos con ERP. La PKHD1 está involucrada. [12] [11]
Mecanismo

La formación de quistes en la enfermedad renal poliquística autosómica dominante y autosómica recesiva está relacionada con una señalización anormal mediada por cilios . Las proteínas policistina-1 y policistina-2 parecen estar involucradas en la enfermedad renal poliquística autosómica dominante y recesiva debido a defectos en ambas proteínas. [21] Ambas proteínas tienen comunicación con las proteínas del canal de calcio y causan una reducción del calcio en reposo (intracelular) y del almacenamiento de calcio en el retículo endoplasmático. [22]
La enfermedad se caracteriza por un fenómeno de "segundo impacto", en el que un alelo dominante mutado se hereda de un progenitor y la formación de quistes se produce solo después de que el gen normal de tipo salvaje sufre un segundo "impacto" genético posterior, lo que da lugar a la formación de quistes tubulares renales y la progresión de la enfermedad. [21]
La PKD es el resultado de defectos en el cilio primario , un orgánulo celular inmóvil, parecido a un pelo, presente en la superficie de la mayoría de las células del cuerpo, anclado en el cuerpo celular por el cuerpo basal. [21] En el riñón, se ha descubierto que los cilios primarios están presentes en la mayoría de las células de la nefrona, proyectándose desde la superficie apical del epitelio renal hacia el lumen del túbulo. Se creía que los cilios se doblaban en el flujo de orina, lo que provocaba cambios en la señalización, sin embargo, desde entonces se ha demostrado que esto era un error experimental (la curvatura de los cilios era un artefacto de la compensación del plano focal, y también el efecto real sobre la micción por hipertensión grave y paro cardíaco) y que la curvatura de los cilios no contribuye a las alteraciones en el flujo de Ca. Si bien no se sabe cómo los defectos en el cilio primario conducen al desarrollo de quistes, se cree que posiblemente esté relacionado con la interrupción de una de las muchas vías de señalización reguladas por el cilio primario, incluido el calcio intracelular, Wnt/β-catenina, el monofosfato de adenosina cíclico (cAMP) o la polaridad celular plana (PCP). La función del cilio primario se ve afectada, lo que da como resultado la interrupción de una serie de cascadas de señalización intracelular que producen la diferenciación del epitelio quístico, el aumento de la división celular, el aumento de la apoptosis y la pérdida de la capacidad de reabsorción. [11] [21]
Diagnóstico
La enfermedad renal poliquística se puede determinar mediante una tomografía computarizada del abdomen, así como una resonancia magnética y una ecografía de la misma zona. [23] Un examen/prueba física puede revelar agrandamiento del hígado , soplos cardíacos y presión arterial elevada . [1]
Historia natural
La mayoría de los casos progresan a enfermedad bilateral en la edad adulta. [12]
Tratamiento

En 2018, se introdujo Jynarque ( Tolvaptan ) [24] como el primer tratamiento aprobado por la FDA para la PKD. En un estudio reciente a largo plazo, los pacientes que usaban Tolvaptan tenían una función renal un 6,4 % más alta después de 5 años en comparación con el estándar de atención. [25] En 2019, un equipo de investigadores de la UCSB descubrió que una dieta cetogénica podría detener, o incluso revertir, la progresión en ratones, [26] y los resultados de un primer estudio de series de casos humanos están mostrando un beneficio potencial. [27] Los resultados de un ensayo clínico prospectivo aleatorizado de intervención dietética de 3 meses están pendientes. [28] Además, investigaciones recientes indican que la restricción calórica leve a moderada o la alimentación restringida en el tiempo [29] retardan la progresión de la enfermedad renal poliquística autosómica dominante (ADPKD) en ratones. [30] [31] Las comunidades de pacientes han estado combinando dietas cetogénicas [32] y alimentación restringida en el tiempo con una dieta baja en oxalato para prevenir la formación de cálculos [33] y los primeros informes muestran un aumento promedio del 17% en la función renal después de aproximadamente un año con un régimen dietético cetogénico restringido en el tiempo. [34] Si y cuando la enfermedad progresa lo suficiente en un caso determinado, el nefrólogo u otro médico y el paciente tendrán que decidir qué forma de terapia de reemplazo renal se utilizará para tratar la enfermedad renal terminal ( insuficiencia renal , típicamente etapa 4 o 5 de la enfermedad renal crónica). [35]
Esto será ya sea alguna forma de diálisis , que puede realizarse al menos de dos maneras diferentes con distintas frecuencias y duraciones (si se hace en casa o en la clínica depende del método utilizado y de la estabilidad y entrenamiento del paciente) y eventualmente, si son elegibles debido a la naturaleza y gravedad de su condición y si se puede encontrar una compatibilidad adecuada, un trasplante de riñón unilateral o bilateral . [35]
Un estudio de revisión Cochrane sobre la enfermedad renal poliquística autosómica dominante destacó el hecho de que es importante en todo momento, evitando la resistencia a los antibióticos , controlar las infecciones de los quistes en los riñones y, si están afectados, en el hígado, cuando sea necesario durante un cierto tiempo para combatir la infección, mediante el uso de " medicamentos bacteriostáticos y bactericidas ". [11] [35]
Pronóstico
Las personas con PQRAD pueden tener una vida normal; por el contrario, la PQRAD puede causar disfunción renal y conducir a una insuficiencia renal a la edad de 40 a 60 años. La PQRAD1 y la PQRAD2 son muy diferentes, ya que la PQRAD2 es mucho más leve. [36]
Actualmente, no existen terapias que hayan demostrado ser efectivas para prevenir la progresión de la PQRAD. [37]
Epidemiología
La enfermedad renal poliquística es una de las enfermedades hereditarias más comunes en los Estados Unidos y afecta a más de 600.000 personas. Es la causa de casi el 10% de todas las enfermedades renales terminales. Afecta por igual a hombres, mujeres y todas las razas. [38] La enfermedad renal poliquística se presenta en algunos animales y también en los seres humanos. [39] [40]
Véase también
Referencias
- ^ abcde «Enfermedad renal poliquística». Enciclopedia médica MedlinePlus . Consultado el 30 de julio de 2015 .
- ^ "Enfermedad renal poliquística autosómica dominante". Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK) . Consultado el 3 de enero de 2018 .
- ^ "Enfermedad renal poliquística autosómica recesiva". Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK) . Consultado el 3 de enero de 2018 .
- ^ "¿Qué es la enfermedad renal poliquística?". Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK) . Consultado el 3 de enero de 2018 .
- ^ Hildebrandt F (abril de 2010). "Enfermedades renales genéticas". Lancet . 375 (9722): 1287–1295. doi :10.1016/S0140-6736(10)60236-X. PMC 2898711 . PMID 20382325.
- ^ Kimberling WJ, Pieke-Dahl SA, Kumar S (noviembre de 1991). "La genética de las enfermedades quísticas del riñón". Seminarios en Nefrología . 11 (6): 596–606. PMID 1767134.
- ^ "enfermedad renal poliquística" en el Diccionario médico de Dorland
- ^ Cramer MT, Guay-Woodford LM (julio de 2015). "Enfermedad renal quística: una introducción". Avances en la enfermedad renal crónica . 22 (4): 297–305. doi : 10.1053/j.ackd.2015.04.001 . PMID 26088074.
- ^ "Enfermedad renal poliquística". www.niddk.nih.gov . Archivado desde el original el 4 de enero de 2017. Consultado el 31 de julio de 2015 .
- ^ Porth C (1 de enero de 2011). Fundamentos de fisiopatología: conceptos de estados de salud alterados. Lippincott Williams & Wilkins. ISBN 9781582557243.
- ^ abcdef Phua YL, Ho J (abril de 2015). "MicroARN en la patogenia de la enfermedad renal quística". Current Opinion in Pediatrics . 27 (2): 219–226. doi :10.1097/mop.0000000000000168. PMC 4409326 . PMID 25490692.
- ^ abcdef Bisceglia M, Galliani CA, Senger C, Stallone C, Sessa A (enero de 2006). "Enfermedades quísticas renales: una revisión". Avances en patología anatómica . 13 (1): 26–56. doi :10.1097/01.pap.0000201831.77472.d3. PMID 16462154. S2CID 12417947.
- ^ ab Torres VE, Harris PC, Pirson Y (abril de 2007). "Enfermedad renal poliquística autosómica dominante". Lancet . 369 (9569): 1287–1301. doi :10.1016/S0140-6736(07)60601-1. PMID 17434405. S2CID 1700992.
- ^ ab Simons M, Walz G (septiembre de 2006). "Enfermedad renal poliquística: ¿división celular sin ac(l)ue?". Kidney International . 70 (5): 854–864. doi : 10.1038/sj.ki.5001534 . PMID 16816842.
- ^ Porath B, Gainullin VG, Cornec-Le Gall E, Dillinger EK, Heyer CM, Hopp K, et al. (junio de 2016). "Las mutaciones en GANAB, que codifican la subunidad de la glucosidasa IIα, causan enfermedad renal y hepática poliquística autosómica dominante". American Journal of Human Genetics . 98 (6): 1193–1207. doi :10.1016/j.ajhg.2016.05.004. PMC 4908191 . PMID 27259053.
- ^ Thivierge C, Kurbegovic A, Couillard M, Guillaume R, Coté O, Trudel M (febrero de 2006). "La sobreexpresión de PKD1 causa enfermedad renal poliquística". Biología molecular y celular . 26 (4): 1538–1548. doi :10.1128/MCB.26.4.1538-1548.2006. PMC 1367205 . PMID 16449663.
- ^ Kumar S, Kimberling WJ, Gabow PA, Kenyon JB (junio de 1991). "Estudios de ligamiento genético de la enfermedad renal poliquística autosómica dominante: búsqueda del segundo gen en una gran familia siciliana". Genética humana . 87 (2): 129–133. doi :10.1007/BF00204167. PMID 1676697. S2CID 22331271.
- ^ Kumar S, Kimberling WJ, Gabow PA, Shugart YY, Pieke-Dahl S (noviembre de 1990). "Exclusión de la enfermedad renal poliquística autosómica dominante tipo II (ADPKD2) de 160 cM del cromosoma 1". Journal of Medical Genetics . 27 (11): 697–700. doi :10.1136/jmg.27.11.697. PMC 1017261 . PMID 1980516.
- ^ Kimberling WJ, Kumar S, Gabow PA, Kenyon JB, Connolly CJ, Somlo S (diciembre de 1993). "Enfermedad renal poliquística autosómica dominante: localización del segundo gen en el cromosoma 4q13-q23". Genómica . 18 (3): 467–472. doi :10.1016/S0888-7543(11)80001-7. PMID 8307555.
- ^ Mochizuki T, Wu G, Hayashi T, Xenophontos SL, Veldhuisen B, Saris JJ, et al. (mayo de 1996). "PKD2, un gen de la poliquistosis renal que codifica una proteína integral de membrana". Ciencia . 272 (5266): 1339-1342. Código Bib : 1996 Ciencia... 272.1339M. doi : 10.1126/ciencia.272.5266.1339. PMID 8650545. S2CID 28192819.
- ^ abcd Halvorson CR, Bremmer MS, Jacobs SC (24 de junio de 2010). "Enfermedad renal poliquística: herencia, fisiopatología, pronóstico y tratamiento". Revista internacional de nefrología y enfermedades renovasculares . 3 : 69–83. doi : 10.2147/ijnrd.s6939 . PMC 3108786. PMID 21694932 .
- ^ Johnson RJ, Feehally J, Floege J (5 de septiembre de 2014). Nefrología clínica integral: consulta a expertos - En línea. Elsevier Health Sciences. ISBN 9780323242875.
- ^ "Enfermedad renal poliquística". Fundación Nacional del Riñón . 2016-01-07 . Consultado el 2022-11-17 .
- ^ "La FDA aprueba el tolvaptán para la PQRAD". Noticias sobre el riñón . 10 (6). 2018-06-01. ISSN 1555-905X.
- ^ Zhou X, Davenport E, Ouyang J, Hoke ME, Garbinsky D, Agarwal I, et al. (mayo de 2022). "Análisis de datos agrupados de los efectos del tratamiento a largo plazo del tolvaptán en la PQRAD". Informes internacionales sobre el riñón . 7 (5): 1037–1048. doi :10.1016/j.ekir.2022.02.009. PMC 9091612 . PMID 35570988.
- ^ Torres JA, Kruger SL, Broderick C, Amarlkhagva T, Agrawal S, Dodam JR, et al. (diciembre de 2019). "La cetosis mejora el crecimiento de quistes renales en la enfermedad renal poliquística". Metabolismo celular . 30 (6): 1007–1023.e5. doi :10.1016/j.cmet.2019.09.012. PMC 6904245 . PMID 31631001.
- ^ Strubl S, Oehm S, Torres JA, Grundmann F, Haratani J, Decker M, et al. (junio de 2022). "Intervenciones dietéticas cetogénicas en la enfermedad renal poliquística autosómica dominante: un estudio retrospectivo de series de casos: primeros conocimientos sobre viabilidad, seguridad y efectos". Revista Clínica Renal . 15 (6): 1079–1092. doi :10.1093/ckj/sfab162. PMC 9155228 . PMID 35664270.
- ^ Müller R (23 de agosto de 2022). "Intervenciones dietéticas cetogénicas en la enfermedad renal poliquística autosómica dominante (ERPAD)". Universidad de Colonia.
- ^ Nowak KL, Hopp K (abril de 2020). "Reprogramación metabólica en la enfermedad renal poliquística autosómica dominante: evidencia y potencial terapéutico". Revista clínica de la Sociedad Americana de Nefrología . 15 (4): 577–584. doi :10.2215/CJN.13291019. PMC 7133124 . PMID 32086281.
- ^ Warner G, Hein KZ, Nin V, Edwards M, Chini CC, Hopp K, et al. (mayo de 2016). "La restricción alimentaria mejora el desarrollo de la enfermedad renal poliquística". Revista de la Sociedad Americana de Nefrología . 27 (5): 1437–1447. doi :10.1681/ASN.2015020132. PMC 4849816 . PMID 26538633.
- ^ Kipp KR, Rezaei M, Lin L, Dewey EC, Weimbs T (abril de 2016). "Una reducción leve de la ingesta de alimentos ralentiza la progresión de la enfermedad en un modelo de ratón ortólogo de enfermedad renal poliquística". Revista estadounidense de fisiología. Fisiología renal . 310 (8): F726–F731. doi :10.1152/ajprenal.00551.2015. PMC 4835927. PMID 26764208 .
- ^ Spencer S (25 de diciembre de 2021). "6 formas en que las personas con enfermedad renal poliquística pueden reducir su presión arterial". Medium . Consultado el 24 de octubre de 2022 .
- ^ Torres JA, Rezaei M, Broderick C, Lin L, Wang X, Hoppe B, et al. (julio de 2019). "La deposición de cristales desencadena la dilatación de los túbulos que acelera la cistogénesis en la enfermedad renal poliquística". The Journal of Clinical Investigation . 129 (10): 4506–4522. doi :10.1172/JCI128503. PMC 6763267 . PMID 31361604.
- ^ "Resultados revolucionarios tras 7 años de revertir la enfermedad renal poliquística". 2022-10-20 . Consultado el 2022-10-24 .
- ^ abc Montero N, Sans L, Webster AC, Pascual J (29 de enero de 2014). "Intervenciones para quistes infectados en personas con enfermedad renal poliquística autosómica dominante". Base de Datos Cochrane de Revisiones Sistemáticas . doi : 10.1002/14651858.cd010946 . S2CID 70649130.
- ^ Torra R (20 de julio de 2018). Talavera F, Aronoff GR (eds.). "Enfermedad renal poliquística: aspectos prácticos, antecedentes y fisiopatología". Medscape .
- ^ Bolignano D, Palmer SC, Ruospo M, Zoccali C, Craig JC, Strippoli GF (julio de 2015). "Intervenciones para prevenir la progresión de la enfermedad renal poliquística autosómica dominante". Base de datos Cochrane de revisiones sistemáticas . 2015 (7): CD010294. doi :10.1002/14651858.CD010294.pub2. PMC 8406618. PMID 26171904 .
- ^ Tamparo C (2011). Quinta edición: Enfermedades del cuerpo humano . Filadelfia, PA: FA Davis Company. pág. 443. ISBN 978-0-8036-2505-1.
- ^ "Enfermedad renal poliquística (PKD): prueba genética y registro negativo". International Cat Care. Archivado desde el original el 17 de noviembre de 2016. Consultado el 2 de noviembre de 2014 .
- ^ "PKD - Enfermedad renal poliquística - British Shorthair". Antagene. Archivado desde el original el 17 de agosto de 2018. Consultado el 2 de noviembre de 2014 .
Lectura adicional
- Chapin HC, Caplan MJ (noviembre de 2010). "La biología celular de la enfermedad renal poliquística". The Journal of Cell Biology . 191 (4): 701–710. doi :10.1083/jcb.201006173. PMC 2983067 . PMID 21079243.
- Harris PC, Torres VE (1 de enero de 2009). "Enfermedad renal poliquística". Revista Anual de Medicina . 60 : 321–337. doi :10.1146/annurev.med.60.101707.125712. PMC 2834200 . PMID 18947299.
- Halvorson CR, Bremmer MS, Jacobs SC (2010). "Enfermedad renal poliquística: herencia, fisiopatología, pronóstico y tratamiento". Revista internacional de nefrología y enfermedades renovasculares . 3 : 69–83. doi : 10.2147/IJNRD.S6939 . PMC 3108786. PMID 21694932 .
